Статтю опубліковано на с. 26-34
Вступ
Бронхіальна астма залишається однією із найбільш актуальних медико-соціальних проблем сучасної педіатрії [1, 2]. За останнє десятиліття спостерігається значне збільшення кількості випадків алергійних захворювань, насамперед бронхіальної астми, що розглядається як проблема світового рівня й перебуває в центрі уваги клініцистів різних спеціальностей [3, 4]. За соціально-економічними збитками, впливом на рівень здоров’я та якість життя бронхіальна астма входить до числа перших трьох патологій у структурі захворювань людини [5–7]. На сучасному етапі бронхіальна астма розглядається як комплексне захворювання з різними клініко-патогенетичними варіантами перебігу, особливостями реакції на проведене лікування та віддалені результати захворювання. Дослідження останніх років свідчать про те, що інфекції відіграють важливу роль у патогенезі бронхіальної астми й можуть бути пусковим механізмом розвитку захворювання, особливо в дітей раннього віку, а також тригерним механізмом загострень бронхіальної астми в дітей [8]. Інфекції дихальних шляхів погіршують мукоциліарний кліренс, порушують нейрогенну регуляцію тонусу гладенької мускулатури бронхів, призводять до ушкодження епітелію й підвищення судинної проникності, підсилюють продукцію IgE. Гіперреактивність бронхів, що формується в результаті цього, обумовлює розвиток і загострення бронхіальної астми [9].
Характерною рисою сучасної інфекційної патології є зростання хронічних інфекційно-запальних захворювань. Як правило, вони викликаються або пов’язані з персистуючими, так званими повільними, мікроорганізмами з атиповими біологічними властивостями, множинною антибіотикорезистентністю в умовах порушень з боку імунної системи макроорганізму, серед яких найпоширенішими є Chlamydophyla pneumoniae, Mycoplasma pneumoniae, віруси простого герпесу (ВПГ) І–ІІ типу, цитомегаловірус (ЦМВ), вірус Епштейна — Барр (ВЕБ) [10].
Віруси, що частіше викликають інфекції в дітей першого року життя, інфікуючи епітелій бронхів, сприяють збільшенню продукції інтерлейкінів. У свою чергу, підвищений рівень IL-6 і ІL-8 призводить до зміни регуляції Т- і В-лімфоцитів, сприяє накопиченню нейтрофілів і еозинофілів, збільшує утворення IgE через вплив на CD8+ і шляхом впливу на макрофаги й базофіли викликає вивільнення гістаміну [8].
Герпетична інфекція залишається найпоширенішою й погано контрольованою патологією. Захворювання, обумовлені вірусом простого герпесу, як причина летального кінця посідають серед інфекційних захворювань друге місце (15,8 %) після грипу (35,8 %) [11]. Значимість цих захворювань полягає в тому, що, починаючись так званою звичайною застудою, при зміні реактивності організму вони можуть перейти в дисеміновану форму, призвести до інвалідності.
Останніми роками активно обговорюється питання про роль так званих атипових збудників у розвитку бронхіальної астми — мікоплазм й хламідій. Термін «атиповий» з’явився вперше в пульмонології. Ним позначали захворювання, що перебігають без звичної клінічної симптоматики (із незначними клінічними, рентгенологічними, аускультативними й лабораторними показниками, без вираженого лейкоцитозу), що не піддаються звичайній терапії антибіотиками пеніцилінового ряду [9].
За даними різних авторів, від 5 до 30 % усіх загострень бронхіальної астми пов’язані з гострою інфекцією, викликаною Chlamydophіla pneumoniae і Mycoplasma pneumoniae. Зазначені інфекційні патогени здатні активно впливати на імунну відповідь, сприяючи, з одного боку, вторинному інфікуванню дихальних шляхів, а з іншого — збільшенню бронхіальної гіперреактивності й розвитку бронхоспазму. Крім того, хворі з атопічною формою бронхіальної астми генетично схильні до персистуючого перебігу внутрішньоклітинних інфекцій [12].
Роль хламідійної інфекції в розвитку бронхіальної астми підтверджується виявленням специфічних IgE до Chlamydophila pneumoniae [13].
Тривала персистенція в організмі інфікованої людини герпесвірусних, хламідофільної й мікоплазмової інфекцій, активація та рецидиви розмноження патогенів із загостренням процесів, що мають хронічний перебіг, різко виражений імуносупресивний процес із пригніченням клітинної ланки імунітету вимагають визначення тактики й стратегії ведення дітей, які страждають від бронхіальної астми на тлі герпесвірусних, хламідофільної і мікоплазмової інфекцій.
Метою нашого дослідження стало підвищення ефективності лікування дітей, хворих на бронхіальну астму на тлі персистуючих інфекцій, на підставі нових наукових даних про особливості перебігу захворювання, клініко-функціональні особливості, показники імунореактивності шляхом диференційованого підходу до лікування й вторинної профілактики.
Матеріали та методи
Для досягнення мети дослідження було проведене комплексне обстеження 328 дітей віком від 5 до 18 років із персистуючим перебігом бронхіальної астми.
Критерії включення дітей у дослідження: діти, які страждають від бронхіальної астми.
Критерії виключення дітей із дослідження: діти з уродженою аномалією дихальних шляхів, наявністю інших різних хронічних захворювань органів дихання.
Діти обстежувалися як у період загострення бронхіальної астми, так і в період ремісії захворювання.
Для виявлення ступеня впливу внутрішньоклітинних збудників на перебіг бронхіальної астми у всіх дітей визначалися рівні специфічних імуноглобулінів класів M та G у сироватці крові, а також ДНК вірусів простого герпесу І–ІІ типів, цитомегаловірусу, вірусу Епштейна — Барр; Сhlamydophila pneumoniae і Mycoplasma pneumoniae у зшкрібках зі слизової оболонки ротової порожнини та мокротинні. Численні дослідження свідчать про те, що вищеперераховані збудники можуть відігравати роль у патогенезі бронхіальної астми та сприяти обтяженню її перебігу [14, 15].
У 256 (78,05 %) дітей, хворих на бронхіальну астму, були виявлені IgM і/або IgG до різних внутрішньоклітинних персистуючих збудників — вірусу простого герпесу І–ІІ типів, цитомегаловірусу, вірусу Епштейна — Барр, Сhlamydophila pneumoniae і Mycoplasma pneumoniae. Ці діти становили основну (І) групу спостереження. Частота інфікованості збудниками була різною. Так, антитіла до вірусу простого герпесу І–ІІ типів виявлено у 80 (31,3 %) дітей, цитомегаловірусу — в 124 (48,4 %), вірусу Епштейна — Барр — у 66 (25,8 %), Сhlamydophila pneumoniae — в 71 (66,8 %) і Mycoplasma pneumoniaе — у 33 (12,9 %) дітей. У 118 (46,1 %) пацієнтів виявлялася поєднана інфікованість різними збудниками.
У 156 (60,9 %) пацієнтів виявлялись інфікування герпесвірусами у вигляді моноінфекції чи коінфекції вірусів. Так, ЦМВ-інфекція спостерігалася у 55 (35,2 %) дітей основної групи, викликана ВЕБ — у 18 (11,5 %), вірусом простого герпесу — у 30 (19,2 %), поєднанням ЦМВ та ВЕБ — у 19 (12,2 %), ЦМВ та ВПГ — у 23 (14,7 %), ВЕБ та ВПГ — в 11 (7,1 %) дітей. Діти з моноінфекцією були віднесені до Іа підгрупи.
У 39 (15,2 %) пацієнтів основної групи виявлялось інфікування Сhlamydophila pneumoniae та/або Mycoplasma pneumoniaе. Так, наявність тільки хламідофільної інфекції спостерігалось у 18 (46,1 %) дітей, мікоплазмової — у 17 (43,6 %), їх асоціація — у 4 (10,3 %). Діти з коінфекцією були віднесені до Іб підгрупи.
Поєднана інфікованість герпесвірусами та Сhlamydophila pneumoniae або Mycoplasma pneumoniaе виявлялась у 61 (23,8 %) пацієнта. Так, комбінація ЦМВ та хламідофільної інфекції виявлена у 22 хворих (36,1 %), ЦМВ та мікоплазмової — у 5 (8,2 %), ВЕБ та хламідофільної — у 15 (24,6 %), ВЕБ та мікоплазмової — у 3 (4,9 %), ВПГ та хламідофільної — у 12 (19,7 %), ВПГ та мікоплазми — у 4 (6,6 %). Діти з поєднаною інфекцією були віднесені до Ів підгрупи.
У 72 (21,95 %) обстежених дітей із бронхіальною астмою не були виявлені специфічні IgM і/або IgG до досліджуваних інфекцій, у зв’язку із чим пацієнти були віднесені до ІІ групи — групи порівняння.
Групу контролю становили 50 практично здорових дітей.
Аналізуючи отримані дані про характер супутньої патології в інфікованих персистуючими інфекціями дітей, хворих на бронхіальну астму, та неінфікованих осіб, можна з певною вірогідністю відзначити більш часту захворюваність у пацієнтів основної групи, що пов’язана з дефектами систем захисту. У 2–3 рази частіше в дітей даної категорії зустрічаються ускладнені форми гострої респіраторної вірусної інфекції, пневмонії, загострення хронічного тонзиліту, анемія, гіпотрофія, рахіт. Ультразвукове дослідження загрудинної залози дає підставу припускати порушення функцій імунотропних структур: у 3 рази частіше змінені розміри залози — гіпо-, гіперплазія.
Отримані дані анамнезу життя спостережуваних дітей, їх захворюваності та соматичного статусу дозволяють обґрунтовано зробити припущення про значущість персистуючих внутрішньоклітинних інфекцій (герпесвірусних, викликаних, зокрема, вірусом простого герпесу І–ІІ типів, цитомегаловірусом, вірусом Епштейна — Барр; Сhlamydophila pneumoniae і Mycoplasma pneumoniae) у формуванні порушень функцій систем захисту дітей і, як наслідок, розвитку імунозалежних захворювань, у тому числі бронхіальної астми.
Нами отримані дані про значне зниження рівня інтерферону альфа (IFN-α) у сироватці крові дітей, хворих на бронхіальну астму, як інфікованих, так і не інфікованих внутрішньоклітинними збудниками. Так, в основній групі пацієнтів рівень IFN-α мав тенденцію до підвищення порівняно з пацієнтами другої групи — 4,12 ± 1,05 пг/мл проти 4,01 ± 1,97 пг/мл відповідно. Статистичної різниці між цими показниками не виявлялося (р = 0,999), однак були статистично значущі відмінності між показниками інфікованих і неінфікованих внутрішньоклітинними інфекціями дітей з бронхіальною астмою та даними практично здорових дітей — 32,56 ± 8,17 пг/мл (p < 0,001). Статистично значущих відмінностей між рівнем IFN-α у групі інфікованих дітей з активним і латентним перебігом внутрішньоклітинних інфекцій виявлено не було. Рівень IFN-α при активному перебігу інфекції становив 4,09 ± 1,09 пг/мл, у групі порівняння — 4,12 ± 1,20 пг/мл (p = 1,0).
Отже, зниження рівня IFN-α свідчить про порушення противірусного імунітету та стимуляції клітин, що мають цитотоксичну активність. З огляду на той факт, що даний цитокін бере участь у поляризації Т-клітин у напрямку Th1-типу, зниження його активності відображає поляризацію Т-хелперних лімфоцитів у напрямку Th2-типу. Хронічний запальний процес у дихальних шляхах, обумовлений ушкоджуючим впливом персистуючих інфекцій на їх клітинні структури, сприяє формуванню підвищеної реактивності бронхіального дерева з розвитком місцевого імунного запалення. Низькі рівні IFN-α як при активному, так і при латентному перебігу внутрішньоклітинних інфекцій в основній групі пацієнтів сприяють хронізації інфекції та підвищують імовірність рецидивів бронхообструкції.
На нашу думку, комбінація зниженої продукції протизапальних цитокінів з підвищенням рівнів прозапальних цитокінів на тлі імунного дисбалансу сприяє підтриманню запального процесу, провокуючи його хронізацію, формування глибокого імунного дисбалансу та виникнення необоротних змін у дихальних шляхах, що призводять до їх ремоделювання. У результаті таких змін підсилюється алергічне запалення слизової оболонки дихальних шляхів, що в остаточному підсумку призводить до формування більш високої гіперреактивності бронхів у дітей із бронхіальною астмою, інфікованих внутрішньоклітинними збудниками, процесів ремоделювання дихальних шляхів і утруднення контролю над перебігом захворювання [16].
Патологічні процеси, що відбуваються в дихальних шляхах у дітей із бронхіальною астмою, які інфіковані внутрішньоклітинними збудниками, характеризуються переважанням запальної реакції при активному перебігу інфекційного процесу. Латентний перебіг інфекції викликає імунопатологічні реакції, обумовлені перевагою впливу Th2-цитокінів і автоімунним процесом.
Основною метою лікування бронхіальної астми та запобігання розвитку ускладнень є зменшення активності хронічного алергічного запалення, що призводить до фіброзування, тобто ремоделювання дихальних шляхів. Сучасні підходи до терапії бронхіальної астми мають на меті контроль над захворюванням, тобто досягнення стану, при якому перебіг бронхіальної астми залишається стабільним протягом тривалого часу, відсутні напади задишки та їх еквіваленти в денний і нічний час, немає потреби в короткодіючих β2-агоністах для купірування симптомів, немає обмежень повсякденної активності, збережена функція зовнішнього дихання [17].
Лікування хворих на бронхіальну астму повинно бути комплексним, тривалим і містити заходи, направлені на елімінацію причинно-значущих алергенів, специфічну імунотерапію, фармакотерапію, а також програми навчання пацієнтів і/або осіб, які доглядають за ними.
Немаловажне значення при лікуванні дітей із бронхіальною астмою має контроль над середовищем навколо хворого, зокрема проведення комплексу заходів, спрямованих на запобігання контакту з алергенами — епідермальними алергенами та слиною домашніх тварин, домашнім пилом, що містить дерматофагоїдних кліщів, цвілевими грибками, пилком дерев і трав, зниження концентрації аероалергенів.
Метою фармакотерапії бронхіальної астми в дітей є досягнення стійкої ремісії, постійний контроль над симптомами захворювання, запобігання загостренням, висока якість життя пацієнтів.
Для досягнення даної мети необхідно тривале лікування хронічного запального процесу бронхіального дерева, проведення базисної фармакотерапії, основу якої становлять інгаляційні глюкокортикостероїди, пролонговані бронхолітики, зокрема пролонговані β2-агоністи, метилксантини, а також антилейкотрієнові препарати. Препаратами невідкладної терапії є β2-агоністи короткої дії та інші бронхолітики. У сучасних умовах стратегія призначення базисної фармакотерапії в дітей із бронхіальною астмою припускає ступінчастий підхід з урахуванням тяжкості перебігу та рівня контролю над захворюванням.
Препаратами, що застосовуються для базисної терапії бронхіальної астми, так званими контролюючими препаратами, є інгаляційні кортикостероїди, які чинять виражену місцеву дію завдяки створенню високої концентрації лікарської речовини в бронхах і практично позбавлені системної активності [17, 18]. Для досягнення оптимального контролю стартова терапія призначається як мінімум на 3 місяці. Якщо наприкінці цього періоду рівень контролю визначається як недостатній, необхідний перехід на наступний ступінь із подвоєнням стартової дози. Однак у випадку, коли не вдається досягти контролю подвоєнням дози інгаляційного глюкокортикостероїду, необхідно оцінити правильність виконання інгаляції та рівень комплайєнсу, оскільки це найбільш часті причини відсутності контролю в дітей [17]. Крім того, можлива комбінація інгаляційних глюкокортикостероїдів з антилейкотрієновими препаратами або β2-агоністами тривалої дії.
Дані лікарські засоби можуть доставлятися в дихальні шляхи за допомогою небулайзера, до п’ятирічного віку дитини необхідне введення дозованого аерозолю через спейсер, у старших дітей використовують сухі порошкові інгалятори. Доза глюкокортикостероїдів залежить від віку дитини, тяжкості та періоду захворювання. Так, для дітей до 5 років відповідно до рекомендації GINA (2015) терапію треба починати із призначення низьких добових доз інгаляційних глюкокортикостероїдів [19]. Беклометазону дипропіонат призначають у дозі 100 мкг, будесонід із дозованою подачею (pMDI) через спейсер — у дозі 200 мкг, будесонід для небулізації — 500 мкг, флутиказону пропіонат із дозованою подачею (pMDI) через спейсер — 100 мкг.
Альтернативним є додаткове введення антилейкотрієнового препарату, але ефективність такої комбінованої терапії для дітей молодшого віку не доведена (рівень доказовості D). Необхідність додаткової терапії оцінюють під час кожного візиту пацієнта, призначають таку терапію на мінімальний строк. Після досягнення контролю, як і в більш старших дітей, рекомендований перегляд обсягу терапії кожні 3–6 місяців [17].
β2-агоністи тривалої дії додаються до терапії у випадку неконтрольованого перебігу бронхіальної астми, частіше в дітей після 4–5 років, тому що в молодшому віці їх ефективність і безпека ще недостатньо досліджені.
Пероральні теофіліни також можуть бути використані як базисна терапія в дітей при недостатньо ефективному застосуванні вищезгаданих препаратів, а також за відсутності інших засобів.
Отримані нами дані свідчать про те, що інфікування внутрішньоклітинними персистуючими збудниками збільшує тяжкість перебігу бронхіальної астми в дітей. Вивчення анамнезу життя обстежених дітей, їх захворюваності та соматичного статусу дозволяє обґрунтовано припустити, що персистуючі внутрішньоклітинні інфекції (герпесвірусні, викликані, зокрема, вірусом простого герпесу І–ІІ типів, цитомегаловірусом, вірусом Епштейна — Барр; Сhlamydophila pneumoniae і Mycoplasma pneumoniae) відіграють значну роль у формуванні порушень функцій систем захисту дітей і, як наслідок, розвитку імунозалежних захворювань, у тому числі бронхіальної астми. Більше того, персистуючий перебіг внутрішньоклітинних інфекцій збільшує тяжкість захворювання, сприяє розвитку ускладнень і активно впливає на формування процесів ремоделювання бронхів.
Вивчення впливу тривалої персистенції в організмі інфікованої людини герпесвірусних, хламідофільної і мікоплазмової інфекцій на процеси ремоделювання дихальних шляхів при бронхіальній астмі в дітей дозволило нам удосконалити схеми лікування, особливо у випадках захворювань на бронхіальну астму дітей з різними варіантами перебігу персистуючих внутрішньоклітинних інфекцій. Тобто наявність бронхіальної астми в комбінації з різними варіантами перебігу зазначених інфекцій, на нашу думку, вимагає призначення етіопатогенетичної терапії залежно від ступеня активності інфекційного процесу.
Необхідно відзначити, що на цей час відсутні ефективні терапевтичні специфічні препарати, здатні привести до повної ерадикації внутрішньоклітинних опортуністичних інфекцій, зокрема викликаних вірусом простого герпесу І–ІІ типів, цитомегаловірусом, вірусом Епштейна — Барр. Труднощі нейтралізації збудника обумовлені ще й тим, що для вищезгаданих вірусів характерна переважно внутрішньоклітинна форма існування, що позначається на повноті впливу препаратів на інфекційний агент. Тому на сучасному етапі лікування герпесвірусних інфекцій спрямоване на купірування активності інфекційного процесу, пригнічення репродукції збудника. Крім того, для запобігання реактивації інфекції необхідно викликати адекватну імунну відповідь.
Пацієнтам основної групи — дітям із бронхіальною астмою, інфікованим внутрішньоклітинними інфекціями: герпесвірусними, викликаними вірусом простого герпесу І–ІІ типів, цитомегаловірусом, вірусом Епштейна — Барр, при активній стадії інфекційного процесу поряд з базисною терапією, що включала інгаляційні кортикостероїди у вікових дозуваннях, які відповідають ступеню тяжкості захворювання, та бронхолітичну терапію (інгаляції β2-агоністів), були призначені ациклічні (атипові) нуклеозиди, зокрема ацикловір.
Критеріями активності інфекційного процесу (первинного епізоду або його загострення) були клінічні прояви захворювання та наявність лабораторних маркерів реплікації (активації) герпесвірусів: ДНК у слизу з ротової порожнини й мокротинні, виявлення специфічного IgМ у сироватці крові, зростання в динаміці низькоавідних специфічних IgG.
Вибір препарату ацикловір був обумовлений певними характеристиками, такими як висока біодоступність, специфічність противірусної дії, відсутність канцерогенної дії, здатність взаємодіяти тільки з внутрішньоклітинними включеннями-мішенями (віріонами), відсутність ушкоджуючого впливу на здорові клітини, добре виведення з організму, відсутність загальнотоксичних властивостей, що важливе для дитячого організму.
Особливістю дії ацикловіру є його здатність обривати процес реплікації вірусів на будь-якій стадії та перешкоджати утворенню нових генерацій вірусів [20].
Препарат ацикловір призначали дітям із бронхіальною астмою на тлі активного перебігу внутрішньоклітинних інфекцій, викликаних вірусом простого герпесу І–ІІ типів, цитомегаловірусом, вірусом Епштейна — Барр, по 200 мг 5 разів на добу протягом 10 днів при гострому первинному перебігу й упродовж 14 днів — при рецидивуючому перебігу інфекції.
Пацієнтам основної групи — дітям із бронхіальною астмою, інфікованим внутрішньоклітинними інфекціями, що перебігають на тлі активної хламідофільної, викликаної Сhlamydophila pneumoniae, і мікоплазмової інфекції, викликаної Mycoplasma pneumoniaе, призначалися антибіотики з групи макролідів.
Антимікробна дія макролідів обумовлена порушенням синтезу білка на етапі трансляції в клітинах чутливих мікроорганізмів. Із пригніченням синтезу білка в рибосомах мікробів пов’язаний і постантибіотичний ефект макролідів — пригнічення життєдіяльності мікроорганізмів, що триває після відміни антибіотика.
Крім антибактеріального ефекту, дана група антибіотиків має протизапальну дію за рахунок інгібування окисного вибуху. Вони здатні модулювати цитокінові реакції за рахунок пригнічення утворення протизапальних цитокінів і стимулювання прозапальних, а також знижують синтез медіаторів запалення — простагландинів, лейкотрієнів і тромбоксанів. Причому протизапальна дія проявляється навіть при субтерапевтичних концентраціях антибіотиків даної групи й порівняна з ефектом нестероїдних протизапальних засобів [21].
Ще однією особливістю макролідів є їх стимулюючий вплив на фагоцитоз, який відбувається за рахунок їх накопичення в нейтрофілах і макрофагах, що приводить до посилення фагоцитарної активності та міграції у вогнище запалення. Завдяки здатності підвищувати активність Т-кілерів антибіотики даної групи мають також імуномодулюючу дію [14].
Дітям із бронхіальною астмою при активному перебігу хламідійної або мікоплазмової інфекцій призначався антибіотик класу макролідів азитроміцин у віковому дозуванні 10 мг/кг 1 раз на добу впродовж 10 днів при гострому первинному перебігу й 14 днів — при рецидивуючому перебігу інфекції.
Останніми роками на тлі росту інфікованості, захворюваності, збільшення числа ацикловір-резистентних форм герпесвірусних інфекцій майже в половини хворих у перші два роки після перенесеного первинного гострого епізоду розвиваються рецидиви, а число випадків із хронічним рецидивуючим перебігом захворювань спостерігається в більше ніж 12 % інфікованих [22, 23]. Імовірність формування резистентних до ациклічних нуклеозидів штамів герпесвірусів може досягати 25 % випадків захворювань [24]. Зростання резистентності герпесвірусів до дії ациклічних нуклеозидів значно погіршило ефективність терапії, особливо при рецидивуючому перебігу інфекції й тривалому проведенні супресивної противірусної терапії [25].
У зв’язку з цим як засоби етіотропної терапії значно поширені флавоноїди, що чинять противірусну дію та використовуються для пригнічення розмноження герпесвірусів. Флавоноїди призначалися як при активному, так і при латентному перебігу інфекційного процесу, викликаного внутрішньоклітинними збудниками, у дітей із бронхіальною астмою. При активному перебігу процесу препарат призначався після закінчення курсу ациклічних нуклеозидів чи макролідів.
Враховуючи здатність внутрішньоклітинних інфекцій впливати на стан імунної системи, наявність випадків резистентності герпесвірусів до ацикловіру та інших ациклічних нуклеозидів, що може безпосередньо вплинути на перебіг і результат захворювання, нами в комплекс лікувальних заходів у спостережуваних пацієнтів були включені імунотропні препарати, зокрема інтерферони. Широкий спектр фізіологічних функцій інтерферонів (противірусна, радіопротективна, антипроліферативна та імуномодулююча) свідчить про їх контрольно-регуляторну роль у збереженні гомеостазу.
Інтерферони є групою багатофункціональних плейотропних цитокінів, які утворюються клітинами організму як захисний засіб у відповідь на їх вірусне ураження або дію патологічних чинників, зокрема ендотоксинів бактерій, найпростіших, онкобілків, у перші години потрапляння в клітину генетично чужорідних агентів. Інтерферони є ключовими компонентами противірусного, антимікробного захисту організму та чинять значну імуномодулюючу, проапоптичну й антипроліферативну дію. Механізм дії інтерферонів полягає в ініціюванні каскаду реакцій, що приводять до руйнування дволанцюжкових РНК та деяких інших молекул. При зараженні клітини вірус починає реплікувати свій геном у середині клітини та розмножуватися, вбиваючи клітину. Клітина-хазяїн при зараженні вірусом починає продукувати інтерферон, що виходить із клітини і вступає в контакт із сусідніми клітинами, роблячи їх несприйнятливими до вірусу. Він запускає ланцюг реакцій, що приводять до припинення синтезу вірусних білків. Інтерферони діють не вибірково, проти якогось одного виду вірусів, вони захищають організм від різноманітних вірусів, що свідчить про універсальну противірусну активність цього цитокіну та підкреслює його роль у неспецифічній резистентності. Крім того, ті клітини, що зазнали дії інтерферону в невеликих концентраціях, пізніше, після відповідної стимуляції, виділяють його більше, ніж клітини, що не зазнали його дії [37].
З огляду на вплив внутрішньоклітинних персистуючих інфекцій на стан імунної системи, девіацію імунної відповіді в бік активації клону Т-хелперів другого типу, пригнічення клону Т-хелперів першого типу, зміни функціонування системи інтерферонів, негативну динаміку рівнів IFN-α у сироватці крові в комплекс лікування дітей основної групи був включений препарат α-2b-інтерферону в ректальних супозиторіях Лаферобіон. Препарат має не тільки строго направлений імунозамісний, але й досить широкий імуномодулюючий і протективний ефекти. Лаферобіон у ректальних супозиторіях не має характерних побічних ефектів, які властиві для рекомбінантних інтерферонів, що вводяться парентерально, крім того, до нього не виробляються інактивуючі антитіла. Форма введення препарату у вигляді ректальних супозиторіїв забезпечує його ефективність при прийомі з інтервалом у 12 годин і є зручною в педіатричній практиці порівняно з парентеральними способами введення, має високий рівень абсорбції лікарської речовини, відсутність метаболічного ефекту першого проходження через печінку, відсутність грипоподобного синдрому [33–35]. Застосування препарату Лаферобіон у формі ректальних супозиторіїв дозволяє звести до мінімуму можливість взаємодії з іншими лікарськими препаратами [34]. До складу ректальних супозиторіїв Лаферобіону входять рекомбінантний α-2b-інтерферон (по 150 000 МО, 500 000 МО), токоферолу ацетат, аскорбінова кислота й твердий жир. Наявність у комплексі Лаферобіону мембраностабілізуючих компонентів, цитопротекторів — токоферолу ацетату й вітаміну С — обумовлює підвищення противірусної активності інтерферону в 10–14 разів шляхом посилення його імуномодулюючої дії на Т- і В-лімфоцити. Включення до складу Лаферобіону антиоксидантів перешкоджає окислювальному руйнуванню молекул інтерферону й сприяє збереженню біологічної активності лікарського препарату [36].
Дітям у віці до 7 років Лаферобіон призначався по 500 000 МО 2 рази на добу. Дітям старше 7 років — 1 000 000 МО 2 рази на добу у вигляді ректальних супозиторіїв курсом 10 днів при гострій первинній інфекції. При активному рецидивуючому перебігу внутрішньоклітинної інфекції препарат призначався в тому же дозуванні трьома десятиденними циклами з десятиденними інтервалами 2 рази на рік. При латентному перебігу — по 10 днів 2 рази на рік [33].
Тісна співпраця лікаря, дитини та її батьків, регулярний поточний контроль (огляд 1 раз на 4 тижні), перегляд базисної терапії (1 раз на 3 місяці) — основні принципи досягнення та підтримання контролю над хронічним запаленням у дітей із бронхіальною астмою.
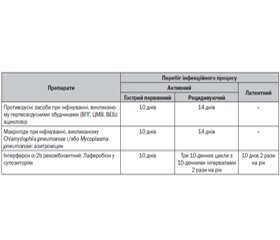
Схема диференційованої етіопатогенетичної терапії в дітей, хворих на бронхіальну астму на тлі інфікування внутрішньоклітинними збудниками, при різних варіантах перебігу персистуючих інфекцій подана в табл. 1.
Отже, лікування дітей, хворих на бронхіальну астму на тлі внутрішньоклітинних інфекцій, викликаних вірусом простого герпесу І–ІІ типів, цитомегаловірусом, вірусом Епштейна — Барр, Сhlamydophila pneumoniae і Mycoplasma pneumoniaе, визначається комплексним системним підходом, причому у випадках рецидивуючого перебігу інфекційного процесу оптимальним є проведення терапії в декілька етапів.
Тривалість, інтенсивність і обсяг терапевтичних втручань обумовлені деякими факторами — клінічною формою захворювання, тяжкістю та характером (наявністю рецидивів) його перебігу, періодом хвороби, віком дитини, наявністю ускладнень і супутньою патологією (табл. 2).
Результати та обговорення
Активний перебіг внутрішньоклітинних інфекцій або активація процесу при хронічному перебігу вимагає проведення спрямованих лікувальних заходів, що включають етіотропні засоби — ациклічні нуклеозиди протягом 10 днів при герпетичній інфекції та макроліди при хламідофільній або мікоплазмовій інфекціях у комплексі з імунотропними препаратами α-2b-інтерферонами (Лаферобіон) — до 10 днів.
При рецидивуючому перебігу герпесвірусних інфекцій показане проведення лікування ациклічними нуклеозидами до 14 днів у комбінації з інтерферонами — три десятиденних курси з десятиденними перервами 2 рази на рік.
При латентному перебігу герпесвірусних інфекцій та інфекцій, викликаних Сhlamydophila pneumoniae і Mycoplasma pneumoniaе, поза клінічними проявами захворювання в дітей із бронхіальною астмою з метою запобігання їх активації в терапію вводяться інтерферони.
Отже, комплексна етіопатогенетична, імуномодулююча терапія в дітей із бронхіальною астмою, інфікованих герпесвірусними, хламідофільною і мікоплазмовою інфекціями, у комплексі з базисною терапією захворювання дозволяє досягати пригнічення запального процесу, що сприяє профілактиці або гальмуванню процесів ремоделювання дихальних шляхів, контролюванню симптомів захворювання, зниженню інвалідизації та смертності.
Лікування дітей, хворих на бронхіальну астму на тлі внутрішньоклітинних інфекцій, викликаних вірусом простого герпесу І–ІІ типів, цитомегаловірусом, вірусом Епштейна — Барр, Сhlamydophila pneumoniae і Mycoplasma pneumoniaе, потребує комплексного системного підходу, причому у випадках рецидивуючого перебігу інфекційного процесу оптимальним є проведення терапії в кілька взаємопов’язаних між собою етапів. Тривалість, інтенсивність і обсяг терапевтичних втручань обумовлені кількома чинниками — клінічною формою захворювання, тяжкістю й характером (наявність рецидивів) його перебігу, періодом хвороби, віком дитини, наявністю ускладнень і супутньою патологією.
Проведене дослідження показало ефективність і дозволяє рекомендувати застосування комплексного підходу при здійсненні лікувальних та профілактичних заходів при бронхіальній астмі в дітей на тлі інфікування внутрішньоклітинними інфекціями, викликаними вірусом простого герпесу І–ІІ типів, цитомегаловірусом, вірусом Епштейна — Барр, Сhlamydophila pneumoniae і Mycoplasma pneumoniaе, що призводить до зменшення тяжкості перебігу захворювання, підвищення контрольованості астми, зменшення інвалідизації. Так, застосування дітям із бронхіальною астмою та активним перебігом внутрішньоклітинної інфекції етіотропних препаратів дозволило знизити число загострень захворювання в 1,6 раза; зменшити ступінь тяжкості перебігу бронхіальної астми у 76 (29,7 %) хворих, підвищити показники функції зовнішнього дихання (пікову швидкість видиху (ПШВ)) на 19,5 %, знизити добові коливання ПШВ на 17,3 %, підвищити форсовану життєву ємність легень на 15,3 %, об’єм форсованого видиху за 1-шу секунду — на 17,2 %; підвищити частку оборотності бронхообструкції понад 12 % — 77 %. Відновлена бронхіальна прохідність зберігалася протягом не менше ніж 12 місяців у 77,7 % хворих. Також після проведеної терапії спостерігалось відновлення інтерферонового статусу; зниження рівня концентрації прозапальних цитокінів та маркерів ремоделювання дихальних шляхів майже в 2 рази. Зникнення цитокінових ознак запалення супроводжувалось зниженням концентрації імуноглобулінів, що може свідчити про термінацію інфекційного процесу.
Висновки
Отже, проведені дослідження виявили вплив персистуючих внутрішньоклітинних інфекцій, зокрема цитомегаловірусної, викликаної вірусом простого герпесу І–ІІ типів, вірусом Епштейна — Барр, Сhlamydophila pneumoniae і Mycoplasma pneumoniaе, особливо при активному їх перебігу, на тяжкість перебігу бронхіальної астми. Отримані результати підтвердили необхідність проведення поряд з базисною терапією захворювання етіопатогенетичного лікування, зокрема призначення ациклічних нуклеозидів або макролідів залежно від діагностованої інфекції, імуномодуляторів і альфа-2b-інтерферону (Лаферобіону) з метою зниження тяжкості захворювання й зменшення інвалідизації.
Список литературы
1. Уманець Т.Р. Клініко-анамнестичні особливості фенотипів бронхіальної астми у дітей / Т.Р. Уманець // Перинатология и педиатрия. — 2011. — № 2(46). — С. 69-71.
2. Аллергология и иммунология: Клинические рекомендации для педиатров. — М.: Союз педиатров России, 2008. — 248 с.
3. Литвинець Л.Я. Концепція динаміки змін показників імунного статусу у дітей з бронхіальною астмою залежно від ступеня контрольованості недуги / Л.Я. Литвинець // Перинатология и педиатрия. — 2011. — № 2(46). — С. 104-406.
4. Тяжка О.В. Прогнозування особливостей клінічного перебігу бронхіальної астми у дітей / О.В. Тяжка, Ю.О. Савенко // Современная педиатрия. — 2014. — № 7(63) — С. 120-123.
5. Антипкин Ю.Г., Лапшин В.Ф. Довідник з дитячої пульмонології / Ю.Г. Антипкин, В.Ф. Лапшин. — К.: Доктор-Медiа, 2011. — 254 с.
6. Крючко Т.А., Вовк Ю.А., Ткаченко О.Я. Роль генетических факторов в развитии тяжелой атопической бронхиальной астмы у детей / Т.А. Крючко, Ю.А. Вовк, О.Я. Ткаченко // Здоровье ребенка. — 2012. — № 5(40). — С. 58-62.
7. Лапшин В.Ф. Бронхиальная астма и фенотипы свистящих хрипов у детей / В.Ф. Лапшин, Т.Р. Уманець // Клінічна імунологія. Алергологія. Інфектологія. — 2010. — № 2. — С. 66-69.
8. Геппе Н.А. Бронхиальная астма и инфекции у детей: есть ли связь? / Н.А. Геппе // Аллергология и иммунология. — 2013. — № 1. — С. 9-10.
9. Савенкова М.С., Савенков М.П. Хламидийно-микоплазменные инфекции у детей / М.С. Савенкова, М.П. Савенков. — М.: Миклош, 2012. — 292 с.
10. Марков И.С. Диагностика и лечение герпетических инфекций и токсоплазмоза / И.С. Марков. — К.: АртЭК, 2002. — 192 с.
11. Спиридонова С.А., Толмачева С.М., Лукиных Л.М. Хронический рецидивирующий герпетический стоматит как болезнь иммунной системы / С.А. Спиридонова, С.М. Толмачева, Л.М. Лукиных // Современные технологии в медицине. — 2012. — № 3. — С. 121-125.
12. Хамитов Р.Ф., Новоженов В.Г., Мустафин И.Г. Распространенность хламидийной инфекции среди больных бронхиальной астмой / Р.Ф Хамитов, В.Г. Новоженов, И.Г. Мустафин // Материалы 9-го нац. конгр. по болезням органов дыхания. — М., 1999. — № 1. — С. 55.
13. Гранитов В.М. Хламидиозы / В.М. Гранитов. — М.: Мед. книга; Нижний Новгород: НГМА, 2000. — 190 с.
14. Гадецька С.Г. Особливості перебігу і терапії бронхіальної астми у дітей з респіраторним хламідіозом: Автореф. дис… канд. мед. наук: (14.01.10) / С.Г. Гадецька; Донецьк. держ. мед. ун-т ім. М. Горького, НДІ мед. проблем сім’ї. — Донецьк, 2006. — 20 с.
15. Хаптхаева Г.Э., Чучалин А.Г. Респираторная инфекция и бронхиальная астма / Г.Э. Хаптхаева, А.Г. Чучалин // Пульмонология. — 2008. — № 5. — С. 75-78.
16. Суханова Н.А., Цветков Э.А., Новик Г.А. Клиническое значение влияния латентной инфекции верхних дыхательных путей на течение бронхиальной астмы у детей / Н.А. Суханова, Э.А. Цветков, Г.А. Новик // Педиатрическая фармакология. — 2012. — Т. 9, № 6. — С. 54-60.
17. Недельская С.Н., Ярцева Д.А. Контроль бронхиальной астмы у детей: определение и возможности достижения / С.Н. Недельская, Д.А. Ярцева // Клиническая иммунология. Аллергология. Инфектология. — 2011. — № 9–10. — С. 12-16.
18. Беш Л.В. Нове в діагностиці і терапії бронхіальної астми у дітей: практичний підхід до трактування найсучасніших вітчизняних та міжнародних узгоджувальних документів / Л.В. Беш // Здоров’я України. — 2014. — Лютий (тематичний номер). — С. 16-17.
19. Рекомендации Глобальной инициативы по борьбе с бронхиальной астмой (Global Initiative for Asthma, GINA), пересмотр 2009 г. // Клінічна імунологія. Алергологія. Інфектологія. — 2010. — № 5–6 (34–35). — С. 56-63.
20. Kimberlin D.W., Chin In.L., Jacob R.F. et al. Safety and efficacy of high-dose intravenous acyclovir in the management herpes implex virus infections / D.W. Kimberlin, In.L. Chin, R.F. Jacob [et al.] // Pediatrics. — № 108. — Р. 230-238.
21. Веселов А.В. Азитромицин: современные аспекты клинического применения / А.В. Веселов, Р.С. Козлов // Клиническая микробиология и антимикробная химиотерапия. — 2006. — Т. 8, № 1. — С. 18-32.
22. Adams O., Besken K., Oberdorfer C., MacKenzie C.R., Russing D., Daubener W. Inhibition of human herpes simplex virus type 2 by interferon gamma and tumor necrosis factor alpha is mediated by indoleamine 2,3-dioxygenase / O. Adams, K. Besken [et al.] // Microbes Infect. — 2004 Jul. — 6(9). — P. 806-812.
23. Illan H., Jacob N., Maiolo E., Cisterna D., Schiavelli R., Freire M.C. Antiviral sensitivity of herpes simplex virus in immunocompromised patients / H. Illan, N. Jacob, E. Maiolo, D. Cisterna, R. Schiavelli, M.C. Freire / [Article in Spanish] // Rev. Argent. Microbiol. — 2004. — № 36(2). — P. 88-91.
24. Кубанова А.А., Зудин А.Б. Герпетическая инфекция: особенности течения, диагностика, проблемы лекарственной резистентности: Посібник з хіміотерапії вірусних інфекцій; [навчально-методичний посібник для лікарів] / За ред. І.В. Дзюблик. — К., 2004. — 176 с.
25. Doward L.C. et al. The development of the herpes symptom checklist and the herpes outbreak impact Questionnaire / L.C. Doward [et al.] // Value in Health. — 2009. — Vol. 12(1). — Р. 139-145.
26. Шамсиев Ф.М., Мирсалихова Н.Х., Алимова К.И., Таджиханова Д.П. Состояние иммунного статуса и эффективность протефлазида в комплексной терапии детей с бронхолегочной патологией, ассоциированной с TORCH инфекцией / Ф.М. Шамсиев, Н.Х. Мирсалихова, К.И. Алимова, Д.П. Таджиханова // Современная педиатрия. — 2011. — № 2(36). — С. 39-41.
27. Крючко Т.О., Кінаш Ю.М. Актуальні питання лікування герпетичної інфекції у дітей / Т.О. Крючко, Ю.М. Кінаш // Перинатология и педиатрия. — 2006. — № 3(27). — С. 60-63.
28. Абатуров О.Є. Імунотропний ефект фітопрепарату «Флавозід» / О.Є. Абатуров, І.Л. Височина // Современная педиатрия. — 2008. — № 4(21). — С. 99-102.
29. Знаменська Т.К. Лікування герпесвірусних інфекцій (цитомегаловірусної, неонатального герпесу) у дітей першого року життя із застосуванням препарату Флавозід / Т.К. Знаменська, А.О. Писарєв // Здоровье женщины. — 2009. — № 4(40). — С. 60-61.
30. Koyama J., Morita I., Kobayashi N., Konoshima T., Takasaki M., Osakai T., Tokuda H. Correlation between oxidation potentials and inhibitory effects on Epstein-Barr virus activation of flavonoids / J. Koyama, I. Morita [et al.] // Cancer Lett. — 2008. — Vol. 263. — P. 61-66.
31. Nahmias Y., Goldwasser J., Casali M., van Poll D., Wakita T., Chung R.T., Yarmush M.L. // Apolipoprotein B-dependent hepatitis C virus secretion is inhibited by the grapefruit flavonoid naringenin / Y. Nahmias, J. Goldwasser, M. Casali, D. van Poll, T. Wakita, R.T. Chung, M.L. Yarmush // Hepatology. — 2008. — № 47. — P. 1437-1445.
32. Отчет Института эпидемиологии и инфекционных болезней: Проведение дополнительных доклинических испытаний препарата «Протефлазид». — К., 2002. — 48 с.
33. Зайцева С.В., Зайцева О.В. Бронхиальная астма у детей: пути оптимизации терапии / С.В. Зайцева, О.В. Зайцева: [Eлектронний ресурс]. — Режим доступу: http://www.osp.ru/doctor/2001/08/036_print.htm.
34. Дудник В.М. Патогенетичні особливості використання препаратів інтерферону в педіатрії // Інформаційний лист про нововведення в сфері охорони здоров’я. — 2013. — № 158. — Протокол № 1 від 30.04.2013.
35. Марушко Ю.В., Голубовська Ю.Є., Марушко Є.Ю. Застосування рекомбінантного інфтерферону альфа‑2β у педіатричній практиці // Здоровье ребенка. — 2016. — № 2(70). — С. 81-86.
36. Юлиш Е.И. Цитомегаловирусная инфекция у детей. Подходы к лечению при различном течении инфекционного процесса // Здоровье ребенка. — № 4(63). — С. 7-14.
37. Якобисяк М. Імунологія: Пер. з польської / За ред. В.В. Чоп’як. — Вінниця: Нова книга, 2004. — 672 с.

/31.jpg)
/32.jpg)