Журнал «Здоровье ребенка» 8 (76) 2016
Вернуться к номеру
Сосудисто-реологические свойства крови при геморрагическом васкулите, начавшемся в детском и взрослом возрасте
Авторы: Герасименко В.В.(1), Егудина Е.Д.(2), Чернышова О.Е.(1), Синяченко О.В.(1)
(1) — Донецкий национальный медицинский университет им. М. Горького, г. Лиман, Украина
(2) — ГУ «Днепропетровская медицинская академия», г. Днепр, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Внаслідок імунних запально-некротичних змін у стінках артеріол і капілярів у хворих на геморагічний васкуліт (ГВ) Шенлейна — Геноха виникає ендотеліальна дисфункція судин, що сприяє порушенням реологічних властивостей крові та процесів мікроциркуляції. Ці чинники залежать від віку пацієнтів, а у випадках початку захворювання в дитячому та дорослому віці залишаються невідомими. Мета дослідження: вивчити судинно-реологічні властивості сироватки крові при ГВ і зіставити показники в групах хворих із різним їх віком у дебюті патологічного процесу. Матеріали та методи. Під спостереженням перебувало 174 хворих на ГВ (83 % чоловіків і 17 % жінок). У 92 пацієнтів захворювання дебютувало в дитячому віці (в середньому в 12 років), а у 82 — у дорослому (у 25 років). І, ІІ і ІІІ ступені активності патологічного процесу встановлено у співвідношенні 1 : 2 : 2. Показники ендотеліальної функції судин досліджували імуноферментним методом, а адсорбційно-реологічні властивості крові — методом комп’ютерної тензіометрії. Результати. ГВ супроводжується вираженими порушеннями судинно-реологічних властивостей крові, які беруть участь в патогенетичних побудовах ураження шкіри (ендотелін-1, поверхневий натяг), суглобів (тільки поверхнева активність), нирок (простациклін, циклічний гуанозинмонофосфат) і серця (ендотелін-1, модуль в’язкоеластичності), причому на інтегральні показники ендотеліальної функції судин, в’язкопружних, поверхнево-активних і релаксаційних характеристик сироватки чинять вплив вік пацієнтів на початку хвороби, ступінь активності патологічного процесу, клінічна форма перебігу захворювання, некротично-виразковий і поліморфний варіанти шкірного васкуліту, а ГВ, що трансформувався з ювенільного, перебігає з меншим рівнем в крові ендотеліну-1, але з більшими концентраціями тромбоксану А2, циклічного гуанозинмонофосфату й показником поверхневої в’язкості. Висновки. Існують особливості змін судинно-реологічних властивостей сироватки крові при ГВ, який почався в дитячому та дорослому віці, що відрізняє ці групи хворих і за деякими ланками патогенезу захворювання.
Актуальность. Вследствие иммунных воспалительно-некротических изменений в стенках артериол и капилляров у больных геморрагическим васкулитом (ГВ) Шенлейна — Геноха возникает эндотелиальная дисфункция сосудов, способствующая нарушениям реологических свойств крови и процессов микроциркуляции. Эти факторы зависят от возраста пациентов, а в случаях начала заболевания в детском и взрослом возрасте остаются неизвестными. Цель исследования: изучить сосудисто-реологические свойства сыворотки крови при ГВ и сопоставить показатели в группах больных с разным их возрастом в дебюте патологического процесса. Материал и методы. Под наблюдением находилось 174 больных ГВ (83 % мужчин и 17 % женщин). У 92 пациентов заболевание дебютировало в детском возрасте (в среднем в 12 лет), а у 82 — во взрослом (в 25 лет). І, ІІ и ІІІ степени активности патологического процесса установлены в соотношении 1 : 2 : 2. Показатели эндотелиальной функции сосудов исследовали иммуноферментным методом, а адсорбционно-реологических свойств крови — методом компьютерной тензиометрии. Результаты. ГВ сопровождается выраженными нарушениями сосудисто-реологических свойств крови, которые участвуют в патогенетических построениях поражения кожи (эндотелин-1, поверхностное натяжение), суставов (только поверхностная активность), почек (простациклин, циклический гуанозинмонофосфат) и сердца (эндотелин-1, модуль вязкоэластичности), причем на интегральные показатели эндотелиальной функции сосудов, вязкоупругих, поверхностно-активных и релаксационных характеристик сыворотки оказывают влияние возраст пациентов в начале болезни, степень активности патологического процесса, клиническая форма течения заболевания, некротически-язвенный и полиморфный варианты кожного васкулита, а ГВ, трансформированный из ювенильного, протекает с меньшим уровнем в крови эндотелина-1, но с большими концентрациями тромбоксана А2, циклического гуанозинмонофосфата и показателем поверхностной вязкости. Выводы. Существуют особенности изменений сосудисто-реологических свойств сыворотки крови при ГВ, начавшемся в детском и взрослом возрасте, что отличает эти группы больных и по некоторым звеньям патогенеза заболевания.
Background. As a result of the immune-inflammatory necrotic changes in the walls of arterioles and capillaries in patients with hemorrhagic vasculitis (HV) Henoch — Schönlein endothelial dysfunction of vessels occurs, contributing to violations of blood rheological properties and microcirculation. These processes depend on the age of patients, and in cases of onset of the disease in childhood and adulthood are unknown. Objective: to study vascular and rheological properties of blood serum in HV and to compare the indices with different age of the debut of the pathological process in the groups of patients. Material and methods. The study included 174 patients with HV (83 % men and 17 % women). In 92 patients, the disease made its debut in childhood (on average in 12 years old), and in 82 — in the adult (on average in 25 years old). I, II and III degree of activity of pathological process are set at a ratio of 1 : 2 : 2. Indicators of vascular endothelial function were investigated by immune-enzyme analysis and the adsorption-rheological properties of blood were assessed by computer tensiometry. Results. HV is accompanied by severe disorders of the blood vascular and rheological properties which are involved in the pathogenesis of lesions of skin (endothelin-1, surface tension), joints (only surface activity), kidney (prostacyclin, cyclic guanosine monophosphate) and heart (endothelin-1, viscoelastic modulus). At that the integrated indicators of vascular endothelial function, viscoelastic, surface-active and relaxation characteristics of serum depend on the age of the patients in the beginning of the disease, the degree of activity of the pathological process, the clinical form of the disease course, necrotic-ulcerative and polymorphic variants of cutaneous vasculitis, and HV, transforming from juvenile, occurs with lower blood levels of endothelin-1, but with a higher concentration of thromboxane A2, cyclic guanosine monophosphate and surface viscosity index. Conclusions. There are features of vascular changes of rheological properties of blood serum in HV begun in childhood and adulthood that distinguishes these groups of patients and in some links of the pathogenesis of the disease.
васкуліт геморагічний; судини; кров; реологія; діти; дорослі
васкулит геморрагический; сосуды; кровь; реология; дети; взрослые
hemorrhagic vasculitis; vessels; blood; rheology; children; adults
Статья опубликована на с. 62-67
Введение
Материалы и методы
Результаты
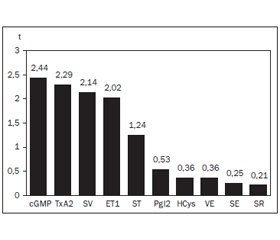
Обсуждение
/63.jpg)
/64.jpg)
/64_2.jpg)
Выводы
1. Albaramki J. Henoch-Schonlein purpura in childhood a fifteen-year experience at a tertiary hospital / J. Albaramki // J. Med. Liban. — 2016. — Vol. 64, № 1. — P. 13-17.
2. Barut K. Diagnostic approach and current treatment options in childhood vasculitis / K. Barut, S. Şahin, A. Adroviç, O. Kasapçopur // Turk. Pediatri Ars. — 2015. — Vol. 50, № 4. — P. 194-205.
3. Baskurt O.K. In vivo correlates of altered blood rheology / O.K. Baskurt // Biorheology. — 2008. — Vol. 45, № 6. — P. 629-638.
4. Calvo-Río V. Relapses in patients with Henoch-Schönlein purpura: Analysis of 417 patients from a single center / V. Calvo-Río, J.L. Hernández, F. Ortiz-Sanjuán [et al.] // Medicine. — 2016. — Vol. 95, № 28. — E. 4217.
5. Carman M. Henoch-Schönlein purpura in the ED / M. Carman, J. Forsman // Am. J. Nurs. — 2016. — Vol. 116, № 5. — P. 57-60.
6. Da Dalt L. Henoch-Schönlein purpura and drug and vaccine use in childhood: a case-control study / L. Da Dalt, C. Zerbinati, M.S. Strafella [et al.] // Ital. J. Pediatr. — 2016. — Vol. 42, № 1. — P. 60-70.
7. Elfving P. Estimating the incidence of connective tissue diseases and vasculitides in a defined population in Northern Savo area in 2010 / P. Elfving, O. Marjoniemi, H. Niinisalo [et al.] // Rheumatol. Int. — 2016. — Vol. 36, № 7. — P. 917-924.
8. Finke C. Plasma viscosity in giant cell arteritis / C. Finke, J. Schroeter, U. Kalus, C.J. Ploner // Eur. Neurol. — 2011. — Vol. 66, № 3. — P. 159-164.
9. Gaskill N. Recurrent adult onset Henoch-Schonlein purpura: a case report / N. Gaskill, B. Guido, C. Mago [et al.] // Dermatol. Online J. — 2016. — Vol. 22, № 8. — P. 163-169.
10. Gur G. Preschool education impact on child development / G. Gur, N. Cakar, S. Kiremitci [et al.] // Arch. Argent. Pediatr. — 2016. — Vol. 114, № 5. — P. 366-369.
11. Jelusić M. Vasculitides in childhood: a retrospective study in a period from 2002 to 2012 at the department of paediatrics, university hospital centre Zagreb / M. Jelusić, L. Kostić, M. Frković [et al.] // Reumatizam. — 2015. — Vol. 62, № 2. — P. 6-10.
12. Khanna G., Sargar K., Baszis K.W. Pediatric vasculitis: recognizing multisystemic manifestations at body imaging / G. Khanna, K. Sargar, K.W. Baszis // Radiographics. — 2015. — Vol. 35, № 3. — P. 849-865.
13. Lee J. Development and application of a one-dimensional blood flow model for microvascular networks / J. Lee, N. Smith // Proc. Inst. Mech. Eng. H. — 2011. — Vol. 222, № 4. — P. 487-511.
14. Macconi D. Methylprednisolone normalizes superoxide anion production by polymorphs from patients with ANCA-positive vasculitides / D. Macconi, A.F. Zanoli, S. Orisio // Kidney Int. — 2013. — Vol. 44, № 1. — P. 215-220.
15. Mao Y. Incidence and clinical features of paediatric vasculitis in Eastern China: 14-year retrospective study, 1999-2013 / Y. Mao, L. Yin, H. Xia [et al.] // J. Int. Med. Res. — 2016. — Vol. 44, № 3. — P. 710-717.
16. Martin E.M. Ultrasound-induced contraction of the carotid artery in vitro / E.M. Martin, F.A. Duck, R.E. Ellis, C.P. Winlove // Ultrasound. Med. Biol. — 2010. — Vol. 36, № 1. — P. 166-172.
17. Nijenhuis H.L. Enhanced endothelium-dependent microvascular responses in patients with Wegener’s granulomatosis / H.L. Nijenhuis, K. de Leeuw, A.J. Smit [et al.] // J. Rheumatol. — 2009. — Vol. 34, № 9. — P. 1875-1881.
18. Shulman K. Expression of vascular permeability factor (VPF/VEGF) is altered in many glomerular diseases / K. Shulman, S. Rosen, K. Tognazzi // J. Am. Soc. Nephrol. — 2006. — Vol. 7, № 5. — P. 661-666.
19. Tatlican S. Reduced erythrocyte deformability in active and untreated Behçet’s disease patients / S. Tatlican, F.S. Duran, C. Eren [et al.] // Int. J. Dermatol. — 2010. — Vol. 49, № 2. — P. 167-171.
20. Ushigome Y. IgA vasculitis with severe gastrointestinal symptoms may be an unusual manifestation of varicella-zoster virus reactivation / Y. Ushigome, Y. Yamazaki, T. Shiohara // Br. J. Dermatol. — 2016. — Vol. 12, № 8. — P. 173-178.

/63_2.jpg)
/65.jpg)