Статтю опубліковано на с. 179-184
В соответствии с рекомендациями Европейского общества кардиологов по лечению гипертрофической кардиомиопатии (ГКМП) [1] в настоящее время рассматривается несколько видов оперативного лечения, направленного на уменьшение обструкции выносящего тракта левого желудочка (ВТЛЖ):
— алкогольная абляция септальных ветвей левой коронарной артерии (ЛКА);
— септальная миэктомия;
— двухкамерная стимуляция из верхушки правого желудочка (ПЖ).
Однако последний метод ввиду исчезновения эффекта в отдаленном периоде утрачивает свои позиции. В настоящее время в соответствии с рекомендациями ESC имплантация двухкамерного электрокардиостимулятора (ЭКС) показана пожилым пациентам с обструктивной формой ГКМП при наличии синусового ритма, рефрактерным к медикаметозной терапии либо плохо толерирующим лечение β-блокаторами и верапамилом, которым противопоказано выполнение алкогольной абляции или миэктомии и у которых есть высокий риск развития атриовентрикулярной (АВ) блокады после данных процедур.
Немедикаментозные методы лечения обструктивной формы ГКМП, которые широко применяются в настоящее время, — это устранение обструкции путем иссечения (миэктомия) либо создания зоны миокардиосклероза — инфарцирование участка миокарда вследствие закрытия питающей гипертрофированный участок ветви коронарной артерии после введения этилового спирта (алкогольная абляция).
Алкогольная абляция септальных ветвей в целом является более щадящей процедурой, чем открытая миэктомия, хотя риск развития осложнений, самым частым из которых является полная АВ-блокада, в 2 раза выше. При этом такие осложнения миэктомии, как дефект межжелудочковой перегородки (МЖП) и тяжелая аортальная недостаточность, практически не встречаются. Важным ограничением данной методики является вариабельность анатомии коронарных артерий, вследствие которой у части пациентов данная процедура не может быть выполнена, еще у части не приносит желаемого результата. Применение алкогольной абляции септальных ветвей приводит к нарушению регионарной сократимости МЖП в области ВТЛЖ вследствие введения небольших доз спирта (0,5–0,7 мл вместо 3,0–5,0 мл при стандартной процедуре) без существенного уменьшения мышечной массы, к достоверному уменьшению пикового градиента.
Хирургическое лечение имеет преимущество в тех случаях, когда есть необходимость во вмешательствах на митральном клапане и папиллярных мышцах в связи с выраженной митральной недостаточностью.
Метаанализ публикаций по сравнению эффективности двух методов лечения на основании оценки лечения 351 пациента с ГКМП (183 — алкогольная абляция и 168 — миэктомия) свидетельствует о подобном влиянии на обструкцию выносящего тракта (градиент давления до вмешательства — 81 и 77 мм рт.ст., после — 18,2 и 10,8 мм рт.ст. соответственно). Но развитие нарушений проводимости, требующее установки пейсмейкера, наблюдалось достоверно чаще при алкогольной абляции (18,0 против 3,3 %).
В последние годы проводится поиск новых методов немедикаментозного лечения ГКМП, которые давали бы стойкий эффект при меньшей частоте побочных эффектов. Как альтернатива алкогольной абляции рассматривается возможность индукции нарушения регионарной сократимости МЖП другими методами, например эмболизацией септальных ветвей, холодовым воздействием или радиочастотным током, о чем имеются немногочисленные сообщения [2, 3].
Так, Lawrenz et al. в своей работе на 19 пациентах продемонстрировали, что радиочастотная абляция (РЧА) в области МЖП приводит к достоверному, существенному и устойчивому снижению пикового градиента на ВТЛЖ в сроки до полугода после выполнения процедуры [3]. При этом аппликации РЧА наносились как слева (9 пациентов), так и справа (10 пациентов) на площади не менее 2 см2, приводя к повреждению миокарда на глубину до 2 см с формированием зон миокардиофиброза по величине эквивалентных таковым при введении малых доз алкоголя без существенного уменьшения мышечной массы миокарда МЖП по данным магнитно-резонансной томографии (МРТ) сердца.
Преимуществом предложенной методики, помимо прямого воздействия в зоне интереса, является возможность наносить аппликации РЧА вне места прохождения проводящей системы сердца, что значительно сокращает риск развития АВ-блокады в периоперационном периоде. В ходе выполнения процедуры при помощи навигационной системы производилось картирование проводящей системы сердца, и воздействия наносились вне ее. Однако несмотря на это у 4 пациентов отмечено развитие стойкой полной АВ-блокады, потребовавшей имплантации ЭКС.
Ограничением предложенной методики является то, что выполнение РЧА без прямой визуализации при помощи внутрисердечного или чреспищеводного ультразвукового исследования (УЗИ) не позволяет в полной мере влиять на такой механизм динамической обструкции, как систолическое движение передней створки митрального клапана, поскольку самая толстая часть МЖП может не быть местом смыкания со створкой. Следовательно, для обеспечения надежного воздействия необходим больший объем повреждения миокарда, что увеличивает длительность процедуры и риск осложнений. Учитывая изложенное, Cooper et al. выполнили РЧА МЖП под контролем внутрисердечной эхокардиографии (ЭхоКГ), при этом местом основного воздействия было место смыкания МЖП и створки митрального клапана [4]. Применение данной методики позволило достоверно снизить пиковый градиент как в покое, так и после провокации физической нагрузкой, улучшить переносимость физической нагрузки, снизить функциональный класс хронической сердечной недостаточности при значительно меньшем объеме повреждения миокарда по данным МРТ сердца. В этой группе больных развитие АВ-блокады отмечено не было, хотя утверждать о большей безопасности данного подхода нельзя вследствие малой выборки. Кроме того, использование прямой визуализации в ходе процедуры также позволяет проводить непрерывный мониторинг осложнений, в первую очередь таких, как гемоперикард.
Описание клинического случая
Больной Х., 53 года, поступил с жалобами на боли за грудиной, головокружение, одышку при незначительной нагрузке, иногда в покое.
Боли в сердце беспокоят с 2000 года, тогда же отмечено значительное повышение артериального давления (АД). В 2008 году диагностирована ГКМП. Больной неоднократно проходил стационарное лечение в Институте терапии АМН Украины, ГКБ № 8. Весь период наблюдения в ХГКБ № 8 с 2012 г. больной регулярно принимал лечение, включающее бета-блокаторы, сартаны, статины и антитромбоцитарные препараты. В 2010, 2013 годах в Институте сердечно-сосудистой хирургии НАМН Украины выполнены алкогольные абляции септальных ветвей ЛКА. Следует отметить, что в ближайший период после второй абляции было существенное снижение градиента давления на выносящем тракте с 95 мм рт.ст. до вмешательства до 31 мм рт.ст. через 10 дней, что сопровождалось положительной динамикой клинических проявлений. Однако состояние ухудшилось в течение 1,5–2 мес., когда участились боли за грудиной, одышка, резко снизилась толерантность к физической нагрузке. При проведении контрольного ультразвукового исследования выявлена выраженная обструкция с градиентом давления 90 мм рт.ст. От проведения миоэктомии пациент отказался, показаний к реконструктивным операциям на митральном клапане и папиллярных мышцах вследствие отсутствия значимой митральной недостаточности выявлено не было. В связи с неэффективностью проводимой терапии, нарастанием обструкции, сопровождающейся усугублением синдрома стенокардии, появлением пресинкопальных состояний пациенту предложено оперативное лечение методом РЧА.
При поступлении в ГУ «Институт общей и неотложной хирургии им. В.Т. Зайцева НАМН Украины» больной предъявляет жалобы на выраженную одышку при малейшей нагрузке, ангинозные боли несколько раз в сутки (до 5–7) при незначительной нагрузке, иногда в покое, приступы резкой слабости, головокружения, пресинкопальные эпизоды.
Объективно. Общее состояние средней степени тяжести. Сознание ясное. Положение активное. Частота дыхательных движений — 18 в 1 минуту. Аускультативно дыхание везикулярное, тоны сердца приглушены, ритмичные, акцент 2-го тона на аорте, грубый систолический шум, частота сердечных сокращений (ЧСС) — 64 уд/мин, АД — 130/80 мм рт.ст.
В лабораторных исследованиях значимых отклонений выявлено не было.
На электрокардиографии (ЭКГ) покоя на фоне синусового ритма регистрируется гипертрофия и перегрузка миокарда ЛЖ (рис. 1).
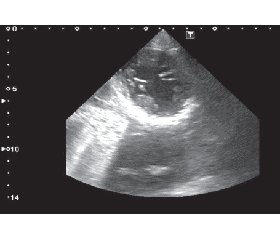
При ЭхоКГ отмечена обструкция ВТЛЖ с пиковым градиентом в состоянии покоя порядка 90 мм рт.ст. и градиентом после провокации физической нагрузки (5 приседаний) выше 150 мм рт.ст. (рис. 2).
Также регистрируется систолическое смещение передней створки митрального клапана в сторону выпячивания, приводящее к дополнительной обструкции в области ВТЛЖ. При этом не регистрируется выраженная митральная регургитация.
РЧА выполнялась под рентген-контролем передвижной станции Phillips BV Pulsera (Phillips Healthcare, Netherlands) с минимизацией лучевой нагрузки благодаря использованию импульс–но-волнового режима ЕР (Electrophysiology). Регистрация внутрисердечных ЭГ и стимуляция сердца производилась при помощи электрофизиологической системы EP Work Mate (St. Jude Medica, USA) различными диагностическими катетерами. РЧА выполнялась аблятором IBI-1500 (Irvine Biomedical, USA) орошаемыми катетерами разных производителей (NAVISTAR® THERMOCOOL® Catheter, Biosense Webster, USA и IBI Therapy™ Cool Path™ Ablation Catheter, St. Jude Medica, USA). Мощность радиочастотного воздействия варьировала от 25 до 55 Вт при общей длительности воздействия 28 мин 47 с. Скорость охлаждения варьировала от 13 до 30 мл/мин, в среднем составляя 15 мл/мин. Применялись два типа контроля РЧА: по мощности (manual) — c постоянной подачей заданной мощности, и по температуре — с постепенным нарастанием мощности. 3D-реконструкция камер сердца осуществлялась при помощи кардионавигационной системы EnSite Velocity (St. Jude Medical, USA). Внутрисердечное ультразвуковое исследование производилось на аппарате Siemens Acuson Cypress (Siemens Healthcare, USA) с использованием специальных внутрисердечных датчиков AcuNav 8F и 10F (Siemens Medical Solutions, USA). Чрес–пищеводная ЭхоКГ проводилась при помощи аппарата Esaote MyLab Alfa (Esaote SpA, Italy).
Пациенту были выполнены пункции vv.femo–rales dextra et sinistra, v.subclavia dextra, a.femoralis dextra. Через подключичный доступ диагностический катетер проведен в коронарный синус, использован в качестве референта для кардионавигационной системы. Через левый бедренный доступ датчик внутрисердечного УЗИ проведен в правое предсердие (ПП). Правым бедренным доступом при помощи абляционного катетера выполнено электрофизиологическое картирование полостей ПЖ и ЛЖ с обозначением проводящей системы сердца (рис. 3).
Под контролем внутрисердечного и чреспищеводного УЗИ выполнены аппликации РЧА в области МЖП со стороны как ПЖ, так и ЛЖ, включая биполярную РЧА между абляционными электродами в обоих выходных трактах (рис. 4).
В ходе процедуры отмечено снижение пикового градиента на ВТЛЖ с 85–90 до 45 мм рт.ст. Непосредственно перед окончанием операции отмечено снижение системной гемодинамики, при чреспищеводной и трансторакальной ЭхоКГ диагностирован гемоперикард, выполнены пункция и дренирование перикарда, гемодинамика стабилизирована, перикардиальный дренаж удален в первые сутки послеоперационного периода.
В дальнейшем течение послеоперационного периода без особенностей: больной активизирован в первые сутки, при динамическом наблюдении больной кардиореспираторно компенсирован, при ЭхоКГ сохраняется обструкция ВТЛЖ с пиковым градиентом в покое до 50 мм рт.ст. Для продолжения лечения больной переведен в кардиологический стационар с рекомендациями продолжить прием β-блокаторов.
Больной обследован через год в ХГКБ № 8. Состояние оценивает как удовлетворительное, вернулся на работу. Сохраняются жалобы на одышку при умеренной физической нагрузке, ангинозные боли беспокоят значительно реже при нагрузке (1–2 раза в неделю), исчезли в покое, синкопальных и пресинкопальных эпизодов нет.
Однако в отдаленном периоде при ультразвуковом исследовании отмечается некоторое нарастание градиента давления на выносящем тракте по сравнению с послеоперационным периодом (70 мм рт.ст. по сравнению с 50 мм рт.ст. накануне операции), но это ниже, чем перед вмешательством (90 мм рт.ст.). Положительным моментом является и некоторое улучшение диастолической функции в послеоперационном периоде с переходом рестриктивного типа нарушения диастолы в псевдонормальный, а также отсутствие признаков прогрессирования гипертрофии перегородки (2,3 см до операции и при контрольном обследовании) на фоне незначительного уменьшения размеров левого предсердия (4,5 см до и 4,4 см при контрольном обследовании).
Таким образом, данный клинический пример свидетельствует о возможности и эффективности радиочастотной абляции в условиях 3D-кардионавигационной системы, выполняемой под контролем внутрисердечного и/или чрес–пищеводного ультразвукового исследования, с обеспечением снижения градиента давления на выносящем тракте в течение года у больного с недостаточной эффективностью двух алкогольных абляций.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/181-1.gif)
/181-2.gif)
/182-1.gif)
/182-2.gif)