Гипертрофическая кардиомиопатия (ГКМП) диагностируется при наличии утолщения стенки левого желудочка (ЛЖ), которое не связано исключительно с его перегрузкой [21]. При апикальной ГКМП (АГКМП) гипертрофия миокарда в основном обнаруживается в области верхушки ЛЖ. Впервые электро- и эхокардиографические особенности АГКМП описали Т. Sakamoto и соавторы [51], а Н. Yamaguchi и соавторы впервые описали синдром и его вентрикулографические особенности [61]. Распространенность АГКМП в Японии составляет 13–25 % [35, 50], в европейской популяции — 3–11 % среди всех больных с ГКМП [22, 35].
Приводим случай семейной АГКМП.
Пациент Т., 60 лет, был проконсультирован в экспертном консультативно-диагностическом центре миокардита и кардиомиопатий и госпитализирован в отделение некоронарных болезней сердца и ревматологии ГУ «ННЦ «Институт кардиологии им. акад. Н.Д. Стражеско» НАМН Украины» 27.09.2016 с жалобами на одышку при обычной физической нагрузке, ощущение неритмичного сердцебиения и общую слабость.
Anamnesis morbi. Более десяти лет страдает гипертонической болезнью (ГБ) с максимальным повышением артериального давления (АД) до 200/100 мм рт.ст. С 2009 года отмечались эпизоды учащенного неритмичного сердцебиения. За медицинской помощью не обращался, регулярно медикаментозно не лечился.
Из представленной медицинской документации следует, что в 2010 году пациент перенес не-Q-инфаркт миокарда передней стенки ЛЖ, в том же году была впервые диагностирована фибрилляция предсердий (ФП), восстановление синусового ритма не проводилось. В 2010, 2013 и 2016 г. перенес острое нарушение мозгового кровообращения (ОНМК). После курса лечения по поводу третьего ОНМК (ишемический инсульт в бассейне правой средней мозговой артерии с левосторонним гемипарезом, псевдобульбарным синдромом от 10.01.2016) пациент был направлен в санаторно-реабилитационный центр, откуда в связи с появлением болевых ощущений в загрудинной области (в течение 1-й недели) и отрицательной ЭКГ-динамики (не описана подробно, ЭКГ-архив отсутствует) 10.02.2016 был переведен в кардиологическое отделение с целью исключения острого коронарного синдрома, анализ крови не выявил повышенного уровня тропонина Т. При проведении эхокардиографического (ЭхоКГ) исследования впервые выявлено утолщение межжелудочковой перегородки (МЖП) до 2,2 см, задней стенки (ЗСт) ЛЖ до 1,3 см, уменьшение фракции выброса (ФВ) ЛЖ до 45 %, наличие гиперэхогенных включений в толще миокарда. При магнитно-резонансной визуализации (МРВ) сердца с контрастированием гадолинием были выявлены гипертрофия ЛЖ с апикальной систолической обструкцией полости, диффузное «пятнистое» усиление миокарда ЛЖ с задержкой вымывания контраста, что позволило заподозрить болезнь накопления (кардиальный амилоидоз?). Кроме того, при исследовании обнаружены признаки перенесенного не-Q-инфаркта миокарда в бассейне левой коронарной артерии (сегмент S8).
Для определения степени атеросклеротического поражения венечных артерий выполнена коронаровентрикулография (18.02.2016) — гемодинамически значимых изменений коронарных сосудов не выявлено, стеноз проксимального отдела левой коронарной артерии до 30 %.
С подозрением на амилоидоз сердца был направлен в нашу клинику.
Anamnesis vitae. Вредные привычки отрицает. Со слов пациента, среди родственников не было случаев внезапной сердечной смерти или заболевания сердца в молодом возрасте.
Объективно при поступлении в стационар: общее состояние удовлетворительное. Рост 176 см, масса 85 кг, индекс массы тела 27,4 кг/м2. Кожные покровы с бледным оттенком, обычной влажности, тургор сохранен.
Границы относительной сердечной тупости: правая — по правому краю грудины, верхняя — на уровне 3-го межреберья по левой парастернальной линии, левая — по среднеключичной линии. При аускультации ритм сердца неправильный, над всей зоной относительной сердечной тупости выслушивается мягкий систолический шум с максимумом на верхушке. Грудная клетка симметрично участвует в акте дыхания, перкуторно легочный звук, при аускультации дыхание везикулярное, хрипы не выслушиваются, дыхание несколько ослабленное, симметрично в нижних отделах, выдох умеренно удлинен.
АД на правой и левой руках 160/100 мм рт.ст. (на фоне приема бисопролола 5 мг и амлодипина 5 мг).
Язык чистый, влажный. Живот участвует в акте дыхания, при пальпации мягкий, безболезненный. Печень не увеличена.
Общий анализ крови и мочи — без патологии. Биохимический анализ крови: уровень глюкозы крови — 4,6 ммоль/л, уровень холестерина — 4,5 ммоль/л.
На электрокардиограмме (ЭКГ) зарегистрирован ритм фибрилляции предсердий со средней частотой сокращения желудочков 60–82 уд/мин; признаки гипертрофии ЛЖ, подъем сегмента ST до 1,5 мм в отведениях V1–V2, отрицательные зубцы Т в отведениях V3–6; депрессия сегмента ST до 1–2 мм в отведениях V4–6 (рис. 1).
При суточном мониторировании АД средние величины активного периода составляли 142/97 мм рт.ст., пассивного периода — 131/84 мм рт.ст.
При суточном мониторировании ЭКГ регистрировалась постоянная ФП, значимых нарушений ритма и проводимости зарегистрировано не было.
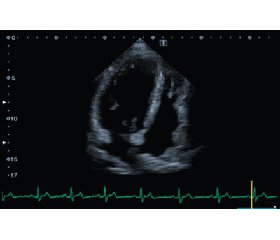
Результаты эхокардиографического исследования: диаметр корня аорты — 37 мм, конечно-диастолический объем (КДО) ЛЖ — 80 мл, конечно-систолический объем (КСО) ЛЖ — 47 мл, ударный объем (УО) — 33 мл, ФВ — 41 %. Толщина МЖП в диастолу от 2,1–2,5 см, толщина ЗСт ЛЖ — 1,2 см. Отмечалось выраженное утолщение до 2,9 см и гипокинез верхушечной области ЛЖ. Наблюдалась выраженная дилатация левого предсердия (ЛП), конечно-диастолический размер — 4,5 см, индекс объема ЛП — 59 мл/м2. Не отмечалось значимого утолщения стенки правого желудочка (0,6 см). Таким образом, при эхокардиографическом исследовании была диагностирована апикальная форма ГКМП (рис. 2).
Для оценки геометрии сокращения левых отделов сердца был использован метод спекл-трекинг эхокардиографии (СТЭхоКГ) по описанной нами ранее методике [2]. Определяли продольную глобальную систолическую деформацию (ПГСД) ЛЖ (норма ≥ 17 %), систолическую деформацию ЛП (СДЛП, норма ≥ 36 %) и оценивали его резервуарную функцию.
Данные СТЭхоКГ подтверждали и уточняли характер поражения сердца у пациента с АГКМП. При сканировании сердца из апикального доступа отмечено значительное уменьшение глобальной систолической деформации ЛЖ (рис. 3).
При сканировании ЛП отмечено значительное уменьшение систолической деформации ЛП, что свидетельствовало об ухудшении резервуарной функции ЛП (рис. 4).
Пациент был проконсультирован неврологом, диагноз и тактика лечения согласованы.
Пациент был выписан из отделения с диагнозом «ГКМП, необструктивная форма, апикальный тип. Постоянная форма фибрилляции предсердий, нормосистолический вариант. Гипертоническая болезнь ІІІ стадии, степень 2, риск IV (очень высокий). Ишемическая болезнь сердца (ИБС): пост–инфарктный (не-Q-инфаркт миокарда, 2010 г.) кардиосклероз. Сердечная недостаточность (СН) ІІА ст. со снижением систолической функции ЛЖ. Цереброваскулярное заболевание. Ишемические кардиоэмболические инсульты в бассейне левой среднемозговой артерии (2010 г.), в бассейне правой среднемозговой артерии (2014, 2016 г.). Синдром когнитивных нарушений (MMSE 24 б.). Левосторонний спастический гемипарез, атаксия, астенодепрессивный синдром».
В отделении пациент получал лечение: ривароксабан 20 мг/сут, бисопролол 5 мг 2 р/сут, амлодипин 5 мг/сут, аторвастатин 10 мг/сут, рамиприл 10 мг/сут. На фоне проводимого лечения состояние пациента улучшилось: уменьшилась одышка, расширился объем физической активности. Выписан с рекомендациями дальнейшего приема назначенной терапии.
Принимая во внимание наследственный характер ГКМП, нами были обследованы два сына пациента.
Старший сын Д., 30 лет, жалоб не предъявлял. При подробном расспросе указал на некоторую «ненормальность» ЭКГ, выявленную при профилактическом осмотре, однако ввиду отсутствия жалоб диагностическим поиском он не занимался. Иногда отмечал повышение АД, но не обследовался.
При объективном осмотре обращала на себя внимание артериальная гипертензия 168/112 мм рт.ст., был проконсультирован офтальмологом, диагностирована ангиопатия сетчаток по гипертоническому типу. Также выполнялось суточное мониторирование АД. Показатели активного периода мониторирования в среднем составляли 149/96 мм рт.ст., пассивного — 123/77 мм рт.ст.
При записи ЭКГ в 12 отведениях выявлены типичные гигантские отрицательные зубцы Т, характерные для апикальной ГКМП (рис. 5).
При суточном мониторировании ЭКГ значимых желудочковых нарушений ритма выявлено не было, однако отмечалась высокая вариабельность частоты сердечных сокращений (ЧСС) с замедлением в ночные и утренние часы до 47/мин и учащением до 132/мин днем (средняя ЧСС составила 74/мин). При скрининговом исследовании лабораторных данных патологии не выявлено.
Результаты ЭхоКГ: диаметр корня аорты — 32 мм, КДО ЛЖ — 101 мл, КСО ЛЖ — 28 мл, УО — 73 мл, ФВ — 72 %. То есть ЛЖ был нормальных размеров, имелась гипердинамическая систолическая функция. Толщина МЖП в диастолу — от 1,3–1,8 см, толщина ЗСт ЛЖ — 1,2 см. Отмечалось выраженное утолщение до 2,4 см и гипокинез верхушечной области ЛЖ (рис. 6). Наблюдалась умеренная дилатация ЛП, конечно-диастолический размер ЛП — 4,4 см, индекс объема ЛП — 35 мл/м2. Таким образом, при эхокардиографическом исследовании у старшего сына была также впервые диагностирована апикальная форма ГКМП.
Методом СТЭхоКГ было выявлено уменьшение продольной деформации ЛЖ (рис. 7), а также величины систолической деформации ЛП, что свидетельствовало об умеренном нарушении резервуарной функции ЛП (рис. 8).
Старшему сыну был рекомендован длительный прием метопролола в суточной дозе 37,5 мг (25 мг утром и 12,5 мг в послеобеденные часы, с учетом данных суточного мониторинга ЭКГ), ежегодное обследование с записью ЭКГ и ЭхоКГ.
Младший сын Е., 26 лет, жалоб не предъявлял. С детства до настоящего времени занимается спортивными танцами. При объективном осмотре АД 120/70 мм рт.ст. ЭКГ в 12 отведениях представлена на рис. 9.
При эхокардиографии показатели соответствовали возрастной норме (рис. 10): диаметр корня аорты — 29 мм, КДО ЛЖ — 134 мл, КСО ЛЖ — 47 мл, УО — 87 мл, ФВ — 64 %. Толщина МЖП в диастолу — 0,9 см, толщина ЗСт ЛЖ — 0,9 см. Конечно-диастолический размер ЛП — 3,4 см, индекс объема ЛП — 29 мл/м2.
Результаты СТЭхоКГ не выявили нарушения продольной деформации ЛЖ и резервуарной функции ЛП (рис. 11, 12).
Обсуждение
Согласно определению, ГКМП — наследуемое заболевание с увеличением толщины стенки ЛЖ (≥ 15 мм в одном и более сегментах миокарда ЛЖ), которое не вызвано нарушением условий его наполнения (артериальная гипертензия, аортальный стеноз и др.) [12, 20].
АГКМП является наиболее редкой и сложной для диагностики формой гипертрофической кардиомиопатии, в патологический процесс может быть изолированно вовлечена анатомическая верхушка ЛЖ или также апикальная треть МЖП [17, 22, 33, 41, 62].
Возникновение АГКМП часто носит спорадический характер (вызывается случайными мутациями), однако было описано несколько семей с аутосомно-доминантным типом наследования, идентифицирована мутация саркомерного гена (мутация E101K кардиального α-актина) [10]. Молекулярно-генетическая экспертиза является золотым стандартом диагностики ГКМП [20], однако в Украине она практически не используется.
Клинические проявления АГКМП встречаются обычно в возрасте 41,4 ± 14,5 года, выражены более слабо по сравнению с другими (обструктивными) формами ГКМП, чаще болеют мужчины [3, 22]. Жалобы больных при АГКМП разнообразны и неспецифичны, преимущественно это боль в груди, одышка при физической нагрузке, сердцебиения, перебои в работе сердца [22]. Кардиалгии являются наиболее частыми жалобами (у 40–50 % больных) и у 20 % носят ангинозный характер. Боль в сердце при ГКМП возникает вследствие субэндокардиальной ишемии, обусловленной диастолической компрессией интрамиокардиальных коронарных артерий при повышении конечно-диастолического давления в ЛЖ и напряжения его стенки, относительного уменьшения плотности капилляров в гипертрофированном миокарде, первичного поражения мелких коронарных артерий с гипертрофией медии, а также наличия мышечных мостиков в коронарных сосудах [3]. При повышении индекса массы ЛЖ до критического уровня уменьшается удельная перфузия миокарда, не происходит адекватного нагрузке увеличения кровоснабжения гипертрофированной сердечной мышцы [22].
Одышка наблюдается при физической нагрузке в 15–30 % случаев. Причиной ее развития при ГКМП является диастолическая дисфункция, в значительно меньшей степени — нарушение сократительной способности ЛЖ [3, 5, 22]. У больных с АГКМП редко бывают головокружения, синкопальные состояния практически не возникают.
Появление аритмий, как правило, утяжеляет клиническую картину и во многом определяет прогноз заболевания — увеличивает риск развития инсульта, общую смертность и способствует прогрессированию сердечной недостаточности (СН) [39]. У больных с АГКМП высокий риск развития фибрилляции предсердий, пароксизмальной предсердной тахикардии, желудочковых нарушений ритма (желудочковой тахикардии или фибрилляции желудочков) [5, 22, 28, 60]. Больные могут жаловаться на внезапные приступы сердцебиения различной продолжительности, хотя короткие эпизоды могут протекать бессимптомно. ФП — наиболее распространенная устойчивая аритмия среди пациентов, страдающих ГКМП, и ее частота составляет 14–28 % [29], а у лиц старше 70 лет достигает 40 % [29, 46, 53, 58]. Более низкая эффективность купирования ФП у больных ГКМП (варьирующая от 45 до 82 % в отдаленном периоде) обусловлена выраженным ремоделированием ЛП — его гипертрофией, дилатацией и наличием фиброзных зон [14].
Появление постоянной формы ФП является прогностически неблагоприятным признаком — распространенность тромбоэмболических осложнений у больных ГКМП с ФП достигает 30 % с ежегодной частотой 3,75 % на 100 пациентов/год [60]. В частности, появление ФП у таких больных увеличивает риск ишемического инсульта в 8 раз, этот показатель не зависит от формы аритмии (пароксизмальная, хроническая) или количества пароксизмов ФП [46].
При проведении кардиопульмонального нагрузочного теста у больных с ГКМП и ФП было отмечено значительное снижение функциональной способности [53]. Это связано с тем, что при ГКМП изначально наблюдается диастолическая дисфункция ЛЖ, а с появлением ФП, то есть утратой скоординированной систолы предсердий, наполнение желудочков существенно ухудшается, что усугубляет СН, особенно в условиях физической нагрузки.
Диагностика АГКМП без проведения адекватного инструментального обследования достаточно затруднена, так как часть больных вообще не имеют никаких жалоб (по данным исследования CARDIA, их имели только 14 % больных с эхокардиографическими признаками ГКМП) [52].
Ведущее значение в выявлении ГКМП принадлежит ЭКГ и ЭхоКГ, которые в большинстве случаев позволяют поставить правильный диагноз [23, 41, 51, 61].
Изменения на ЭКГ регистрируются у 92–97 % больных с АГКМП [41]. Для АГКМП наряду с вольтажными признаками гипертрофии ЛЖ характерны нарушения процессов реполяризации — глубокие (гигантские) более 10 мм отрицательные зубцы Т в левых грудных отведениях, иногда в отведениях от конечностей, с одновременной глубокой косонисходящей депрессией сегмента ST [3, 5, 22, 62]. Выраженная гипертрофия МЖП приводит к появлению патологических зубцов Q, что может обусловить ошибочную диагностику острого инфаркта миокарда. Патологические зубцы Q при ГКМП –обычно глубокие, но не уширенные и остроконечные, регистрируются в отведениях II, III, avF, в левых грудных отведениях, иногда в отведениях V3–V4. Одновременно может уменьшаться амплитуда зубцов R в отведениях V2–V4.
У нашего пациента и его старшего сына на ЭКГ на фоне гипертрофии ЛЖ имелись гигантские негативные зубцы T с максимальной глубиной 10 и 17 мм соответственно, что позволяло заподозрить у них наличие АГКМП. Для больных с амилоидозом сердца характерна низковольтажная ЭКГ [4].
При холтеровском мониторировании ЭКГ выявляются предсердные и желудочковые аритмии, а также эпизоды ишемии миокарда. Для выявления нарушений ритма всем больным с ГКМП показано проведение холтеровского мониторирования ЭКГ в течение 48 ч [20].
Методом выбора в диагностике АГКМП является ЭхоКГ.
Диагностические критерии включают наличие асимметричной гипертрофии в области верхушки ЛЖ с апикальной толщиной стенки ≥ 15 мм, соотношение максимальной толщины верхушки к задней стенке в диастолу составляет ≥ 1,5 мм на основании эхокардиограммы или МРВ [22]. Секторальное сканирование в проекции по длинной оси позволяет обнаружить характерную для этого заболевания выраженную гипертрофию апикальных сегментов и свободной стенки ЛЖ, включая папиллярные мышцы, из-за чего полость желудочка в конце диастолы приобретает своеобразную форму карточной «пиковой масти» или «туза червей» в нижней трети желудочка, с острием «пики» в области верхушки, описанную H. Yamaguchi с соавторами (1979) [61]. Отличительной особенностью является также гипокинезия гипертрофированного участка. Рекомендовано определение максимальной толщины стенки в проекции по короткой оси сердца во всех сегментах ЛЖ от базального отдела до верхушки [20]. Помимо оценки типа гипертрофии ЛЖ (асимметричная, симметричная), с помощью ЭхоКГ возможно оценить аппарат митрального клапана, наличие обструкции выносящего тракта ЛЖ, диастолическую дисфункцию ЛЖ [20].
При АГКМП возможна обструкция в нижней трети ЛЖ, обусловленная наличием мышечного жома или туннеля, разделяющая полость ЛЖ на две камеры — базальную и апикальную. При ретроградном токе крови из базальной камеры в апикальную возможно формирование аневризмы верхушки ЛЖ с формированием тромбов и последующими эмболиями, что является одним из факторов риска развития внезапной сердечной смерти [16, 43, 47].
Изолированное поражение верхушки ЛЖ при апикальной ГКМП создает трудности диагностики при ЭхоКГ приблизительно у половины пациентов, поскольку эта область наименее доступна для визуализации, особенно в случае плохого акустического окна. Гипокинез гипертрофированной верхушки ЛЖ при неоптимальной визуализации эндокарда может трактоваться врачами как аневризма ЛЖ, что в сочетании с изменениями на ЭКГ и клиническими симптомами (ангинозные боли) приводит к постановке ошибочного диагноза перенесенного инфаркта миокарда.
При невозможности получить качественное изображение верхушки ЛЖ лучшую визуализацию можно получить с помощью контрастной эхокардио–графии для установления диагноза [49].
В последние годы интенсивно развиваются новые эхокардиографические технологии. У больных с АГКМП двухмерная СТЭхоКГ позволяет оценивать апикальную деформацию ЛЖ [32]. Радиальная сократительная функция (ФВ или фракционное укорочение) у пациентов с ГКМП обычно нормальная или повышенная. Однако ФВ не является оптимальным параметром оценки систолической функции при наличии гипертрофии ЛЖ [20, 40]. Параметры продольной деформации и ее скорости (стрейна), полученные с помощью СТЭхоКГ, часто снижены, несмотря на нормальную ФВ, и могут нарушаться до развития утолщения стенки, продольная деформация типично уменьшена в участке гипертрофии [6, 20, 59].
При ГКМП отмечаются существенные нарушения диастолической функции, в частности снижение максимальной скорости наполнения, уменьшение продолжительности фазы быстрого наполнения и уменьшение индекса объемной податливости (отношение объема наполнения в первой трети диастолы до объема наполнения во вторую треть диастолы). При ГКМП нарушение диастолы может развиваться как по гипертрофическому, так и по рестриктивному типу, последний является следствием сочетания гипертрофии с выраженными фиброзными процессами.
Увеличение размера и объема ЛП ассоциируется с возникновением или рецидивом ФП [29, 46]. Однако до сих пор не ясно: увеличивается ли ЛП перед появлением ФП или его дилатация носит вторичный к аритмии характер [39]. Рассматривают несколько причин, ответственных за увеличение ЛП. В частности, характерная для ГКМП диастолическая дисфункция ЛЖ приводит к повышению давления наполнения в ЛП и, в свою очередь, его ремоделированию и дилатации [1]. Кроме того, увеличение ЛП при ГКМП обусловлено первичной саркомерной миопатией миокарда предсердий, обструкцией выносящего тракта ЛЖ, повышением жесткости миокарда, митральной регургитацией. При проспективном исследовании 427 больных ГКМП, у 41 из которых в дальнейшем развилась ФП уже после включения в исследование, ФВ ЛП и его конечно-диастолический объем были важными маркерами предрасположенности к ФП [26]. Среди показателей, сочетающихся с ФП, также важны размер и индекс объема ЛП, соотношение Е/Е, отражающие наличие и степень диастолической дисфункции [48].
Информативным методом выявления АГКМП является магнитно-резонансная томография (МРТ) сердца. Метод позволяет с большой точностью определять морфофункциональные особенности сердца: толщину стенок, локализацию гипертрофии миокарда, размеры камер сердца, ФВ, степень фиброза миокарда, четко визуализировать эндокардиальную поверхность миокарда и верхушку ЛЖ в случаях плохого акустического окна [3, 8].
Для диагностики АГКМП может быть использована мультиспиральная компьютерная томография: кроме диагностики она предоставляет информацию относительно анатомии сердца, функции и коронарных артерий [63].
Лечение
В зависимости от наличия или отсутствия градиента систолического давления в полости ЛЖ ГКМП разделяют на обструктивную и необструктивную, что имеет важное практическое значение при выборе тактики лечения.
Бета-блокаторы (ББ) стали первой и остаются по сей день наиболее эффективной группой лекарственных средств, применяемых в лечении ГКМП. Рекомендованы ББ без вазодилатирующего эффекта с титрованием до максимально переносимых доз в качестве препаратов первой линии для уменьшения выраженности симптомов у пациентов с обструкцией выводного тракта (ОВТ) ЛЖ в покое или при провокации и у симптомных больных с АГКМП [13, 20, 22, 30]. Они оказывают хороший симптоматический эффект в отношении основных клинических проявлений: одышки и сердцебиения, болевого синдрома, включая стенокардию, не менее чем у половины больных ГКМП, что обусловлено в основном их способностью уменьшать потребность миокарда в кислороде. Хотя ББ не оказывают прямого влияния на диастолическое расслабление миокарда, они могут улучшать наполнение ЛЖ за счет уменьшения частоты сердечных сокращений и предупреждения ишемии сердечной мышцы [5].
Верапамил с титрованием до максимально переносимых доз рекомендован для уменьшения выраженности симптомов у пациентов с ОВТ ЛЖ в покое или при провокации, которые нечувствительны к ББ или имеют противопоказания к их применению [13, 20, 22]. Верапамил способствует уменьшению ишемии миокарда, в том числе безболевой, и улучшает его диастолическое расслабление и податливость ЛЖ. Верапамил или дилтиазем следует применять лишь при условии нормальной ФВ ЛЖ [9].
Aмиодарон и прокаинамид используются при ФП и желудочковых аритмиях [44].
Дигоксин может применяться самостоятельно или в комбинации с ББ при отсутствии выраженной обструкции выносящего тракта для контроля ЧСС у пациентов с ФП и ФВ < 50 %, хотя данные о его эффективности в этом контексте отсутствуют [20].
С целью предупреждения тромбоэмболий при отсутствии противопоказаний пероральные антикоагулянты показаны всем пациентам с ГКМП с пароксизмальной, персистирующей и постоянной формой ФП [20]. При этом не рекомендуется применять шкалу CHA2-DS2-VASC для оценки риска тромбоэмболических осложнений [39], так как при ГКМП она не обеспечивает эффективную стратификацию риска [29]. Новые антикоагулянты — прямой ингибитор тромбина (дабигатран) и прямые ингибиторы фактора Ха (ривароксабан и апиксабан) — могут применяться у пациентов ГКМП с ФП [27, 37]. Антикоагулянтная терапия с помощью антагонистов витамина К проводится всем больным с ФП с целевым диапазоном международного нормализированного отношения 2,0–3,0 [25, 42].
Антитромбоцитарная терапия рекомендована пациентам с трепетанием/фибрилляцией предсердий [20]. ББ, верапамил и дилтиазем рекомендованы для контроля ЧСС у больных с постоянной или персистирующей ФП [20].
Очень мало исследований было посвящено изу–чению эффектов блокаторов ренин-ангиотензин-альдостероновой системы (РААС) у больных с ГКМП [55]. Несмотря на отсутствие рандомизированных исследований, имеется положительное влияние блокады РААС на госпитализацию, симптомы и смертность. Больных со сниженной ФВ и симптомами СН рекомендовано лечить диуретиками, ББ, ингибиторами ангиотензинпревращающего фермента, блокаторами рецептора ангиотензина и антагонистами минералокортикоидных рецепторов в соответствии с рекомендациями по лечению хронической СН. ФВ < 50 % рекомендуется как порог для рассмотрения терапии с ингибиторами РААС из-за сохранения размера полости у больных ГКМП и прогрессирующей СН [20].
Относительно небольшие объемы ЛЖ также означают, что некоторые больные не могут переносить высокие дозы вазодилататоров и диуретиков. Следует помнить, что необходима адекватная гидратация, и диуретики должны назначаться с осторожностью.
Интересным и перспективным является новейший опыт применения ранолазина (ранексы) у больных с ГКМП. Уже хорошо изучено, что ГКМП ассоци–ирована с аритмиями и диастолической дисфункцией вследствие электрофизиологических сигнальных нарушений [24]. При ГКМП кардиомиоциты имеют пролонгированный потенциал действия, что обусловлено увеличением поздних потоков натрия и изменениями в гомеостазе кальция (увеличением внутриклеточного Ca2+ через натрий-кальциевый обменник) [7, 11]. Ранолазин — селективный ингибитор позднего тока через натриевые каналы. В исследованиях in vitro ранолазин показал способность уменьшить или нивелировать эти нарушения [14, 24]. Установлено, что ранолазин ингибирует позднюю фазу внутреннего натриевого тока в ишемизированных кардиомиоцитах. Снижение внутриклеточного накопления натрия ведет к уменьшению избытка внутриклеточных ионов кальция (блокирование работы натриево-кальциевого обменника), что уменьшает внутриклеточный ионный дисбаланс при ишемии, способствует улучшению диастолического расслабления миокарда и таким образом снижению диастолического напряжения стенки желудочка, улучшению микроциркуляции, в том числе в субэндокардиальных отделах миокарда, снижению риска нарушений ритма.
Установлено, что в предсердиях ранолазин, помимо блокады позднего натриевого тока (INal) и уменьшения задержки активации быстрого ретрификационного тока калия (IKr), замедляет пик потока натриевых каналов, а также имеет определенное воздействие на другие токи, такие как ICaL, INa-Ca и IKs [14]. Возникла гипотеза, что ингибирование позднего натриевого тока может иметь терапевтические преимущества у пациентов с ГКМП в плане уменьшения диастолической дисфункции, микрососудистой ишемии, желудочковых аритмий и тяжести обструкции выносящего тракта ЛЖ [45].
Результаты пилотного одноцентрового исследования RHYME (Ranolazine for Treatment of Angina or Dyspnea in Hypertrophic Cardiomyopathy Patients) показали значительное улучшение клинического состояния больных с ГКМП (преимущественно необструктивной) в виде уменьшения стенокардии и симптомов СН и улучшения качества жизни после двухмесячного применения ранолазина в суточной дозе 1000–2000 мг в дополнение к принимаемой терапии.
В другом исследовании было показано, что в кардиомиоцитах пациентов с ГКМП увеличение поздних натриевых и кальциевых токов было ассоциировано с увеличением активности Ca2+/кальмодулинкиназы II (CAMKII). Оказалось, что увеличение поздних натриевых потоков является ключевым в электрофизиологических нарушениях в кардиомиоцитах и трабекулах больных с ГКМП, тем самым доказывая важность ингибирования поздних натриевых токов [15]. Ранолазин в терапевтических концентрациях частично восстанавливал клеточные нарушения посредством ингибирования поздних натриевых токов при ГКМП, чего не происходило в контрольных образцах. Сокращая продолжительность потенциала действия в кардиомиоцитах больных с ГКМП, ранолазин препятствовал возникновению ранней и отсроченной постдеполяризации; в результате более быстрой кинетики транзита кальция и более низкого диастолического тока кальция ранолазин ускорял цикл «сокращение — расслабление» трабекул, улучшая диастолическую функцию при ГКМП.
Накопленные данные свидетельствуют о важности проведения крупных исследований для оценки значения ингибиторов поздних натриевых токов в лечении симптомных пациентов с ГКМП. В настоящее время начато рандомизированное плацебо-контролируемое многоцентровое исследование у больных с ГКМП для решения этих вопросов [45].
Течение
АГКМП имеет наиболее доброкачественное клиническое течение по сравнению с другими вариантами ГКМП. Частота общей смертности у больных с АГКМП была 10,5 %, сердечно-сосудистой смертности — 1,9 % за период наблюдения 13,6 ± 8,3 года [22]. Вероятность выживания составляет 74 % в течение 15 лет при отсутствии предикторов плохого прогноза — семейного анамнеза внезапной смерти, молодого возраста при диагностике, мужского пола, синкопальных состояний и гипотензии при нагрузках [18, 61]. В другом исследовании определили 95% выживание больных с АГКМП в течение 15 лет и 3 предиктора сердечно-сосудистой смертности: возраст при установлении диагноза < 41 года, размер ЛП и исходный NYHA ФК ≥ II [22]. Ежегодная сердечно-сосудистая смертность для этих пациентов составила 0,1 % [22]. Большой диастолический размер ЛЖ также может предсказывать сердечные события у пациентов с AГКМП [57].
Пациентам с ГКМП необходимо наблюдение у терапевта или врача общей практики, обязательны консультации кардиолога. Частота визитов к врачу определяется тяжестью заболевания, возрастом и наличием симптомов. Клиническое обследование, включая ЭКГ в 12 отведениях и ЭхоКГ, должно проводиться каждые 1–2 года или чаще, если возникают новые симптомы СН. Амбулаторная ЭКГ рекомендована ежегодно (или каждые 6 мес. при наличии дилатации ЛП > 45 мм) для выявления бессимптомной предсердной или желудочковой аритмии и показана при эпизодах синкопальных состояний [20].
Выводы
Таким образом, приведенный клинический случай демонстрирует классический вариант течения апикальной формы ГКМП и поздней диагностики заболевания — правильный диагноз пациенту был поставлен спустя 10 лет от начала клинических проявлений. Вероятно, своевременное назначение адекватной терапии и контроль за факторами риска позволили бы снизить риск возникновения тромбоэмболических осложнений (инфаркт, инсульты).
Следует подчеркнуть важность каждого из методов, используемых кардиологом на пути постановки верного диагноза, — от внимательного сбора анамнеза, в том числе семейного, и физикального исследования до анализа результатов ЭКГ, эхокардиографии и МРВ сердца.
В связи с неспецифической клинической картиной пациенты с ГКМП долгие годы наблюдаются у кардиологов и терапевтов с ошибочными диагнозами (ИБС, перенесенный инфаркт миокарда, аортальный стеноз, гипертоническая болезнь). При этом необходимо помнить, что ГКМП нередко сочетается с этими заболеваниями. Сочетание ИБС с ГКМП наблюдается в 20 % случаев, поэтому пациентам с АГКМП старше 40 лет и/или имеющим факторы риска развития коронарного атеросклероза, предъявляющим жалобы на стенокардию, рекомендовано проводить коронаровентрикулографию [19].
Наиболее сложна дифференциальная диагностика между сочетанием ГБ и ГКМП и артериальной гипертензией с гипертензивным сердцем. В этой ситуации необходим очень тщательный сбор анамнеза заболевания, с уточнением хронологии развития повышения АД, клинических признаков ГКМП и данных ЭКГ или ЭхоКГ. Кроме того, необходимо оценить выраженность гипертензии, гипертрофии и наличие признаков поражения других органов-мишеней [5].
В описываемом нами клиническом случае у отца и старшего сына ГКМП сочеталась с гипертонической болезнью, что, возможно, также вносило коррективы в степень гипертрофии. Подозрение на ГКМП, как уже указывалось, требует обязательного и тщательного обследования кровных родственников. Свое–временная диагностика АГКМП и гипертонической болезни у старшего сына регламентирует долгосрочное наблюдение и своевременную медикаментозную коррекцию для профилактики осложнений.
Дифференциальную диагностику у больных с ГКМП следует также проводить такими нозологиями, как некомпактная кардиомиопатия ЛЖ [54], эндомиокардиальный фиброз [62].
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Богданов Д.В. Сферическое ремоделирование левого предсердия при гипертрофической необструктивной кардиомиопатии // Кардиология. — 2012. — № 4. — C. 49-52.
2. Коваленко В.М., Несукай О.Г., Поленова Н.С. та ін. Спекл-трекінг ехокардіографія: нормативні значення і роль методу у вивченні систолічної та діастолічної функції лівого шлуночка // Укр. кардіол. журн. — 2012. — № 6. — C. 103-109.
3. Крылова Н.С., Демкина А.Е., Хашиева Ф.М., Ковалевская Е.А., Потешкина Н.Г., Ванюков А.Е. Случай диагностики апикальной формы гипертрофической кардиомиопатии у пациентки с клиникой прогрессирующей стенокардии // Клиницист. — 2014. — № 2. — С. 39-44.
4. Несукай Е.Г., Даниленко А.А., Козлюк А.С., Чернюк С.В., Федькив В.А. Амилоидоз: клиника, диагностика, лечение // Український кардіологічний журнал. — 2016. — № 5. — С. 98-109.
5. Целуйко В.И. Гипертрофическая кардиомиопатия (Часть 1) // Ліки України. — 2008. — № 4(120). — С. 9-14.
6. Целуйко В.И., Киношенко К.Ю., Мищук Н.Е. Оценка деформации миокарда левого желудочка в клинической практике // Ліки України. — 2014. — № 9(185). — С. 52-56.
7. Татарский Б.А. Антиаритмический потенциал ранолазина: от теории к практике // Consilium Medicum. — 2014. — № 10. — С. 32-39.
8. Alpendurada F., Prasad S.K. The missing spade: apical hypertrophic cardiomyopathy investigation // Int. J. Cardiovasc. Imaging. — 2008. — № 24. — Р. 687-689.
9. Ammirati E., Contri R., Coppini R. et al. Pharmacological treatment of hypertrophic cardiomyopathy: current practice and novel perspectives // Eur. J. Heart Fail. — 2016. — Vol. 18(9). — P. 1106-1118.
10. Arad M., Penas-Lado M., Monserrat L. et al. Mutations in apical hypertrophic cardiomyopathy // Circulation. — 2005. — № 112. — Р. 2805-2811.
11. Barajas-Martinez H.E., Hu D., Goodrow R.J. et al. Electrophysiologic characteristics and pharmacologic response of human cardiomyocytes isolated from a patient with hypertrophic cardiomyopathy // Pacing. Clin. Electrophysiol. — 2013. — № 36. — Р. 1512-5.
12. Bugala K., Plaza W., Konieczyriska M. et al. Apical hypertrophic cardiomyopathy in an adult // Journal of Rare Cardiovascular Diseases. — 2016. — Vol. 2(6). — P. 185-188.
13. Chen C.C., Lei M.H., Hsu Y.C. et al. Apical hypertrophic cardiomyopathy: correlations between echocardiographic para–meters, angiographic left ventricular morphology, and clinical outcomes // Clin. Cardiol. — 2011. — Vol. 34. — P. 233-238.
14. Contreras-Valdes F.M., Buxton A.E., Josephson M.E. et al. Atrial fibrillation ablation in patients with hypertrophic cardiomyopathy long — term outcomes and clinical predictors // J. Am. Coll. Cardiol. — 2015. — Vol. 65(14). — P. 1485-1487.
15. Coppini R., Ferrantini C., Yao L. et al. Late Sodium Current Inhibition Reverses Electromechanical Dysfunction in Human Hypertrophic Cardiomyopathy // Circulation. — 2013. — Vol. 127. — P. 575-584.
16. Dahiya A., Thavendiranathan P., Thomas J.D. et al. Apical hypertrophic cardiomyopathy with and without aneurysm // J. Am. Coll. Cardiol. — 2012. — Vol. 60(17). — P. 1709.
17. Delfino M., Gemma D., Calcagno S. et al. Complete systolic obliteration of the left ventricle due to an apical hypertrophic cardiomyopathy in a totally asymptomatic patient // Rom. J. Intern. Med. — 2013. — Vol. 51(2). — P. 119-22.
18. Dioconu С.С., Dumitru N., Frunteloto A.G. et al. Apical Hypertrophic Cardiomyopathy: The Ace-of-Spades as the Disease Card // Acta. Cardiol. Scan. — 2015. — Vol. 31. — P. 83-86.
19. Duygu H., Zoghi M., Nalbantgil S. et al. Apical hypertrophic cardiomyopathy might lead to misdiagnosis of ischaemic heart disease // Int. J. Cardiovasc. Imagittg. — 2008. — № 24. — Р. 675-681.
20. Elliott P.M., Anastasakis A., Borger M.A. et al. 2014 ESC Guidelines on Diagnosis and Management of Hypertrophic Cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardio–logy (ESC) // Eur. Heart J. — 2014. — Vol. 35. — P. 2733-2779.
21. Elliott P.M. Hypertrophic cardiomyopathy: job done or work in progress? // J. Am. Coll. Cardiol. — 2016. — Vol. 67. — P. 1410-1411.
22. Eriksson M.J., Sonnenberg B., Woo A. Long-Term Outcome in Patients With Apical Hypertrophic Cardiomyopathy // Journal of the American College of Cardiology. — 2002. — Vol. 39, № 4. — P. 638-645.
23. Flett A.S., Maestrinib V., Milliken D. et al. Diagnosis of apical hypertrophic cardiomyopathy: T — wave inversion and relative but not absolute apical left ventricular hypertrophy // International Journal of Cardiology. — 2015. — № 183. — Р. 143-148.
24. Gentry J.L., Mentz R.J., Hurdle M. et al. Ranolazine for Treatment of Angina or Dyspnea in Hypertrophic Cardiomyopathy Patients (RHYME) // JACC. — 2016. — Vol. 68, № 16. — P. 1815-1817.
25. Gersh B.J., Maron B.G., Bonow R.O. et al. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy. A report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines // J. Am. Coll. Cardiol. — 2011. — Vol. 58(25). — P. 2703-2738.
26. Girasis С.,Vassilikos V., Efthimiadis G.K. et al. Patients with hypertrophic cardiomyopathy at risk for paroxysmal atrial fibrillation: advanced echocardiographic evaluation of the left atrium combined with noninvasive P-wave analysis // Eur. Heart J. Cardiovasc. Imaging. — 2013. — Vol. 14. — P. 425-434.
27. Granger C.B., Alexander J.H., McMurray J.J. et al. ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation // N. Engl. J. Med. — 2011. — Vol. 365. — P. 981-992.
28. Gu S., Liu Z., Liu Z. Prevalence and related factors of arrhythmias in patients with hypertrophic cardiomyopathy // Heart. — 2012. — Vol. 98(Suppl. 2). — P. 248-249.
29. Guttmann O.P., Pavlou M., O’Mahony C. et al. Hypertrophic Cardiomyopathy Outcomes Investigators. Prediction of thromboembolic risk in patients with hypertrophic cardiomyopathy (HCM Risk — CVA) // Eur. J. Heart Fail. — 2015. — Vol. 17. — P. 837-845.
30. Hamada M., Ikeda S., Shigematsu Y. Advances in medical treatment of hypertrophic cardiomyopathy // J. Cardiol. — 2014. — Vol. 64(1). — P. 1-10.
31. Hebl V.B., Miranda W.R., Ong K.C. et al. The natural history of nonobstructive hypertrophic cardiomyopathy // Mayo Clin. Proc. — 2016. — Vol. 91. — P. 279-287.
32. Kao Y.C., Lee M.F., Mao C.T. et al. Differences of left ventricular systolic deformation in hypertensive patients with and without apical hypertrophic cardiomyopathy // Cardiovasc. Ultrasound. — 2013. — Vol. 11. — P. 40.
33. Kim S.H., Kim S.O., Han S. et al. Long-term comparison of apical versus asymmetric hypertrophic cardiomyopathy // Int. Heart J. — 2013. — Vol. 54(4). — P. 207-211.
34. Kirchhof P., Benussi S., Kotecha D. et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. The Task Force for the management of atrial fibrillation of the European Society of Cardiology (ESC) // Eur. J. Cardiothorac. Surg. — 2016 Sep. — № 23. — Р. ezw313.
35. Kitaoka H., Furuno T., Casey S.A. et al. Comparison of the prevalence of apical hypertrophic cardiomyopathy in Japanese and American patients // Circulation. — 2000. — Vol. 102 –(Suppl. 11). — P. 11480.
36. Klarich K.W., AttenhoferJost C.H., Binder J. et al. Risk of death in long-term follow-up of patients with apical hypertrophic cardiomyopathy // Amer. J. Cardiol. — 2013. — Vol. 111. — P. 1784-1791.
37. Kumar K.R., Mandleywala S.N., Link M.S. Atrial and ventricular arrhythmias in hypertrophic cardiomyopathy // Card. Electrophysiol. Clin. — 2015. — Vol. 7(2). — P. 173-186.
38. Lovelock J.D., Monasky M.M., Jeong E.M. et al. Ranolazine improves cardiac diastolic dysfunction through modulation of myofilament calcium sensitivity // Circ. Res. — 2012. — № 110. — Р. 841-50.
39. Macintyre C., Lakdawala N.K. Management оf atrial fibrillation in hyperthrophic cardiomyopathy // Circulation. — 2016. — Vol. 133. — P. 1901-1905.
40. Maciver D.H. A new method for quantification of left ventricular systolic function using a corrected ejection fraction // Eur. J. Echocardiogr. — 2011. — № 12. — Р. 228-234.
41. Madias J.E. Electrocardiogram in apical hypertrophic cardiomyopathy with a speculation as to the mechanism of its features // Neth. Heart J. — 2013. — Vol. 21(6). — P. 268-271.
42. Maron M.S., Rowin E.J., OLivotto I. et al. Contemporary natural history and management of nonobstructive hypertrophic cardiomyopathy // J. Amer. Coll. Cardiol. — 2016. — Vol. 67. — P. 1399-1409.
43. Minami Y., Haruki S., Hagiwara N. et al. Phenotypic overlap in hypertrophic cardiomyopathy: Apical hypertrophy, midventricular obstruction, and apical aneurysm // Journal of Cardio–logy. — 2014. — Vol. 64. — P. 463-469.
44. Okishige K., Sasano T., Yano K. et al. Serious arrhythmias in patients with apical hypertrophic cardiomyopathy // Intern. Med. — 2001. — № 40. — Р. 396-402.
45. Olivotto I., Hellawell J.L., Farzaneh-Far R. et al. Novel approach targeting the complex pathophysiology of hypertrophic cardiomyopathy: the Impact of Late Sodium Current Inhibition on Exercise Capacity in Subjects with Symptomatic Hypertrophic Cardiomyopathy (LIBERTY-HCM) Trial // Circ. Heart Fail. — 2016. — № 9. — Р. e002764.
46. Olivotto I., Cecchi F., Casey S.A. et al. Impact of atrial fibrillation on the clinical course of hyperthrophic cardiomyopathy // Circulation. — 2001. — Vol. 104. — P. 2517-2524.
47. Ozekea O., Ertanb C., Keskin G. et al. Association of ST elevation with apical aneurysm in hypertrophic cardiomyopathy // Indian. Heart Journal. — 2015. — Vol. 67. — P. 434-439.
48. Park K.M., Im S.I., Kim E.K. et al. Atrial fibrillation in hypertrophic cardiomyopathy: is the extent of septal hypertrophy important? // PLoS One 2016. — Vol. 11(6). — Р. eO156410.
49. Patel J., Michaels J., Mieres J. et al. Echocardiography diagnosis of apical hypertrophic cardiomyopathy with optison contrast // Echocardiography. — 2002. — № 19. — Р. 521-524.
50. Sakamoto T., Amano K., Hada Y. et al. Asymmetric apical hypertrophy, ten years experience // Postgrad. Med. J. — 1986. — Vol. 62. — P. 567-570.
51. Sakamoto T., Tei C., Muravama M. et al. Giant T wave inversion as a manifestation of asymmetrical apical hypertrophy (AAH) of the left ventricle: Echocardiography and ultrasono-cardiotomographic study // Jpn. Heart J. — 1976. — Vol. 17. — P. 611-629.
52. Semsarian C., Ingles J., Maron M.S. et al. New Perspectives on the Prevalence of Hypertrophic Cardiomyopathy // JACC. — 2015. — Vol. 65, № 12. — P. 1249-1254.
53. Siontis K.C., Geske J.B., Ong K. et al. Atrial fibrillation in hypertrophic cardiomyopathy: prevalence, clinical correlations, and mortality in a large high — risk population // J. Am. Heart Assoc. — 2014. — Vol. 3. — Р. e001002.
54. Spirito P., Autore C. Apical hypertrophic cardiomyopathy or left ventricular non-compaction? A difficult differential diagnosis // Eur. Heart J. — 2007. — Vol. 28(16). — P. 1923-1924.
55. Spoladore R., Maron M.S., D’Amato R. et al. Pharmacological treatment options for hypertrophic cardiomyopathy: high time for evidence // Eur. Heart J. — 2012. — Vol. 33. — P. 1724-1733.
56. Stainback R.F. Apical Hypertrophic Cardiomyopathy // Tex. Heart Inst. J. — 2012. — Vol. 39(5). — P. 747-749.
57. Suganuma Y., Shinmura K., Hascgawa H. et al. Clinical characteristics and cardiac events in elderly patients with apical hypertrophic cardiomyopathy // Nippon Ronen Igakkai Zasshi. — 1997. — № 34. — Р. 474-481.
58. Thyagarajan B., Kalra A., Rajabali A. et al. Subclinical atrial fibrillation in patients with hypertrophic cardiomyopathy // US Cardiology Review. — 2016. — Vol. 10(2). — P. 75-77.
59. Urbano-Moral J.A., Rowin E.J., Maron M.S. et al. Investigation of global and regional myocardial mechanics with 3-dimensional speckle tracking echocardiography and relations to hypertrophy and fibrosis in hypertrophic cardiomyopathy // Circ. Cardiovasc. Imaging. — 2014. — Vol. 7. — P. 11-19.
60. Wijeyeratne Y.D. Arrhythmias in hypertrophic cardiomyopathy and 2014 ESC Guidelines // British Heart Rhythm. Society. Editorial. — 2015. — http://www.bhrs.com/editorial-arrhythmias-in-hypertrophic-cardiomyopathy.
61. Yamaguchi H., lshimura T., Nishiyama S. et al. Hypertrophic nonobstructive cardiomyopathy with giant negative T waves (apical hypertrophy): ventriculographic and echocardiographic features in 30 patients // Amer. J. Cardiol. — 1979. — Vol. 44. — P. 401-412.
62. Yusuf S., Bathina J., Banchs J. et al. Apical hypertrophic cardiomyopathy // World J. Cardiol. — 2011. — Vol. 26; 3(7). — P. 256-259.
63. Zhou X.H., Peng Z.P., Peng Q. et al. Clinical application of 64-slice spiral CT for apical hypertrophic cardiomyopathy // Chin. J. of Radiol. — 2008. — № 42. — Р. 911-915.
/65-2.gif)

/61-1.gif)
/61-2.gif)
/62-1.gif)
/62-2.gif)
/63-1.gif)
/63-2.gif)
/64-1.gif)
/64-2.gif)
/65-1.gif)
/65-3.gif)