Резюме
Актуальність. Цироз печінки алкогольної етіології часто ускладнюється гепаторенальним синдромом, при якому патофізіологічні зміни у нирках розглядаються у взаємозалежності з іншими органами, в тому числі з печінкою, проте існує досить обмежена кількість досліджень із одночасною оцінкою ниркового та печінкового кровотоку допплерівським методом залежно від стадії тяжкості у таких хворих. Мета дослідження. Визначити, порівняти зміни ультразвукових допплерівських параметрів печінкового та ниркового кровотоку у пацієнтів із алкогольним цирозом печінки залежно від стадії захворювання й оцінити взаємозв’язок цих показників із сурогатними маркерами функції нирок. Матеріали та методи. Всього обстежено 152 пацієнтів, які були розподілені на 3 групи відповідно до стадії захворювання: група 1 (n = 42), група 2 (n = 58), група 3 (n = 52). При допплерографії вивчали показники печінкового та ниркового кровотоку. Результати. Серед усіх допплерографічних показників суттєві відмінності за стадіями захворювання спостерігалися переважно для портального кровотоку, артеріальна ланка суттєвих відмінностей не зазнала. У пацієнтів групи 3 відзначалось суттєве зростання максимальної швидкості кровотоку у ворітній вені, збільшення конгестивного індексу та зменшення ворітно-селезінкового індексу, що може бути пояснено формуванням гіпокінетичного типу печінкової гемодинаміки. Показники ниркового кровотоку, за винятком максимальної швидкості у ниркових артеріях, показали суттєву різницю між стадіями захворювання. Ми спостерігали кореляцію між показниками портального кровотоку та показниками ниркового кровотоку залежно від стадії захворювання та віку пацієнтів. Висновки. Встановлено, що при прогресуванні алкогольного цирозу печінковий і нирковий кровотік зазнає паралельних змін, тому допплерографія ниркових артерій може бути рекомендована як складова частина комплексного спостереження таких пацієнтів, особливо при прогнозуванні короткострокової смертності та стратифікації тяжкості стану.
Актуальность. Цирроз печени алкогольной этиологии часто осложняется гепаторенальным синдромом, при котором патофизиологические изменения в почках рассматриваются во взаимозависимости с другими органами, в том числе с печенью, однако существует достаточно ограниченное количество исследований по одновременной оценке почечного и печеночного кровотока допплеровским методом в зависимости от стадии тяжести у таких больных. Цель исследования. Определить и сравнить изменения ультразвуковых допплеровских параметров печеночного и почечного кровотока у пациентов с алкогольным циррозом печени в зависимости от стадии заболевания и оценить взаимосвязь этих показателей с суррогатными маркерами функции почек. Материалы и методы. Всего обследованы 152 пациента, которые были распределены на 3 группы в соответствии со стадией заболевания: группа 1 (n = 42), группа 2 (n = 58), группа 3 (n = 52). При допплерографии изучали показатели печеночного и почечного кровотока. Результаты. Среди всех допплерографических показателей существенные различия по стадиям заболевания наблюдались преимущественно для портального кровотока, артериальное звено существенных различий не претерпевало. У пациентов группы 3 отмечалось значительное увеличение максимальной скорости кровотока в воротной вене, увеличение конгестивного индекса и уменьшение воротно-селезеночного индекса, что может быть объяснено формированием гипокинетического типа печеночной гемодинамики. Показатели почечного кровотока, за исключением максимальной скорости в почечных артериях, показали существенную разницу между стадиями заболевания. Мы наблюдали корреляцию между показателями портального кровотока и показателями почечного кровотока в зависимости от стадии заболевания и возраста пациентов. Выводы. Установлено, что при прогрессировании алкогольного цирроза печеночный и почечный кровоток претерпевает параллельные изменения, поэтому допплерография почечных артерий может быть рекомендована как составная часть комплексного наблюдения таких пациентов, особенно при прогнозировании краткосрочной смертности и стратификации тяжести состояния.
Background. Alcoholic liver cirrhosis (ALC) is often complicated by hepatorenal syndrome (HRS), in which pathophysiological changes in kidneys are considered to be dependent with other organs, including the liver, but there is a very limited number of studies with concurrent evaluation of renal and hepatic blood flow by means of Doppler method, depending on the stage of severity in such patients. The aim of our study was to determine and compare the changes of Doppler ultrasound parameters of hepatic and renal blood flow in patients with alcoholic cirrhosis, depending on the stage of the disease, and to assess the relationship of these indicators with surrogate markers of renal function. Materials and methods. The study enrolled 152 patients. ALC was diagnosed antemortem by laboratory tests and imaging methods, at autopsy — on the basis of macro- and micromorphological features in a view of clinical data. All patients were divided into 3 groups according to the stage of the disease by CLIF-ACLF scale and MELD scale: group 1 — CLIF-ACLF-I (MELD < 15) (n = 42), group 2 — CLIF-ACLF-II (MELD < 20) (n = 58), group 3 — CLIF-ACLF-III (MELD > 20) (n = 52). Doppler indices of hepatic and renal blood flow were studied. Results. Clinical characteristics of the patients: the average age of patients at the time of inclusion in the study was (42.34 ± 12.57) years; the average duration of ALC — (3.50 ± 1.54) years; the average length of alcohol abuse (being registered at the Regional Drug Dispensary) — (8.42 ± 3.53) years; gender distribution: 79.6 % (n = 121) — males, 20.4 % (n = 31) — females (p < 0.05). Among all enrolled patients, only 52 had score by MELD > 20, which corresponds to a high risk of mortality over the next 3 months in 19.6 % of them. According to the CLIF-ACLF scale, all these patients had the third stage. MELD score < 20 corresponded to the I–II stage by CLIF-ACLF scale. Among all Doppler indices, only portal blood flow demonstrated the significant differences by the stages of CLIF-ACLF scale, arterial hepatic blood flow didn’t change significantly. Patients of group 3 had a significant reduction of TAMH PV, Vmax PV, QPV, PSVI, reduced PSI and mPSI, but increased CI, which may be explained by the formation of hypokinetic type of liver hemodynamics. It was also found a strong correlation between the stage by CLIF-ACLF scale and Vmin, RI and PI of the left and right renal arteries (RA). We revealed the correlation between the values of Doppler parameters and indicators by MELD scale. Significant reduction of Vmean, Vmin in the right and left RA, and increase in RI and PI in right and left RA was observed in patients with MELD index < 20, compared with those, who had MELD > 20 and stage III by CLIF-ACLF scale. Only Vmax values of the right and left RA had no statistically significant changes. In patients with esophageal varices, we observed a decreased Vmean of the right RA (p = 0.02) and left RA (p = 0.038), reduced Vmax of the right RA (p = 0.045), and decreased Vmin of the right RA (p = 0.003) and left RA (p = 0.025) as compared to rates in those without esophageal varices. When comparing patients of groups 1–2 with patients of group 3, we noticed a significant reduction of Vmin in right RA (p = 0.021) and increased RI in the right RA (p = 0.020) and left RA (p = 0.028), increased PI in the right RA (p = 0.024) and left RA (p = 0.002). Vmean in the right and left RA (p = 0.015) and Vmin in the right RA (p = 0.027) were also reduced in patients with ascites, as compared to those without it. We observed a correlation between the Doppler indices in the arteria hepatica communis and hepatic arterial index on the one hand, and indicators of renal blood flow — on the other. Conclusions. The results of our studies showed that in patients with alcoholic liver cirrhosis, hepatic and renal blood flow undergo the parallel changes, especially depending on the stage of the disease by CLIF-ACLF scale and on the patient’s age. We found no direct correlation between the kinds of alcoholic liver cirrhosis complications and most indicators of hepatic blood flow. In contrast, renal doppler parameters correlate with the severity of liver cirrhosis and the presence of its complications. Due to the significant changes in renal blood flow parameters as the progression of cirrhosis, we can recommend doppler ultrasound of the renal arteries as part of a comprehensive observation of patients in the dynamics, especially for predicting the short-term mortality and for stratification of severity of the disease.
Вступ
Гепаторенальний синдром (ГРС) — гостре прогресуюче зниження ниркового кровотоку та швидкості клубочкової фільтрації (ШКФ) функціонального характеру, є формою ниркової недостатності, яка розвивається на фоні гострої або хронічної (декомпенсованої) хвороби печінки за відсутності хвороби нирок.
ГРС однаково часто виникає в чоловіків і жінок віком 40–80 років. За епідеміологічними даними США, частота ГРС дорівнює 10 % серед усіх госпіталізованих хворих із цирозом печінки та асцитом. У цих пацієнтів щорічний ризик розвитку ГРС становить 8–20 %. Цей показник зростає до 40 % через 5 років. У 20 % пацієнтів із цирозом печінки та портальною гіпертензією ГРС виникає упродовж 1 року після встановлення діагнозу, у 40 % — упродовж перших 5 років.
Цироз печінки алкогольної етіології (алкогольний цироз печінки, АЦП) часто ускладнюється ГРС, особливо за умов асциту та портальної гіпертензії, на фоні діуретичної терапії та надмірного діурезу або видалення великої кількості рідини при парацентезах (без уведення альбуміну); при кровотечі з варикозно розширених вен стравоходу або прямої кишки, а також при спонтанному бактеріальному перитоніті.
Сьогодні у клінічній практиці для оцінки ступеня тяжкості АЦП та прогнозування короткострокового виживання пацієнтів найбільш часто користуються прогностичною моделлю модифікованої шкали Chronic Lіver Failure-Consortium-Acute-on-Chronic Liver Failure (CLIF-C-ACLF) за даними дослідження EASL-CLIF Acute-on-Chronic Liver Failure in Cirrhosis (CANONIC), 2013 [10], що враховує число декомпенсованих органів/систем (печінка, нирки, головний мозок, коагуляція, кровообіг, легені) [3]. Тому на сучасному етапі доцільним є комплексний підхід до вивчення патогенезу ГРС, що розглядає патофізіологічні зміни у нирках у взаємозалежності з іншими органами, в тому числі з печінкою.
ГРС фактично є преренальним гострим ушкодженням нирок. У клінічній практиці для визначення функціональної ниркової недостатності орієнтуються на показники добового діурезу та кліренсу креатиніну, до лабораторних критеріїв діагностики ГРС зараховують також зниження концентрації натрію в крові < 130 ммоль/л і сечі < 10 ммоль/л, зниження систолічного артеріального тиску, швидке зростання рівня загального білірубіну зі зниженням протромбінового індексу. Одним із неінвазивних методів, що дозволяє прогнозувати розвиток ГРС у хворих на цироз печінки, є ультразвукове допплерівське дослідження (УЗД) з визначенням показника опору артеріального русла нирок. Значно підвищений показник (індекс опору понад 0,9) може бути раннім діагностичним маркером ГРС у хворих на цироз печінки з асцитом і нормальним рівнем креатиніну сироватки крові. За допомогою УЗД при ГРС можливе виключення обструкції сечовивідних шляхів і хвороб нирок. Якщо концентрація креатиніну є високою, а рівень натрію в плазмі залишається в межах норми, то діагноз ГРС не встановлюється. Проте існує обмежена кількість досліджень з одночасною оцінкою ниркового та печінкового кровотоку допплерівським методом у таких хворих.
Метою нашого дослідження було визначення та порівняння зміни ультразвукових допплерівських параметрів печінкового та ниркового кровотоку у пацієнтів з АЦП залежно від стадії захворювання та оцінювання взаємозв’язку цих показників із сурогатними маркерами функції нирок.
Матеріали та методи
Всього обстежено 152 пацієнтів з АЦП, госпіталізованих у гастроентерологічне відділення обласної клінічної лікарні м. Чернівців у період із січня 2013 по серпень 2016 року. Діагноз за життя встановлювався на підставі даних лабораторно-інструментальних методів дослідження, на автопсії — на підставі макро- і мікроморфологічних ознак з урахуванням клінічних даних. Усі пацієнти були розподілені на 3 групи відповідно до стадії захворювання за шкалами CLIF-ACLF та MELD (Model for End-Stage Liver Disease): група 1 — CLIF-ACLF-І (MELD < 15) (n = 42), група 2 — CLIF-ACLF-ІІ (MELD = 15–20) (n = 58), група 3 — CLIF-ACLF-ІІІ (MELD > 20) (n = 52).
Діагноз ГРС встановлювався за критеріями Міжнародного клубу асциту (2005):
1) цироз печінки з асцитом;
2) рівень сироваткового креатиніну понад 133 ммоль/л (1,5 мг/дл);
3) відсутність збільшення ШКФ (досягнення рівня сироваткового креатиніну ≤ 133 ммоль/л) після як мінімум дводенної відміни сечогінних і введення альбуміну — доза, що рекомендується, — 1 г на 1 кг маси тіла на день (до максимальної дози 100 г/день);
4) відсутність шоку;
5) відсутність даних про використання нефротоксичних препаратів;
6) відсутність будь-яких паренхіматозних хвороб нирок, що проявляються протеїнурією, макрогематурією та/або відповідними УЗ-ознаками.
Для оцінки тяжкості стану застосовували шкалу MELD, що включає показники білірубіну, креатиніну, міжнародного нормалізованого відношення (МНВ) протромбінового часу.
Індекс за шкалою MELD співвідноситься зі смертністю упродовж перших 3 місяців так [6]: ≥ 40 — 71,3 % смертності; 30–39 — 52,6 % смертності; 20–29 — 19,6 % смертності; 10–19 — 6,0 % смертності; ≤ 9 — 1,9 % смертності.
Критеріями недостатності органів/систем за шкалою CLIF-C-ACLF були: з боку печінки — білірубін ≥ 205 мкмоль/л; нирок — креатинін ≥ 177 мкмоль/л; головного мозку — печінкова енцефалопатія ΙΙΙ–ΙV ступеня; коагуляції — МНВ ≥ 2,5; кровообігу — використання вазопресорів; легень — PaO2/FiO2 або SpO2/FiO2 ≤ 200 і ≤ 214 відповідно (www.clifconsortium.com).
Крім стандартних клінічних та біохімічних лабораторних обстежень додатково визначали екскрецію натрію з сечею (ммоль/24 год), ШКФ (мл/хв), нормалізовану ШКФ (нШКФ × 1,73/площа тіла, мл/хв).
Усі обстежені хворі отримували базисну терапію (силімарин + вітамінні препарати); 39 пацієнтів із варикозним розширенням вен стравоходу (ВРВС) отримували бета-адреноблокатори (пропранолол); 42 пацієнти отримували діуретики (18 — верошпірон, 2 — фуросемід, 22 — верошпірон + фуросемід).
Критеріями виключення були: 0-й та 4-й ступінь за шкалою CLIF-C-ACLF, шлунково-кишкова кровотеча упродовж останніх 8 тижнів, гостра алкогольна інтоксикація, хірургічні втручання, тромбоз ворітної вени (ВВ), обтураційна жовтяниця, декомпенсація супутньої патології.
Дослідження проводились згідно з основними біоетичними вимогами Фундаментальних вказівок до проведення клінічних досліджень (Fundamental Guidelines for Clinical Research): ICH GCP (1996), а також Гельсінської декларації (Declaration of Helsinki, 2004), Об’єднаної європейської директиви (EU Directive) 2001/20/EC; Об’єднаної європейської директиви (EU Directive) 2005/28/EC.
Комплексне УЗ-обстеження проводилось одним дослідником відповідно до стандартного протоколу. Заміри виконувались на УЗ-сканері Aloka SSD 4000 конвексним датчиком з частотою 2,5–5,0 MHz, низькочастотним фільтром 100 Hz, з кутом нахилу допплерівського променя 50° та спектральним вікном 2–3,5–5 мм, що становило не менше третини діаметра судини. При допплерографії вивчали ворітну вену, загальну печінкову артерію (ЗПА), інтерлобулярні (міжчасточкові) та сегментарні гілки ниркових артерій (НА). Переважно досліджували ректилінеарний (прямолінійний) сегмент (відрізок) загального тракту ВВ, щонайближче до місця його біфуркації. ЗПА обстежувалась біля місця її перетину з ВВ. Отримувалися серії з принаймні трьох подібних, послідовних допплерівських сигналів на висоті затримки дихання. Такі ж серії сигналів враховувалися для кожної нирки шляхом послідовних замірів правої (ПНА) та лівої (ЛНА) НА у верхній, середній та нижній частині нирки, з подальшим обчисленням середнього показника для обох нирок.
Були оцінені допплерографічні параметри печінкового та ниркового кровотоку (см/с): максимальна систолічна швидкість у ВВ (Vmax ВВ),
максимальна швидкість у ВВ, усереднена за часом (ТАМХ ВВ = Vmax ВВ × 0,57), ворітно-селезінковий венозний індекс (ВСВІ = Qвв/Qcв), конгестивний індекс (СI = піR2/ТАМХ), максимальна систолічна швидкість у ЗПА (Vmax ЗПА), мінімальна та діастолічна швидкість у ЗПА (Vmin ЗПА), середня швидкість у ЗПА (Vmean ЗПА = Vmax ЗПА × 0,62), резистивний індекс у ЗПА (RI ЗПА = Vmax ЗПА − Vmin ЗПА/Vmax ЗПА), пульсаційний індекс у ЗПА (РІ ЗПА = Vmax ЗПА − Vmin ЗПА/Vmean ЗПА), печінковий судинний індекс (ПСІ = ТАМХ ВВ/РІ НА), модифікований печінковий судинний індекс (мПСІ = ТАМХ ВВ/RI НА), артеріопортальний індекс (АПІ = Vmax НА/Vmax ВВ), максимальна систолічна швидкість у НА (Vmax НА), мінімальна і діастолічна швидкість у НА (Vmin НА), середня швидкість у НА (Vmean НА), резистивний індекс у НА = Vmax НА − Vmin НА/Vmax НА, пульсаційний індекс у НА (PI НА = Vmax НА – Vmin НА/Vmean НА).
Статистичний аналіз отриманих даних проводили з використанням критерію Mann — Whitney і кореляційного аналізу (SPSS v.14). Статистично значущим вважали значення р < 0,05.
Результати
Клінічна характеристика обстежених хворих: середній вік пацієнтів на момент включення у дослідження становив (42,34 ± 12,57) року; середня тривалість перебігу АЦП (3,5 ± 1,54) року; середній стаж зловживання алкоголем (перебування на обліку в обласному наркологічному диспансері) (8,42 ± 3,53) року; гендерний розподіл: 79,6 % (n = 121) чоловіків, 20,4 % (n = 31) жінок (р < 0,05) (табл. 1).
Отже, серед усіх обстежених пацієнтів тільки 52 особи мали бал за MELD > 20, що відповідало високому ризику смертності упродовж подальших трьох місяців у 19,6 % із них. Згідно зі шкалою CLIF-ACLF, усі ці хворі зараховувались до ІІІ ст. Бал за MELD > 20 відповідав І–ІІ ст. за CLIF-ACLF.
Серед усіх допплерографічних показників відмінності за стадіями шкали CLIF-ACLF спостерігалися переважно для портального кровотоку, артеріальна ланка суттєвих відмінностей не зазнала. У пацієнтів групи 3 відзначалось суттєве зниження ТАМХ ВВ, Vmax ВВ, QВВ, ВСВІ, зменшення ПСІ та mПСІ й зростання СІ, що може бути пояснено формуванням гіпокінетичного типу печінкової гемодинаміки (табл. 2).
Показники ниркового кровотоку, за винятком Vmax лівої та правої НА, показали суттєву різницю між стадіями за шкалою CLIF-ACLF (табл. 3).
Також визначено сильний кореляційний зв’язок між стадією за шкалою CLIF-ACLF та Vmin, RI та PI лівої і правої НА.
Було виявлено кореляцію між значеннями допплерографічних параметрів та показниками за шкалою MELD. Суттєве зниження Vmean, Vmin у правій та лівій НА, а також зростання RI та PI у правій та лівій НА спостерігалося у пацієнтів з індексом MELD < 20 порівняно з тими, які мали MELD > 20 та ІІІ стадію за шкалою CLIF-ACLF. Тільки значення Vmax у правій та лівій НА не мали статистично значущих змін.
У пацієнтів із ВРВС ми спостерігали зниження Vmean у правій (Р = 0,02) та лівій (Р = 0,038) НА, Vmax у правій НА (Р = 0,045), а також — Vmin у правій (P = 0,003) та лівій (Р = 0,025) НА порівняно з показниками в осіб без ВРВС.
При порівнянні пацієнтів груп 1 і 2 з пацієнтами групи 3 ми помітили значне зниження Vmin у правій НА (Р = 0,021) та зростання RI у правій (Р = 0,020) та лівій (Р = 0,028) НА, зростання РІ у правій (Р = 0,024) та лівій (Р = 0,002) НА Vmean у правій та лівій (Р = 0,015) НА, Vmin у правій НА (Р = 0,027) також були знижені у пацієнтів з асцитом порівняно з тими, у кого не було асциту.
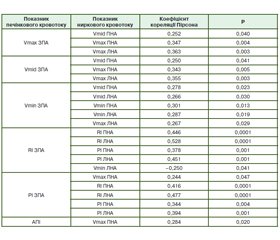
Ми спостерігали кореляцію між показниками кровотоку у ЗПА та АПІ з одного боку та показниками ниркового кровотоку — з іншого (табл. 4).
Сурогатні маркери ниркової функції, такі як сечовина та натрій плазми крові, корелювали з показниками шкал CLIF-ACLF і MELD (табл. 5).
Було виявлено, що рівні сечовини та креатиніну плазми крові корелюють із показниками ниркового кровотоку, але з показниками печінкового кровотоку кореляції не відзначалось. ШКФ, нШКФ та екскреція натрію з сечею не показали статистично значимої кореляції.
Обговорення
Багато допплерівських показників печінкового кровотоку використовуються для розрізнення хворих із портальною гіпертензією від пацієнтів із нормальною артеріальною та портальною гемодинамікою [2–7, 10]. Але є суперечливі дані щодо змін цих показників залежно від стадій за шкалою CLIF-ACLF або бала за шкалою MELD, а також залежно від наявності ускладнень цирозу печінки [2, 5–7, 9]. У цьому дослідженні ми одночасно оцінили та порівняли зміни допплерівських показників печінки і нирок, виміряні у хворих з АЦП залежно від стадії захворювання. Отримані результати показали, що ТАМХ ВВ, Vmax ВВ, ПСІ та мПСІ корелюють зі стадією за шкалою CLIF-ACLF. Деякі автори відзначають взаємозв’язок між допплерографічними показниками та балом за шкалою MELD, а також псевдонормалізацію портальної гемодинаміки із прогресуванням АЦП [5–7, 9–12]. Однак шкала MELD має більшу стратифікаційну цінність для оцінки прогнозу короткострокового виживання пацієнтів з АЦП, зокрема при їх відборі для трансплантації печінки, та не є досконалою для оцінки ступеня поліорганної недостатності. У зв’язку з цим ми використовували також шкалу CLIF-ACLF як універсальну систему оцінки тяжкості стану хворих з АЦП. Vmid ЗПА, Vmax ЗПА та АПІ були суттєво вищими у пацієнтів із ІІІ ст. CLIF-ACLF порівняно з І–ІІ ст. CLIF-ACLF. З іншого боку, не було відзначено жодних суттєвих відмінностей між показниками кровотоку й різними видами ускладнень цирозу печінки. В цілому наші результати підтверджують буферну роль ЗПА при прогресуванні АЦП та псевдонормалізацію допплерографічних параметрів. Відмінності у типах гемодинамічних розладів можуть залежати від наявності чи відсутності гіперкінетичного синдрому та колатералей [5, 9].
Оцінка показників ниркового кровотоку у пацієнтів з АЦП в основному базується на визначенні індексу резистентності у ниркових артеріях [11–13]. Ниркова вазоконстрикція у пацієнтів з АЦП була підтверджена у кількох клінічних дослідженнях саме на підставі цього показника [1]. У пацієнтів із рефрактерним асцитом, так само як і у пацієнтів із нормальними рівнями креатиніну, підвищений RI корелює з високим ризиком подальшого погіршення ниркових функцій [1, 12]. У нашому дослідженні на відміну від печінкових показників кровотоку всі ниркові показники (за винятком Vmax НА) показали суттєву асоціацію з тяжкістю АЦП, оціненою за обома шкалами — CLIF-ACLF і MELD.
Більшість цих параметрів корелюють із наявністю ВРВС та асциту, декомпенсацією цирозу та поліорганною недостатністю. Подібні результати були відзначені і для пацієнтів з АЦП, які не мали початкових ознак ниркової недостатності [13]. Дані про кореляцію RI та рівень гломерулярної фільтрації залишаються суперечливими [1, 13]. Збільшення рівнів креатиніну відповідає вищим значенням індексу імпедансу. Допплерівські показники кровотоку у нирковій артерії можуть бути корисними для виявлення на ранніх стадіях пацієнтів з високим ризиком ниркової недостатності. У той же час немає доказів того, що допплерівське дослідження допомагає віддиференціювати пацієнтів із порушеною нирковою функцією, обумовленою лише вазоконстрикцією, від тих пацієнтів, які мають як вазоконстрикцію, так і ушкодження паренхіми нирок. Допплерівські показники ниркового кровотоку також залежать від багатьох факторів [1].
Одночасне допплерографічне дослідження печінки та нирок дозволяє знайти взаємозв’язок між параметрами кровотоку печінкової артерії та ниркових артерій. Ці дані підкреслюють спорідненість патофізіологічних механізмів при розладах артеріального кровотоку у печінці та нирках. З іншого боку, при прогресуванні цирозу нирковий кровотік зазнає більших змін у динаміці, ніж власне печінковий, що потребує подальшого дослідження.
Висновки
Результати проведених нами досліджень показали, що при алкогольному цирозі печінковий та нирковий кровотік зазнає паралельних змін, особливо залежно від стадії захворювання за шкалою CLIF-ACLF та віку пацієнта. Нами не виявлено прямої кореляції між різновидами ускладнень АЦП та більшістю показників печінкового кровотоку. На противагу цьому ниркові допплерографічні параметри корелюють як із тяжкістю цирозу печінки, так і з наявністю його ускладнень. У зв’язку з вірогідними змінами показників ниркового кровотоку в міру прогресування цирозу печінки ми можемо рекомендувати допплерографічне ультразвукове дослідження ниркових артерій як складову частину комплексного спостереження таких пацієнтів у динаміці, особливо при прогнозуванні короткострокової смертності та стратифікації тяжкості стану.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів.
Список литературы
1. Francoz C. The evaluation of renal function and disease in patients with cirrhosis / C. Francoz, D. Glotz, R. Moreau, and F. Durand // Journal of Hepatology. — 2010. — Vol. 52, № 4. — Р. 605-613.
2. Cosar S. Doppler and gray-scale ultrasound evaluation of morphological and hemodynamic changes in liver vascualture in alcoholic patients / S. Cosar, S. O. Oktar, B. Cosar [et al.] // European Journal of Radiology. — 2005. — Vol. 54, № 3. — Р. 393-399.
3. O’Donohue J. Diagnostic value of Doppler assessment of the hepatic and portal vessels and ultrasound of the spleen in liver disease / J. O’Donohue, C. Ng, S. Catnach, P. Farrant [et al.] // European Journal of Gastroenterology and Hepatology. — 2004. — Vol. 16, № 2. — Р. 147-155.
4. Wu C.-C. Ultrasonographic evaluation of portal hypertension and liver cirrhosis / C.-C. Wu // Journal of Medical Ultrasound. — 2008. — Vol. 16, № 3. — Р. 188-193.
5. Annet L. Hepatic flow parameters measured with MR imaging and Doppler US: correlations with degree of cirrhosis and portal hypertension / L. Annet, R. Materne, E. Danse [et al.] // Radiology. — 2003. — Vol. 229, № 2. — Р. 409-414.
6. Piscaglia F. Value of splanchnic Doppler ultrasound in the diagnosis of portal hypertension / F. Piscaglia, G. Donati, C. Serra [et al.] // Ultrasound in Medicine and Biology. 2001. — Vol. 27, № 7. — Р. 893-899.
7. Berzigotti A. Renovascular impedance correlates with portal pressure in patients with liver cirrhosis / A. Berzigotti, A. Casadei, D. Magalotti [et al.] // Radiology. — 2006. — Vol. 240, № 2. — Р. 581-586.
8. Colli A. Renovascular impedance and esophageal varices in patients with child-pugh class a cirrhosis / A. Colli, M. Fraquelli, R. Pometta [et al.] // Radiology. — 2001. — Vol. 219, № 3. — Р. 712-715.
9. Bardi A. Intrarenal arterial doppler ultrasonography in cirrhotic patients with ascites, with and without hepatorenal syndrome / A. Bardi, J. Sapunar, D. Oksenberg [et al.] // Revista Medica de Chile. — 2002. — Vol. 130, № 2. — Р. 173-180.
10. Kastelan S. The role of Duplex-Doppler ultrasonography in the diagnosis of renal dysfunction and hepatorenal syndrome in patients with liver cirrhosis / S. Kastelan, N. Ljubicic, Z. Kastelan [et al.] // Hepato-Gastroenterology. — 2004. — Vol. 51, № 59. — Р. 1408-1412.
11. Rendon Unceta P. Renal Doppler ultrasonography and its relationship with the renal function in patients with liver cirrhosis / P. Rendon Unceta, M. A. Macias Rodriguez, P. Guillen Mariscal [et al.] // Medicina Clinica. — 2001. — Vol. 116, № 15. — Р. 561-564.
12. Kamath P.S. A model to predict survival in patients with end-stage liver disease / P.S. Kamath, R.H. Wiesner, M. Malinchoc [et al.] // Hepatology. 2001. — Vol. 33, № 2. — Р. 464-470.
13. Baik S.K. Relationship of hemodynamic indices and prognosis in patients with liver cirrhosis / S.K. Baik, M.G. Jee, P.H. Jeong [et al.] // Korean Journal of Internal Medicine. — 2004. — Vol. 19, № 3. — Р. 165-170.

/22.jpg)
/23.jpg)
/23_2.jpg)
/24.jpg)