Журнал "Гастроэнтерология" Том 51, №1, 2017
Вернуться к номеру
Клініко-лабораторні особливості стеатозу підшлункової залози у дітей з надлишковою вагою та ожирінням
Авторы: Завгородня Н.Ю., Лук’яненко О.Ю.
ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
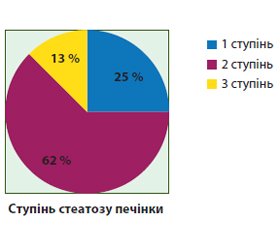
Актуальність. Неалкогольна жирова хвороба підшлункової залози — патологічний стан, тісно асоційований з ожирінням та іншими компонентами метаболічного синдрому. Клінічні прояви обумовлюються порушенням екзокринної функції залози, що супроводжується розвитком дисбіотичних змін та інтестинальних розладів. Мета. Вивчити клініко-лабораторні особливості стеатозу підшлункової залози у дітей з надлишковою вагою та ожирінням. Матеріали та методи. У 24 дітей з функціональними розладами шлунково-кишкового тракту визначали наявність стеатозу підшлункової залози за допомогою ультразвукового дослідження. Для характеристики стану тонкокишкової мікробіоти проводили водневий дихальний тест з навантаженням глюкозою або лактозою. Виявлення стеатозу печінки проводили за допомогою транзієнтної еластрографії печінки з визначенням контрольованого параметра ультразвукового затухання. Розподіл за групами відбувся на підставі наявності стеатозу підшлункової залози: контрольну групу (S0) становили 12 пацієнтів без стеатозу підшлункової залози, основну групу (S+) — 12 пацієнтів зі стеатозом підшлункової залози. Результати. Стеатоз підшлункової залози у дітей з надлишковою вагою та ожирінням характеризувався неспецифічною клінічною картиною з переважанням диспептичних явищ. Встановлено, що у дітей основної групи спостерігалось зниження рівня амілази сироватки крові порівняно з контрольною групою (середнє значення (30,40 ± 12,45) ммоль/л в основній групі та (51,88 ± 19,81) ммоль/л у контрольній, p < 0,05). Було виявлено, що у пацієнтів основної групи вірогідно частіше зустрічалась стеаторея (75 % хворих основної групи проти 33,3 % дітей контрольної групи, p < 0,05). Стеатоз підшлункової залози у дітей був асоційований з розвитком синдрому надмірного бактеріального росту (50 % хворих основної групи проти 8,3 % дітей контрольної групи, р < 0,05). Серед пацієнтів зі стеатозом підшлункової залози 41,6 % мали ознаки стеатозу печінки, в той час як панкреатичний стеатоз зустрічався у 62,5 % пацієнтів із неалкогольною жировою хворобою печінки. Діти зі стеатозом підшлункової залози мали помірне прискорення швидкості осідання еритроцитів (середній показник становив (16,6 ± 6,76) мм/год у пацієнтів основної групи проти (7,17 ± 3,18) мм/год у пацієнтів контрольної групи). Висновки. Панкреатичний стеатоз може виступати більш раннім маркером ектопічного накопичення жиру порівняно зі стеатозом печінки. Стеатоз підшлункової залози у дітей з надлишковою вагою та ожирінням характеризується наявністю низькорівневого системного запалення, диспептичних явищ, непрямих ознак зовнішньосекреторної недостатності залози та синдромом надмірного бактеріального росту.
Актуальность. Неалкогольная жировая болезнь поджелудочной железы — патологическое состояние, ассоциированное с ожирением и другими компонентами метаболического синдрома. Клинические проявления жировой инфильтрации поджелудочной железы обусловлены нарушением экзокринной функции, что сопровождается развитием дисбиотических изменений и интестинальных расстройств. Цель. Изучить клинико-лабораторные особенности стеатоза поджелудочной железы у детей с избыточным весом и ожирением. Материалы и методы. У 24 детей с патологией желудочно-кишечного тракта определяли наличие стеатоза поджелудочной железы с помощью ультразвукового исследования органов брюшной полости. Для характеристики состояния тонкокишечной микробиоты проводили водородный дыхательный тест с нагрузкой глюкозой или лактозой. Определение стеатоза печени проводили с помощью транзиентной еластрографии печени с определением контролируемого параметра ультразвукового затухания. Распределение по группам состоялось на основании наличия стеатоза поджелудочной железы: контрольную группу (S0) составили 12 пациентов без стеатоза поджелудочной железы, основную группу (S+) — 12 пациентов со стеатозом поджелудочной железы. Результаты. Стеатоз поджелудочной железы у детей с избыточным весом и ожирением характеризуется неспецифической клинической картиной с преобладанием диспептических явлений. Выявлено, что у детей со стеатозом поджелудочной железы наблюдается снижение уровня амилазы сыворотки крови при сравнении с контрольной группой (среднее значение составило (30,40 ± 12,45) ммоль/л в основной группе и (51,88 ± 19,81) ммоль/л в контрольной, p < 0,05). Также у пациентов основной группы достоверно чаще наблюдалась стеаторея при проведении копрологического исследования (75 % больных основной группы против 33,3 % детей контрольной группы, p < 0,05). Стеатоз поджелудочной железы у детей был ассоциирован с развитием синдрома избыточного бактериального роста (50 % больных основной группы против 8,3 % детей контрольной группы, р < 0,05). Среди пациентов со стеатозом поджелудочной железы 41,6 % имели признаки стеатоза печени, в то время как панкреатический стеатоз встречался у 62,5 % пациентов с неалкогольной жировой болезнью печени. У детей со стеатозом поджелудочной железы наблюдалось умеренное повышение скорости оседания эритроцитов (средний показатель составил (16,6 ± 6,76) мм/ч у пациентов основной группы против (7,17 ± 3,18) мм/ч у детей контрольной группы). Выводы. Панкреатический стеатоз может выступать более ранним маркером эктопического накопления жира по сравнению со стеатозом печени. Стеатоз поджелудочной железы у детей с избыточным весом и ожирением характеризуется наличием низкоуровневого системного воспаления, диспептических явлений, косвенных признаков внешнесекреторной недостаточности железы и синдромом избыточного бактериального роста.
Background. Nonalcoholic fatty pancreas disease is a pathological condition associated with obesity and components of the metabolic syndrome. Clinical features of the pancreatic steatosis can be caused by exocrine insufficiency, which is accompanied with the development of dysbiotic changes and intestinal disorders. The aim of the study was to examine the clinical and laboratory features of pancreatic steatosis in children with overweight and obesity. Materials and methods. We determined the presence of pancreatic steatosis by ultrasound examination of the abdominal cavity in 24 children with disorders of the gastrointestinal tract. To characterize the state of the intestinal microbiota, a hydrogen breath test with a load of glucose or lactose was carried out. Determination of hepatic steatosis was performed using transient liver elastography (FibroScan) with determination of controlled attenuation parameter. Patients were divided into 2 groups: a control group (S0) was presented by 12 patients without pancreatic steatosis, the main group (S+) — 12 patients with pancreatic steatosis. Results. Pancreatic steatosis in children with overweight and obesity was characterized by nonspecific clinical picture with the prevalence of dyspepsia. Children with pancreatic steatosis had lower levels of serum amylase compared to control group (mean value was (30.40 ± 12.45) mmol/l in the main group and (51.88 ± 19.81) mmol/l — in the control, p < 0.05). Also, patients of the main group had significantly more common incudence of steatorrhea during coprological study (75 % of children of the main group vs. 33.3 % in the control group, p < 0.05). Pancreatic steatosis in children was associated with development of small intestinal bacterial overgrowth (50 % of children of the main group vs. 8.3 % in the control group, p < 0.05). Among patients with pancreatic steatosis, 41.6 % had signs of liver steatosis, whereas pancreatic steatosis was found in 62.5 % of patients with nonalcoholic fatty liver disease. Children with pancreatic steatosis had moderate acceleration of erythrocyte sedimentation rate (average level was (16.60 ± 6.76) mm/h in patients of the main group vs. (7.17 ± 3.18) mm/h in the control group). Conclusions. Pancreatic steatosis may be a better marker of early ectopic fat accumulation compared with liver steatosis. Рancreatic steatosis in children with overweight and obesity is characterized by low level of systemic inflammation, dyspepsia, indirect signs of exocrine pancreatic insufficiency and small intestinal bacterial overgrowth.
стеатоз підшлункової залози; синдром надмірного бактеріального росту; діти
стеатоз поджелудочной железы; синдром избыточного бактериального роста; дети
pancreatic steatosis; small intestinal bacterial overgrowth; children
Вступ
Матеріали та методи
Результати та обговорення
Висновки
1. Дуб М. Сучасні підходи до фізичної реабілітації осіб з надлишковою масою тіла та ожирінням в умовах навчання у ВНЗ / М. Дуб, К. Мелега // Молода спортивна наука в Україні. — 2012. — № 3. — С. 87-94.
2. Величко В.І. Особливості епідеміології дитячого ожиріння в умовах Півдня України / В.І. Величко // Здоровье ребенка. — 2011. — № 7(34). — С. 23-26.
3. Lobstein T. Estimated burden of paediatric obesity and co-morbidities in Europe. Part 2. Numbers of children with indicators of obesity-related disease / T. Lobstein, R. Jackson-Leach // International Journal of Pediatric Obesity. — 2006. — № 1. — Р. 33-41.
4. Chiarelli F. Insulin resistance and obesity in childhood / Francesco Chiarelli, Maria Loredana Marcovecchio // Eur. J. Endocrinol. — 2008. — № 159. — S67-S74. — doi: 10.1530/EJE-08-0245.
5. Berenson G.S. Association between multiple cardiovascular risk factors and atherosclerosis in children and young adults. The Bogalusa Heart Study / G.S. Berenson, S.R. Srinivasan, W. Bao [et al.] // New England Journal of Medicine. — 1998. — № 338. — P. 1650-1656.
6. Pizzi M.A. Childhood obesity: effects on children’s participation, mental health, and psychosocial development / M.A. Pizzi, K. Vroman // Occup. Ther. Health Care. — 2013. — № 27. — Р. 99-112.
7. Диденко В.И. Современные достижения в оценке стеатоза печени / В.И. Диденко // Гастроентерологія. — 2015. — № 3(57). — С. 94-100.
8. Smits M. The clinical significance of pancreatic steatosis / M.M. Smits, E.J. van Geenen // Nat. Rev. Gastroenterol. Hepatol. — 2011. — № 8. — Р. 169-177.
9. Exploring the metabolic syndrome: Nonalcoholic fatty pancreas disease / R. Catanzaro, B. Cuffari, A. Italia [et al.] // World Journal of Gastroenterology. — 2016. — № 22(34). — Р. 7660-7675. — doi: 10.3748/wjg.v22.i34.7660.
10. Prevalence of Pancreatic Steatosis at a Pediatric Tertiary Care Center / Pham Y.H., Bingham B.A., Bell C.S. [et al.] // South Med. J. — 2016. — № 109(3). — P. 196-198.
11. Звенигородская Л.А. Клинико-диагностические особенности стеатоза поджелудочной железы у пациентов с метаболическим синдромом / Л.А. Звенигородская, Н.Г. Самсонова // Вестник семейной медицины. — 2015. — № 1–2. — С. 30-36.
12. Nonalcoholic Steatohepatitis (NASH) Is Associated with a Decline in Pancreatic Beta Cell (β-Cell) Function / S. Mohammad Siddiqui, L. Kai Cheang [et al.] // Digestive Diseases and Sciences. — 2015. — Vol. 60, Is. 8. — P. 2529-2537.
13. Pancreatic fat accumulation and its relationship with liver fat content and other fat depots in obese individuals / G. Targher, A.P. Rossi, G.A. Zamboni [et al.] // J. Endocrinol. Invest. — 2012. — № 35. — P. 748-753.
14. Prevalence of Non-Alcoholic Fatty Pancreas Disease (NAFPD) and its risk factors among adult medical check-up patients in a private hospital: a large cross sectional study / C. Lesmana, L.S. Pakasi, S. Inggriani [et al.] // BMC Gastroenterology. — 2015. — № 15. — P. 174. — doi: 10.1186/s12876-015-0404-1.
15. Prachayakul V. Pancreatic Steatosis: What Should Gastroenterologists Know? / Varayu Prachayakul, Pitulak Aswakul // J. Pancreas (Online). — 2015. — № 16(3). — Р. 227-231.
16. The association between ectopic fat in the pancreas and subclinical atherosclerosis in type 2 diabetes / M.K. Kim, H.J. Chun, J.H. Park [et al.] // Diabetes Res. Clin. Pract. — 2014. — № 106(3). — P. 590-6. — doi: 10.1016/j.diabres.2014.09.005.
17. Clinical implications of fatty pancreas: correlations between fatty pancreas and metabolic syndrome / J.S. Lee, S.H. Kim, D.W. Jun [et al.]. — World J. Gastroenterol. — 2009. — № 15. — Р. 1869-75.
18. World Health Organization: Growth reference 5–19 years. BMI-for-age (5–19 years).
19. Waist circumference percentiles in nationally representative samples of African-American, European-American, and Mexican-American children and adolescents / J.R. Fernández, D.T. Redden, A. Pietrobelli, D.B. Allison // J. Pediatr. — 2004. — № 145(4). — Р. 439-44.
20. Wan-Chen Wu. Association between non-alcoholic fatty pancreatic disease (nafpd) and the metabolic syndrome: case-control retrospective study / Wan-Chen Wu, Chih-Yuan Wang // Cardiovascular Diabetolog. — 2013. — № 12. — Р. 77. — doi: 10.1186/1475-2840-12-77.
21. Mirrakhimov A. Nonalcoholic fatty pancreatic disease and cardiometabolic risk: is there is a place for obstructive sleep apnea? / A. Mirrakhimov // Cardiovascular Diabetology. — 2014. — № 13. — P. 1-6. — doi: 10.1186/1475-2840-13-29.

/37.jpg)
/37_2.jpg)
/38.jpg)
/38_2.jpg)
/38_3.jpg)