Введение
Открытие Helicobacter pylori стало революцией в представлениях об этиологических и патогенетических особенностях развития таких болезней, как хронический гастрит, язвенная болезнь и рак желудка (рис. 1) [1]. Научное сообщество встретило открытие довольно настороженно, авторитетный медицинский журнал «Lancet» в течение года отказывался публиковать его результаты, и только после дублирования экспериментов в Великобритании статья B. Marshall и R. Warren была напечатана [2]. За всестороннее изучение биологической роли Helicobacter pylori австралийским ученым в 2005 году была присуждена Нобелевская премия в области медицины. Это событие перевернуло многие представления о причинах возникновения гастродуоденальной патологии у человека и позволило совершенно по-новому осмыслить суть явлений, лежащих в основе формирования указанной патологии и дающих базу для эффективного лечения пациентов. Были выявлены новые механизмы взаимодействия микро- и макроорганизма [3], разработаны и научно обоснованы современные методы лечения и профилактики хронических болезней желудочно-кишечного тракта [4].
/10-1.jpg)
И вот уже более 30 лет гастроэнтерология переживает период, который можно охарактеризовать как эпоху спиралевидной, кислотоустойчивой, продуцирующей уреазу бактерии — Helicobacter pylori. Robin Warren и его коллега Barry Marshall –сумели выделить и культивировать спиралевидные микроорганизмы, найденные на слизистой оболочке желудка больного, страдающего гастритом. Описанный микроорганизм был включен в международную таксономию бактерий в 1985 году как Campylobacter pyloridis. В 1987 году его переименовали в Campylobacter pylori. Дальнейшее исследование жирнокислотного и нуклеотидного состава ее РНК не позволило отнести бактерию к кампилобактерам, а обосновало необходимость по предложению S. Goodwin (1989) переименовать Campylobacter pylori в ре 1996 года на международном симпозиуме в Копенгагене американской исследовательской группой Jean-Francois Tomb [5–7].
В настоящее время H.pylori (Нр) изучается не–обычайно интенсивно, ежегодно в мире публикуется более тысячи работ, так или иначе связанных с бактерией, ее ролью в патогенезе разных заболеваний, в том числе и у детей; компьютерная сеть PubMed содержит более 21 тыс. упоминаний о бактерии — количество публикаций по бактериологии, связанных с Hp, уступает лишь кишечной палочке [8Helicobacter pylori. Последний термин отражает два морфологических признака: in vivo — микроорганизм спиралевидный (helical), in vitro — палочковидный (bacter). Полная последовательность ДНК генома была представлена в октяб].
На сегодняшний день установлено, что Helicobacter pylori — S-образная спиралевидная грамотрицательная микроаэрофильная бактерия. При культивировании на искусственных питательных средах принимает форму палочки, а при длительной культивации — коккоидную форму [9, 10]. Длина бактерии составляет 2,5–3,5 мкм, ширина — 0,5–1,0 мкм. Наиболее благоприятными условиями существования хеликобактера являются температура 37–42 °С и рН среды 6–8 [11]. При более низких значениях рН (4–6) бактерии сохраняют свою жизнеспособность, но прекращают рост и размножение [12]. Бактериальная клетка окружена хлопьевидным слоем геля — гликокаликсом, который представляет собой гликопротеидный полианионный гель, поддерживающийся матрицей и состоящий на 99 % из воды. Он служит своеобразным анионным диффузным барьером [13]. Разрушение гликокаликса приводит к повреждению бактериальной клетки, а в дальнейшем — к ее гибели [14]. H.pylori, подобно другим микроорганизмам, существующим в виде микроколоний, заключенных в гликокаликс, размножается относительно медленно, в связи с чем трудно поддается действию антимикробных препаратов [15].
Особым признаком Нр является насыщенность ее энзимными системами. Установлено, что Нр продуцирует ферменты уреазу, щелочную фосфатазу, глюкофосфатазу, протеазу, муциназу (за счет чего слизь становится менее вязкой, теряет свои защитные свойства, происходит нарушение целостности геля слизи, повышается проницаемость для Н-ионов), фосфолипазу, поражающую сурфактаноподобный фосфолипидный защитный слой слизистой оболочки, каталазу, препятствующую фагоцитозу бактерий (в том числе самой Нр), супероксиддисмутазу, а также гемолизин, вакуолизирующий цитотоксин, белок, ингибирующий секрецию соляной кислоты, и белки-адгезины. Уреаза, главный фермент Нр, расщепляет мочевину (в том числе пищевых продуктов, мочевину из кровеносного русла) до аммиака и углекислоты (бикарбоната), что в целом является положительным для микроорганизма. Образование в своем микроокружении «облачка» щелочных продуктов предохраняет возбудителя от воздействия кислой среды — буферный эффект аммиака и способствует размножению Нр (рН 6,0–8,0). Наличие Нр на слизистой желудка приводит к активации секреторного аппарата — стимуляции гастрина, снижению секреции соматостатина и постоянной стимуляции соляной кислоты [16]. Следует подчеркнуть, что длительное содержание в желудочном соке аммиака нарушает митохондриальное и клеточное дыхание, вызывая некротическое повреждение слизистой оболочки желудка, и это один из факторов развития антрального гастрита и гипергастринемии.
Естественной средой обитания хеликобактерий является слизь желудка. Благодаря своему строению и продукции указанных веществ хеликобактерии способны преодолевать защитные барьеры желудка, прикрепляться к клеткам желудочного эпителия, колонизировать его слизистую оболочку, повреждать ее и вызывать развитие хронического патологического процесса. Наиболее благоприятные условия для жизни возбудителя имеются на поверхности покровного эпителия в антральном отделе желудка, где бактерия располагается в области межклеточных соединений и шеек желез под слоем желудочной слизи. Однако при лечении антисекреторными препаратами рН в этой области повышается, и Нр может перемещаться в область тела и дна желудка. Хеликобактер может проникать внутрь эпителиоцитов, что способствует хронизации инфекции и снижению эффективности эрадикационной терапии. Внутриклеточный пул Нр, таким образом, поддерживает стабильность внеклеточной популяции возбудителя [17].
В настоящее время известно около 30 штаммов Нр. Заселяя желудок человека, Нр может персистировать годы, десятилетия и даже всю жизнь. Фактором, способствующим инвазии и высокой обсемененности Нр, является дефицит IgА.
Под действием неблагоприятных факторов, в частности антибактериальной терапии, образуются кокковидные формы Нр. Кокковидные формы микроорганизма устойчивы к внешним воздействиям, способны выживать в просвете кишечника, однако утрачивают способность к репродукции. Попав в благоприятные условия, они вновь превращаются в полноценные вегетативные формы и могут колонизировать слизистую оболочку желудка. Необходимо отметить, что кокковые формы нечувствительны к действию антибиотиков [18].
Тяжесть клинического течения хеликобактериоза во многом зависит от степени патогенности штаммов возбудителя, что, в свою очередь, определяется наличием и особенностями цитотоксических генов [19]. Важнейшим фактором патогенности считают секретируемые Нр цитотоксины белковой природы, ответственные за вакуолизацию, повреждение микроворсин, отек эпителиальных клеток, вплоть до некроза, и увеличенную проницаемость.
Воспаление слизистой оболочки желудка — неизбежный результат взаимодействия Нр с клетками желудочного эпителия. Свойственный им прямой повреждающий эффект усиливается продукцией вакуолизирующего цитотоксина (vacA) и высвобождением продуктов цитотоксинассоциированного гена А (CagA) [20]. Вакуолизирующий цитотоксин стимулирует вакуолизацию цитоплазмы в эукариотических клетках и способствует проникновению Нр в цитоплазму эпителиоцитов. В результате эпидемиологических исследований была выявлена неоднородность географического распределения различных подтипов vacA-гена, с которой могут быть связаны особенности течения патологии верхних отделов желудочно-кишечного тракта в разных регионах мира [21]. Более 40 генов патогенности (вирулентности) Нр присутствуют в одном из сегментов хромосомы, названном «островком патогенности» — CagPAI. «Островок патогенности» встроен в геном наиболее вирулентных штаммов Нр. Его маркер — белок CagA с молекулярной массой 120–140 кД, кодируемый геном citotoxin associated gene A — CagA, обладающий высокой вирулентностью относительно ульцерогенности и канцерогенности [22].
Другой важной особенностью патогенности Нр является его способность блокировать протонные помпы париетальных клеток, в результате чего преходящая гипохлоргидрия способствует развитию других инфекций, например гельминтозов.
В ответ на внедрение Нр резко увеличивается инфильтрация слизистой оболочки антрального отдела желудка лимфоцитами, богатыми рецепторами для специфических соединений с нейротрансмиттерами, усиливающими моторную функцию желудка. Это, в свою очередь, ведет к чрезмерному выбросу кислого желудочного содержимого в двенадцатиперстную кишку (ДПК) и к перестройке (метаплазии) ее слизистой оболочки по желудочному типу [23].
В настоящее время ведущая роль Нр в развитии патологии верхних отделов желудочно-кишечного тракта (гастритов, язвенных процессов) не вызывает сомнений [24]. Хеликобактериоз является причиной гастритов в 50–96 % случаев. Язвенная болезнь желудка и ДПК обусловлена Нр в 70–100 % случаев. Карцинома и В-клеточная лимфома желудка связаны с Нр в 70–80 % случаев [25].
Международное агентство по изучению рака (IARC) отнесло Нр к канцерогенам первой группы (определенный канцероген). Хеликобактер не является единственным этиологическим фактором развития рака желудка, но играет причинную роль в цепи событий, ведущих к его развитию. Механизм опухолевой трансформации клеток окончательно не изучен. Однако считают, что Нр-инфицирование способствует развитию атрофического гастрита и кишечной метаплазии; кроме того, Нр увеличивает адгезию канцерогенов; Нр сам может проявлять свойства митогена, так как ускоряет пролиферацию и делает эпителий менее зрелым. Нр, стимулируя макрофаги, способствует высвобождению токсигенных цитокинов и различных радикалов О2. При колонизации Нр уменьшается поступление витамина С из циркуляторного русла в желудочный сок (соответственно, снижается потребление клетками слизистой желудка этого антиоксиданта), что способствует пролиферации эпителия желудка. Хеликобактер — медленная инфекция: в течение ряда лет под ее влиянием развивается антральный гастрит с повышенным риском язвенной болезни ДПК, атрофический гастрит с повышенным риском появления рака или лимфомы желудка. У Нр-инфицированных пациентов в 3–6 раз увеличивается риск рака желудка [26].
За время интенсивного изучения биологической роли этого микроорганизма с 1982 года было показано, что Нр может не только выступать в качестве этиологического фактора гастродуоденальной патологии, но также способствовать развитию внегастральных патологических состояний (поражение поджелудочной железы, атеросклеротические изменения, аутоиммунные заболевания, крапивница, анемия, тромбоцитопеническая пурпура).
В 1987 году создана Европейская группа по изучению пилорического хеликобактера (The European Helicobacter pylori Study Group) — неправительственная структура, призванная координировать усилия различных групп исследователей. В 1990 году на IX Международном конгрессе гастроэнтерологов принята Сиднейская классификация гастритов, отводящая Нр роль одного из пяти диагностических критериев. В 1994 году согласительная комиссия Американского национального института здоровья (U. S. National Institute of Health) признала ведущую роль Нр в возникновении и развитии язвенной болезни, а Международное агентство по изучению рака (International Agency for Research on Cancer, France) отнесло Нр к канцерогенам I типа вследствие существования эпидемиологической связи Нр с развитием аденокарцином и лимфом слизистой оболочки желудка. Нр является первой бактерией, которая классифицирована Международным агентством по исследованию рака как доказанный канцероген.
Современная терапия хеликобактерассоциированной гастродуоденальной патологии предполагает эрадикацию Нр. Первые рекомендации, касающиеся вопросов диагностики инфекции, основных показаний для антихеликобактерной терапии и различных схем лечения заболеваний, ассоциированных с Нр, были разработаны в 1996 году в городе Маастрихт. В связи с этим они получили название «Первый Маастрихтский консенсус», сокращенно — Маастрихт-1. По мере получения новых данных о Нр каждые пять лет проводится пересмотр документа, регламентирующего тактику ведения пациентов с хеликобактерассоциированными заболеваниями: в 2000 году были разработаны и изданы рекомендации Маастрихт-2, а в 2005 году — Маастрихт-3. Последний пересмотр рекомендаций произошел в конце 2010 года во Флоренции и получил условное название Маастрихт-4. Полный текст рекомендаций на английском языке был опубликован в феврале 2012 года под названием «Management of Helicobacter Pylori infection — the Maastricht IV/ Flo–rence Consensus Report» в журнале «GUT» [27].
Регулярный пересмотр подходов к диагностике и лечению хеликобактерассоциированных заболеваний продиктован необходимостью разработки высокоэффективных схем эрадикации на фоне прогрессирующего роста устойчивости Нр к большинству традиционно используемых антибиотиков. Антибиотикорезистентность приводит к тому, что эффективность эрадикации снизилась в развитых странах с 80–90 до 40–70 %.
Основной целью Маастрихтского консенсуса 2010 года было всестороннее изучение ключевых вопросов тактики врача при различных заболеваниях, ассоциированных с инфекцией Нр. Все положения оценивались с точки зрения доказательной медицины. Экспертами были рассмотрены три основных раздела нового консенсуса:
— клинические сценарии и показания к терапии инфекции Нр;
— диагностика и лечение инфекции Нр;
— предупреждение развития рака желудка путем эрадикации инфекции Нр.
Однако известные к настоящему времени согласительные документы по диагностике и лечению инфекции Нр у взрослых пациентов — Maastricht IV/ Florence Consensus Report Европейской группы по изучению НР от 2012 года [28] и рекомендации American College of Gastroenterology от 2007 года [29] — не могут быть в полной мере использованы у детей по многим причинам, среди которых:
1. Разная частота инфицированности Нр и отдельных клинических проявлений (язвенной болезни, атрофического гастрита и малигнизации) в детской и взрослой популяциях.
2. Разная чувствительность и применимость диагностических тестов.
3. Различающийся ответ на лекарственную терапию, в частности большая частота антибиотикорезистентности Нр в детской популяции.
В 2011 году был опубликован согласительный документ Европейской (ESPGHAN) и Северо–американской (NASPGHAN) ассоциаций детских гастроэнтерологов [30], в котором с позиций доказательной медицины представлена основная цель клинического исследования желудочно-кишечных симптомов — определение основных причин симптомов, а не только подтверждение наличия Нр-инфекции. Диагностическое исследование на определение Нр-инфекции не рекомендуется проводить у детей с функциональными болями в животе. Рекомендовано проведение исследования на определение Нр-инфекции у детей с родственниками первой степени, имеющими рак желудка, а также у детей с рефрактерной железодефицитной анемией при исключении всех других причин.
Для диагностики хеликобактерной инфекции во время ЭГДС рекомендуется брать биопсию желудка (антрального отдела и тела) для выявления гистопатологии. Первоначальный диагноз хеликобактерной инфекции должен быть основан на положительном гистопатологическом исследовании и уреазном дыхательном тесте (УДТ) или позитивной культуре.
Для контроля эрадикации Нр-инфекции надежными неинвазивными методами являются 13С-УДТ и иммуноферментный анализ (ИФА) для определения Нр-антигена в стуле. Рекомендуется проводить неинвазивные исследования для определения эффективности эрадикации через 4–8 недель после завершения терапии, то есть не менее чем через две недели после прекращения терапии ингибиторами протонной помпы (ИПП) и не менее чем через четыре недели после прекращения приема антибиотиков.
В согласительном документе указано, что тесты, основанные на обнаружении антител (IgG, IgA) к Нр в сыворотке крови, цельной крови, моче и слюне, не являются надежными для использования в клинических условиях.
В отличие от нынешних руководящих принципов для взрослых пациентов, стратегия «исследование и лечение» у детей не рекомендуется.
Обязательными компонентами современных схем эрадикации НР должны быть ИПП и/или препараты висмута и не менее двух антибактериальных препаратов. Комбинация двух антибиотиков и ИПП была рекомендована в качестве терапии первой линии в первом издании педиатрических рекомендаций [31–33].
Исследования по сопоставлению различных вариантов лечения в педиатрической популяции остаются ограниченными. В 2000 г. G. Oderda и соавт. [34] осуществили систематический обзор опубликованных эрадикационных исследований у детей. В связи с отмеченной неоднородностью и ограниченным числом хорошо спланированных исследований было трудно сформулировать окончательные рекомендации. В 2001 году первое рандомизированное двойное слепое исследование по сравнению двойной терапии амоксициллином и кларитромицином с тройной терапией, включающей омепразол, у детей подтвердило, что при применении тройной терапии уровень эрадикации составил 74,2 % [35].
Последние данные показывают снижение скорости ликвидации Нр. Например, в Европейском педиатрическом реестре лечения сообщили результаты использования 27 различных схем у 518 детей с Нр-инфекцией [36]. Общий уровень эрадикации составил 65,6 %. Одна из возможных причин снижения и недостаточного уровня эрадикации Нр — снижение чувствительности бактерии к антибиотикам, входящим в схемы эрадикации. Рекомендуется изучать характер антибиотикорезистентности штаммов Нр у детей и подростков в разных странах и географических регионах и обязательно учитывать его при назначении эрадикационной терапии. Некоторые европейские исследования свидетельствуют о высоком уровне показателя устойчивости к кларитромицину и метронидазолу в педиатрической практике и при лечении взрослого населения [37–39]. Перспективные многоцентровые исследования среди взрослых и детей в США также зафиксировали аналогичные высокие показатели резистентности к метронидазолу и кларитромицину [40], поэтому информированность об устойчивости к антибиотикам — важная составляющая успеха лечения [41].
Действительно, эффективность эрадикационной терапии у детей, получавших стандартные схемы лечения, со временем уменьшается, в то время как возрастает антибиотикорезистентность. Если резистентность микроорганизма возникла после предшествующего лечения антибактериальным препаратом по поводу другой патологии — это первичная форма резистентности. При вторичной резистентности бактерия подверглась мутации уже в процессе антихеликобактерной терапии.
У Нр резистентность к антибиотикам обусловлена точечными мутациями в процессе репликации ДНК. Штаммы бактерий, несущие мутации, связанные с формированием резистентности, закономерно отбираются в процессе лечения антибактериальными средствами. В реальных условиях селекция таких штаммов может быть связана с воздействием низких доз антибиотиков, что имеет место при проведении монотерапии других заболеваний или при нерегулярном приеме препаратов пациентами с низкой приверженностью к лечению [42].
Другой механизм антибиотикорезистентности может быть ассоциирован с белками, образующими мембранные каналы, через которые осуществляется быстрый эффлюкс (активное выведение) антибиотика еще до его контакта с внутриклеточной мишенью.
Важной рекомендацией международного консенсуса является необходимость проводить исследование чувствительности Нр к кларитромицину до начала тройной терапии в регионах с высоким уровнем кларитромицинустойчивых штаммов Нр (> 20 %). Резистентность к кларитромицину отрицательно сказывается на процессе эрадикации у детей [43, 44]. Как указывает В.В. Рафальский, формирование устойчивости Нр к макролидам происходит преимущественно за счет негастроэнтерологического потребления препарата [45].
Сегодня из всех антибиотиков, применяемых в схемах эрадикационной терапии Hp, проблема резистентности к кларитромицину имеет более высокую клиническую значимость.
Резистентность Hp к кларитромицину служит главным препятствием для назначения классической тройной терапии первой линии на основе ИПП. Основными причинами развития резистентности к кларитромицину являются увеличение количества больных, которые лечатся самостоятельно, принимая неадекватную антихеликобактерную терапию, недостаточные дозы антибиотиков, самостоятельное прекращение приема препаратов на второй-третий день лечения, неправильная комбинация лекарственных средств в схеме и часто неоправданное назначение антибиотиков в ситуациях, когда они не показаны [46, 47]. К сожалению, из-за широкого применения макролидных антибиотиков этот показатель практически во всем мире неуклонно растет. Многоцентровые исследования резистентности штаммов Hp, проведенные в странах европейского региона, выявили ее уровень в 21–28 % для взрослых и 24 % для детей [48–50]. В Японии отмечен значительный рост частоты резистентных штаммов Hp с 27,7 % в 2004–2005 гг. [51] до 78 % в последние годы [52]. Значительный уровень резистентности (48,2 %) к кларитромицину зарегистрирован и в Турции [53]. В случае неудачной эрадикации при использовании схемы с включением кларитромицина уровень вторичной резистентности еще выше и составляет от 36 до 85 % [54, 55].
Исследование в педиатрической практике, проведенное в странах Европы, в котором приняли участие 1233 пациента, определило устойчивость к кларитромицину на уровне 20 %, к метронидазолу — 25 % [56]. Также высокая резистентность штаммов Нр к кларитромицину зафиксирована в мультицентровом исследовании, проведенном в 18 европейских странах с апреля 2008 года по июнь 2009 года, в которое были включены 2204 пациента (1893 взрослых, 311 детей) [57] (табл. 1).
В Украине исследования чувствительности Hp к антибактериальным препаратам и уровня антибиотикорезистентности представлены ограниченным количеством данных, однако в диссертационной работе Л.Б. Бардах (научный руководитель — проф. А.С. Свинцицкий) наличие метронидазол-резистентных штаммов Нр зафиксировано у 70,2 % пациентов, кларитромицин-резистентных — у 22,6 % пациентов с хроническим эрозивным гастритом [58].
С учетом роста резистентности к основным препаратам антихеликобактерной терапии первой линии (метронидазол, кларитромицин) является актуальным поиск новых препаратов, обладающих антихеликобактерной активностью, и модификация схем с уже хорошо известной эффективностью. В отечественной и зарубежной литературе имеются данные о применении нитрофурановых препаратов для эрадикации Нр [59–61], в частности нифуратела [62–64]. На сегодняшний день из препаратов нитрофуранового ряда наиболее изученным для использования в схемах эрадикации Нр является нифурател.
На основании последних данных доказательной медицины в Украине разработаны и внедрены современные схемы эрадикации хеликобактерной инфекции у детей, которые представлены в клинических протоколах медицинской помощи детям с заболеваниями органов пищеварения, утвержденных приказом МЗ Украины № 59 от 29 января 2013 г. [65]. В качестве первой линии терапии протокол предлагает одну из следующих эрадикационных схем:
1. Коллоидный субцитрат висмута + амоксициллин (рокситромицин) или кларитромицин (азитромицин) + нифурател (фуразолидон), преимущественно для детей до 12 лет.
2. Омепразол (пантопразол) + амоксициллин (рокситромицин) или кларитромицин (азитромицин) + нифурател (фуразолидон).
Цель исследования: оценка эффективности и безопасности схем тройной терапии с использованием нифуратела для эрадикации Helicobacter pylori в педиатрической практике.
Материалы и методы
Дизайн исследования
Открытое проспективное исследование эффективности антихеликобактерной терапии в педиатрической практике проходило в период с февраля по май 2014 года на базе детского городского гастроэнтерологического центра г. Киева и амбулаторно-консультативного отделения городской клинической больницы им. Б.Я. Резника г. Одессы.
Постановка предварительного диагноза осуществлялась на основании клинических методов исследования: жалоб пациента, анамнеза заболевания и жизни, а также данных объективного обследования пациентов. Окончательный диагноз подтверждался данными эзофагогастродуоденоскопии (ЭГДС). Выявление Нр осуществляли при помощи быстрого уреазного теста и 13С-уреазного дыхательного теста, а также гистологического исследования гастробио–птатов. Контроль эрадикации осуществляли с помощью уреазного дыхательного теста (УДТ).
Критерии включения в исследование:
1. Пациенты, чьи родители подписали информированное согласие на участие в исследовании.
2. Пациенты с хроническими гастритами и гастродуоденитами, ассоциированными с Нр.
3. Пациенты с эрозивно-язвенными поражениями двенадцатиперстной кишки, ассоциированными с Нр.
4. Амбулаторные и стационарные пациенты.
5. Пациенты, которые в течение месяца до начала исследования не принимали препараты, к которым мог быть чувствителен Нр.
Критерии невключения в исследование:
1. Пациенты с известной гиперчувствительностью или аллергией к применяемым препаратам.
2. Пациенты с эрозивно-язвенными поражениями желудка и/или двенадцатиперстной кишки, не ассоциированными с Нр.
3. Сопутствующие врожденные заболевания двенадцатиперстной и тонкой кишки (дивертикулы, мегадуоденум, мегаеюнум).
4. Невозможность или нежелание родителей дать информированное согласие на участие в исследовании.
Критерии исключения
Из исследования исключались пациенты, которые не могли пройти все его стадии или отказывались от дальнейшего участия в исследовании, в том числе:
1. Пациенты, которые не способны были продолжать участвовать в исследовании по причине развития у них гиперчувствительности к принимаемым препаратам.
2. Пациенты, которые нарушали или не соблюдали режим и дозировку принимаемых лекарственных препаратов.
Все пациенты, родители которых подписали согласие на участие в исследовании, проходили обследование, включавшее сбор жалоб и анамнеза заболевания, данных объективного обследования. Также применялись лабораторные и инструментальные методы исследования: клинический и биохимический анализ крови, общие анализы мочи и кала, ультразвуковое исследование (УЗИ) органов брюшной полости, ЭГДС, уреазный дыхательный (чувствительность — 90 %, специфичность — 90 %) и быстрый (чувствительность — 97 %, специфичность — 97 %) хелик-тесты, гистологическое исследование гастробиоптатов. Полное обследование пациентов проводилось в первые дни с момента обращения за помощью в амбулаторную клинику или госпитализации в стационар, а затем в дни, преду–смотренные дизайном исследования для контроля эффективности лечения. Все исследования проводили натощак в период с 8 до 10 часов утра.
Контроль эрадикации проводили через 5–6 недель после окончания лечения.
Сбор жалоб и их оценка проводились при поступлении в стационар или обращении за амбулаторной помощью и далее с интервалом в 3–4 дня в процессе проводимого лечения, после окончания приема препаратов эрадикационных схем и при-
мерно через 6 недель после окончания эрадикационной терапии. При оценке абдоминального болевого синдрома обращалось внимание на локализацию болей (эпигастрий, пилородуоденальная зона, область правого и левого подреберий), наличие или отсутствие иррадиации, характер болевого синдрома (колющие, ноющие, тупые), длительность (постоянная, периодическая), наличие связи с приемом пищи (ранние, поздние, «голодные»), а также факторы и положения, провоцирующие, облегчающие или купирующие их.
Была проведена оценка диспептических проявлений: изжоги (или чувства жжения в эпигастральной области), всегда сопутствующей гастроэзофагеальной рефлюксной болезни, отрыжки тухлым, съеденной пищей, воздухом, горечи во рту, тошноты, рвоты, неприятных ощущений и чувства распирания в эпигастрии после еды, чувства быстрого насыщения, кишечного диспептического синдрома (метеоризм и вздутие живота, спастические боли по ходу толстого кишечника, нарушения стула).
Говоря о наличии общесистемных жалоб, следует отметить, что ведущими из них были слабость и частые головные боли. При сборе анамнеза обращали внимание на возраст больного к началу заболевания, особенность первых клинических проявлений, длительность болезни, периодичность и характер обострений, проведение в прошлом эрадикационной терапии, ее эффект, наличие осложнений и сопутствующей патологии, характер питания, а также наличие у живых ближайших родственников аналогичной нозологии. При объективном обследовании определяли пальпаторную болезненность, наличие мышечного дефанса над проекцией пораженных органов, симптом Менделя.
Для обследования всех пациентов был применен метод видео- и фиброэзофагогастродуоденоскопии. Исследование проводилось по общепринятым требованиям. Гастроскоп вводился под контролем глаза. В процессе проведения исследования определялось присутствие эрозивно-язвенных дефектов слизистой оболочки желудка и ДПК, их локализация, размеры, форма, характер краев, а также рубцовой деформации желудка и ДПК. Оценку этих изменений проводили с помощью установленных стандартом эндоскопических критериев [66, 67].
По эндоскопическим признакам воспалительных процессов в желудке и ДПК (гастрит, гастродуоденит, дуоденит) выделяли поверхностный, выраженный, резко выраженный, а также атрофический эрозивный гастрит и дуоденит.
Общая характеристика обследованных пациентов
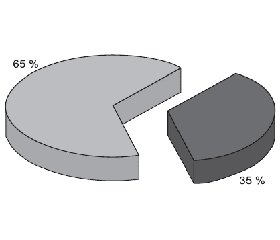
Для решения поставленной задачи были обследованы 60 детей в возрасте от 6 до 17 лет (средний возраст 8,0 ± 2,1 года), из них детей от 6 до 12 лет — 18 (30 %), от 12 до 17 лет — 42 (70 %) (рис. 2); мальчиков было 39 (65 %), девочек — 21 (35 %) (рис. 3).
У обследованных пациентов была выявлена следующая патология, ассоциированная с Нр: хронический гастрит — 15 (25 %), хронический гастродуоденит — 39 (65 %), язвенная болезнь ДПК — 6 (10 %).
Эрадикационная терапия является основной для лечения патологии, ассоциированной с Нр. Согласно рекомендациям ESPGHAN и NASPGHAN (2011), у детей эрадикационную терапию следует начинать при подтверждении Нр-позитивной язвенной болезни; вопрос о начале анти-Нр-терапии также может быть рассмотрен при обнаружении Нр методом гистопатолoгии в отсутствие язвенной болезни [30]. В связи с наличием у детей не только клинической картины, но и морфологически подтвержденных изменений слизистой оболочки желудка и ДПК (эрозивный гастродуоденит, язвенный дефект ДПК), а также с обнаружением Нр гистологически и с помощью неинвазивных методов принималось решение о начале антихеликобактерной терапии. Успешная антихеликобактерная терапия подразумевает полное уничтожение микроорганизма, включая кокковые формы. В нашем исследовании использовались режимы эрадикации, рекомендованные МЗ Украины: для детей от 6 до 12 лет (18 детей) — тройная схема, включающая препарат коллоидного субцитрата висмута в сочетании с амоксициллином и нифурателом, для детей старше 12 лет (42 ребенка) — омепразол в сочетании с амоксициллином и нифурателом (табл. 2). Дозы препаратов: коллоидный субцитрат висмута — 8 мг/кг/сут, омепразол — 0,5 мг/кг/сут, амоксициллин — 25 мг/кг/сут, нифурател — 30 мг/кг/сут. Все препараты принимались два раза в день — утром и вечером.
В настоящее время важным базисным компонентом антихеликобактерной терапии являются ИПП, что обусловлено их синергизмом с антибиотиками, входящими в эрадикационные схемы, и способностью повышать рН внутрижелудочной среды [68]. Омепразол представляет собой замещенный пиридинметилсульфинилбензимидазол. Данный препарат на 95 % связывается с белками плазмы и необратимо связывается с Н+К+-АТФазой париетальных клеток слизистой оболочки желудка (СОЖ), блокируя тем самым синтез соляной кислоты. Максимальная концентрация его в сыворотке крови (tmax) составляет от 1 до 3 часов. Процент доступности его колеблется от 40 до 65. Лекарственный препарат быстро проходит метаболизм в печени системой цитохрома Р450 и экскретируется почками. Период полувыведения составляет один час [69].
Коллоидный субцитрат висмута обладает опо–средованным антихеликобактерным действием за счет подавления подвижности и адгезии Hp к эпителиоцитам [70]. Также препараты висмута оказывают выраженное цитопротективное действие на пораженную слизистую оболочку желудка и ДПК. Цитопротекторы способствуют активации синтеза гликопротеинов желудочной слизи, улучшая ее качественный состав, повышая гидрофобность — важный показатель цитопротекции и повышая резистентность эпителия слизистой оболочки желудка и ДПК [71]. Препараты висмута в кислой желудочной среде соединяются с протеинами в гликопротеин-висмутовый хелатный комплекс, который локализуется преимущественно в области эрозивно-язвенных дефектов в виде защитной пленочки, замещающей отсутствующий слой слизистого геля, под которой, как под струпом, идет процесс заживления. Данный механизм защищает эпителиальные клетки от прямого действия кислоты, но почти не влияет на базальную и стимулированную секрецию. Существенным является то, что препараты висмута адсорбируют пепсин, снижают его активность вследствие взаимодействия при низком значении рН отрицательно заряженных солей висмута, которые формируются из висмута трикалия дицитрата, с положительно заряженными группами пепсина, приводя к его инактивации [72].
Амоксициллин является единственным бета-лактамным антибактериальным препаратом широкого спектра действия, применяющимся для лечения инфекции Hp. Он кислотоустойчив, хорошо всасывается в желудочно-кишечном тракте. Амоксициллин биодоступен на 75–93 %, и это вне зависимости от приема пищи (нарушать всасывание могут антациды и энтеросорбенты). Метаболизм проходит частично в печени, около 80 % в неизмененном виде выводится почками. Период полувыведения составляет 1–1,3 часа. Амоксициллин характеризует низкий и стабильный уровень резистентности к нему Нр. В Европе и США, по некоторым данным, он колеблется на отметке не более 2 % [73].
Нифурател — оригинальная молекула, разработанная научно-исследовательской лабораторией Polichem (Италия). Нифурател, препарат из группы нитрофуранов, обладает широким спектром антибактериального, противопротозойного и противогрибкового действия [74]. Механизм действия нифуратела заключается в блокировании ряда энзимных цепочек и ингибировании синтеза белка в рибосомах на самых ранних этапах трансляции. Это препятствует появлению устойчивых штаммов микроорганизмов и развитию перекрестной резистентности к антибиотикам [75], что является важным при комбинировании нифуратела с другими антибактериальными средствами при проведении антихеликобактерной терапии [76]. Выводится нифурател преимущественно почками, что снижает нагрузку на печень, так как не выявляется во внутрипеченочной циркуляции. Нифурател обладает хорошими органолептическими свойствами, что особенно важно у детей, не вызывает горечи, тошноты и других неприятных ощущений. Период полувыведения препарата позволяет применять его два раза в день, как и остальные компоненты антихеликобактерной терапии. При применении нифуратела в сочетании с антибиотиками в эрадикационных схемах снижается вероятность развития антибиотикассоциированной диареи, так как нифурател достоверно нормализует содержание бифидобактерий и лактобацилл в кишечнике [77].
Результаты и обсуждение
Анализ субъективных признаков патологии показал, что основной жалобой, предъявляемой пациентами всех групп, являлась боль. У обследованных нами пациентов в первой группе — 94,4 % (17 детей), во второй группе — 95,2 % (40 детей). Характер болевого синдрома у обследованных детей расценивался как умеренный, при этом пациенты предъявляли жалобы на тупую, ноющую боль. Также отмечалась периодичность возникновения боли и связь с приемом пищи: у большинства детей обеих групп боль в животе возникала натощак — у 16 (88,8 %) в первой группе и у 39 (92,8 %) во второй группе. Говоря о симптомокомплексе желудочной диспепсии, на первое место следует поставить ощущение тошноты у 66,6 % (12) детей первой группы и у 90,4 % (38) детей второй группы.
Снижение аппетита, почти всегда сопутствующее абдоминальной боли и синдрому диспепсии, наблюдалось у 100 % (18 и 42) детей обеих групп.
Рассматривая симптомокомплекс кишечной диспепсии, стоит обратить внимание на высокий процент симптомов запора: 77,7 % (14) детей в первой группе и 73,8 % (31) — во второй. Неустойчивость стула отмечали 27,8 % (5) детей первой группы и 45,8 % (18) второй группы. На метеоризм и вздутие живота, ощущение перистальтирующего кишечника жаловались немногие пациенты, причем эти симптомы скорее были связаны с погрешностями в диете (употребление большого количества сырых овощей) и приемом сладких газированных напитков и не были постоянными.
Анализируя объективную симптоматику при обследовании органов желудочно-кишечного тракта, мы не обнаружили существенных различий между группами. У большинства пациентов отмечался налет на языке (86,6–100,0 %) и умеренная или выраженная пальпаторная болезненность в эпигастральной области (96,6–98,3 %). Мышечный дефанс, преимущественно локализующийся в эпигастральной области, и симптом Менделя довольно часто выявлялись в обеих группах пациентов.
Эндоскопическое исследование проводилось не только с целью выявления и оценки характера эрозивно-язвенно-воспалительного процесса в слизистой оболочке желудка и ДПК, но и для прослеживания динамики воспалительного процесса. В нашем исследовании при эзофагогастродуоденоскопии выявляли ассоциированные с Нр язвенную болезнь ДПК (6 детей), хронический гастрит (15 детей) и хронический эрозивный гастродуоденит (39 детей). Язвенное поражение ДПК, зарегистрированное у 6 больных, характеризовалось язвенным дефектом на передней стенке луковицы ДПК круглой или овальной формы. У детей, страдающих эрозивным хеликобактерным гастритом и гастродуоденитом, при ЭГДС визуализировались небольшие (около 0,1 см) поверхностные дефекты эпителия слизистой оболочки желудка и ДПК округлой или овальной формы, окруженные венчиком гиперемии.
В результате лечения у пациентов обеих групп отмечена выраженная положительная клиническая динамика, а также достигнут высокий достаточный процент эрадикации Нр. На фоне проводимой терапии у 88,8 % (16) детей первой группы к 3–4-му дню полностью исчезли болевые ощущения, к 7–8-му дню лечения болевые ощущения не регистрировались у всех 100 % (18) детей. Во второй группе 87,5 % (35) детей не предъявляли жалобы на боли в животе уже на 3–4-й день лечения, а к 7–8-му дню от начала терапии болевые ощущения были полностью купированы у всех детей. В целом к 8–10-му дню от начала лечения у всех пациентов при объективном обследовании отмечалось отсутствие болевых ощущений.
Тошнота у 75 % (9) пациентов первой и 84,2 % (32) второй группы купировалась к 3–4-му дню лечения. На 7–8-й день у пациентов первой группы тошнота не отмечалась, во второй группе у одного пациента (2,6 %) сохранялись жалобы на тошноту, но было отмечено снижение интенсивности данного симптома. Дефекация стала ежедневной (один-два раза в день) к 3–4-му дню лечения у 92,8 % (13) пациентов первой группы и у 96,7 % (30) второй. Нормализация консистенции стула отмечена к 3–4-му дню лечения у 100 % (5) пациентов первой группы и у 94,4 % (17) второй группы, из тех, у кого отмечался данный симптом до лечения. К 7–8-му дню лечения у всех пациентов обеих групп отмечена нормализация стула.
По данным 13С-уреазного дыхательного теста, примерно на 50-й день наблюдения (через 5–6 недель после окончания лечения) уровень эрадикации Нр в первой группе (КСВ, амоксициллин, нифурател) составил 88,8 % (16 из 17 пациентов), во второй группе (омепразол, амоксициллин, нифурател) — 87,5 % (35 из 40 пациентов). Одному из пациентов второй группы лечение было остановлено в связи с развитием аллергической реакции (острая крапивница), у одного из пациентов второй группы родители нарушали режим приема лекарств. У 96,6 % детей отмечалась хорошая переносимость лечения. Все нежелательные явления, которые отмечались у пациентов (горечь во рту, желтая окраска мочи), были слабо выражены и не требовали отмены или изменения режима терапии.
Выводы
В результате проведенного исследования показана высокая и достаточная эффективность схем эрадикации Helicobacter pylori первой линии у детей до 12 лет (терапия КСВ + амоксициллин + нифурател — 88,8 %) и у детей старше 12 лет (омепразол + амоксициллин + нифурател — 87,5 %), быстрое купирование клинических симптомов, отличная переносимость и безопасность данных режимов антихеликобактерной терапии, что позволяет рекомендовать их использование в лечении Нр-ассоциированных гастритов, гастродуоденитов и язвенной болезни у детей.
Конфликт интересов. Не заявлен.
Впервые опубликовано в журнале
«Современная педиатрия». 2014. № 5(61)

/10-1.jpg)
/14-1.gif)
/16-1.gif)