Журнал «» 3 (53) 2017
Ризик і предиктори розвитку артеріальної гіпертензії у хворих на системну склеродермію
Авторы: Курята О.В.(1), Лисунець Т.К.(2), Семенов В.В.(1)
(1) — ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро, Україна
(2) — КЗ «Дніпропетровська обласна клінічна лікарня ім. Мечникова», м. Дніпро, Україна
Рубрики: Кардиология
Разделы: Клинические исследования
Резюме
Актуальність. Пацієнти із запальними захворюваннями суглобів (ЗЗС), до яких можна зарахувати системну склеродермію (ССД), мають підвищений ризик кардіоваскулярних (КВ) ускладнень порівняно із загальною популяцією. Артеріальна гіпертензія (АГ) є потужним фактором, що піддається модифікації та впливає на КВ-ризики у пацієнтів із ЗЗС. Мета. Дослідити ризик і предиктори розвитку АГ у хворих на ССД. Матеріали та методи. Ми провели 5-річне проспективне спостереження за 73 пацієнтами, які перебували у регіональному регістрі. Дослідження ризику розвитку АГ проводилося за допомогою процедури Каплана — Мейєра. Обчислення впливу предикторів на ризик розвитку АГ проводилося за допомогою регресії Кокса. Результати. П’ятирічний ризик розвитку АГ при ССД становить 20,3 %. Ризик розвитку АГ через 1, 3 та 5 років — 18,2, 25,0 та 19,4 % відповідно. Отримано показники впливу початкових клініко-лабораторних показників на ризик розвитку АГ (відношення ризиків): вік > 45 років — 2,04, дифузна склеродермія — 0,65, синдром Рейно — 1,17, набряк кистей — 1,74, артрит — 0,99, пневмофіброз — 1,84, анемія — 0,78, швидкість осідання еритроцитів (ШОЕ) > 25 мм/год — 1,68, С-реактивний протеїн (СРП) > 5 мг/л — 1,52, ревматоїдний фактор (РФ) > 14 МО/мл — 1,48, протеїнурія — 1,09. Висновки. П’ятирічний ризик розвитку АГ при ССД становить 20,3 %. Найбільший вплив на ризик розвитку АГ при ССД показали: вік > 45 років, наявність набряку кистей, пневмофіброзу, ШОЕ > 25 мм/год, СРП > 5 мг/л, РФ > 14 МО/мл. У пацієнтів, які мали АГ у дебюті ССД, у п’ятирічній перспективі можна очікувати збільшення зустрічальності протеїнурії та зниження швидкості клубочкової фільтрації.
Актуальность. Пациенты с воспалительными заболеваниями суставов (ВЗС), к которым можно отнести системную склеродермию (ССД), имеют повышенный риск кардиоваскулярных (КВ) осложнений по сравнению с общей популяцией. Артериальная гипертензия (АГ) является мощным модифицируемым фактором, влияющим на КВ-риски у пациентов с ВЗС. Цель. Исследовать риск и предикторы развития АГ у пациентов с ССД. Материалы и методы. Проведено 5-летнее проспективное наблюдение за 73 пациентами, находящимися в региональном регистре. Исследование риска развития АГ проводилось с помощью процедуры Каплана — Мейера. Вычисления влияния предикторов на риск развития АГ осуществлялись с помощью регрессии Кокса. Результаты. Пятилетний риск развития АГ при ССД составил 20,3 %. Риск развития АГ через 1, 3 и 5 лет составляет 18,2, 25,0 и 19,4 % соответственно. Получены показатели влияния начальных клинико-лабораторных показателей на риск развития АГ (отношение рисков): возраст > 45 лет — 2,04, диффузная склеродермия — 0,65, синдром Рейно — 1,17, отек кистей — 1,74, артрит — 0,99, пневмофиброз — 1,84, анемия — 0,78, скорость оседания эритроцитов (СОЭ) > 25 мм/ч — 1,68, С-реактивный протеин (СРП) > 5 мг/л — 1,52, ревматоидный фактор (РФ) > 14 МЕ/мл — 1,48, протеинурия — 1,09. Выводы. Пятилетний риск развития АГ при ССД составляет 20,3 %. Наибольшее влияние на риск развития АГ при ССД показали возраст > 45 лет, наличие отека кистей, пневмофиброза, СОЭ > 25 мм/ч, СРП > 5 мг/л, РФ > 14 МЕ/мл. АГ при ССД имеет гетерогенный характер. У пациентов, имевших АГ в дебюте ССД, в пятилетней перспективе можно ожидать увеличения встречаемости протеинурии и снижение скорости клубочковой фильтрации.
Background. Patients with inflammatory joint diseases, which include systemic scleroderma (SS), have increased cardiovascular disease risk compared with the general population. Arterial hypertension (AH) is a major modifiable risk factor contributing to increased cardiovascular disease risk in inflammatory joint diseases. The purpose of the study was to investigate the prognosis and predictors of AH development in patients with SS. Materials and methods. We have conducted a 5-year prospective observation of 73 patients, who were in the regional registry. The investigation of risk for AH development was performed using the Kaplan-Meier procedure. Calculations of predictors’ influence on the risk of AH were performed using Cox regression. Results. The 5-year risk of AH development in SS was 20.3 %. Estimated risk of AH on the first, third and fifth year of the disease is 18.2, 25.0 and 19.4 %, respectively. The resulting impact of the initial clinical and laboratory parameters on the risk of AH development (hazard ratio): age > 45 years — 2.04, diffuse scleroderma — 0.65, Raynaud phenomenon — 1,17, tightness of the skin of the hands — 1.74, arthritis — 0.99, pulmonary fibrosis — 1.84, anemia — 0.78, erythrocyte sedimentation rate (ESR) > 25 mm/h — 1.68, C-reactive protein (CRP) level > 5 mg/l — 1.52, rheumatoid factor (RF) > 14 IU/ml — 1,48, proteinuria — 1.09. Conclusions. The 5-year risk of AH in SS is 20.3 %. The strongest influence on the risk of AH development in SS showed: age > 43.7 years, the presence of the tightness of the skin of the hands, pulmonary fibrosis, ESR > 25 mm/h, CRP > 5 mg/l, RF > 14 IU/mL. AH in systemic scleroderma has a heterogeneous nature. In patients, who had AH at the onset of SS, in a five-year term, we can expect an increase in the occurrence of proteinuria and glomerular filtration rate decline.
Ключевые слова
системна склеродермія; артеріальна гіпертензія; протеїнурія
системная склеродермия; артериальная гипертензия; протеинурия
systemic scleroderma; hypertension; proteinuria
Актуальність
Системна склеродермія (ССД) — системне захворювання сполучної тканини невідомої етіології із широким спектром клінічних проявів. Пацієнти із запальними захворюваннями суглобів, до яких можна віднести ССД, мають підвищений ризик кардіоваскулярних (КВ) ускладнень порівняно із загальною популяцією [1]. Серед причин смерті, не пов’язаних із ССД, КВ-ускладнення (зокрема, серцева недостатність) посідають друге місце [2, 3].
Оцінка КВ-ризиків проводиться з використанням таких шкал, як Фремінгемська або SCORE. Проте в низці досліджень була продемонстрована неточність прогнозу цих шкал для пацієнтів із ревматоїдним артритом (РА) [4, 5]. Можливо, рівень запалення та застосування протизапальних засобів впливають на показники, за допомогою яких оцінюють КВ-ризик у загальній популяції [1]. Робоча група EULAR у 2016 р. розробила рекомендації з ведення КВ-ризиків для пацієнтів із РА [1], але для пацієнтів із ССД такі дослідження ще не проводились.
Артеріальна гіпертензія (АГ) є потужним фактором, що впливає на КВ-ризики, який піддається модифікації [6–8] та відносно просто діагностується. Як і у випадку з РА, при ССД спостерігається підвищений рівень запальної активності. Зважаючи на це, використовуються препарати, що впливають на серцево-судинну систему (нестероїдні протизапальні, цитостатичні препарати та глюкокортикостероїди). Це ускладнює застосування загальноприйнятих алгоритмів ведення АГ у даній групі пацієнтів. Виявлення факторів, що передують появі АГ у пацієнтів, дозволить прояснити механізми її розвитку та впливати на КВ-ризики (вживати профілактичних заходів щодо її розвитку). Виявлення клінічних проявів ССД, пов’язаних з АГ на початку захворювання, дозволить обґрунтувати доцільність додаткових діагностичних процедур.
АГ як прояв ССД залишається маловивченим синдромом. АГ зустрічається у 20 % пацієнтів із ССД на початку захворювання та рідко зустрічається при дифузній клінічній формі [9, 10]. Проте для визначення прогнозу розвитку АГ і впровадження ефективних профілактичних заходів цих даних недостатньо.
Мета роботи: дослідити ризик і предиктори розвитку АГ у хворих на ССД.
Матеріали та методи
Проведено проспективне дослідження у 163 хворих на ССД (7 чоловіків і 156 жінок) віком 17–71 рік, які перебувають у локальному регістрі. Середній вік (M ± m) пацієнтів становив 45,00 ± 0,84 року (дані, зареєстровані на початку спостереження). Максимальний термін спостереження — 21 рік. Усі пацієнти в нашому дослідженні відповідали критеріям ACR (1980; 2013) ACR/EULAR Classification Criteria for Scleroderma [11, 12] та отримували медичну допомогу відповідно до Клінічного протоколу надання медичної допомоги хворим із системною склеродермією [13]. В одного пацієнта розвинувся хронічний лімфолейкоз.
Критерії включення:
— вік пацієнтів від 18 до 75 років;
— верифікований діагноз ССД;
— інформована згода пацієнта на збір та обробку даних.
Критерії виключення:
— гостре ураження нирок;
— протеїнурія > 3 г/добу;
— гострий коронарний синдром;
— хронічна серцева недостатність IV функціонального класу (NYHA);
— АГ III ступеня, що не контролювалася медикаментозно;
— некомпенсований цукровий діабет;
— індекс маси тіла < 18,5 кг/м2;
— термінальна стадія хронічної ниркової недостатності (швидкість клубочкової фільтрації (ШКФ) < 15 мл/хв).
Із регістру були відібрані 73 пацієнти (3 чоловіки та 70 жінок) віком від 20 до 71 року, із середнім віком на початку спостереження 45,0 ± 1,0 року, які найбільш регулярно проходили обстеження та відповідали критеріям включення й виключення з дослідження. Пацієнти були розподілені на три групи: група 1 — пацієнти, які мали АГ на момент діагностики ССД; група 2 — пацієнти, в кого АГ не визначалась на момент діагностики ССД. Пацієнти з групи 2, в яких протягом 5 років спостереження розвинулась АГ (схильні до АГ), були зараховані до групи 2А, а в яких не розвинулась (не схильні до АГ) — до групи 2В.
Не всі пацієнти в нашому дослідженні з’явилися на повторний огляд через 5 років. Зв’язок із 12 пацієнтами був втрачений через 1 рік, із 19 пацієнтами — через 3 роки (рис. 1). Ці дані були враховані при проведенні аналізу Каплана — Мейєра. При обчисленні відношення ризиків (ВР) у регресійній моделі Кокса ці дані враховувалися автоматично.
/18-1.jpg)
Наявність АГ було верифіковано за допомогою класифікації, що прийнята в Україні й рекомендована для застосування у практиці [14]. Щільний набряк кистей діагностувався на підставі критеріїв ACR (1980; 2013) ACR/EULAR Classification Criteria for Scleroderma [11, 12]. Артрит визначався як наявність припухання, почервоніння та болючості у суглобах (одному або кількох). Наявність пневмофіброзу визначали за допомогою рентгенографії або комп’ютерної томографії органів грудної порожнини. Синдром Рейно визначався клінічно (розвиток блідості шкірних покривів із подальшим ціанозом і гіперемією під впливом холоду або емоційного стресу) та за допомогою капіляроскопії нігтьового ложа
Критерії діагностики анемії: рівень гемоглобіну у чоловіків — 129 г/л і нижче; рівень гемоглобіну у жінок — 119 г/л іа нижче. Для клінічної оцінки функції нирок визначали рівень креатиніну в сироватці крові за допомогою колориметричних методів із подальшим обчисленням ШКФ і наявність протеїнурії турбідиметричним методом. Протеїнурія діагностувалася при екскреції білка з сечею понад 0,3 г/добу та менше 3 г/добу [15]. Для виключення сечокам’яної хвороби проводилося ультразвукове дослідження нирок. ШКФ обчислювали за формулою GFR (Glomerular Filtration Rate)-ЕРІ [16]. Для вивчення впливу віку на початку дослідження на ризик розвитку АГ ми вибрали вік 45 років як точку розподілу пацієнтів на групи. Визначення показників С-реактивного протеїну (СРП) та ревматоїдного фактора проводили за стандартною методикою.
Дані обробляли за допомогою комп’ютерної техніки, використовуючи програмне забезпечення Microsoft Excel та SPSS. Порівняння середніх здійснювали за критерієм Стьюдента та однофакторним дисперсійним аналізом ANOVA. Ризик розвитку обчислювався згідно з процедурою Каплана — Мей–єра. ВР розраховували за допомогою регресії Кокса. Критичний рівень р при перевірці статистичних гіпотез вважали рівним 0,05.
Результати
Клінічні характеристики пацієнтів із ССД на початку дослідження
У нашому дослідженні середній вік пацієнтів на початку захворювання становив 45,0 ± 1,0 року. Найбільш поширеними симптомами на початку захворювання були синдром Рейно та артрит (табл. 1).
Аналіз ризику та предикторів розвитку АГ у хворих на ССД протягом 5 років
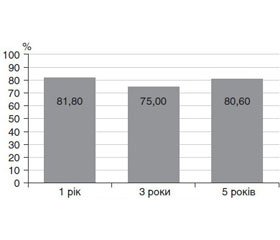
Ризик розвитку АГ для всієї вибірки пацієнтів нашого дослідження становив 20 %. Результати аналізу Каплана — Мейєра подані на рис. 2 і 3.
Ризик розвитку АГ через 1, 3 та 5 років спостереження становив 18,2, 25,0 та 19,4 % відповідно. Зі збільшенням терміну захворювання ризик розвитку АГ змінювався несуттєво. Можна говорити про відсутність критичного терміну розвитку АГ у хворих на ССД.
Ми провели дослідження впливу початкових клініко-лабораторних показників на ризик розвитку АГ у пацієнтів із ССД протягом 5 років за допомогою уніваріативної регресійної моделі Кокса. Результати аналізу наведені у табл. 2.
У пацієнтів, які мали вік > 45 років, набряк кистей, пневмофіброз, відзначався вищий ризик розвитку АГ протягом 5 років. З усіх обраних для дослідження предикторів вік > 45 років показав найсильніший і найбільш достовірний вплив. Виявлено, що на ризик розвитку АГ впливали підвищені показники активності запального процесу (ШОЕ, СРП, РФ), але не артрит. Майже нейтральний вплив на ризик розвитку АГ мала наявність дифузної форми ССД, синдрому Рейно, артриту та анемії на початку захворювання.
Додатково провели порівняння клінічних характеристик пацієнтів із ССД залежно від наявності АГ на початку захворювання. Результати подані у табл. 3.
Наприкінці терміну спостереження у початково гіпертензивних пацієнтів спостерігалося збільшення частоти виявлення протеїнурії та зниження ШКФ.
Обговорення
Середній вік пацієнтів у нашому регістрі мало відрізнявся від поданого у регістрах країн Європейського Союзу. Наші дані є порівнянними з даними регістру EULAR і німецького регістру; середній вік пацієнтів на початку захворювання в іспанському регістрі був вищим. Спостерігалися відмінності у початкових клініко-лабораторних показниках: у нашому регістрі в пацієнтів частіше діагностували дифузну форму на початку захворювання, частіше спостерігались прояви артриту та протеїнурії, ніж у пацієнтів в європейських регістрах [9, 10, 17]. Такий феномен можна пояснити різним етнічним складом населення Східної та Західної Європи або більш ранньою діагностикою ССД у країнах Західної Європи.
У попередній роботі ми виявили відсутність асоціації між АГ і протеїнурією [18], що ставить під сумнів думку про суто нирковий генез АГ при ССД [19].
Вважається, що протеїнурія є як маркером ураження судин [20], так і класичним показником ураження клубочкового апарату нирок, у тому числі при ССД [21]. Проте, появу протеїнурії можна пояснити не тільки підвищеною клубочковою проникністю, а й підвищеною продукцією антитіл і гострофазових протеїнів при активному запальному процесі. Буручи до уваги вагомий і вірогідний вплив протеїнурії на смертність при ССД [22], можна припустити зв’язок між нею та ускладненнями ССД, що лідирують за причинами смерті — серцевими та легеневими ускладненнями [23, 24]. Завдяки рутинному призначенню інгібіторів ангіотензинперетворюючого ферменту при ССД вдається контролювати ураження нирок [23] та запобігати розвитку ренопаренхіматозної АГ.
Відсутність зв’язку між АГ і дифузною формою ССД у нашому дослідженні не суперечить результатам аналізу незалежних предикторів проявів захворювання у регістрі EULAR — предиктором розвитку АГ, за їхніми даними, була відсутність антитіл до ДНК-топоізомерази I (Scl-70) [10]. Відомо, що Scl-70 асоційовані з дифузною формою ССД.
Із наведених вище даних можна висловитись про гетерогенний характер АГ при ССД. Істотний вплив збільшення віку на ризик розвитку АГ може частково свідчити на користь її есенціальної природи. Дебют ССД у старшому віці (понад 65 років) є предиктором гіршої виживаності [2, 25]. Асоціація з показниками запальної активності може вказувати на судинний механізм розвитку АГ (розвиток імунного запалення у стінках судин із подальшим розвитком фіброзу та збільшенням жорсткості судинної стінки) [26]. У продовження цієї думки — потребує вивчення роль тривалого застосування протиревматичних засобів, що, певною мірою, обумовлює обмеження наведеного нами дослідження.
Висновки
1. Факторами прогнозу розвитку артеріальної гіпертензії у хворих на ССД встановлені: вік > 45 років, набряк кистей, пневмофіброз, підвищення показників активності запального процесу (ШОЕ, СРП, РФ) на початку захворювання.
2. Прогнозований ризик розвитку АГ при ССД протягом 5 років становив 20,3 %, та механізм її розвитку, ймовірно, має гетерогенний характер.
3. У пацієнтів, які мали АГ у дебюті ССД, у п’ятирічній перспективі очікується збільшення частоти виявлення протеїнурії та погіршення функції нирок (за показником ШКФ).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Agca R. EULAR recommendations for cardiovascular di–sease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update / Agca R., Heslinga S.C., Rollefstad S., et al. // Ann. Rheum. Dis. — 2016.
2. Simeon-Aznar C.P. Registry of the Spanish Network for Systemic Sclerosis. Survival, Prognostic Factors, and Causes of Death / Simeon-Aznar C.P., Fonollosa-Pla´ V., Carles Tolosa-Vilella et al. // Medicine. — 2015. — Vol. 94, № 43. — P. 1-9.
3. Tyndal A.J. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database / Tyndall A.J., Bannert B., Vonk M., et al. // Ann. Rheum. Dis. — 2010. — Vol. 69, № 10. — P. 1809-1815.
4. Arts E.E. Performance of four current risk algorithms in predicting cardiovascular events in patients with early rheumatoid arthritis / Arts E.E., Popa C., den Broeder A.A. et al. // Ann. Rheum. Dis. — 2015. — Vol. 74. — P. 668-674.
5. Gomez-Vaquero C. SCORE and REGICOR function charts underestimate the cardiovascular risk in Spanish patients with rheumatoid arthritis / Gómez-Vaquero C., Corrales A., Zacarias A. et al. // Arthritis Res. Ther. — 2013. — № 15. — R91.
6. Chung C.P. Prevalence of traditional modifiable cardiovascular risk factors in patients with rheumatoid arthritis: comparison with control subjects from the multi-ethnic study of atherosclerosis / Chung C.P., Giles J.T., Petri M. et al. // Semin. Arthritis Rheum. — 2012. — № 41. — P. 535-544.
7. Protogerou A.D. Arterial hypertension assessed “out-of-office” in a contemporary cohort of rheumatoid arthritis patients free of cardiovascular disease is characterized by high prevalence, low awareness, poor control and increased vascular damage-associated “white coat” phenomenon / Protogerou A.D., Panagiotakos D.B., Zampeli E. et al. // Arthritis. Res. Ther. — 2013. — № 15. — R142.
8. Baghdadi L.R. The impact of traditional cardiovascular risk factors on cardiovascular outcomes in patients with rheumatoid arthritis: a systematic review and meta-analysis / Baghdadi L.R., Woodman R.J. Shanahan E.M. et al. // PLoS ONE. — 2015. — № 10. — e0117952.
9. Hunzelmann N. The registry of the German Network for Systemic Scleroderma: frequency of disease subsets and patterns of organ involvement / Hunzelmann N., Genth E., Krieg T. et al. // Rheumatology. — 2008. — Vol. 47. — P. 1185-1192.
10. Walker U.A. Clinical risk assessment of organ manifestations in systemic sclerosis: a report from the EULAR cleroderma Trials And Research group database / Walker U.A., Tyndall A., Czirja´k L. et al. // Ann. Rheum. Dis. — 2007. — № 66. — P. 754-763.
11. Masi A.T. Preliminary criteria for the classification of systemic sclerosis (scleroderma) / Masi A.T., Rodnan G.P., Medsger T.A. et al. // Arthritis Rheum. — 1980. — Vol. 23. — P. 581-590.
12. Van den Hoogen. 2013 classification criteria for systemic sclerosis: an American college of rheumatology / European league against rheumatism collaborative initiative / Van den Hoogen, Khanna D., Fransen J. et al. // Ann. Rheum. Dis. — 2013. — Vol. 72. — P. 1747-55.
13. Наказ МОЗ України від 12.10.2006 № 676 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Ревматологія». «Клінічний протокол надання медичної допомоги хворим із системною склеродермією (ССД)».
14. Наказ МОЗ України від 24.05.2012 № 384 «Артеріальна гіпертензія. Оновлена та адаптована клінічна настанова, заснована на доказах».
15. Наказ МОЗ України від 02.12.2004 № 593 «Про затвердження протоколів надання медичної допомоги за спеціальністю «Нефрологія». «Клінічний протокол надання медичної допомоги хворим із нефротичним синдромом».
16. Hilde Tent. Performance of MDRD study and CKD-EPI equations for long-term follow-up of nondiabetic patients with chronic kidney disease / Hilde Tent, Femke Waanders, Jan A. Krikken et al. // Nephrol. Dia. Transplant. — 2011.
17. Simeon-Aznar C.P. Registry of the Spanish Network for Systemic Sclerosis: Clinical Pattern According to Cutaneous Subsets and Immunological Status / Simeon-Aznar C.P., Fonollosa-Pla´ V., Carles Tolosa-Vilella et al. // Semin. Arthritis Rheum. — 2012. — Vol. 41, № 6. — P. 789-800.
18. Курята О.В. Ризик розвитку та особливості нефропатії у хворих на системну склеродермію / Курята О.В., Лисунець Т.К., Караванська І.Л., Семенов В.В. // Український ревматологічний журнал. — 2015. — № 3(61). — С. 17-23.
19. Яцишин Р.І. Клініко-патогенетична характеристика системної склеродермії та особливості її лікування: Автореф. дис… д-ра мед. Наук / Яцишин Роман Іванович; Івано-Франківська державна медична академія. — Івано-Франківськ, 2003. — 17 с.
20. Shanmugamand V.K. Renal Manifestations in Scleroderma: Evidence for Subclinical Renal Disease as a Marker of Vasculopathy / Shanmugamand V.K., Steen V.D. // International Journal of Rheumatology. — 2010.
21. Sirenko O. Clinical features and nephropathy risk in patients with systemic sclerosis (based on 5-year follow-up) / Sirenko O., Kuryata O., Semenov V., Lusynets T. // Journal of Scleroderma and Related Disorders. — 2016. — Vol. 1. — P. 132.
22. Bryan C. Prediction of five-year survival following presentation with scleroderma / Bryan C., Knight C., Black C.M., Silman A.J. // Arthritis & Rheumatism. — 1999. — Vol. 42, № 12. — P. 2660-2665.
23. Steen V.D. Changes in causes of death in systemic sclerosis, 1972–2002 / Steen V.D., Medsger T.A. // Ann. Rheum. Dis. — 2007. — Vol. 66. — P. 940-944.
24. Elhai M. Trends in mortality in patients with systemic sclerosis over 40 years: a systematic review and meta-analysis of cohort studies / Elhai M., Meune C., Avouac J., Kahan A., Allanore Y. // Rheumatology (Oxford). — 2012. — Vol. 51, № 6. — P. 1017-1026.
25. Strickland G. Mortality in systemic sclerosis-a single centre study from the UK / Strickland G., Pauling J., Cavill C., Shaddick G., McHugh N. // Clin. Rheumatol. — 2013. — Vol. 32, № 10. — P. 1533-1539.
26. Müller-Ladner U. Mechanisms of vascular damage in systemic sclerosis / Müller-Ladner U., Distler O., Ibba-Manneschi L., Neumann E., Gay S. // Autoimmunity. — 2009. — Vol. 42, № 7. — P. 587-595.

/18-1.jpg)
/19-1.jpg)
/19-2.jpg)
/20-1.jpg)