Резюме
Актуальність. Вивчення виживаності онкологічних хворих є головним завданням клінічного і експериментального онколога. Спираючись на математичний аналіз відразу багатьох факторів, можна прогнозувати очікувану тривалість життя хворого на рак шлунка. Материали та методи. Усього в дослідження, проведене на базі абдомінального онкохірургічного відділення КЗ «Одеський обласний онкологічний диспансер», включений 221 хворий, оперований з приводу раку шлунка в період 2007–2013 років. Хворим було проведено радикальні онкохірургічні операції, після яких пухлинна тканина досліджувалася рутинно гістологічно і на наявність експресії певних молекулярних маркерів, що також були маркерами прогнозу, подібно до ступеня диференціювання, глибини проростання стінки шлунка або кількості уражених метастазами лімфатичних вузлів. Результати. Найгірший прогноз виживання у наявній групі хворих був пов’язаний із так званим потрійним негативним раком шлунка, за аналогією з подібною ж формою раку грудної залози. Цікавою особливістю, виявленою в процесі аналізу комбінацій маркерів, було поєднання VEGFR-p53-Her2+Ki-67–: такі пухлини були високодиференційованими формами, без проростання в сусідні структури, екзофітного характеру росту, без ознак агресивного зростання. Те, що прийнято позначати як локальні форми, перспективні в плані віддаленої виживаності навіть в локо-регіонарній стадії. Знайдена група, де виконання мультиорганної резекції вплинуло на виживаність хворих на рак шлунка в пізні терміни спостереження — після 100 місяців. Головною, критичною особливістю групи VEGFR-p53+Her2-Ki-67+ була відсутність метастазів у регіонарні лімфатичні вузли навіть при наявності пухлини Т4. Вдається відстежити вплив стандартних морфологічних чинників і експресованих на мембранах пухлинних клітин онкобілків на тривалість життя конкретного хворого на рак шлунка. Методи розрахунку виживання можуть бути використані хірургами і хіміотерапевтами для персоніфікації хіміотерапевтичного (Нer2/new, VEGFR) і індивідуалізації хірургічного методу лікування раку шлунка: інвазія в стінку, вік хворого, уражені лімфовузли, розмір пухлини, ступінь злоякісності G і біоагресивності р53. Висновки. З огляду на зростаючу залежність медичної спільноти від доступності медичної інформації на різні теми назріла і перезріла необхідність створення більш чітких градацій залежностей виживаності хворих на рак від різних клініко-морфологічних ситуацій.
Актуальность. Изучение выживаемости онкологических больных является главной задачей клинического и экспериментального онколога. Опираясь на математический анализ сразу многих факторов, можно прогнозировать ожидаемую продолжительность жизни больного раком желудка. Материалы и методы. Всего в исследование, проведенное на базе абдоминального онкохирургического отделения КУ «Одесский областной онкологический диспансер», включен 221 больной, оперированный по поводу рака желудка в период 2007–2013 годов. Больным были проведены радикальные онкохирургические операции, после которых опухолевая ткань исследовалась рутинно гистологически и на наличие экспрессии определенных молекулярных маркеров, которые также являлись маркерами прогноза, подобно степени дифференцировки, глубине прорастания стенки желудка или количеству пораженных метастазами лимфатических узлов. Результаты. Наихудший прогноз выживаемости в имевшейся группе больных был связан с так называемым тройным негативным раком желудка, по аналогии с подобной же формой рака грудной железы. Интересной особенностью, выявленной в процессе анализа комбинаций маркеров, оказалось сочетание VEGFR-p53-Her2+Ki-67–: такие опухоли являлись высокодифференцированными формами, без прорастания в соседние структуры, экзофитного характера роста, без признаков агрессивного роста. То, что принято обозначать как локальные формы, перспективные в плане отдаленной выживаемости даже в локорегионарной стадии. Найдена группа, в которой выполнение мультиорганных резекций повлияло на выживаемость больных раком желудка в поздние сроки наблюдения — после 100 месяцев. Главной, критической особенностью группы VEGFR-p53+Her2-Ki-67+ было отсутствие метастазов в регионарные лимфатические узлы даже при наличии опухоли Т4. Удается отследить влияние стандартных морфологических факторов и экспрессированных на мембранах опухолевых клеток онкобелков на продолжительность жизни конкретного больного раком желудка. Методы расчета выживаемости могут быть использованы хирургами и химиотерапевтами для персонификации химиотерапевтического (Her2/new, VEGFR) и индивидуализации хирургического метода лечения рака желудка: инвазия в стенку, возраст больного, пораженные лимфоузлы, размер опухоли, степень злокачественности G и биоагрессивности р53. Выводы. С учетом растущей зависимости медицинского сообщества от доступности медицинской информации на различные темы назрела и перезрела необходимость создания более четких градаций зависимостей выживаемости больных раком от различных клинико-морфологических ситуаций.
Background. Studying the survival rate of cancer patients is the main task of the clinical and experimental oncologist. Based on the mathematical analysis of many factors at once, it is possible to predict the life expectancy of a patient with stomach cancer. Materials and methods. A total of 221 patients operated for gastric cancer in the period of 2007–2013 were included in the study conducted at the premises of the abdominal oncosurgical department of the Odessa regional oncology center. Patients underwent radical oncosurgical operations, after which the tumor tissue was examined routinely histologically and for the presence of expression of certain molecular markers, which were also prognosis markers, like the degree of differentiation, the depth of invasion to the stomach wall or the number of lymph nodes affected by metastases. Results. The worst prognosis of survival, based on the existing group of patients, was the so-called “triple negative” gastric cancer, by analogy with a similar form of breast cancer. An interesting feature revealed in the process of analyzing marker combinations was the combination of VEGFR-p53-Her2+Ki-67–: such tumors were highly differentiated forms, without invasion into neighboring structures, exophytic growth, without signs of aggressive growth. What is commonly referred to as local forms, promising in terms of long-term survival, even in the loco-regional stage. A group was found where the performance of multiorgan resections affected the survival rate of patients with gastric carcinoma at late observation periods — after 100 months. The main critical feature of the VEGFR-p53+Her2-Ki-67+ group was the absence of metastases in regional lymph nodes, even in the case of Т4 tumor. It is possible to monitor the influence of standard morphological factors and tumor cells expressed on the membranes of oncoproteins on the life expectancy of a particular patient. Survival methods can be used by surgeons and chemotherapists to personalize chemotherapy (Her2/new, VEGFR) and to individualize surgical methods of treatment: invasion into the stomach wall, patient’s age, affected lymph nodes count, tumor size, G grade and p53 bioagressivity. Conclusions. Given the increasing dependence of medical community on the availability of medical data on various topics, there is the need to create more precise gradations in the dependency of survival of cancer patients on various clinical and morphological situations.
Введение
Злокачественные эпителиальные опухоли желудка, как свидетельствует статистика ВОЗ, занимают 2-е место среди всех злокачественных новообразований в мире, уступая лишь раку легкого, и остаются ведущей причиной онкологической летальности во всем мире [7]. Местно-распространенный рак желудка (РЖ) на момент обращения имеют примерно 70 % больных, удельный вес IV стадии не имеет тенденции к снижению и составляет 50–60 % [1]. В собственных исследованиях частота прорастания желудочной стенки составляла 52,66 %, что обусловливает высокую частоту опухолевых осложнений [2].
Изучение выживаемости онкологических больных является главной задачей клинического и экспериментального онколога. Множество факторов влияет на количественный и качественный анализ продолжительности жизни пролеченных пациентов. На сегодняшний момент не известно ни одного инструмента или прибора, который мог бы измерить длительность предстоящей жизни конкретного человека. Однако, опираясь на математический анализ сразу многих факторов, можно прогнозировать ожидаемую продолжительность жизни больного раком желудка. Это зависит от многих факторов, которые являются переменными, т.е. могут меняться в зависимости от данного конкретного больного. Нашей задачей являлось изучение подобных тенденций, когда, зная возраст больного, стадию заболевания, показатели степени агрессивности биологии опухоли, можно составить ориентировочный прогноз длительности жизни после операции. При этом не учитывались возможные другие причины смерти больного, не связанные с онкологическим заболеванием (инфаркты, инсульты, другие причины).
Материалы и методы
Предоперационное обследование больных РЖ проводилось в соответствии со стандартами обследования и лечения онкологических больных. Приказ «Об утверждении протоколов оказания медицинской помощи по специальности «онкология» от 17.09.03 г.
№ 554 МЗ регламентирует «Стандарты диагностики и лечения онкологических больных». В протокол обследования конкретного больного включались следующие процедуры.
/31-1.jpg )
Выполнение эзофагогастродуоденоскопии с био–псией, включающей как цитологическое, так и гистологическое подтверждение диагноза. Контрастная рентгенография желудка. Видеоколоноскопия/ирригоскопия. Ультразвуковое исследование органов брюшной полости. Компьютерная/магниторезонансная томография брюшной полости по показаниям. Рентгенография органов грудной клетки. Выполнение онкомаркеров СА 72-4, СА 19-9, РЭА по показаниям. Компьютерная ангиография брюшной полости по показаниям. Общеклинические исследования крови и мочи, включающие биохимический анализ крови, коагулограмму, развернутый общий анализ крови и др. Терапевтическое обследование, включающее ЭКГ (в динамике по показаниям), эхокардиоскопию, коронарокардиографию по показаниям. Консультация кардиолога, невропатолога, гепатолога и др. — по показаниям. Диагностическая лапароскопия и чрезбрюшинная пункционная биопсия под УЗИ-навигацией выполнялись по показаниям. С учетом частых и множественных трансфузий препаратов крови в периоперационном периоде большинству больных выполнялось скрининговое обследование на маркеры вирусных гепатитов, ВИЧ (наличие информированного согласия больного), РВ. Естественно, весь протокол выполнялся только у плановых больных. В случае выполнения срочной операции протокол сокращался, о чем делалась запись в истории болезни, больному проводился мультидисциплинарный консилиум и больной оперировался.
/32-1.jpg )
Особую роль у больных с осложненным течением рака желудка играло эндоскопическое исследование, которое выполнялось как ургентно, при планировании ургентной операции, так и планово, если вмешательство носило плановый характер. Особенностью узкоспектральной NBI-гастроскопии на аппарате Olympus, серия 190 (Япония) является возможность осмотра слизистой желудка в разных частях спектра. С использованием технологии EVIS EXERA III наряду с осмотром слизистой в обычном белом свете (HD-WLE) больному выполнялся осмотр слизистой в синем спектре видимых лучей (длина волны 415 нм) и в лучах зеленого спектра видимого света (540 нм). Особенностью данного метода являлась возможность видеть стенку желудка как бы «на глубине»: коричневым цветом обозначались поверхностные капилляры, синим цветом — более глубоко расположенные вены и венулы слизистой оболочки. В настоящее время мы располагаем опытом выполнения 176 подобных исследований.
/32-2.jpg )
При проведении рентгеноскопии желудка больной не должен завтракать утром накануне исследования. В качестве рентгеноконтрастного вещества использовали водную взвесь сульфата бария из расчета 200 г сухого порошка на 1600–2000 мл воды. Рентгеноконтрастную взвесь подогревали до 34–36 °С, больной принимал препарат непосредственно перед исследованием per os. Контраст постепенно заполнял верхние отделы желудочно-кишечного тракта, в т.ч. полость желудка, выполнялись обзорные и уточняющие снимки желудка, чаще всего в прямой проекции. Прием контраста при необходимости повторялся, как непосредственно на этапе исследования, так и через 6, 12, 24 часа в случае диагностирования стеноза. Степень стеноза выходного отдела желудка оценивалась следующим образом: декомпенсированный стеноз означает наличие взвеси BaSO4 через 24 часа после приема контрастной жидкости per os; субкомпенсированный — 12–24 часа: элиминация контраста из полости желудка до суток; компенсированный — до 12 часов.
В случае ургентной операции больному выполнялись общеклинические анализы, ЭКГ, ургентная ЭФГДС, больной осматривался анестезиологом с установлением высшей степени анестезиологического риска по Гологорскому, выполнялась категоризация статуса пациента по ASA, и он направлялся в операционную.
Всего в исследование, проведенное на базе абдоминального онкохирургического отделения КУ «Одесский областной онкологический диспансер», включен 221 больной, оперированный по поводу рака желудка в период 2007–2013 годов. Исследование было ретроспективным, одноцентровым, нерандомизированным, включало только радикально или условно-радикально прооперированных больных. Средний возраст составил 60,88 ± 10,50 года, мужчин было 180, женщин — 41. Всего выполнено 143 гастрэктомии и 78 дистальных субтотальных резекций. Гастрэктомии выполнялись по методике Бондаря с формированием терминолатерального петлевого муфтообразного позадиободочного эзофагоеюноанастомоза с межкишечным соустьем по Брауну. Дистальные субтотальные резекции заканчивались в большинстве случаев формированием позадиободочного гастроэнтероанастомоза по Бильрот-2 в модификации Гофмейстера — Финстерера. Летальность составила 1,2 %, операбельность — 84 %. Учитывалась выживаемость данной группы больных по стадиям и по виду операции. Анализ выживаемости представлен в таблице 1.
/30-1.jpg )
Для оценки эффективности того или иного метода лечения использовали три критерия: среднюю продолжительность жизни в группе; кривые выживаемости, указывающие, что различия с базовой группой были менее 0,05; а также, в некоторых случаях, сравнение площадей под кривыми выживаемости, что было более эффективно, чем оценка средней продолжительности жизни, т.к. давало информацию не только о длительности жизни больных, но и о количестве пациентов, проживших такой срок. В таблице 1 приведены числовые значения средней продолжительности жизни больных РЖ, перенесших тот или иной вид лечения.
Кроме влияния лимфодиссекций на продолжительность жизни больных, оценивалась группа, где были выполнены мультивисцеральные резекции (МВР).
Результаты и обсуждение
Жизнь конкретного онкологического больного зависит не только от стадии заболевания. В ближайшую группу определителей прогноза должны быть обязательно включены возраст больного, объем опухоли (читай — численность колонии клеток, чего вообще не учитывает TNM), степень генной «подконтрольности» клеточного цикла (выраженность ИГХ-экспрессии онкобелка ТР53), факторы выраженности неоангиогенеза VEGFR. Поэтому само по себе наличие мысли и стремления спрогнозировать дальнейшую жизнь не должно восприниматься как средневековые суеверия. Для того чтобы иметь возможность спрогнозировать продолжительность жизни, необходимо накопить так называемую критическую массу информации, посвященной предмету наблюдения. В таблице 3 представлена средняя продолжительность жизни больных в зависимости от вида операции и наличия тех или иных морфологических критериев.
/31-2.jpg )
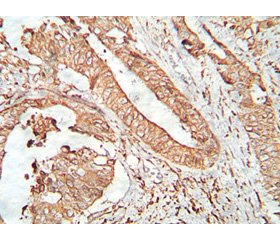
Особое значение имело количество факторов, от которых зависела выживаемость больных. Чтобы сделать исследование всеобъемлющим, мы попытались проанализировать не только морфологические, но и молекулярные факторы, которые смогли бы повлиять на прогноз. Чем больше был объем обработанной информации, тем большая возможность открывалась перед авторами отследить параллели, которые затем стали выводами и практическими рекомендациями, выносимыми из обилия цифр, графиков и формул. На рисунках 1 и 5 показаны микроскопические картины положительной экспрессии молекулярных маркеров р53 и Her-2neu.
На графиках приведены различия в выживаемости больных РЖ в зависимости от различной выраженности иммуноморфологических особенностей опухоли.
Наихудший прогноз выживаемости был у больных т.н. тройным негативным РЖ, по аналогии с подобной же формой рака грудной железы. Он характеризовался отсутствием проявлений неоангиогенеза, экспрессии белка ТР53 и отсутствием в анализируемых микропрепаратах реакции на иммуногистохимические красители белка c-erbB2 [3, 5].
Интересной особенностью, выявленной в процессе анализа комбинаций маркеров, оказалось сочетание VEGFR-p53-Her2+Ki-67–, являющееся высокодифференцированной формой без прорастания в соседние структуры, экзофитного характера роста, без признаков агрессивного роста. То есть то, что принято обозначать как локальные формы, перспективные в плане отдаленной выживаемости даже в локорегионарной стадии. Но общая выживаемость в этой группе, как показано на рисунке 6, будет низкой. Это гистологически «хорошие» раки с «плохой» иммуногистохимией (ИГХ) и, соответственно, прогнозом.
/33-1.jpg )
Найдена группа, в которой выполнение мультиорганных резекций повлияло на выживаемость больных РЖ в поздние сроки наблюдения — после 100 месяцев. Главной, критической особенностью группы VEGFR-p53+Her2-Ki-67+ было отсутствие метастазов в регионарные лимфатические узлы даже при наличии опухоли Т4. Почему в этой группе были более эффективны комбинированные, а не, скажем, расширенные операции, для нас остается загадкой. Обращает на себя внимание еще одна особенность группы: отсутствие периневральной инвазии и обилие экзофитных форм. Принадлежность к генетической группе микросателлитно-нестабильных РЖ [5].
Приведенные критерии предсказывают значительную эффективность выполнения при микросателлитно-нестабильном РЖ мультиорганных резекций; в основном отсутствие метастазов в регионарные лимфатические узлы, а также отсутствие потенциала «оккультной» генерализации, например по периневральным щелям.
Интересной деталью проведенных наблюдений является варьирование понятия «степень злокачественности» или «степень биологической агрессивности» в зависимости от вида сочетания ИГХ-маркеров. Это трудно назвать стадированием, т.к. из-за малых размеров группы мы не могли выделить 3–4 группы в каждом из VEGFR, p53, Her2, Ki-67 видов. Поэтому выживаемость в той или иной группе воспринималась как главный показатель агрессивности рака, делая его либо более злокачественным, либо, наоборот, более торпидным и доброкачественным.
Группа 100-го месяца (синий график) VEGFR-p53+Her2-Ki-67+ может быть названа группой плохой ИГХ из-за высокого пролиферативного потенциала Ki-67 [2], но относительно благоприятного прогноза.
Когда мы анализировали всю группу больных РЖ (n = 221), графики выживаемости больных с опухолями антрального отдела желудка, тела и кардии сливались. Ободряюще было видеть, что существует такая система координат (VEGFR-p53+Her2-Ki-67+), где «антральные желудки» живут дольше, чем традиционно более «плохие» в плане отдаленной выживаемости больные, прооперированные по поводу злокачественных эпителиальных опухолей тела и кардии.
Методы расчета выживаемости могут быть использованы хирургами и химиотерапевтами для персонификации химиотерапевтического (Нer2/new, VEGFR) и индивидуализации хирургического метода лечения РЖ: инвазия в стенку, возраст больного, пораженные лимфоузлы, размер опухоли, степень злокачественности G и биоагрессивности р53 [3].
Влияние высокого пролиферативного индекса
Ki-67 в данных группах больных (зеленая и голубая кривые выживаемости) нивелировано влиянием экспрессии р53.
Трудно сказать, почему при наличии белка неоангиогенеза в самой опухоли РЖ не всегда проявлял тропность к распространению по микроскопическим сосудам (не всегда прорастал ими в достаточной степени даже в стадии Т4, которых здесь n = 5). Видимо, в данном случае значение имели высокий пролиферативный индекс, низкие индексы р53 и CD 340.
Высокая степень сосудистой (v, венозной и ly, лимфатической) вовлеченности классифицировали по JRSGC [6]: показана на рисунке 11.
Таким образом, удается отследить влияние морфологических факторов и экспрессированных на мембранах опухолевых клеток онкобелков на продолжительность жизни конкретного больного РЖ. Чем больше накапливается фактического материала, описывающего микроскопическую биологию опухолевой ткани, тем больше у нас возможностей по индивидуализации лечебных подходов и больше шансов выделить более и менее агрессивные формы рака желудка, как это уже сделано сегодня для рака грудной железы, рака предстательной железы и других видов опухолей.
Для различных локализаций рака существует вполне конкретная информация о выживаемости больных в зависимости от стадии заболевания. Сейчас есть существенная потребность в подобной справочной информации для более узких клинических ситуаций (количество пораженных лимфоузлов, объем опухоли, измеренный на КТ, и т.д.). Должны существовать решения, которые затем могут быть использованы как консультативная справочная информация для больного, его родственников, планирования количества курсов химиотерапии, степени агрессивности комплексного лечения с учетом высокой стоимости химиотерапии и т.д. Подобная мотивация может сыграть не последнюю роль в персонификации/индивидуализации/модификации лечебного подхода.
Выводы
1. С учетом высокой информированности больных и их родственников и растущей зависимости медицинского сообщества от тотальной доступности медицинской информации на различные темы назрела и перезрела необходимость создания более четких градаций зависимости выживаемости больных раком от различных клинико-морфологических ситуаций.
2. Полученные результаты всегда будут носить исключительно консультативный, справочный, рекомендательный характер, т.к. человеческая жизнь не может быть измерена с помощью самой сложной математики и лежит за пределами естественных вычислений.
3. Персонификация/индивидуализация схем лечения РЖ должна содержать в себе некие математические алгоритмы со многими переменными для обоснования медико-социального обеспечения, доступные как узкому медицинскому, так и широкому публичному сообществу.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/31-1.jpg )
/32-1.jpg )
/32-2.jpg )
/30-1.jpg )
/30-2.jpg )
/31-2.jpg )
/32-3.jpg )
/33-1.jpg )
/34-1.jpg )
/34-2.jpg )