Вступ
Упродовж останнього десятиріччя в розвинутих країнах світу спостерігається тенденція до поширення харчової алергії (ХА), і це вважається серйозною проблемою сучасної медицини [1]. Відзначається зростання частоти алергічних захворювань серед дітей, у 34,2 % вони проявляються тільки гастроінтестинальнимим симптомами [3]. Особливо актуальна дана проблема в педіатричній практиці. Адже саме в дитячому віці формується сенсибілізація організму до різноманітних алергенів, і провідну роль у цьому відіграє харчова гіперчутливість. Харчова алергія — це опосередкована імунними механізмами (за рахунок як IgE-залежних, так і IgE-незалежних реакцій та їх комбінації) гіперчутливість до харчових продуктів [2].
Останніми роками багато досліджень зосере-джені на розумінні імунного клітинного та молекулярного механізму виникнення алергічної реакції. Зокрема, було показане значення мікрофлори кишечника не тільки для підтримки нормального його функціонування, але і для правильного розвитку імунної системи та індукції оральної толерантності. Накопичуються свідчення того, що такі фактори, як пробіотики, пребіотики, антиоксиданти, поліненасичені жирні кислоти, фолієва кислота та вітаміни, позитивно впливають на імунні функції. Так, пробіотичні штами показали здатність відновлювати рівновагу кишкової мікробіоти та активувати імунні клітини, що може бути корисним у терапії багатьох захворювань, у тому числі й у лікуванні алергічної патології [5, 14].
Оральна толерантність встановлюється в ранньому дитинстві й викликає пригнічення місцевої та системної імунної відповіді на харчові алергени та бактерії ендогенної мікрофлори кишечника. Імунна система слизової оболонки травного каналу здатна пригнічувати відповідь на нешкідливі антигени (наприклад, симбіотичні бактерії, харчовий білок), зберігаючи при цьому можливість виявляти активну захисну реакцію при зіткненні з ентеропатогенами [4, 6].
/18-1.jpg )
Гастроінтестинальний тракт є найбільшим відділом імунної системи організму людини, що піддається щоденній дії екзогенних алергенів [7]. Мікрофлора кишечника відіграє центральну роль у регуляції шлунково-кишкової стабільності, фізіологічного функціонування й цілісності слизової оболонки кишечника. Кишкова мікробіота є найважливішим джерелом мікробної стимуляції й відіграє головну роль у дозріванні імунної системи й підтриманні кишкового гомеостазу. Інформація, що надходить від мікробіому, інтерпретується через сигнали від Toll-like-рецепторів, які відіграють важливу роль у становленні кишкового гомеостазу, походженні Т-регуляторних клітин, а тому й у виникненні алергічних захворювань [8].
Підвищена проникність слизової оболонки кишечника й ранній вплив екзогенних алергенів вважаються причиною сенсибілізації дітей раннього віку. Алергічні реакції в сенсибілізованих осіб є наслідком втрати оральної толерантності й дисрегуляції реакції Т-клітин [6].
При народженні шлунково-кишковий тракт людини є стерильним, а її імунна система — недосконалою. Приблизно через один тиждень після народження завершується колонізація численними різновидами мікроорганізмів органів травлення. Кишкова мікрофлора людини складається з Bacteroides, Clostridia, Enterobacteria, Bifidobacteria і Lactobacilli, що значно відрізняються в новонароджених, які знаходяться на грудному та штучному вигодовуванні. У дорослих осіб кишкову флору становить понад 1014 мікроорганізмів, а ідентифіковано на сьогодні менше ніж 50 % [9]. Бактерії мікробіоти можуть як сприяти перетравлюванню поживних речовин, так і запобігати колонізації кишечника патогенними мікроорганізмами.
Оскільки кишкова мікробіота бере участь у розвитку імунної толерантності, виникає зацікавленість у використанні пробіотиків, що сприятимуть колонізації кишечника та становленню кишкового гомеостазу. Вимогами до якісних пробіотиків є: здатність прилипати до епітеліальних клітин кишечника для запобігання адгезії патогенів, сприяти утворенню умов для вироблення кислот, пероксиду водню та бактеріоцинів проти патогенного росту мікробів. Пробіотичний препарат має бути безпечним, неінвазивним, неканцерогенним, непатогенним і здатним до агрегації для формування нормальної збалансованої мікрофлори [10].
До складу пробіотиків входять бактерії або дріжджі, що здатні повторно колонізувати та відновлювати симбіоз мікрофлори в кишковому тракті. Пробіотичні бактерії зазвичай належать до груп Lactobacillus і Bifidobacterium, а саме Lactobacillus acidophilus і Bifidobacterium bifidus, які включають різноманітні штами (L.rhamonusus, L.bulgaricus, L.salivarius, L.plantarum, L.casei, B.infantis, B.longum, Streptococcus thermophilus). Деякі загальні пробіотики, такі як Saccharomyces boulardii, є дріжджами [11].
Добре відомо, що мікросередовище слизової оболонки кишечника відіграє вирішальну роль у дозріванні імунної системи з моменту народження. Зокрема, баланс між Th1- і Th2-імунною відповіддю та індукцією імунної толерантності регулюється в кишечнику взаємодією бактеріальних антигенів мікробіоти та імунних клітин. Висновок про те, що зміни в складі кишкової мікробіоти беруть участь у патогенезі алергічних захворювань, привернув увагу дослідників до використання пробіотиків для лікування або профілактики алергічної патології. Клінічні ж дослідження в пацієнтів з алергією дали суперечливі результати щодо ефективності застосування пробіотиків як протиалергічної терапії [5, 12], тому доцільно проводити дослідження, спрямовані на з’ясування цих моментів.
Доведено, що пробіотики мають певні протизапальні й протиалергічні властивості, пов’язані із впливом на експресію цитокінів, посиленням T1-хелперної імунної відповіді (Th1) і потенційною можливістю зменшення проалергічної T2-хелперної імунної відповіді (Th2) та продукції алергічних антитіл (IgE). Відомо, що розвиток алергічних захворювань частково пов’язаний з порушенням Thl/Th2-цитокінового балансу в бік активації Th2-клітин, що призводить до збільшення продукції Th2-цитокінів, таких як інтерлейкін (IL) 4, IL-5 та IL-13, що, у свою чергу, зумовлює індукцію синтезу IgE і IgA, активацію тучних клітин і еозинофілів, які спричинюють більшість симптомів алергії. Пробіотичні бактерії здатні інгібувати Th2- та активізувати Th1-відповідь, а також продукцію ними Th1-цитокінів, таких як інтерферон гамма, IL-2 і IL-12 [12].
Сенсибілізація в дітей пов’язана зі змінами відносної кількості конкретних видів кишкової мікробіоти на початку життя. Разом з тим низка досліджень виявила декілька факторів ризику, пов’язаних із розвитком алергічної сенсибілізації: прийом протимікробних препаратів жінками під час вагітності, народження дитини шляхом кесарського розтину, раннє застосування протимікробних препаратів і штучне вигодовування дитини [13].
У більшості досліджень визначений позитивний профілактичний і лікувальний ефект пробіотичних препаратів при використанні в дітей. Кращий профілактичний ефект спостерігається при пренатальному й постнатальному призначенні пробіотиків. Клінічний ефект при лікувальному застосуванні залежить від штаму пробіотика, дозування, тривалості терапії, особливостей алергічних захворювань. Відсутність клінічного ефекту від призначення пробіотиків у частині досліджень може бути зумовлена особливостями організації дослідження, використанням малоефективного штаму бактерій, недостатньою дозою, значною тривалістю хвороби [12].
З огляду на вищезазначене існує потреба в продовженні клінічних досліджень щодо вивчення ефективності застосування пробіотиків з метою профілактики та лікування алергічних захворювань у дітей. Важливим лишається з’ясувати питання безпеки при їх застосуванні, а саме: які пробіотичні штами бактерій можна використовувати в дітей на тлі імунодефіцитних станів, тривалих тяжких захворювань.
З урахуванням вищевказаного видається доцільним вивчення ефекту використання біопрепарату, створеного на основі спороутворюючого мікроорганізму Bacillus subtilis виробництва ТОВ «ФЗ «Біофарма» (Україна) в комплексній терапії харчової алергії з гастроінтестинальними проявами. Механізми пробіотичної дії представників роду Bacillus, зокрема Bacillus subtilis, пов’язані iз синтезом протимікробних речовин, посиленням неспецифічного й специфічного імунітету, стимуляцією росту нормальної мікрофлори кишечника та виділенням травних ферментів. Посилення неспецифічного імунітету забезпечується активацією макрофагів і вивільненням з них прозапальних цитокінів, підвищенням бар’єрної функції слизової оболонки кишечника, виділенням вітамінів і амінокислот. Посилення специфічного імунітету проявляється активацією Т- і В-лімфоцитів і вивільненням з останніх імуноглобулінів — IgG та IgA. Мікроорганізми Bacillus subtilis належать до транзиторної нормальної мікрофлори та сприяють нормалізації якісного й кількісного складу кишкової облігатної мікрофлори, зокрема бактерій родів Lactobacillus і Bifidobacterium, а також збільшують різноманітність мікрофлори кишечника, виділяють у просвіт кишки всі основні травні ферменти, які руйнують антихарчові фактори та алергенні речовини, що містяться в спожитій їжі. Bacillus subtilis не містить факторів патогенності, не є вірулентною, токсигенною, токсичною. При пероральному її застосуванні не відбувалося патологічних змін нормобіоценозу мікрофлори кишечника [15].
Мета дослідження: оцінити ефективність застосування біопрепарату, створеного на основі спороутворюючого мікроорганізму Bacillus subtilis, у комплексній терапії дітей із гастроінтестинальними проявами харчової алергії.
Матеріали та методи
Для досягнення мети проведено відкрите рандомізоване дослідження методом випадкового відбору, у якому взяли участь 34 дитини віком від 3,5 до 12 років, хворі на харчову алергію, зі скаргами з боку шлунково-кишкового тракту, серед яких дівчаток було 15, а хлопчиків — 19.
Обстеження хворих дітей включало: опитування батьків щодо скарг і даних індивідуального та сімейного алергоанамнезу, оцінку об’єктивного статусу дітей у динаміці спостереження, аналіз даних харчового щоденника, лабораторне обстеження (загальний аналіз крові і сечі, біохімічний аналіз крові, копрограма, аналіз калу на дисбактеріоз) до призначення препарату (0-й день), на 10-й день і після закінчення лікування (21-й день), бактеріологічне дослідження випорожнень, визначення рівня загального й специфічних імуноглобулінів класу Е (IgE) до харчових продуктів у сироватці крові за допомогою методу імуноферментного аналізу, ультразвукове дослідження органів черевної порожнини, фіброгастродуоденоскопію і ректороманоскопію (за показаннями) з біопсією слизової оболонки верхніх і нижніх відділів гастроінтестинального тракту.
Усі 34 пацієнти отримували терапію основного захворювання. Основну групу становили 18 дітей, групу порівняння — 16 дітей. Діти основної групи додатково отримували споровий пробіотик на основі Bacillus subtilis по 1 дозі 2 рази на день протягом 20 днів. Ефективність терапії оцінювалась за швидкістю й повнотою згасання гастроінтестинальних симптомів та проявів коморбідної алергічної патології.
Критеріями ефективності були перш за все клінічні прояви хвороби — поліпшення загального стану, позитивна динаміка гастроінтестинальних проявів харчової алергії, тривалість загострення алергічного процесу, вплив на коморбідні захворювання, меншою мірою — рівень загального і специфічних IgE, ступінь дисбактеріозу.
Лікування усіх пацієнтів, які брали участь у дослідженні, проводили після підписання батьками інформованої згоди на участь їх дітей у дослідженні. Батьки також здійснювали елімінаційні заходи, спрямовані на зменшення впливу причинно-значущих факторів.
Статистична обробка отриманого матеріалу проводилась за допомогою програми Microsoft Excel та Statistica 6.0.
Результати та обговорення
За даними опитування, у 36 % хворих дітей був обтяжений з алергії сімейний анамнез. Родичі цих дітей страждали: від алергічного риніту — 31,5 ± ± 11,0 %, бронхіальної астми — 45,3 ± 10,0 %, атопічного дерматиту — 47,2 ± 13,0 %, ангіонабряку (набряк Квінке) — 10,0 ± 4,7 %, кропив’янки — 13,0 ±
± 7,1 %, медикаментозної алергії — 7,5 ± 6,5 %. Отже, сімейний анамнез дитини дає вагому підставу для підозри щодо спадкової схильності алергічної патології шлунково-кишкового тракту у хворих з алергічними хворобами, що також є діагностично значущим.
З коморбідної патології найчастіше були наявні бронхiальна астма, алергічний ринiт, атопiчний дерматит.
Серед скарг із боку шлунково-кишкового тракту найчастішим був абдомінальний біль (82,35 %), метеоризм спостерігався в 61,76 % пацієнтів, поганий чи знижений апетит — у 58,82 %. 88,23 % дітей скаржилися на порушення випорожнення, з них у 47,06 % були запори, у 41,18 % — неоформлені випорожнення.
Об’єктивне обстеження дітей виявило зміни з боку гастроінтестинального тракту — болючість різного ступеня при пальпації живота, а саме: в епігастрії — у 23,5 %, у навколопупковій ділянці — у 44,12 %, по ходу кишечника — у 35,29 %.
Випорожнення в дітей з гастроінтестинальною алергією мали різні характеристики: у 72,9 ± 10,1 % хворих вони були оформленими й регулярними (1–3 рази на день), схильність до запорів спостерігалась у 21,83 % обстежених, а схильність до діареї — у 5,9 % дітей.
У 61,7 % дітей кількість еозинофiлів дорівнювала 4,6 ± 0,6 %, а у 40,5 % була вище від 5 %. Рівень загального сироваткового IgE у хворих на поєднану алергічну патологію свідчить про високий ступінь сенсибілізації дітей із коморбідністю ХА та інших алергічних захворювань.
При ендоскопічному обстеженні зміни слизової оболонки гастроінтестинального тракту були виявлені в 76,47 % пацієнтів.
На жаль, візуальна оцінка верхніх відділів шлунково-кишкового тракту за допомогою ендоскопії не дає можливості чітко підтвердити алергічний характер патологічних змін.
Особливий інтерес становили результати морфологічного дослідження біоптатів слизової оболонки верхніх відділів травного каналу. Так, з боку стравоходу запальних змін не було виявлено в жодного обстеженого, проте в усіх дітей, яким було проведене гістологічне дослідження, у шлунку мали місце нерівномірний міжклітинний набряк, вогнища проліферації ямкового епітелію та інфільтрація плазматичними клiтинами, лiмфоцитами. Що стосується слизової оболонки дванадцятипалої кишки, то в усіх обстежених дітей виявлено помiрну атрофiю ворсинок із вкороченням та розширенням крипт, невелику кількість келихоподібних клітин, вогнища псевдобагатошаровості покривного ентероепiтелiю, на поверхнi якого був щiльний оксифiльний секрет, у власній пластинці слизової оболонки — нерівномірна помірна інфільтрація плазматичними клiтинами з поодинокими лiмфоцитами з еозинофілами, у 80 % у просвіті окремих залоз — щільний оксифільний секрет і в 70 % — вогнища гіперплазії дуоденальних (брунерових) залоз, що свідчить про наявність хронічного iмуноалергічного запального процесу в гастродуоденальній зоні.
У 64,57 % дітей кількість еозинофiлів дорівнювала 4,8 ± 0,7 %, а в 40,8 % — була вище від 5 %.
Аналіз даних харчових щоденників засвідчив, що в усіх пацієнтів була підозра на певний причинний продукт, причому найчастіше інформація стосувалася коров’ячого молока (21,8 %), цитрусових (11,3 %), шоколаду (9,7 %) і полуниці (8,5 %), волоських горіхів (5,1 %) тощо.
Підвищена ж концентрація специфічних IgЕ до харчових алергенів (коров’яче молоко, куряче яйце, пшеничне й вівсяне борошно, риба, морква, персик, картопля) виявлена в 55,88 % з усіх дітей. Рівень загального IgE у сироватці крові хворих був підвищений у 41,18 % дітей, що, можливо, свідчить про різні механізми виникнення харчової алергії, як IgE-залежні, так і IgE-незалежні.
На фоні проведеної терапії відзначалося покращання загального стану всіх дітей. Слід зазначити, що в пацієнтів основної групи згасання симптоматики з боку шлунково-кишкового тракту та симптомів супутньої алергічної патології відзначалося швидше, ніж у пацієнтів групи порівняння.
Аналізуючи отримані дані до та після лікування, відмітили, що прийом спорового пробіотика на основі Bacillus subtilis значно зменшив прояви з боку шлунково-кишкового тракту порівняно з пацієнтами другої групи (рис. 1).
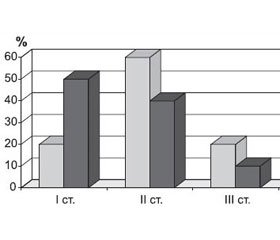
Підвищення вмісту загального IgE відзначено в 41,18 % хворих, а збільшення рівня специфічних IgE до харчових алергенів — у всіх пацієнтів, але різного рівня (високий — у 27 %). Через 10 днів використання спорового пробіотика на основі Bacillus subtilis відмічалося поступове зниження рівня специфічних IgE як до харчових, так і до інгаляційних алергенів на 25–30 % у дітей, які отримували комплексну терапію, а через 21 добу — на 35–40 %, що відображено на рис. 2, де на матеріалі змін рівня специфічного IgE до білків коров’ячого молока наведено найбільшу позитивну динаміку щодо харчових алергенів.
При бактеріологічному дослідженні випорожнень дисбактеріоз кишечника був виявлений у всіх дітей, але він був різного ступеня (за рахунок дефіциту біфідо- і лактобактерій, збільшення кількості та змін видового співвідношення умовно-патогенної флори). Тобто були наявні показання для призначення пробіотиків. У динаміці обстеження відзначено вірогідне підвищення до нормального рівня популяції біфідо- і лактобактерій у дітей, які приймали споровий пробіотик на основі Bacillus subtilis і мали вихідний знижений рівень цих бактерій (рис. 3). Поряд з цим виявлено чітку позитивну динаміку щодо представників умовно-патогенної мікрофлори фекалій. При повторному дослідженні калу на дисбактеріоз у дітей, які отримували споровий пробіотик на основі Bacillus subtilis, нормалізація мікробіоценозу кишечника відзначалася в 78 % дітей, що підтверджує позитивний вплив препарату на склад кишкової мікробіоти.
/19-1.jpg )
Споровий пробіотик на основі Bacillus subtilis добре переносився всіма пацієнтами, які його приймали, без будь-яких ускладнень. Побічних явищ у вигляді диспепсії та алергічних реакцій під час застосування не спостерігалося. Слід відзначити добрі органолептичні якості даного пробіотика. Діти, навіть молодшого віку, не відмовлялися від прийому. Патологічних змін з боку гемограми, урограми, біохімічних показників крові після закінчення терапії у всіх дітей, які брали участь у дослідженні, не відзначалось.
На підставі результатів катамнестичного спостереження обстежених пацієнтів було показано, що в подальші 3 місяці абдомінального болю та порушень із боку випорожнень у 83,33 % пацієнтів основної групи не спостерігалося, а в дітей групи порівняння продовжували відзначатися епізоди абдомінального болю та порушень випорожнень. Слід відзначити, що у період 3-тижневого курсу застосування спорового пробіотика на основі Bacillus subtilis відзначалося помірне покращання клінічної симптоматики коморбідної патології — алергічного риніту та атопічного дерматиту, а загострень бронхіальної астми не було зовсім на противагу дітям, які не приймали споровий пробіотик, у яких не відзначалося суттєвої клінічної позитивної динаміки коморбідних захворювань.
Отже, застосування спорового пробіотика на основі Bacillus subtilis у комплексній терапії дітей із гастроінтестинальною формою харчової алергії сприяє швидкому регресу клінічних проявів з боку шлунково-кишкового тракту та покращанню загального стану хворих.
Висновки
1. Споровий пробіотик на основі Bacillus subtilis має унікальні властивості й добру переносимість дітьми будь-якого віку.
2. Включення спорового пробіотика на основі Bacillus subtilis до складу комплексної терапії гастроінтестинальної форми харчової алергії є патогенетично обґрунтованим і клінічно доцільним.
3. Ефективність спорового пробіотика на основі Bacillus subtilis переконливо доведено у хворих зі значущою харчовою алергією скороченням тривалості гострого періоду хвороби, зниженням рівня специфічного ІgE до білків коров’ячого молока, швидким покращанням стану шлунково-кишкового тракту.
4. Безпечність використання спорового пробіотика на основі Bacillus subtilis разом з його ефективністю дозволяють рекомендувати його до більш частого застосування в дітей із харчовою алергією.
Конфлікт інтересів. Не заявлений.

/18-1.jpg )
/19-1.jpg )