Резюме
Вступ. Останніми десятиріччями в світі зафіксовано зростання кількості хворих на деформуючий остеоартроз різної етіології від 19,8 до 63 %. В Україні поширеність остеоартрозу становить 2200,6 на 100 000 населення, в Америці — 6500 на 100 000 населення. В той же час залишаються не повністю вивченими питання визначення остеосцинтиграфічних параметрів, при яких можливо спрогнозувати в передопераційному періоді параендопротезні ускладнення з метою проведення ендопротезування без ризику їх виникнення. Мета. Ви-значення діагностичної ролі радіонуклідного методу у прогнозуванні параендопротезних ускладнень у хворих на деформуючий остеоартроз кульшових і колінних суглобів шляхом розробки сцинтиграфічної моделі «dual time point imaging». Матеріали та методи. Трифазова остеосцинтиграфія проводилась на томографічній сцинтиляційній гамма-камері «Тамара-301Т» за стандартним протоколом: І етап — ангіографічна фаза, проводилась одразу після внутрішньовенного болюсного введення 600–800 МБк 99mTc-метилендифосфонату; ІІ етап — рання статична фаза, виконувалась у статичному режимі одразу після закінчення ангіографічної фази, збір інформації протягом 120 секунд; ІІІ етап — відстрочена статична фаза, проводилась через 2–4 години після введення радіофармацевтичного препарату (РФП), виконувалась у статичному режимі. Результати. При деформуючому остеоартрозі відбувалась швидка елімінація радіологічного індикатора з патологічного вогнища у зв’язку з активним вимиванням РФП внаслідок зниження кровопостачання тканин ділянки. У вогнищах ревматоїдного артриту, навпаки, спостерігалось зростання відсотка накопичення індикатора через інтенсифікацію інтегральної перфузії цих ділянок, за рахунок підвищення проникності судин внаслідок дії інфекційних агентів, активації факторів резорбції та синтезу мінеральних компонентів, ангіогенезу. Встановлено позитивну вірогідну кореляцію між показниками сцинтиграфічних параметрів включення РФП до ендопротезування та кількістю післяопераційних імплант-асоційованих ускладнень, а саме: між показниками сцинтиграфії при ревматоїдних артритах і кількістю випадків гематогенної суглобової інфекції в післяопераційний період — через 1 рік після ендопротезування (r = 0,581; p < 0,05). Висновки. Застосування радіонуклідної моделі «dual time point imaging» сприяє ранньому виявленню та зниженню відсотка параендопротезних ускладнень у післяопераційний період, зменшенню кількості виконання ревізійних ендопротезувань і скороченню терміну реабілітаційно-відновлювальних заходів після ендопротезування кульшових і колінних суглобів.
Актуальность. В последние десятилетия в мире зафиксирован рост количества пациентов с деформирующим остеоартрозом разной этиологии с 19,8 до 63 %. В Украине распространенность остеоартроза составляет 2200,6 на 100 000 населения, в Америке — 6500 на 100 000 населения. В то же время остаются не полностью изученными вопросы определения остеосцинтиграфических параметров, при которых возможно спрогнозировать в предоперационном периоде параэндопротезные осложнения, с целью проведения эндопротезирования без риска их возникновения. Цель. Определение диагностической роли радионуклидного метода в прогнозировании параэндопротезных осложнений у пациентов с деформирующим остеоартрозом тазобедренных и коленных суставов путем разработки сцинтиграфической модели «dual time point imaging». Материалы и методы. Трехфазовая остеосцинтиграфия проводилась на томографической сцинтиляционой гамма-камере «Тамара»-301Т по стандартному протоколу: І этап — ангиографическая фаза, проводилась сразу после внутривенного болюсного введения 600–800 МБк 99mTc-метилендифосфоната; II этап — ранняя статическая фаза, выполнялась в статическом режиме сразу после окончания ангиографической фазы, сбор информации на протяжении 120 с; ІІІ этап — отсроченная статическая фаза. Результаты. При деформирующем остеоартрозе отмечалась быстрая элиминация радиологического индикатора из патологического очага в связи с активным вымыванием РФП, по причине снижения кровоснабжения тканей исследуемой области. В очагах ревматоидного артрита, наоборот, отмечался рост процента накопления индикатора в очаге в связи с интенсификацией интегральной перфузии этих областей исследования, за счет повышения проницаемости сосудов, вследствие воздействия инфекционных агентов, активации факторов резорбции и синтеза минеральных компонентов, ангиогенеза. Установлена позитивная достоверная корреляция между показателями сцинтиграфических параметров включения РФП в эндопротезирование и количеством послеоперационных имплант-ассоциированных осложнений, а именно: между показателями сцинтиграфии при ревматоидных артритах и количеством случаев гематогенной суставной инфекции в послеоперационный период — через 1 год после эндопротезирования (r = 0,581; p < 0,05). Выводы. Применение радионуклидной модели «dual time point imaging» способствует раннему выявлению и снижению процента параэндопротезных осложнений в послеоперационный период, уменьшению количества проведения ревизионных эндопротезирований и сокращению срока реабилитационных мероприятий после эндопротезирования тазобедренных и коленных суставов.
Background. In recent decades in the world, there has been an increase in the number of patients with deforming osteoarthritis of different etiologies from 19.8 to 63 %. In Ukraine, the prevalence of osteoarthritis is 2,200.6 per 100,000 population, in America — 6,500. At the same time, questions regarding the determination of bone scintigraphic parameters, which can be predicted in the preoperative period of parаprosthetic complications, with the aim of arthroplasty without the risk of their occurrence, remain incompletely studied. The purpose of the study was to determine the diagnostic role of radionuclide method in predicting paraprosthetic complications in patients with deforming osteoarthritis of the hip and knee joints, by redesigning the dual time point imaging scintigraphic model. Materials and methods. Three-phase bone scintigraphy was performed on a tomographic scintillation gamma-camera Tamara-301T using the standard protocol: stage I — angiographic phase, was performed immediately after intravenous bolus administration of 600–800 MBq of 99mTc-methylene diphosphonate; stage II — early static phase, performed in a static mode immediately after the completion of angiographic phase, collection of information for 120 s; stage III — delayed static phase. Results. In deforming osteoarthritis, there was a rapid elimination of the radiological indicator from the pathological focus, in connection with the active washout of the radiopharmaceutical, due to a decrease in the blood supply to the tissues of the region under investigation. In the area of rheumatoid arthritis, on the contrary, there was an increase in the percentage of indicator accumulation in the focus resulting from the intensification of the integral perfusion of these areas, due to increased vascular permeability as a result of the action of the infectious agents, activation of resorption factors and synthesis of mineral components, angiogenesis. Positive, reliable correlations were established between the scintigraphic parameters of radiopharmaceutical incorporation and the number of postoperative implant-associated complications, namely: between scintigraphy indices for rheumatoid arthritis and the number of cases of hematogenous articular infection in the postoperative period — 1 year after arthroplasty (r = 0.581; p < 0.05). Conclusions. The application of the radionuclide model of dual time point imaging facilitates the early detection and reduction of the percentage of paraprosthetic complications in the postoperative period, a decrease in the number of revision arthroplasty and the shortening of rehabilitation after hip and knee arthroplasty.
Вступ
Сьогодні в сучасній медицині одним із найпоширеніших захворювань опорно-рухової системи є деформуючий остеоартроз, що характеризується прогресуючим, хронічним перебігом і ураженням усіх компонентів суглоба, в першу чергу дегенерацією суглобового хряща [1, 2]. При деформуючому остеоартрозі ураження суглобового хряща пов’язане з виникненням вторинного синовіїту, що посилює процеси дегенерації [3]. Останніми десятиріччями в світі зафіксовано зростання кількості хворих на деформуючий остеоартроз різної етіології від 19,8 до 63 %. У Західній Європі майже 80 % усіх захворювань суглобів становлять остеоартрози [4]. В Україні поширеність остеоартрозу дорівнює 2200,6 на 100 000 населення, в Америці — 6500 на 100 000 населення. Слід зазначити, що жінки хворіють на остеоартроз вдвічі частіше, ніж чоловіки. На сьогодні майже 11,5 % хворих на деформуючий остеоартроз мають інвалідність у працездатному віці з тимчасовою або стійкою втратою працездатності [5]. Остеоартроз входить до групи поширених патологій серед професійних захворювань опорно-рухової системи, становлячи 7,1 % в їх структурі [6].
Найбільш ефективним методом лікування деформуючого остеоартрозу кульшових і колінних суглобів є тотальне ендопротезування. Завдяки даному методу лікування хворі швидко відновлюють працездатність і повертаються до повноцінного життя.
За даними літератури, загальнообов’язкових аналізів, стандартної рентгенографії, комп’ютерної томографії (КТ), магнітно-резонансної томографії (МРТ), термографії кульшових і колінних суглобів у перед-операційному періоді недостатньо для виявлення реактивної остеобластичної активності патологічного процесу при деформуючому остеоартрозі [7]. Тому нині з метою диференціальної діагностики дистрофічно-дегенеративних та запальних процесів кульшових і колінних суглобів у клінічній практиці активно використовують метод остеосцинтиграфії (ОСГ). ОСГ протягом понад 50 років є однією з основних методик дослідження опорно-рухової системи завдяки здатності кісткової тканини фіксувати остеотропні фосфатні сполуки при деструктивно-репаративних змінах пропорційно інтенсивності метаболічного процесу [8]. До основних клінічних особливостей і переваг ОСГ, що є актуальними, належать:
— можливість виявлення ділянок підвищеного метаболізму в суглобових компонентах на ранніх стадіях їх виникнення;
— можливість проведення томографічного дослідження певних зон інтересу для уточнення локалізації, поширення, активності патологічного процесу;
— можливість порівняння або суміщення сцинтиграфічного зображення з даними КТ і МРТ для більш точної локалізації патологічних процесів;
— можливість контролю перебігу захворювання й ефективності лікування пацієнтів із дегенеративно-дистрофічними, інфекційно-запальними ураженнями суглобів, у тому числі у випадках, коли діагностика за допомогою КТ і МРТ може бути обмеженою (наприклад, наявність металевих фіксаторів).
У той же час залишаються не повністю вивченими питання визначення остеосцинтиграфічних параметрів, при яких можливо спрогнозувати в передопераційному періоді параендопротезні ускладнення з метою проведення ендопротезування без ризику їх виникнення.
Вищенаведене зумовило потребу поглибленого вивчення та вирішення такої проблеми, як визначення діагностичної ролі радіонуклідного методу у прогнозуванні параендопротезних ускладнень у хворих на деформуючий остеоартроз кульшових і колінних суглобів шляхом розробки сцинтграфічної моделі «dual time point imaging».
Матеріали та методи
В основу роботи покладено результати ретроспективних даних клінічних та інструментальних досліджень, проведених за період 2005–2015 р. Основну групу представлено 241 пацієнтом з дистрофічно-дегенеративними та інфекційно-запальними ураженнями кульшових і колінних суглобів (серед них 133 жінки та 108 чоловіків) віком від 17 до 85 років. Середній вік обстежених пацієнтів становив 55,4 ± 11,8 року. За первинним діагнозом хворих розподілено на дві діагностичні групи. До першої групи включено 142 пацієнти з деформуючим остеоартрозом, до другої діагностичної групи — 99 хворих на ревматоїдний артрит. Контрольна група представлена 102 хворими (64 жінки та 48 чоловіків), у яких була відсутня загальноклінічна симптоматика щодо ураження кульшових і колінних суглобів. Середній вік пацієнтів контрольної групи становив 65,1 ± 7,8 року (у жінок — 67,2 ± 9,1 року, в чоловіків — 66,4 ± 4,6 року).
Трифазова остеосцинтиграфія (3-ф ОСГ) проводилась на томографічній сцинтиляційній гамма-камері «Тамара-301Т» за протоколом [5]:
І етап — ангіографічна фаза (АФ), проводилась одразу після внутрішньовенного болюсного введення 600–800 МБк 99mTc-метилендифосфонату (99mTc-MDP);
ІІ етап — рання статична фаза (РСФ), виконувалась у статичному режимі через 3 години після закінчення збору АФ;
ІІІ етап — відстрочена статична фаза (ВСФ), проводилась через 24 години після введення радіофармацевтичного препарату (РФП).
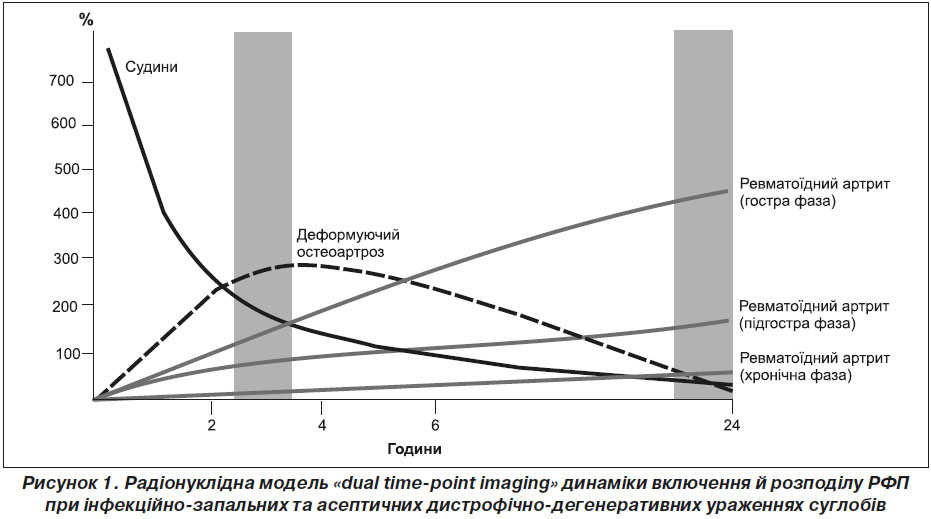
Принцип остеосцинтиграфічної моделі «dual time point imaging» базується на двократному проведенні 3-ф ОСГ у передопераційний період — через 3 та 24 години після внутрішньовенного болюсного введення 99mTc-MDP.
Після отримання зображень та проведення стандартних операцій комп’ютерної обробки діагностичної інформації проводили візуальну оцінку зон, що досліджувались. У кожного хворого виявили одну або декілька ділянок підвищеної фіксації РФП, загальна їх кількість дорівнювала 354, з них: 219 ділянок припадало на деформуючий остеоартроз, 135 — на ревматоїдний артрит. Ділянки локалізувались переважно в проекціях структур суглобових комплексів кульшових і колінних суглобів. Форма, розміри та інтенсивність візуалізації ділянок варіювали в широких межах. Природу кожного вогнища було чітко визначено за результатами клініко-інструментальних і променевих методів діагностики (рентгенографія, КТ, МРТ), підтверджено повторними сцинтиграфічними обстеженнями.
Цифрові дані, що отримано в роботі, обробляли методом варіаційної статистики з використанням пакета статистичних програм SPSS v10.0.5 for Windows.
Результати та обговорення
При аналізі кількісних параметрів результатів РСФ 3-ф ОСГ спостерігається поступове зростання відсотка включення та розподілу РФП у дистрофічно-дегенеративних та інфекційно-запальних вогнищах. Підвищення накопичення індикатора в інфекційно-запальних вогнищах і ділянках деформуючого остеоартрозу обумовлено підвищенням інтенсивності кровотоку в АФ, що вказувало на інтенсифікацію артеріального кровопостачання таких вогнищ внаслідок активного запалення, впливу інфекційного агента або підвищеної остеобластичної активності.
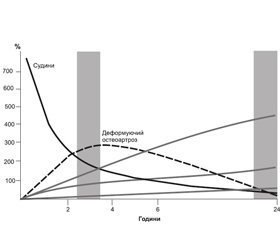
Найбільш показовим виявився аналіз параметрів ВСФ 3-ф ОСГ через добу після введення РФП. За даними аналізу, при деформуючому остеоартрозі відбувалась швидка елімінація радіологічного індикатора з патологічного вогнища у зв’язку з активним вимиванням РФП, внаслідок зниження кровопостачання тканин ділянки — так званий ретенційний провал (рис. 1).
Слід зазначити, що у вогнищах ревматоїдного артриту, навпаки, спостерігалось експоненціальне зростання відсотка накопичення індикатора у зв’язку з інтенсифікацією інтегральної перфузії цих ділянок, за рахунок підвищення проникності судин, внаслідок дії інфекційних агентів, активації факторів резорбції та синтезу мінеральних компонентів, ангіогенезу.
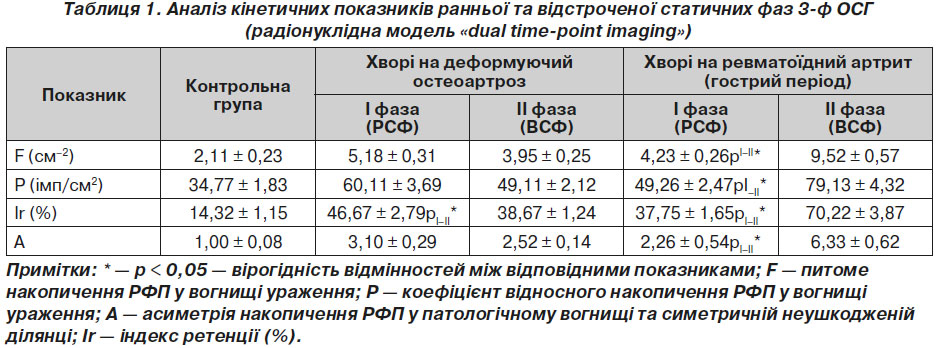
Результати аналізу кінетичних показників ранньої та відстроченої статичних фаз 3-ф ОСГ наведено у табл. 1.
З метою верифікації патологічного процесу всім хворим здійснювали внутрішньосуглобову пункцію з подальшим мікробіологічним дослідженням пунктату. За даними культурального дослідження, в переважної більшості пацієнтів з інфекційно-запальним процесом була висіяна грампозитивна флора (77 % випадків), зокрема за рахунок S.aureus (33 %) та St.gemoliticus (24 %).
За результатами кореляційного аналізу встановлено позитивну вірогідну кореляцію між показниками сцинтиграфічних параметрів включення РФП до ендопротезування та кількістю післяопераційних імплант-асоційованих ускладнень, а саме: між показниками ОСГ при ревматоїдних артритах і кількістю випадків гематогенної суглобової інфекції в післяопераційний період — через 1 рік після ендопротезування (r = 0,581; p < 0,05).
Отже, згідно з результатами оцінки кінетичних параметрів 3-ф ОСГ ранньої та відстроченої статичних фаз шляхом аналізу кривих «активність — час» радіонуклідної моделі «dual time point imaging» (наявність ретенційного провалу внаслідок швидкої елімінації індикатора з патологічного вогнища), у пацієнтів з асептичним процесом (за даними мікробіологічного дослідження) можливо проведення ендопротезування без ризику виникнення параендопротезних ускладнень. У той час як при діагностуванні септичного процесу (за даними мікробіологічної верифікації) в ділянці ураженого суглоба спостерігається експоненціальне зростання кривої радіонуклідної моделі «активність — час». Пацієнтам даної групи з метою запобігання виникненню імплант-асоційованих ускладнень доречно проводити курс антибактеріального лікування, зважаючи на чутливість збудника до антибіотиків, без проведення ендопротезування на даному етапі.
Висновки
Застосування радіонуклідної моделі «dual time point imaging» сприяє ранньому виявленню та зниженню відсотка параендопротезних ускладнень у післяопераційний період, зменшенню кількості виконання ревізійних ендопротезувань та скороченню терміну реабілітаційно-відновлювальних заходів після ендопротезуваня кульшових і колінних суглобів.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Мечев Д.С. Радіонуклідні методи дослідження скелета: роль в клінічній практиці / Д.С. Мечев, О.В. Щербіна // Радіологічний вісник. — 2011. — Т. 38, №1. — С. 23-25.
2. Сучасні аспекти застосування трифазної остеосцинтиграфії в діагностиці уражень опорно-рухового апарату / В.Ю. Кундін, М.В. Сатир, І.В. Новерко [та ін.] // Укр. радіол. журн. — 2012. — Т. 20, № 3. — С. 310-312.
3. Современные взгляды на эндопротезирование и перспективы развития мобилизующих операций на тазобедренном суставе / A.A. Корж, Н.И. Кулиш, В.А. Танькут, C.B. Колотев // Ортопедия, травматология и протезирование. — 2005. — № 2. — С. 1-5.
4. Ткаченко М.М. Пріоритети вибору інструментальних методів дослідження в діагностичному скринінгу при ендопротезуванні кульшових суглобів / М.М. Ткаченко, П.О. Король // Променева діагностика, променева терапія. — 2015. — № 2. — С. 34-36.
5. Щербіна О.В. Однофотонно-емісійна комп’ютерна томографія: теоретичні аспекти і роль в онкології / О.В. Щербіна // Досягнення біології та медицини. — 2010. — Т. 15, № 1. — С. 45-49.
6. De Smet K.A. Revisions of metal-on-metal hip resurfacing: lessons learned and improved outcome / K.A. De Smet, C. Van Der Straeten, M. Van Orsouw // Orthop. Clin. North Am. — 2011. — Vol. 42, № 2. — P. 259-269.
7. Rosado-de-Castro P.H. Rheumatoid arthritis: nuclear medicine state-of-the-art imaging / P.H. Rosado-de-Castro, S.A. Lopes de Souza, D. Aleхandre, L.M. Barbosa da Fonseca, B. Gutfilen // World J. Orthop. — 2014. — Vol. 5, № 3. — P. 312-318.
8. Stuchin S.A. Anatomic diameter femoral heads in total hip arthroplasty: a preliminary report / S.A.Stuchin // J. Bone Joint Surg. Am. — 2008. — Vol. 90, Suppl. 3. — P. 52-56.