Порой мы проходим мимо очевидных научных фактов о естественных эффективных средствах защиты нашего здоровья. К таким парадоксам можно отнести и «приручение» природной аминокислоты таурин.
Это вещество было впервые обнаружено в желчи крупного рогатого скота немецкими учеными Леопольдом Гмелином и Фридрихом Тидеманом еще в 1827 году и названо таурином (от латинского слова taurus — бык). Прошло много лет, а соединение продолжает привлекать внимание ученых и практических врачей во всем мире.
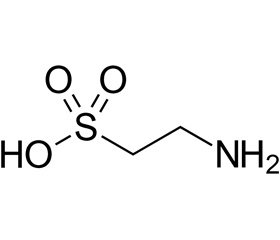
Таурин (NH2-CH2CH2-SО3H) — 2-аминоэтансульфоновая кислота — один из конечных продуктов обмена серы в организме (рис. 1).
/20-1.jpg )
Эта аминокислота не образует пептидные связи и поэтому не является строительным материалом для белков. Ее кислотная группа представлена сульфогруппой, а не карбоксильной, как у традиционных аминокислот. Таурин не является незаменимой аминокислотой для большинства животных и людей, но по своей значимости для жизнедеятельности он незаменим. Суточная потребность для взрослого здорового человека составляет 3 г. Однако у этого вещества отмечена одна особенность: таурин практически невозможно передозировать, так как клетки человеческого организма не возьмут его больше, чем требуется. В кишечнике под воздействием микрофлоры таурин распадается до сероводорода, других серосодержащих конечных продуктов (сульфидов) и выводится с калом. С мочой выводится незначительно в свободном состоянии, а также в виде производных с гуанидином или карбаминовой кислотой. Таурин, содержащийся в тканях человека, поступает в организм с пищей животного происхождения и образуется из серосодержащих аминокислот цистеина и метионина. Лидером по содержанию таурина являются морепродукты (рако–образные, моллюски, кальмары). Намного меньше его в мясных продуктах, рыбе, молоке, яйцах, практически отсутствует он в белках растительного происхождения. Основными источниками для синтеза в организме человека служат серосодержащие аминокислоты цистеин и метионин при обязательном достаточном присутствии витамина В6.
Существует как минимум пять возможных путей биосинтеза, однако наиболее изучены три, представленные на рис. 2.
/20-2.jpg )
Свободный таурин в организме содержится в головном и спинном мозге, периферических нервах, мышцах, печени, почках, крови, молоке, тканях глаза. В форменных элементах крови его в 500 раз больше, чем в плазме. В белых клетках крови (лейкоцитах и тромбоцитах) таурина в 12–20 раз больше, чем любой другой аминокислоты. Такая же закономерность отмечается и в других активных тканях. Так, в сердце на долю таурина приходится 50 % от суммы всех незаменимых аминокислот. В интенсивно работающих мышцах содержание таурина в 10 раз выше, чем в атрофированных, что косвенно доказывает связь таурина с энергетическими процессами в организме. Высокие уровни таурина в активно функционирующих тканях, его очевидная необходимость для организма противоречат первоначальной точке зрения о нем как об инертном конечном продукте катаболизма серосодержащих аминокислот. Примечательно, что в норме транспортные системы организма стараются поддерживать внутриклеточное содержание таурина на постоянном уровне даже в экстремальных состояниях.
На сегодняшний день выполнено достаточно много экспериментальных и клинических исследований о влиянии таурина на организм млекопитающих, в том числе человека, а также о перспективности применения его в терапии различной патологии.
Доказано, что таурин обладает различными биологическими эффектами, направленными на поддержание физиологического гомеостаза, включая антиоксидацию, модуляцию ионного транспорта, осморегуляцию, регуляцию нейротрансмиттеров и конъюгацию желчных кислот.
Он управляет работой клеточных мембран, обладает мембранозащитными и осморегулирующими свойствами, положительно влияет на их фосфолипидный состав, нормализует электролитный баланс, удерживая калий и магний внутри клеток, а натрий — снаружи. Очень важную роль таурин играет в отношении движения ионов кальция через мембраны, в частности в сердце: в зависимости от потребности повышает или понижает уровень кальция. Именно со стабилизирующим действием таурина на мембраны связывают его регулирующее влияние на нормализацию белкового, углеводного, электролитного обменов, активность ряда ферментов и гормонов, энергетические и восстановительные процессы в организме, укрепление иммунной системы. Еще одним важным свойством в организме является его функция нейропередатчика или нейромодулятора. Кроме того, таурин входит в состав главных компонентов желчи. Его конъюгирование с желчными кислотами способствует коллоидной стабильности желчи, что крайне необходимо для поддержания нормального уровня холестерина в крови. Значимость этих процессов трудно переоценить. С нормализацией обмена таурина в печени связывают лечение и профилактику различных заболеваний сердечно-сосудистой системы, печени, ожирения, дислипидемии и атеросклероза, а также инсулинорезистентности и манифестировавшего сахарного диабета, глазных болезней, неврозов и депрессий.
Мы лишь коротко перечислили свойства таурина. Целью нашей работы является раскрытие гепатотропного эффекта таурина для стабилизации и сохранения морфофункциональной активности жизненно важных органов и систем в современных экспериментальных исследованиях.
Классическим вариантом подтверждения этому являются работы об эффективности таурина в условиях развития гепатотоксического поражения.
W.M. El-Sayed и соавт. показали, что в условиях индуцированной на мышах гепатотоксичности алюминием с использованием соединения AlCl(3) имело место развитие угнетения практически всех компонентов антиоксидантной активности в печени — глутатионпероксидазы, глутатион-S-трансферазы, каталазы. Кроме того, алюминий вызывал кровоизлияние в печени, клеточную дегенерацию, а также некроз гепатоцитов. Ультраструктурное исследование показало набухание митохондрий, нарушение цистерн эндоплазматического ретикулума и плейоморфных ядер с аномальным распределением хроматина. Таурин вводился интраперитонеально до моделирования алюминиевой интоксикации в дозе 100 мг/кг или через 2 часа после в дозе 1000 мг/кг. Авторы отмечают значительное восстановление всех вовлеченных в интоксикационный процесс параметров при использовании таурин-содержащего раствора, однако позитивный эффект был лучше представлен в условиях предварительного введения таурина [1].
Применение таурина как цитопротекторного вещества оправданно и в некоторых областях клинической медицины, где возможно проявление непреднамеренного негативного ятрогенного эффекта основной этиопатогенетической терапии [19].
Так, препараты антинеопластического действия, применяемые в онкологии в сфере химиотерапии, оставляют в той или иной степени след токсического поражения печени, почек и сердца. В связи с этим исследование, проведенное в эксперименте на мышах с использованием метотрексата и тамоксифена с подключением таурина, продемонстрировало довольно значимый цитопротекторный эффект таурина с существенным нивелированием токсического действия вышеперечисленных химиопрепаратов [2]. В ходе исследования метотрексат и тамоксифен вводились в дозах 10 и 50 мг/кг соответственно, таурин применялся в дозе 100 мг/кг перорально в виде питья (водный раствор) в течение 10 дней. Влияние таурина проявилось выраженным приростом восстановленной формы глутатиона в ткани печени, редукцией разрушительного процесса фрагментации ДНК и ступенчатым формированием самой печеночной ткани, по-видимому, вследствие активации репаративных процессов. Выраженные протекторные свойства и антитоксический эффект с преимущественным антиоксидантным влиянием обосновывают обязательное использование таурина как терапии сопровождения в лечении онкологических пациентов.
Положительные свойства предварительного введения таурина как гепатопротекторного и противовоспалительного вещества зафиксированы в исследовании повреждения печени при моделировании тяжелого острого панкреатита, достигаемого введением 5% таурохолата [3]. Показан эффект стойкого снижения экспрессии тотальной и фосфорилированной стресс-индуцируемой протеинкиназы-р38 МАРК и нуклеарного фактора kB (NF-kB) в купферовских клетках печени, а также значительное ингибирование активности цитокинов TNF-α и интерлейкина-1β (IL-1β), что указывает на выраженное подавление воспалительного процесса.
Обращают на себя внимание данные результатов серии исследований по изучению роли таурина при алкогольной интоксикации. Здесь целесообразно рассматривать эффект таурина при различных режимах введения в организм алкоголя — острое одноразовое, приводящее к выраженной интоксикации с соответствующими последствиями, и длительное хроническое, что соответствует клиническому эффекту развития алкоголизма.
Так, в модели с одноразовым интрагастральным введением 60% этанола (0,4 мл) интрагастральное введение таурина значительно инициировало увеличение уровня специфических печеночных ферментов — алкогольдегидрогеназы и ацетальдегиддегидрогеназы, что указывает на выраженное усиление метаболизации этанола под влиянием таурина и существенно сглаживает негативные последствия проявления токсичности алкоголя [4].
Представляют интерес исследования с применением таурина при длительном введении в организм этанола. Введение алкоголя лабораторным животным в течение 3 месяцев позволило авторам проследить влияние таурина при алкогольном поражении печени [5]. Полученные результаты продемонстрировали весь спектр положительных изменений, связанных со свойствами таурина: в крови отмечалось снижение уровня аспартатаминотрансферазы и щелочной фосфатазы. Уровни общего белка, глутатиона и сукцинатдегидрогеназы были намного выше, чем у животных без введения таурина. Кроме того, на фоне влияния таурина оказывались пониженными уровни печеночного гидроксипролина, сывороточной гиалуроновой кислоты, интерлейкина-2 (IL-2), интерлейкина-6 (IL-6) и фактора некроза опухоли α (TNF-α). Процент поражения печени в связи с развитием жировой дистрофии и воспаления был ниже в группе с введением таурина по отношению к контрольным животным.
Аналогичный положительный эффект таурина прослежен относительно формирования печеночного фиброза у крыс, вызванного введением этанола 6 г/кг/день в комбинации с ионами железа (0,5% раствор) на протяжении 60 дней [6]. Таурин при этом вводился в виде питьевого 2% водного раствора. В данном исследовании обращено внимание на проявление двух основных повреждающих факторов: нитрозативного и оксидативного стресса. В группе животных с введением таурина отмечалась значительная редукция образования липидных гидроперекисей, а также минимизация оксидативно измененных протеинов ткани печени: 4-гидроксиноненаль, 3-нитротирозин, в то же время наблюдалась элевация уровней тиолов — белковых, небелковых и общих. Авторы указывают на проявление восстановительных процессов как белковых, так и липидных печеночных компонентов, что рассматривается как отражение угнетения оксидативного и нитрозитивного стресса, препятствующего дальнейшему развитию фиброза, и на восстановление структурно-биохимических процессов ткани печени.
Большой интерес представляют экспериментальные данные, свидетельствующие о гепатопротекторных свойствах таурина в лечении неалкогольной жировой болезни печени (НАЖБП).
Чтобы представить важность и серьезность этой проблемы, достаточно отметить, что этой болезнью страдают до 24 % всего населения земного шара (по состоянию на 2015 г.) [7].
Считается, что такого рода изменения в ткани печени имеют два основных направления патобиохимических преобразований [20]:
1) в результате увеличения содержания свободных жирных кислот в плазме крови, обусловленного либо мобилизацией жира из жировой ткани, либо гидролизом триацилглицеролов (в составе липопротеинов или хиломикронов), внепеченочной липопротеинлипазой. При этом возрастает поглощение и эстерификация (образование эфиров) свободных жирных кислот (СЖК) клетками печени. Последние накапливаются в печени в виде триацилглицеролов, вызывая ее жировое перерождение, поскольку количество печеночных липопротеинов оказывается недостаточным для утилизации СЖК;
2) жировое перерождение печени в связи с метаболическим блоком образования липопротеинов плазмы крови, в результате чего происходит накопление триацилглицеролов. Это нарушение может быть вызвано: а) блокированием синтеза белковой части липопротеинов; б) блокированием образования липопротеинов из липидов и апобелков; в) недостаточным поступлением фосфолипидов, входящих в состав липопротеинов; г) нарушением собственно секреторного механизма.
Кроме того, жировое перерождение печени может возникать при недостатке белков, а также незаменимых жирных кислот и витаминов (например, токоферола, пиридоксина и пантотеновой кислоты). При недостатке незаменимых жирных кислот тормозится синтез фосфолипидов, поэтому жировое перерождение печени могут вызывать такие вещества, как холестерол, конкурирующие за доступные свободные жирные кислоты, участвующие в их эстерификации.
Результаты экспериментального исследования Gentile et al. [8] свидетельствуют о возможности таурина снижать выраженность стресса эндоплазматического ретикулума, окислительного стресса, подавлять активность каспазы-3 и апоптоз гепатоцитов, проявления хронического системного воспаления в гепатоцитах. Кроме того, таурин подавлял аккумуляцию триглицеридов в гепатоцитах, что позволяет рассматривать его как перспективный препарат для профилактики и лечения НАЖБП. На модели неалкогольного стеатогепатита (НАСГ) на крысах было показано, что при диете, обогащенной жирами, таурин существенно уменьшает вес печени, активность трансаминаз в сыворотке, уровень триглицеридов и глюкозы, окислительный стресс, количество экспрессируемого mRNA фактора некроза опухоли α, трансформирующего ростового фактора и проколлагена-1; значительно увеличивает экспрессию адипонектина по сравнению с опытной группой животных.
Таурин проявляет положительный эффект относительно коррекции регуляции липидного гомеостаза на уровне ткани печени и в то же время оказывает цитопротекторное влияние проявлением антиоксидантных свойств. Более детально это продемонстрировано в модели на хомячках с инициированием НАСГ пищей с высоким уровнем жира и холестерина [9]. Показано, что введение таурина улучшает липидный профиль сыворотки крови, что, по-видимому, напрямую связано с повышенной экскрецией холестерина, триацилглицерола и желчных кислот с фекалиями. Кроме того, с влиянием таурина связывается повышение экспрессии гена CYP7A1, кодирующего рецептор ЛПНП на мембранах гепатоцита, что приводит к инициации данного рецептора.
В данной модели, по мнению авторов, описанные преобразования через влияние таурина способствовали усилению метаболизации ЛПОНП и ЛПНП, связанной с включением рецептор-ассоциированного механизма эндоцитоза с последующим увеличением содержания холестерола и желчных кислот, высвобождающихся с фекальными массами. В этом отношении немаловажным является также инициирование антиоксидантной системы печени, что было отмечено по увеличению содержания глутатиона, супероксиддисмутазы и каталазы, угнетению пероксидации липидов, наблюдаемых по снижению уровня малондиальдегида в ткани печени.
Применение таурина при дислипидемиях любой этиологии, неалкогольном и алкогольном стеатозе печени проявляет не только противовоспалительное и антиоксидантное действие, но и обеспечивает модулирующий эффект регуляторной функции печени в поддержании липидного гомеостаза и, в частности, катаболизма холестерина. Последнее важно не только в плане регуляции состояния печени, но и первичной, а возможно, и вторичной профилактики атеросклеротических поражений сердечно-сосудистой системы.
Поэтому немаловажным является тот факт, что между возникновением коронарного атеросклероза и концентрацией ЛПНП существует прямая корреляция [15, 18]. Классическое представление о формировании атеросклеротического поражения стенки сосуда состоит в запуске механизма, в основе которого лежит нарушенный баланс между уровнем ЛПНП и липопротеидов высокой плотности (ЛПВП) с преобладанием ЛПНП. ЛПНП определяются как атерогенные липопротеины, обеспечивающие перенос холестерола в ткани, а ЛПВП — антиатерогенные, удаляющие из тканей избыток холестерина [16]. Отмечается, что примерно 50 % деградации ЛПНП осуществляется во внепеченочных тканях, а остальные 50 % — в печени. Причем механизм метаболизации или разрушения ЛПНП запускается с момента сцепленности этого соединения с соответствующим ЛПНП-рецептором, что было описано выше. Поглощение ЛПНП тем выше, чем больше указанных рецепторов в различных тканях и в печени [17].
Таким образом, одним из вариантов уменьшения уровня холестерина является процесс инициирования увеличения количества в печени ЛПНП-рецепторов, что наблюдается под влиянием таурина. В этом отношении значительный интерес представляет информация об основных аспектах проявления свойств таурина в плане регуляции холестеринового метаболизма [10]. В рамках экспериментальных исследований в условиях введения в организм животных экзогенного таурина была выявлена редукция холестерина плазмы и ткани печени со снижением уровней ЛПОНП и ЛПНП, повышением уровня ЛПВП. Показана роль включения таурина в механизм регуляции гомеостаза холестерина и желчных кислот, в котором имеет существенное значение уже ранее упоминаемый ген CYP7A1 [9], который, как биомаркер холестеринового метаболизма, сам способен регулировать некоторые факторы в данном механизме и функционирование рецепторов клеточных ядер. Авторы указывают на проявление модулирующей и регулирующей значимости таурина в метаболизме холестерина по следующим направлениям:
1) извлечение холестерина из циркуляторного русла крови;
2) конвертация холестерина в желчные кислоты в печени;
3) экскреция холестерина с желчью через кишечник.
Цитопротекторный эффект таурина приобретает особо важное значение в форме конъюгированного соединения с некоторыми желчными кислотами.
В гепатоцитах из холестерола синтезируются первичные ЖК: холевая и хенодезоксихолевая; при последующем воздействии на них микрофлоры кишечника образуются вторичные — дезоксихолевая и литохолевая, но только из хенодезоксихолевой кислоты образуется урсодезоксихолевая третичная гидрофильная ЖК, составляющая 5 % от общего пула ЖК. Желчные кислоты представляют собой амфипатические вещества, что связано с их молекулярной структурой, которая включает гидрофобную и гидрофильную части, определяемую числом и позицией гидроксильных групп и карбоксильной группой на боковой цепи. По возрастанию гидрофобных свойств желчные кислоты располагаются в следующем порядке: холевая (ХК) и урсодезоксихолевая (УДХК) — хенодезоксихолевая (ХДХК) — дезоксихолевая (ДХК) — литохолевая (ЛХК). Этот порядок одновременно определяет и увеличение токсичности желчных кислот: именно гидрофобные (соответственно липофильные) свойства обеспечивают проникновение желчных кислот в липидные слои, прежде всего в мембраны, как плазматические, так и мембраны митохондрий, что вызывает изменение их функционирования и в конечном итоге — гибель клетки [18].
Выраженными повреждающими свойствами обладает ЛХК. Введенная в организм, она может вызывать изменения в печени крыс, подобные тем, которые наблюдаются при циррозе у человека [11, 20]. Однако лишь конъюгированные желчные кислоты (соединенные с глицином и таурином) способны образовывать липидные мицеллы и участвовать в переваривании жиров. Поэтому лишь в процессе сульфатирования в связи с таурином литохолевая ЖК человека лишается токсических свойств [11]. В этом контексте может быть рассмотрено соединение таурина с урсодезоксихолевой кислотой. Обладая существенными свойствами гидрофильности и имея особенности молекулярно-структурной тропности, урсодезоксихолевая кислота способна встраиваться в клеточную мембрану, которая становится более устойчивой к повреждающему действию токсичных ЖК [18]. Отмечается также, что УДХК предотвращает и другие эффекты токсичных ЖК: дисфункцию митохондрий, выход цитохрома С в цитозоль гепатоцита с последующим развитием апоптоза, нарушением гомеостаза ионов клетки и клеточной гибели по типу некроза. Усиление цитопротекторного эффекта воспроизводится при конъюгации УДХК с таурином (то есть с появлением тауродезоксихолевой кислоты (ТУДХК)) [13, 15]. В своем исследовании C. Benz et al. показали цитопротекторный эффект ТУДХК в условиях индуцированного апоптоза и цитолиза с фрагментацией ДНК, индуцированных гликохенодезоксихолевой кислотой в культуре ткани гепатоцитов [12]. В результате проявляется значительная редукция апоптоза, но цитопротекторный эффект ТУДХК этим не ограничивается. Проявление ингибирования апоптоза под влиянием ТУДХК инициирует соответствующий сигналинговый путь через включение митоген-активируемых протеинкиназ (MAPK) — р38, экстрацеллюлярной протеинкиназы (ЕRK), фосфатидилинозитол-3-киназы (РI3К) — и не зависит от активации нуклеарного фактора каппа-би (NF-κB).
Таким образом, таурин способствует синтезу желчных солей, снижает уровень холестерина в крови, сдерживает от проникновения в кровеносное русло ЛПНП и ЛПОНП, приводит к росту в крови ЛПВП, тем самым сохраняя коллоидную устойчивость желчи, и препятствует камнеобразованию в желчном пузыре и желчевыводящих путях.
Кроме того, таурин является мощным антиоксидантом и нейтрализует избыток свободных радикалов, снижает артериальное давление, усиливает работу мышечных ферментов, регулирующих окисление жиров и высвобождение энергии, стимулирует циклический АМФ, что ведет к выбросу адреналина и норадреналина. Эти гормоны, в свою очередь, активизируют липазу в жировых клетках, что приводит к высвобождению жиров для обеспечения энергетических потребностей организма. Таурин снижает уровень сахара в крови, обладает седативным действием, является средством детоксикации и универсальным гепатопротектором.
Применение препаратов таурина в лечебных целях окажется эффективным подспорьем в лечении различных заболеваний не только гастроэнтерологического профиля. Создание новых лекарственных форм таурина (в частности, для внутривенного введения или в соединениях с УДХК) расширит возможности терапии многих болезней человека.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.

/20-1.jpg )
/20-2.jpg )