Резюме
Мета дослідження — установити стан макро- та мікроелементного забезпечення хворих на вузлову патологію щитоподібної залози (ЩЗ) із регіонів, постраждалих після Чорнобильської аварії. Матеріали та методи. Обстежені 65 мешканців постраждалих після Чорнобильської аварії районів Чернігівської області: 40 без тиреоїдної патології — контрольна група та 25 — із діагностованим вузловим зобом. Результати. При дослідженні екскреції йоду з сечею показник медіани йодурії становив в контрольній групі 95,6 мкг/л, у дослідній групі — 89,3 мкг/л, що вказувало на наявність йодного дефіциту слабкого ступеня. Рівень тиреоглобуліну в крові в осіб контрольної групи дорівнював 9,26 ± 0,99 нг/мл та дослідної — 23,48 ± 4,83 нг/мл (p < 0,05), що також свідчило про наявність йодної недостатності серед обстежених дослідної групи. Результати ультразвукових досліджень ЩЗ підтвердили наявність сталого йодного дефіциту серед осіб із тиреоїдною патологією. Середній об’єм ЩЗ в осіб контрольної групи дорівнював 10,1 ± 0,3 см3, у дослідній — 18,6 ± 1,7 см3 (p < 0,001). Рівень тиреотропного гормона понад 4,0 мМО/л мали 5 % обстежених контрольної групи та 8,9 % — дослідної. В обстежених пацієнтів із вузловим зобом установлено знижений (p < 0,0001) рівень забезпечення макроелементами (кальцієм — 67,26 ± 3,21 мг/л та магнієм — 14,88 ± 0,35 мг/л), мікроелементами (цинком — 0,72 ± 0,04 мг/л (p < 0,0001) та залізом — 0,54 ± 0,06 мг/л (p < 0,05)) у сироватці крові порівняно з дослідженнями в контрольній групі. Висновки. В обстежених контрольної та дослідної груп спостерігали вірогідно нижчий рівень селену. Відносний ризик розвитку вузлового зоба при низькому вмісті кальцію (критерій χ2 для чотирипільної таблиці спряженості з корекцією за Фішером) становив RR = 2,24 (95% ДІ 1,58–2,61), ризик розвитку вузлового зоба при низькому вмісті магнію — відповідно 2,56 (95% ДІ 1,77–3,03).
Цель исследования — установить состояние макро- и микроэлементного обеспечения больных узловой патологией щитовидной железы (ЩЖ) из регионов, пострадавших после Чернобыльской аварии. Материалы и методы. Обследованы 65 жителей Черниговской области: 40 — без тиреоидной патологии (15 мужчин и 25 женщин) в возрасте 36,62 ± 0,60 года и 25 (5 мужчин и 20 женщин) — с диагностированным узловым зобом. Результаты. Исследование экскреции йода выявило, что медиана в контрольной группе составляла 95,6 мкг/л, в группе исследования — 89,3 мкг/л. Это указывает на наличие йодного дефицита легкой степени. Уровень тиреоглобулина в крови пациентов контрольной группы 9,26 ± 0,99 мкг/л, в группе исследования — 23,03 ± 4,7 мкг/л. Уровень ТТГ выше 4 мМЕ/л был в 8,9 % наблюдений в группе исследования и в 5 % случаев в контрольной группе. По данным ультразвуковых исследований средний размер ЩЖ у пациентов контрольной группы 10,1 ± 0,3 см3, в группе исследования — 18,6 ± 1,7 см3. В группе пациентов с узловым зобом установлен сниженный (p < 0,0001) уровень макроэлементов в плазме крови (кальций — 67,26 ± 3,21 мг/л и магний — 14,88 ± 0,35 мг/л) и микроэлементов (цинк — 0,72 ± 0,04 мг/л (p < 0,0001) и железо — 0,54 ± 0,06 мг/л (p < 0,05)) в сравнении с результатами в контрольной группе. Выводы. Относительный риск (критерий χ2 для четырехпольной таблицы сопряженности с коррекцией по Фишеру) развития узлового зоба при низком содержании кальция составлял RR = 2,24 (95% ДИ 1,58–2,61), риск развития узлового зоба при низком содержании магния — 2,56 (95% ДИ 1,77–3,03).
Background. The purpose of our study was to determine the state of macro- and micronutrient support of patients with nodular thyroid pathology from the regions injured after the Chornobyl accident. Materials and methods. 65 habitants of the Chernihiv area were examined: 40 — without thyroid pathology (15 men and 25 women) aged 36.62 ± 0.60 years, and 25 (5 men and 20 women) — with the diagnosed nodular goiter. Results. Research of urinary iodine excretion showed that a median in the control group was 95.6 µg/l, among patients with nodular goiter — 89.3 µg/l, indicating the presence of moderate iodine deficiency. Blood thyroglobulin level in patients of control group was 9.26 ± 0.99 ng/l, among patients with nodular goiter — 23.03 ± 4.70 ng/l. Thyroid-stimulating hormone level higher than 4.0 mIU/l was in 8.9 % of patients with nodular goiter and in 5.0 % of persons from the control group. The data of ultrasonic researches demonstrated that the average thyroid volume in patients of control group was 10.1 ± 0.3 cm3, among patients with nodular goiter — 18.6 ± 1.7 cm3. In the group of patients with nodular goiter, the decreased (p < 0.0001) level of macronutrients in blood plasma was detected: calcium was 67.26 ± 3.21 µg/l and magnesium — 14.88 ± 0.35 µg/l, as well as of microelements: zinc content was 0.72 ± 0.04 µg/l (p < 0.0001) and iron — 0.54 ± 0.06 µg/l (p < 0.05), in comparison with the results in the control group. Conclusions. The relative risk (χ2 criterion for the four-course table of connectivity with Fisher’s correction) of nodular goiter development at subzero content of calcium was 2.24 (95% confidence interval (CI) 1.58–2.61), the risk of nodular goiter development at subzero levels of magnesium — 2.56 (95% CI 1.77–3.03).
Вступ
Захворювання щитоподібної залози (ЩЗ) — одна з поширених ендокринних патологій у дітей і дорослих України [1]. Чорнобильська аварія зробила певний внесок у їх виникнення. За впливом на стан здоров’я хворих, прогнозом та втратою праце–здатності суттєве місце серед патології ЩЗ посідає вузловий зоб. Частота і характер вузлової тиреоїдної патології визначається впливом багатьох екзо- та ендогенних факторів.
У сучасній літературі широко обговорюється проблема механізмів стимуляції проліферації тирео–цитів та формування вузлового зоба. Це захворювання більш поширене в йододефіцитних районах. Тому часто нетоксичний зоб розглядають як наслідок йодного дефіциту. Крім того, в етіології нетоксичного зоба важливими факторами ризику є гойтрогени [2–4], куріння, наслідком чого є утворення тіоціонату. Етіологічно важливими також є гендерний фактор [5, 6], вік та підвищення індексу маси тіла [7]. Крім природного йодного дефіциту, розвитку вузлового зоба сприяє також дефіцит інших мікроелементів та порушення їх співвідношення (мікроелементози) природного походження [8–10]. Виникнення вузлового нетоксичного зоба може починатися з гіперплазії ЩЗ та порушення гормонального генезу [11]. Йодний дефіцит підвищує мутагенез за двох причин: унаслідок збільшення продукції Н2О2 і вільних радикалів або через проліферацію та підвищену кількість поділених тиреоцитів. Як наслідок, гіперплазія формує клони змінених клітин. Деякі з них складають соматичні мутації TSHR, які призводять до виникнення автономно функціонуючих тиреоїдних вузлів або містять мутації, що сприяють дедиференціації, а потім виникненню холодних тиреоїдних вузлів, або аденом [12].
Окремі автори вказують, що розвиток вузлового зоба відбувається за наявності соматичних (набутих) мутацій певних генів, які кодують різні етапи процесу гормоноутворення [9]. Безпосередньо до них належать гени, причетні до утворення протеїнів, визначальних за синтез тиреоїдних гормонів, та ті, які забезпечують транспорт йоду в тиреоцит. Гени тиреоглобуліну (TGgene), тиреоїдної пероксидази (TPOgene), натріййодсимпортера (SLC5A5), синдрому Пендреда (SLC26A4), рецептора тиреотропного гормона (ТТГ) (TSHRgene), йодотирозиндейододинази (DEHALI) та тиреоїд–оксидази-2 (THOX2) визначають сімейну історію еутиреоїдного зоба. Можливим є внесок варіантів цих генів в етіологію нетоксичного зоба у випадках менш виражених функціональних порушень, які ще можуть бути компенсованими [13–17].
Мутації гена ТТГ, що здійснює регуляторні функції щодо ЩЗ, вважають основною причиною багатовузлового зоба. Із соматичними мутаціями цього гена пов’язують також розвиток автономних ділянок у ЩЗ, із яких формуються тиреотоксичні вузли.
Деякі автори дотримуються думки, що основну роль у стимуляції проліферації тиреоцитів відіграють автокринні фактори росту, такі як інсуліноподібний фактор росту, епідермальний фактор росту та фактор росту фібробластів. Ці біокомпоненти є фізіологічними модуляторами проліферації та апоптозу тиреоцитів [18, 19]. Проліферація тирео–цитів обернено залежить від умісту йоду в залозі. Надходячи до тиреоцита, йод зв’язується не лише з тирозильними залишками тиреоглобуліну (ТГ), а і з ліпідами, утворюючи йодолактони та йодоальдегіди. Останні і є фізіологічними блокаторами продукування автокринних факторів росту.
Таким чином, існуючі дані літератури однозначно свідчать про роль йодної недостатності та складної взаємодії ендогенних та численних екзогенних факторів у виникненні вузлового зоба. Тому ця патологія вважається багатофакторним захворюванням [9, 20].
Дослідження, які проводились нами раніше, виявили йодний дефіцит практично на всій території України та сталу недостатність йоду в харчуванні населення Північного регіону України [21–24]. Питання поєднаного дисбалансу інших мікроелементів у пацієнтів із вузловим зобом нами висвітлюється вперше та є, на нашу думку, важливим для вивчення патогенетичних факторів виникнення вузлового зоба і порушень гомеостазу макро- та мікроелементів у хворих із вузловою патологією ЩЗ.
Мета дослідження — встановити стан макро- та мікроелементного забезпечення хворих на вузлову патологію щитоподібної залози з регіонів, постраждалих після Чорнобильської аварії.
Матеріали та методи
Обстежені 65 мешканців Чернігівської області: 40 без тиреоїдної патології (15 чоловіків та 25 жінок) віком 36,62 ± 0,60 року та 25 пацієнтів із діагностованим вузловим зобом (5 чоловіків і 20 жінок) віком 37,0 ± 1,0 року, із підтвердженими результатами тонкоголкової пункційної біопсії.
Визначення вмісту йоду в сечі проводили церій-арсенітним методом Sandell — Kolthoff в модифікації Dunn [25]. Результати дослідження трактували згідно з критеріями ВООЗ [26]. Дослідження йодурії проходять постійний зовнішній контроль якості в СDC центрі, Атланта (США).
Ультразвукові дослідження (УЗД) ЩЗ проводились сканером Terason 2000 з лінійним датчиком частотою 10 мГц. Розміри ЩЗ визначали відповідно до рекомендацій Brunn [27]. При оцінці об’ємів ЩЗ у дорослих використовувались граничні нормативи (Цыб и соавт.): для жінок — 13 см2, для чоловіків — 15 см2 [28].
Дослідження вмісту макро- (макЕ) і мікроелементів (мікЕ) у сироватці крові проводилося після мікрохвильової мінералізації проб плазми крові та подальшого визначення їх умісту методом атомно-емісійної спектрометрії з індуктивно-зв’язаною плазмою на приладі Optima 2100 DV фірми «Perkin Elmer» (США) за рекомендованою методикою в лабораторії аналітичної хімії та моніторингу токсичних сполук ДУ «Інститут медицини праці НАМН України». Нижня та верхня межа норми вмісту елементів у сироватці крові становили для магнію 17–28 мг/л, кальцію — 90–112 мг/л, цинку — 0,6–1,2 мг/л, заліза — 0,6–1,68 мг/л, міді — 0,7–1,55 мг/л, селену — 0,046–0,14 мг/л [29, 30].
Функціональний стан ЩЗ досліджували за рівнем гормонів (ТТГ, вільного тироксину — вТ4) методом радіоімунного аналізу за допомогою стандартних наборів фірми «Amersham» (Велика Британія). Для дослідження рівнів антитіл до ТГ та тиреодної пероксидази (ТПО) в сироватці крові застосовували імуноферментний метод із використанням стандартних наборів фірми «Medizim» (Німеччина). Референтні значення відповідно до використаного набору реактивів становили для вТ4 10,0–23,2 пмоль/л, ТТГ — 0,23–3,4 мкМО/мл, антитіл до ТПО — 0–30 МО/мл.
Статистичну обробку даних проводили відповідно до вимог доказової медицини та біостатистики, застосовуючи підходи сучасної неінфекційної епідеміології [31, 32]. При проведенні статистичного аналізу використовували пакет програм SPSS 11.0. та MedStat [33].
Результати
Проведені дослідження показали, що середній уміст йоду в сечі обстежених із Чернігівської області контрольної групи становив 102,12 ± 13,34 мкг/л. При цьому прийнятий для досліджень йодурії показник медіани (МЕ) дорівнював 81,1 мкг/л. У дослідній групі серед пацієнтів із вузловим зобом МЕ становила 95,6 мкг/л, середнє значення — 106,38 ± 21,07 мкг/л. Вірогідних відмінностей по групах не спостерігалося, показники медіани йодурії вказували на наявність йодного дефіциту слабкого ступеня в мешканців Чернігівської області (табл. 1).
У групі контролю 37,5 % результатів вказували на достатній рівень йодного забезпечення, у 7,5 % випадків йодурія була до 20 мкг/л — зона тяжкого йодного дефіциту. Серед пацієнтів із вузловим зобом 44 % результатів вказували на достатній рівень йодного забезпечення, проте близько чверті обстежених знаходилися в зоні тяжкого йодного дефіциту. Дані порівняно з контролем не вірогідні (р = 0,185).
Показник ТГ належить до критеріїв більш сталого йодного дефіциту. Значення медіани ТГ від 10–19,9 мкг/л вказує на легкий ступінь, 20–39,9 мкг/л — на середній та понад 40 мкг/л — на тяжкий ступінь йодного дефіциту. У контрольній групі середнє значення ТГ становило 9,26 ± 0,99 мкг/л (медіана — 8,4 мкг/л), у дослідній — 23,48 ± 4,83 мкг/л (медіана — 18,7 мкг/л). Рівень ТГ у групі з вузловим зобом був значно вищим порівняно з контролем (р = 0,00084).
За результатами УЗД ЩЗ середній її розмір у групі з вузловим зобом становив 18,61 ± 1,72 см3, МЕ = 15,8, значно вищий (p < 0,001) за показник у конт–рольній групі — 10,13 ± 0,35 см3, МЕ = 10,3. Тобто збільшені розміри ЩЗ також вказували на наявність сталого дефіциту йоду в харчуванні населення. Ці дані вказують на можливу роль сталого йодного дефіциту на виникнення досліджуваної тиреоїдної патології.
Рівень ТТГ понад 4 мМО/л спостерігався у 8,9 % обстежених у дослідній та в 5 % — у конт–рольній групі. Відзначається активація імунних процесів у ЩЗ. У групі пацієнтів із вузловим зобом наявний високий рівень титру антитіл до ТПО — 802,46 ± 367,84 МО/мл, МЕ = 20 МО/мл, в конт–рольній групі — 15,47 ± 2,17 МО/мл порівняно з контролем (p < 0,05).
Отримані дані стосовно балансу макЕ та мікЕ у сироватці крові обстежених були досить неоднорідні, тому для оцінки їх значимості нами проведено аналіз розподілу результатів по кожному з досліджуваних елементів (табл. 2).
У більшості рядів отриманих нами даних установлено анормальний розподіл результатів вибірки, проте в існуючих публікаціях, присвячених дослідженню вмісту макЕ та мікЕ у біологічних середовищах організму людини, дані наводяться у вигляді М ± m [34, 35, 37]. Для порівняння результатів з іншими публікаціями ми наводимо значення середніх показників та медіани.
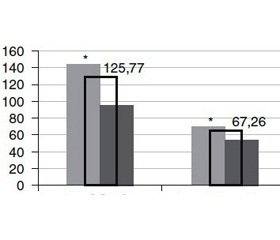
Середній показник вмісту кальцію у сироватці крові в контрольній групі обстежених становив 125,77 ± 12,6 мг/л, МЕ = 106,41 мг/л. Уміст кальцію у групі з вузловим зобом був низьким та становив 67,26 ± 3,21 мг/л, МЕ = 64,8 мг/л, він був вірогідно нижчим (p < 0,0001 за критерієм Манна — Уїтні) порівняно з контрольною групою, 92 % проб плазми крові були із умістом кальцію, нижчим від оптимального рівня. Серед пацієнтів обстежених груп спостерігалися гендерні відмінності за вмістом кальцію: у групі контролю та з вузловим зобом вищий рівень кальцію у жінок порівняно з чоловіками (р < 0,05) (рис. 1).
/402-1.jpg)
Середній уміст магнію в сироватці контрольної групи обстежених становив 22,70 ± 1,47 мг/л, МЕ 19,7 мг/л. Кількість проб плазми крові зі вмістом магнію вище оптимального рівня — 25,6 %, проб зі вмістом мікроелемента, нижчим за норму, — 35,8 %. Уміст магнію у сироватці крові пацієнтів із вузловим зобом був низьким та становив 14,88 ± 0,35 мг/л, МЕ = 14,7 мг/л, він був вірогідно нижчим (p < 0,0001 за критерієм Манна — Уїтні) порівняно з контрольною групою, 92 % проб плазми крові були зі вмістом магнію, нижчим від оптимального рівня. Гендерних відмінностей за вмістом магнію в крові осіб різної статі не виявлено (рис. 2).
Середній вміст цинку в сироватці контрольної групи обстежених становив 1,000 ± 0,047 мг/л, медіана 0,99 мг/л. Кількість проб плазми крові з умістом цинку вище від оптимального рівня становила 12,8 %, нижче за норму — 7,7 %. Уміст цинку у сироватці крові групи пацієнтів з вузловим зобом становив 0,72 ± 0,04 мг/л, медіана — 0,71 мг/л. Рівні цинку вірогідно нижчі (p < 0,0001 за критерієм Манна — Уїтні) порівняно з контрольною групою, 20 % проб плазми крові були зі вмістом цинку, нижчим від оптимального рівня. Гендерних відмінностей за вмістом цинку не виявлено (рис. 3).
/402-2.jpg)
У сироватці крові обстежених контрольної групи середній уміст заліза становив 0,79 ± 0,08 мг/л, медіана дорівнювала 0,65 мг/л. Уміст заліза, нижчий від 0,6 мг/л, виявлено у 43,59 % обстежених та вище від норми — у 10,2 %. Уміст заліза в групі з вузловим зобом був зниженим та становив 0,54 ± 0,06 мг/л, медіана — 0,56 мг/л, вірогідно нижчі показники (p < 0,05 за критерієм Манна — Уїтні) порівняно з контрольною групою, 56 % проб плазми крові були зі вмістом заліза, нижчим від оптимального рівня. У групі контролю вміст заліза у чоловіків був вірогідно вищим порівняно з жінками (p = 0,008) (рис. 4).
Середній уміст міді у сироватці крові обстежених контрольної групи становив 0,95 ± 0,067 мг/л, медіана — 0,89 мг/л. Нижчими від референтних значень були 20,5 % результатів, понад верхню границю — 10,2 %. Серед пацієнтів із вузловим зобом уміст міді був дещо нижчим та становив 0,79 ± 0,04 мг/л, медіана — 0,81 мг/л, вірогідно не відрізнявся порівняно з показником контрольної групи. 28 % проб плазми крові були зі вмістом міді, нижчим від оптимального рівня. У групі з вузловим зобом спостерігався вищий уміст міді у жінок порівняно з чоловіками (p < 0,05) (рис. 5).
Середній показник умісту селену у сироватці крові різних груп обстежених був низьким: у 95–100 % випадків значення було нижче за 0,003 мг/л. Так, у контрольній групі обстежених середній показник становив 0,006 ± 0,001 мг/л, медіана — 0,003 мг/л. Кількість проб плазми крові зі вмістом селену, нижчим від оптимального рівня, — 100 %. Уміст селену в крові серед пацієнтів із вузловим зобом також був низьким та становив 0,005 ± 0,001 мг/л, медіана — 0,003 мг/л, 100 % проб плазми крові були зі вмістом селену, нижчим від оптимального рівня (0,046 мг/л).
Для оцінки поєднаного впливу одночасного дисбалансу важливих для людини елементів в патогенезі тиреоїдної патології досліджували кореляцію між умістом різних елементів між собою по групах обстежених (табл. 3).
Виявлена вірогідна кореляція між умістом кальцію та магнію у всіх групах. Так, кореляція між умістом магнію та кальцію в контрольній групі (0,768) з високою вірогідністю (р = 0,0000), у групі з вузловим зобом (К = 0,472) — вірогідна (р = 0,017). Вірогідна кореляція встановлена між умістом кальцію та цинку в групі з вузловим зобом — 0,415 (р = 0,039). Вірогідна (р = 0,008) кореляція встановлена між умістом кальцію та міді, у групі контролю — 0,415. У групі з вузловим зобом також виявлена вірогідна (р = 0,001) кореляція (0,614) між умістом цих елементів.
Для аналізу тиреоїдного статусу та залежності показників функціонування ЩЗ від балансу досліджуваних нами макро- та мікроелементів при тиреоїдній патології досліджували кореляцію між ними по групах обстежених. У контролі виявлений вірогідний (p = 0,009) корелятивний зв’язок між йодурією (К = 0,405), рівнем антитіл до ТГ та вТ4 (К = 0,900, p = 0,037). У групі з вузловим зобом встановлені корелятивні зв’язки між тиреоїдним об’ємом та ТГ (К = 0,543, p = 0,05), ТТГ та рівнем антитіл до ТПО (К = 0,403, p = 0,046), рівнем антитіл до ТГ та антитіл до ТПО (К = 0,511, p = 0,009) (табл. 4).
Для визначення впливу біологічно активних елементів на розвиток вузлового зоба було оцінено відносний ризик розвитку цього захворювання в обстежених. Для оцінки відносного ризику на розвиток вузлового зоба при дефіциті або надлишку біологічно активного елемента користувалися критерієм χ2 для чотирипільної таблиці спряженості з корекцією за Фішером.
Відносний ризик розвитку вузлового зоба при низькому вмісті кальцію порівняно з контрольною групою становив RR = 2,24 (95% ДІ 1,58–2,61), ризик розвитку вузлового зоба при низькому вмісті магнію становив 2,56 (95% ДІ 1,77–3,03) та при поєднаному зниженому їх вмісті — 3,29 (95% ДІ 2,05–4,19).
Обговорення
Таким чином, установлено, що вузлова патологія ЩЗ супроводжується порушенням вмісту мікро- (І, Zn, Fe, Se) та макроелементів (Mg, Ca) в сироватці крові, що, можливо, є одним із факторів причинно-наслідкового зв’язку при виникненні цієї патології.
Наші дослідження інтегруються в сучасне коло інтересів науковців з інших країн. Дослідження вмісту мікроелементів Se, Zn, Fe, Cu, Mn при багатовузловому зобі та порівняння з контрольною групою проводилися в Туреччині, установлений йодний дефіцит, дефіцит селену, надлишок міді та марганцю при цій патології [36].
Дослідження вмісту мікроелементів у волоссі при тиреоїдній патології проводилось у трьох районах Башкортостану. Установлено, що мікроелементи залізо, селен, мідь мають патогенетичне значення в розвитку тиреопатій, особливості мікроелементного тиреоїдного профілю мають зональний характер, обумовлений геолого-геоморфологічними факторами місцевості проживання [36].
Висновки
1. Установлено наявність йодного дефіциту легкого ступеня у всіх мешканців Чернігівської області, медіана йодурії становила 81,1–95,6 мкг/л.
2. Значення ТГ у групі обстежених із патологією ЩЗ та збільшені розміри ЩЗ також підтверджують наявність йодного дефіциту легкого ступеня та його можливу роль у виникненні тиреоїдної патології. Рівень ТГ у групі з вузловим зобом був значно вищим порівняно з контролем (р = 0,00084).
3. У всіх обстежених Чернігівської області середній показник вмісту селену у сироватці крові був суттєво знижений: 95–100 % обстежених мали значення, нижчі за 0,003 мг/л.
4. У пацієнтів із вузловим зобом спостерігався знижений (р < 0,001) уміст цинку в сироватці крові порівняно з контрольною групою.
5. Порівняно з контрольною групою у пацієнтів із вузловим зобом виявлений знижений уміст кальцію та магнію. Відносний ризик виникнення вузлового зоба в пацієнтів мав вірогідні значення (р < 0,001) при зниженому вмісті кальцію в крові RR = 2,24 (95% ДІ 1,58–2,61), при низькому вмісті магнію — 2,56 (95% ДІ 1,77–3,03) та при поєднаному зниженому їх вмісті — 3,29 (95% ДІ 2,05–4,19).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Oliynyk VA. Thyroid pathology in Ukraine (epidemiology and regional features. Zhurnal praktychnogo likarja.2001;2:5-7. (in Ukrainian).
2. Knudsen N1, Laurberg P, Perrild H, Bülow I, Ovesen L, Jørgensen T. Risk factors for goiter and thyroid nodules. Thyroid. 2002 Oct;12(10):879-88. doi: 10.1089/105072502761016502.
3. Pisarikova B, Herzig I, Riha J. Inorganic anions with a potential goitrogenic effect in drinking water supply for humans and animals. Vet Med (Praha). 1996 Feb;41(2):33-9. PMID: 8629316. (in Czech).
4. Scanelli G. Lithium thyrotoxicosis. Report of a case and review of the literature. Recenti Prog Med. 2002 Feb;93(2):100-3. PMID: 11887342. (in Italian).
5. Brix TH, Kyvik KO, Hegedus L. Major role of genes in the etiology of simple goiter in females: a population-based twin study. J Clin Endocrinol Metab. 1999 Sep;84(9):3071-5. doi: 10.1210/jcem.84.9.5958.
6. Knudsen N1, Bülow I, Laurberg P, Ovesen L, Perrild H, Jørgensen T. Parity is associated with increased thyroid volume solely among smokers in an area with moderate to mild iodine deficiency. Eur J Endocrinol. 2002 Jan;146(1):39-43. PMID: 11751065.
7. Krohn K, Fuhrer D, Bayer Y, et al. Molecular pathoge–nesis of euthyroid and toxic multinodular goiter. Endocr Rev. 2005 Jun;26(4):504-24. doi: 10.1210/er.2004-0005.
8. Avcyn AP, Zhavoronkov AA, Rysh MA, et al. Human microelementosis: etiology, classification. Moscow: Medgiz; 1991. 96 p. (in Russian).
9. Galkina NV, Mazurina NV, Trishina EA. Diffuse euthyroid goiter: epidemiology, etiology and pathogenesis, a role of genetic factors in its development, and treatment. Problems of Endocrinology. 2006;4(52):49-56. (in Russian).
10. Tliashinova AM, Rustambekova SA. The multicomponent system in the development of thyroid diseases (iodine and endo-exogenous factors). Mezhdunarodnyi Endokrinologicheskii Zhurnal. 2006;2(4):71-4. (in Russian).
11. Veldanova MV. Role of some strumogenic environmental factors in the origin of goiter epidemic. Trace Elements in Medicine. 2000;1(1):17-25. (in Russian).
12. Paschke R. Molecular pathogenesis of nodular goiter. Langenbecks Arch Surg. 2011 Dec;396(8):1127-36. doi: 10.1007/s00423-011-0788-5.
13. Hansen PS, Brix TH, Bennedbaek FN, Bonnema SJ, Kyvik KO, Hegedüs L. Genetic and environmental causes of indivi–dual differences in thyroid size: a study of healthy Danish twins. J Clin Endocrinol Metab. 2004 May;89(5):2071-7. doi: 10.1210/jc.2003-031999.
14. Everett LA, Glaser B, Beck JC, et al. Pendred syndrome is caused by mutations in a putative sulphate transporter gene (PDS). Nat Genet. 1997 Dec;17(4):411-22. doi: 10.1038/ng1297-411.
15. Masmoudi S, Charfedine I, Hmani M. Pendred syndrome: phenotypic variability in two families carrying the same PDS missense mutation. Am J Med Genet. 2000 Jan 3;90(1):38-44. PMID: 10602116.
16. Fujiwara H, Tatsumi K, Miki K, et al. Recurrent T354P mutation of the Na+/I- symporter in patients with iodide transport defect. J Clin Endocrinol Metab. 1998 Aug;83(8):2940-3. doi: 10.1210/jcem.83.8.5029.
17. Matsuda A, Kosugi S. A homozygous missense mutation of the sodium /iodide symporter gene causing iodide transport defect. J Clin Endocrinol Metab. 1997 Dec;82(12):3966-71. doi: 10.1210/jcem.82.12.4425.
18. Gydee H1, O’Neill JT, Patel A, Bauer AJ, Tuttle RM, Francis GL. Differentiated thyroid carcinomas from children and adolescents express IGF-I and the IGF-I receptor (IGF-I-R). Cancers with the most intense IGF-I-R expression may be more aggressive. Pediatr Res. 2004 Apr;55(4):709-15. doi: 10.1203/01.PDR.0000111282.98401.93.
19. Yeh MW, Rougier JP, Park JW, et al. Differentiated thyroid cancer cell invasion is regulated through epidermal growth factor receptor-dependent activation of matrix metalloproteinase (MMP)-2/gelatinase. Endocr Relat Cancer. 2006 Dec; 13(4): 1173-83. doi: 10.1677/erc.1.01226.
20. Balabolkin MI. Solved and unsolved problems of endemic goiter and iodine deficiency states (lecture). Problems of endocrinology. 2005;4(51):31-7. (in Russian).
21. Tronko MD, Kravchenko VI, Bertolini R, et al. Iodine supplementation and goiter endemia among children in Northern Ukraine. Zhurnal NAMN Ukrai’ny. 2003;9(1):52-61. (in Ukrainian).
22. Kravchenko VI, Myroniuk NI, Turchyn VI, Luzanchuk IA, Tkachuk LA. The dynamics of iodine status in northern oblasts of Ukraine contaminated as a result of the Chornobyl accident. Endokrynologia. 2006; 11(1):124-33. (in Ukrainian).
23. Kravchenko VI, Luzanchuk IA. Problem of iodine deficiency in Zhytomyr region 20 years after the Chernobyl accident. Mezhdunarodnyi Endokrinologicheskii Zhurnal. 2007;1(7):29-31. (in Ukrainian).
24. Tronko MD, Mabuchi K, Kravchenko VI, et al. Iodine status and thyroid exposure doses in victims of Chernobyl nuclear accident who are permanent residents of northern regions of Ukraine (Ukrainian-American cohort study). Zhurnal NAMN Ukrai’ny. 2013;19(3):355-64. (in Ukrainian).
25. Dunn JT, Grutchfield HE, Gutekunst RD, et al. Methods for measuring iodine in urine. Amsterdam, Netherlands: International Council for Control of Iodine Deficiency Disorders; 1993. 71 p.
26. World Health Organization, UNICEF, ICCIDD. Assessment of iodine deficiency disorders and monitoring their elimination: a guide for programme managers. 3rd ed. Geneva: WHO; 2007. 97 p.
27. Brunn J, Block U, Ruf G, Bos I, Kunze WP, Scriba PC. Volumetric analysis of thyroid lobes by real-time ultrasound (author’s transl). Dtsch Med Wochenschr. 1981 Oct 9;106(41):1338-40. doi: 10.1055/s-2008-1070506. (in German).
28. Tsyb AF, Parshin VS, Nestaiko GV, et al. Ultrasound diagnostic of thyroid diseases. Мoscow: Meditsina; 1997. 332 p. (in Russian).
29. Andrusyshyna IM, Lampeka OG, Golub IO. Comparative evaluation of spectral methods for the detection of macro and microelements in human biological samples. Aktual’ni problemy transportnoi’ medycyny. 2009;18(4):75-83. (in Ukrainian).
30. Andrusyshyna IM, Lampeka OG, Golub IO, Lubjanova IP, Harchenko TD. Methodological recommendations 72.14 / 133.14. Evaluation of violations of mineral exchange in professional contingents by the method of atomic emission spectrometry with an inductively coupled plasma. Kyi’v: Avicena; 2014. 60 p. (in Ukrainian).
31. Vlasov VV. Introduction to evidential medicine. Moscow: Medya Sfera; 2001. 392 p. (in Russian).
32. Biglkhol R, Bonita R, K’el’strem T. Bases of epidemiology. Geneve: WHO; 1994. 259 p. (in Russian).
33. Liakh IuE, Gur’ianov VG. Analysis of the results of medical-biological research and clinical trials in the specialized statistical package MEDSTAT. Vestnik gigieny i epidemiologii. 2004;8(1):155-67. (in Russian).
34. Koch W, Karim MR, Marzec Z, Miyataka H, Himeno S, Asakawa Y. Dietary intake of metals young adult population of Eastern Poland: Result from a market basket study. J Trace Elem Med Biol. 2016 May;35:36-42. doi: 10.1016/j.jtemb.2016.01.007.
35. Gietka-Czernel M, Dębska M, Kretowicz P, et al. Iodine status of pregnant women from central Poland ten years after introduction of iodine prophylaxis programme. Endokrynol Pol. 2010 Nov-Dec;61(6):646-51. PMID: 21104637.
36. Giray B, Arnaud J, Sayek I, Favier A, Hincal F. Trace element status in multinodular goiter. J Trace Elem Med Biol. 2010 Apr;24(2):106-10. doi: 10.1016/j.jtemb.2009.11.003.
37. Farkhutdinova LM, Nikulicheva VI, Speranskii VV. Clinical and pathogenetic value of microelements in the development of thyroid pathology. Perm Medical Journal. 2006;18(2):6-13. (in Russian).

/401-1.jpg)
/402-1.jpg)
/402-2.jpg)
/403-1.jpg)