Резюме
Актуальність. На сьогодні активно вивчається роль порушень вуглеводного обміну в патогенезі синдрому полікістозних яєчників (СПКЯ), оскільки своєчасне їх виявлення та корекція дозволяють покращити стан репродуктивної системи та якість життя пацієнток. Мета дослідження: проаналізувати стан вуглеводного обміну у жінок із класичним фенотипом СПКЯ та визначити особливості секреції гонадотропних і статевих гормонів залежно від наявності або відсутності інсулінорезистентності (ІР). Матеріали та методи. Обстежено 246 жінок із класичним фенотипом СПКЯ: 128 з нормальною масою тіла (нормМТ) та 118 з надлишковою масою тіла (надлМТ) та ожирінням (Ож). Проводили стандартизований двогодинний пероральний тест толерантності до глюкози (ПТТГ), розраховували індекс НОМА-IR, глікемічні коефіцієнти (Бодуена, Рафальського). Досліджували в сироватці крові імунореактивний інсулін (ІРІ) натще та через 120 хвилин на тлі ПТТГ. Визначали рівні лютеїнізуючого гормону (ЛГ), фолікулостимулюючого гормону (ФСГ), глобуліну, що зв’язує статеві гормони (ГЗСГ), тестостерону вільного (Твіл.) та загального (Тзаг.). Розраховували коефіцієнт ЛГ/ФСГ, індекс вільного андрогену (ІВА). Результати. Проведення ПТТГ виявило наявність порушення толерантності до глюкози в 66,1 % хворих зі СПКЯ з надлМТ і Ож та 18,8 % жінок з нормМТ у вигляді патологічних глікемічних кривих, гіперінсулінемії (ГІ) та ІР. ГІ натще зустрічалась у 27,3 % жінок з нормМТ та 60,2 % осіб із надлМТ та Ож. У відповідь на навантаження глюкозою спостерігалось збільшення частоти ГІ (до 50 та 83 % відповідно), що вказує на доцільність визначення стимульованого рівня ІРІ для діагностики ГІ. Встановлено існування позитивного кореляційного зв’язку між ІМТ та індексом НОМА-IR (р < 0,001). Не виявлено вірогідних відмінностей у вмісті гонадотропінів та співвідношенні ЛГ/ФСГ у хворих зі СПКЯ з наявністю та відсутністю ІР і ГІ. У той же час концентрація Тзаг. та Твіл. у жінок з ІР була вірогідно вищою за показники пацієнток без ІР. Статистично значущі відмінності спостерігались у жінок зі СПКЯ як з нормМТ, так і з надлМТ та Ож. У всіх жінок зі СПКЯ відзначалося зниження ГЗСГ, однак найнижчі його показники відзначались при поєднанні надлМТ та Ож з ІР. Встановлено існування негативної кореляційної залежності між ГЗСГ та ІМТ (р < 0,001), ІРІ (р < 0,001), Твіл. (р < 0,001). У обстежених зі СПКЯ відзначалось значне (р < 0,001) підвищення ІВА, що може свідчити про збільшення в крові Твіл. і зниження Тзаг., зв’язаного з ГЗСГ. Виявлена позитивна залежність між вмістом у сироватці крові інсуліну, андрогенів та індексом маси тіла (р < 0,05). Висновки. Хворі зі СПКЯ вже в молодому віці незалежно від маси тіла мають підвищений ризик розвитку порушень вуглеводного обміну, що призводить до формування ГІ, ІР та посилює існуючу гіперандрогенію. Тому для ранньої діагностики порушень вуглеводного обміну всім хворим зі СПКЯ необхідно проводити ПТТГ.
Актуальность. Сегодня активно изучается роль нарушений углеводного обмена в патогенезе синдрома поликистозных яичников (СПКЯ), поскольку своевременная их диагностика и коррекция позволяют улучшить состояние репродуктивной системы и качество жизни пациенток. Цель исследования: проанализировать состояние углеводного обмена у женщин с классическим фенотипом синдрома поликистозных яичников (СПКЯ) и определить особенности секреции гонадотропных и половых гормонов в зависимости от наличия или отсутствия инсулинорезистентности (ИР). Материалы и методы. Обследовано 246 женщин с классическим фенотипом СПКЯ: 128 с нормальной масой тела (нормМТ) и 118 с избыточной масой тела (избМТ) и ожирением (Ож). Проводили стандартизированный двухчасовой пероральный тест толерантности к глюкозе (ПТТГ), рассчитывали индекс НОМА-IR, гликемические коэффициенты (Бодуэна, Рафальского). Исследовали в сыворотке крови иммунореактивный инсулин (ИРИ) натощак и через 120 минут на фоне ПТТГ. Определяли уровни лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), глобулина, связывающего половые гормоны (ГСПГ), тестостерона свободного (Тсв.) и общего (Тобщ.). Рассчитывали коэффициент ЛГ/ФСГ, индекс свободного андрогена (ИСА). Результаты. Проведение ПТТГ выявило наличие нарушения толерантности к глюкозе у 66,1 % больных СПКЯ с избМТ и Ож и 18,8 % женщин с нормМТ в виде патологических гликемических кривых, гиперинсулинемии (ГИ) и ИР. ГИ натощак встречалась у 27,3 % женщин с нормМТ и 60,2 % лиц с избМТ и Ож. В ответ на нагрузку глюкозой наблюдалось увеличение частоты ГИ (до 50 и 83 % соответственно), что указывало на целесообразность определения стимулированного уровня ИРИ для диагностики ГИ. Установлено существование позитивной корреляционной связи между ИМТ и индексом НОМА-IR (р < 0,001). Не выявлено отличий в содержании гонадотропинов и в соотношении ЛГ/ФСГ у больных СПКЯ с наличием и отсутствием ИР и ГИ. В то же время концентрация Тобщ. и Тсв. у женщин с ИР была достоверно выше, чем у пациенток без ИР. Статистически значимые отличия наблюдались у женщин с СПКЯ как с нормМТ, так и с избМТ и Ож. У всех пациенток с СПКЯ имелось снижение ГСПГ, но наиболее низкие его показатели отмечались при сочетании избМТ и Ож с ИР. Установлена негативная корреляционная зависимость между ГСПГ и ИМТ (р < 0,001), ИРИ (р < 0,001), Тсв (р < 0,001). У обследованных с СПКЯ отмечено существенное (р < 0,001) повышение ИСА, что может свидетельствовать об увеличение в крови Тсв. и снижение Тобщ., связанного с ГСПГ. Выявлена позитивная зависимость между содержанием в сыворотке крови ИРИ, андрогенов и ИМТ (р < 0,05). Выводы. Больные СПКЯ уже в молодом возрасте независимо от массы тела имеют повышенный риск развития нарушений углеводного обмена, что приводит к формированию ГИ, ИР и усугубляет имеющуюся гиперандрогению. Поэтому для ранней диагностики нарушений углеводного обмена всем больным СПКЯ необходимо проводить ПТТГ.
Background. Today, the role of carbohydrate metabolism disorders in the pathogenesis of polycystic ovary syndrome (PCOS) is actively studied, because their timely diagnosis and correction can improve the reproductive health and the quality of life of patients. The purpose was to analyse the state of carbohydrate metabolism in women with a classic phenotype of PCOS and to determine the features of gonadotropic and sex hormone secretion, depending on the presence or absence of insulin resistance (IR). Materials and methods. We examined 246 women with a classic phenotype of PCOS: 128 — with normal body mass index (BMI) of 23.1 ± 0.9 kg/m2 and 118 — with overweight and obesity (29.8 ± 1.2 kg/m2). A standard two-hour oral glucose tolerance test (GTT) was performed. The HOMA-IR index, glycemic coefficients (Baudouin, Rafalski) were calculated. Immunoreactive insulin (IRI) was tested in the blood serum on an empty stomach and 120 minutes after glucose testing. The levels of luteinizing hormone (LH), follicle-stimulating hormone (FSH), sex hormone binding globulin (SHBG), free testosterone and total testosterone were determined. The coefficient of LH/FSH, the free androgen index were calculated. Results. The results of GTT revealed that 18.8 % of women with PCOS with BMI < 25 kg/m2 and 66.1 % of women with BMI > 25 kg/m2 had impaired glucose tolerance in the form of pathological glycemic curves, hyperinsulinemia (HI) and IR. Fasting HI was found in 27.3 % of women with BMI < 25 kg/m2 and in 60.2 % of patients with BMI > 25 kg/m2. In response to glucose load, there was an increase in the incidence of HI (up to 50 and 83 %, respectively) indicating the expediency of determining the stimulated level of IRI for the diagnosis of HI. A positive correlation was established between BMI and the HOMA-IR index (p < 0.001). There were no differences in the content of gonadotropins and in the ratio of LH/FSH in patients with PCOS with and without IR and HI. At the same time, the concentration of total and free testosterone in women with IR was significantly higher than in patients without IR. Statistically significant differences were observed in women with PCOS, both with BMI > 25 kg/m2 and with BMI < 25 kg/m2. All patients with PCOS had a decrease in SHBG, but its lowest values were found in combination of BMI > 25 kg/m2 with IR. A negative correlation was found between SHBG and BMI (p < 0.001), IRI (p < 0.001), free testosterone (p < 0.001). The examined patients with PCOS had a significant (p < 0.001) increase in the free androgen index that may indicate an increase of free testosterone and a decrease in the total testosterone amount associated with SHBG. A positive correlation was found between the content in the blood serum of inslulin, androgens and BMI (p < 0.05). Conclusions. Patients with PCOS, already at a young age, have an increased risk of carbohydrate metabolism disorders, which leads to the formation of HI, IR and aggravates the existing hyperandrogenism, regardless of body weight. Therefore, for the early diagnosis of carbohydrate metabolism disorders, GTT should be carried out in all patients with PCOS.
Вступ
Сучасна наука має докази важливої ролі інсуліну в патогенезі синдрому полікістозних яєчників (СПКЯ). Є факти, які підтверджують наявність інсулінорезистентності (ІР) та гіперінсулінемії (ГІ) у пацієнток із будь-якими патогенетичними формами захворювання. Чи ГІ відіграє роль у патогенезі СПКЯ, чи вона є фактором, що посилює ендокринні порушення, до кінця не вивчено. Дослідники дотримуються єдиної думки про вагому роль ГІ у формуванні метаболічних змін, підвищенні ризику розвитку ендотеліальної дисфункції, ановуляторної безплідності, цукрового діабету (ЦД) 2-го типу й серцево-судинної патології, які у хворих зі СПКЯ маніфестують раніше, ніж у популяції [1]. Тому стає очевидним, що раннє виявлення та лікування порушень вуглеводного обміну дозволить не тільки підвищити ефективність стимуляції овуляції при відновленні репродуктивної функції, а й поліпшити якість життя пацієнток зі СПКЯ.
Мета дослідження: проаналізувати стан вуглеводного обміну в жінок із класичним фенотипом СПКЯ та визначити особливості секреції гонадотропних і статевих гормонів залежно від наявності або відсутності ІР.
Матеріали та методи
Для реалізації поставленої мети обстежено 246 жінок, яким на підставі критеріїв Роттердамського консенсусу 2003 року (хронічна ановуляція, гіпер–андрогенія, ехографічні ознаки полікістозних яєчників) [2] виставлено діагноз «класичний фенотип СПКЯ».
Залежно від індексу маси тіла (ІМТ) усі жінки були розподілені на групи: перша — 128 жінок зі СПКЯ з нормальною масою тіла (нормМТ) (ІМТ 23,1 ± 0,9 кг/м2), друга — 118 хворих із надлишковою масою тіла (надлМТ) та ожирінням І ступеня (Ож) (ІМТ 29,8 ± 1,2 кг/м2). Середній вік обстежених — 23,4 ± 0,6 року.
Контрольну групу становили 60 здорових жінок із нормальною менструальною функцією, які звернулися для уточнення стану репродуктивної системи перед плануванням вагітності.
Дослідження вуглеводного обміну містило визначення глюкози натще та проведення стандартизованого двогодинного перорального тесту толерантності до глюкози (ПТТГ). Нормальним рівнем глюкози натще вважали показник, менший від 5,6 ммоль/л [3]. Результати ПТТГ оцінювали відповідно до критеріїв ВООЗ [4]. Залежно від результатів ПТТГ глікемічні криві були розподілені на три типи: торпідна (плоска) глікемічна крива — рівень глюкози при проведенні ПТТГ через 60 хвилин після навантаження підіймався менше ніж на 50 %; іритативна глікемічна крива — рівень глюкози через 30 або 60 хвилин після навантаження підіймався більше ніж у 1,7 раза; глікемічна крива нормального типу відповідала показникам контрольної групи [5]. Для інтегральної оцінки глікемічних кривих розраховували такі коефіцієнти: гіперглікемічний коефіцієнт Бодуена (максимальний рівень глюкози після навантаження/рівень глюкози натще) та гіпоглікемічний коефіціент Рафальського (рівень глюкози через 120 хв після навантаження/рівень глюкози натще) [6]. Відповідно до довідкових даних у нормі гіперглікемічний коефіцієнт Бодуена становить менше ніж 1,7, а гіпоглікемічний коефіцієнт Рафальського перебуває в межах 0,9–1,04 [7].
Для визначення рівня імунореактивного інсуліну (ІРІ) використовували набори фірми DRG (США). Оцінку ступеня ІР проводили шляхом визначення індексу НОМА-IR (рівень інсуліну сироватки натще (мкОД/мл) × глюкоза плазми натще (ммоль/л) / 22,5), де показник НОМА-IR вище від 2,5 розцінювався як об’єктивний критерій ІР [8]. Дані літератури вказують, що нормальний показник індексу НОМА-IR не завжди поєднується зі стимульованою гіперглікемічною реакцією на навантаження глюкозою, тому у своєму дослідженні ми оцінювали базальний і стимульований показники інсуліну [9].
Визначали базальні рівні лютеїнізуючого (ЛГ), фолікулостимулюючого (ФСГ) гормонів (набори фірми «Алкор Био», Росія), загального тестостерону (Тзаг.), глобуліну, що зв’язує статеві гормони (ГЗСГ) (тест системи Elecsys®, Швейцарія), естра–діолу (Е2) (набори фірми DRG, США). Вимірювання рівня секреції гомонів проводили в сироватці крові на 2–3-й день менструального циклу. Розрахунок індексу вільного андрогену проводили за загальноприйнятою формулою: ІВА = (Тзаг./ГЗСГ) × 100 % [10].
Проведені дослідження відповідають морально-етичним нормам та принципам Гельсінської декларації, Конвенції Ради Європи та відповідних законів України щодо дотримання прав людини.
Статистична обробка одержаних даних проводилася методами варіаційної статистики за допомогою стандартного пакета прикладних програм StatSoft Statistica 6.0 для Microsoft Windows Vista. Розраховували середнє арифметичне значення та похибку середнього арифметичного
/408-1.jpg)
. Вірогідність розбіжностей середніх величин визначали за t-критерієм Стьюдента. Розбіжності вважалися значущими при р < 0,05. При порівняльному аналізі відносних величин використовували критерій χ
2. Для вивчення зв’язку між показниками застосовували метод кореляції з визначенням коефіцієнтів кореляції Пірсона (r) і встановленням його значущості за t критерієм із 95% рівнем надійності (P < 0,05). Дані наведені як
/408-2.jpg)
.
Результати
У хворих зі СПКЯ відзначалося вірогідне підвищення рівня глюкози натще відносно жінок конт–рольної групи. Варіабельність показників глюкози становила від 4,1 до 5,5 ммоль/л, тобто глікемія не виходила за межі діапазону її фізіологічних коливань (не перевищувала показник 5,6 ммоль/л). Аналіз базальних рівнів глюкози у хворих зі СПКЯ залежно від ІМТ показав вірогідне (р < 0,001) підвищення даного показника серед пацієнток з ІМТ > 25 кг/м2 порівняно з жінками з ІМТ < 25 кг/м2 (табл. 1).
За результатами ПТТГ в обох групах обстежених рівень глюкози через 30 і 60 хвилин після навантаження вірогідно (р < 0,001) підвищувався порівняно з показниками натще. Однак аналіз структури варіантів реакцій на навантаження глюкозою свідчив про їх неоднорідність серед жінок зі СПКЯ: у 61 (24,8 %) хворої спостерігався іритативний тип глікемічної кривої з надмірним (+106 %) підйомом рівня глюкози через 30 хвилин після навантаження, а в 41 (16,7 %) — торпідний тип глікемічної кривої з недостатнім підйомом рівня глюкози через 30 і 60 хвилин (+25,5 та +11,8 % відповідно) порівняно з показниками жінок контрольної групи (+60,9 та +50 % відповідно). Нормальний тип глікемічних кривих спостерігався у 144 (58,5 %) жінок зі СПКЯ (табл. 2).
Проведені дослідження показали, що іритативний та торпідний типи глікемічних кривих спостерігалися серед хворих зі СПКЯ як з ІМТ < 25 кг/м2, так і з ІМТ > 25 кг/м2, однак за наявності надлМТ та Ож частота їх виявлення була вірогідно більшою (табл. 3).
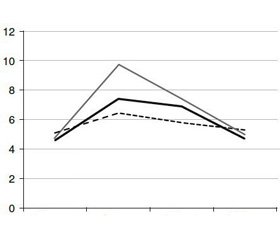
Результати дослідження глікемічних кривих, що складаються з оцінки висоти підйому рівня глюкози в крові й характеру його падіння, наведені на рис. 1.
При оцінці глікемічних коефіцієнтів встановлено, що підвищення коефіцієнта Бодуена понад 1,7 спостерігалося у 61 (41,8 %) обстеженої, причому значно частіше (χ2 = 35,8; р < 0,001) траплялося серед жінок із надлМТ та Ож (табл. 3) і свідчило про дискоординацію процесів всмоктування глюкози та секреції інсуліну. Статистичні відмінності щодо ступеня підвищення глюкози у хворих із різною масою тіла були відсутні (р > 0,05). Збільшення коефіцієнта Рафальського понад 1,04 вказувало на недостатній викид інсуліну у відповідь на навантаження глюкозою та відсутність адекватної гіпоглікемічної фази й спостерігалось також значно частіше (χ2 = 7,2; р < 0,05) серед хворих із надлМТ та Ож. Перевищення нормальних значень одного або обох коефіцієнтів свідчило про зниження толерантності до глюкози (табл. 4).
/410-2.jpg)
Концентрація рівня ІРІ натще в жінок зі СПКЯ коливалась у діапазоні від 8,3 до 22,3 мкМО/мл і в середньому була вірогідно вищою за показник контрольної групи (16,4 ± 0,3 мкМО/мл проти 10,1 ± 0,3 мкМО/мл; р < 0,001). Вірогідне збільшення (р < 0,001) середньої концентрації ІРІ відносно показників здорових жінок спостерігалося як у пацієнток із надлМТ та Ож (19,9 ± 0,3 мкМО/мл), так і у хворих із нормМТ (12,9 ± 0,3 мкМО/мл) (табл. 1). Однак ГІ натще вірогідно частіше (χ2 = 25,6; р < 0,001) спостерігалась у хворих із надлМТ та Ож — 71 (60,2 %), ніж серед хворих із нормМТ, — 35 (27,3 %). Для більш точної діагностики ГІ ми визначали ІРІ на тлі ПТТГ. Проведений аналіз показав, що у хворих із нормМТ після навантаження глюкозою частота ГІ вірогідно зростала (85 (66,4 %); χ2 = 3,89, р < 0,05). Серед пацієнток з надлМТ та Ож також спостерігалось підвищення частоти виявлення ГІ, однак це збільшення не було вірогідним (92 (77,9 %); χ2 = 1,61, р > 0,05). Слід відзначити, що через 120 хвили після навантаження глюкозою частота ГІ в обох групах хворих зі СПКЯ вірогідно не відрізнялась (χ2 = 3,51; р > 0,05).
Встановлено існування прямої кореляційної залежності між ІМТ і концентрацією ІРІ натще (r = 0,321; р < 0,001) та концентрацією ІРІ через 120 хвилин після навантаження глюкозою (r = 0,619; р < 0,001). Виявлено наявність високої варіабельності секреторної відповіді інсуліну на стимуляцію глюкозою, що, можливо, обумовлено поєднанням різного ступеня вираженості дисфункції β-клітин підшлункової залози та зниженням чутливості до інсуліну.
Середній показник індексу НОМА-IR у жінок зі СПКЯ вірогідно перевищував показник контрольної групи (3,6 ± 0,3 проти 1,9 ± 0,1; р < 0,001). Статистично значуще підвищення індексу НОМА-IR відносно здорових жінок спостерігалось як серед пацієнток із нормМТ (р < 0,002), так і серед хворих із надлМТ та Ож (р < 0,001) (табл. 1). При індивідуальному аналізі збільшення індексу НОМА-IR понад 2,5 значно (χ2 = 39,9; р < 0,001) частіше виявлялося в обстежених із надлМТ та Ож — 100 (84,7 %) порівняно з хворими з нормМТ — 58 (45,3 %). Встановлено існування позитивного кореляційного зв’язку між ІМТ та індексом НОМА-IR (r = 0,549; р < 0,001).
Значний внесок у формування цих порушень можуть робити й гормональні зміни, притаманні СПКЯ. Тому наступний етап дослідження передбачав визначення особливостей гормонального стану пацієнток з класичним фенотипом СПКЯ залежно від наявності або відсутності ІР (табл. 5). В обстежених обох груп не встановлено вірогідних розбіжностей у вмісті гонадотропінів (р > 0,05) та співвідношенні ЛГ/ФСГ (р > 0,05) у жінок з ІР та без ІР. Не виявлено й кореляційної залежності між ЛГ і ІРІ (r = 0,162; Р > 0,05), НОМА-IR (r = 0,171; Р > 0,05) та ЛГ/ФСГ й ІРІ (r = 0,097; р > 0,05), НОМА-IR (r = 0,141; р > 0,05). Не встановлено також кореляційного зв’язку між зниженим рівнем Е2 та концентрацією ІРІ (r = 0,104; р > 0,05), НОМА-IR (r = 0,156; р > 0,05). У той же час рівень Тзаг. та Твіл. у сироватці крові в жінок з ІР був вірогідно вищим за показники пацієнток без ІР. Статистично значущі відмінності спостерігались у жінок зі СПКЯ як із нормМТ, так і з надлМТ та Ож (табл. 5).
/411-1.jpg)
Середні рівні ГЗСГ у сироватці крові в пацієнток як із нормМТ, так і з надлМТ та Ож були вірогідно вищими за показники контрольної групи (39,8 ± 1,2 нмоль/л та 26,4 ± 1,4 нмоль/л проти 67,5 ± 3,6 нмоль/л відповідно; р < 0,001). Статистично значуще зниження ГЗСГ спостерігалось у всіх жінок зі СПКЯ незалежно від наявності або відсутності ІР, однак необхідно зазначити, що ІР супроводжувалась вірогідно (р < 0,001) більш низькими показниками ГЗСГ. Найнижчі показники ГЗСГ спостерігались при поєднанні надлМТ та Ож з ІР. Встановлено існування негативної кореляційної залежності між ГЗСГ та ІМТ (r = –0,712; р < 0,001), ІРІ (r = –0,345; р < 0,001), Твіл. (r = –0,414; р < 0,001).
В обстежених зі СПКЯ порівняно з жінками контрольної групи відзначалося значне (р < 0,001) підвищення ІВА, що може свідчити про збільшення в крові фракції Твіл. і зниження фракції тестостерону, зв’язаного з ГЗСГ. Нами встановлено існування прямого кореляційного зв’язку між Тзаг. та ІВА (r = 0,641; р < 0,001) у загальній групі пацієнток зі СПКЯ. ІР супроводжувалась більш суттєвим підвищенням ІВА у жінок як із нормМТ (8,4 ± 0,9 % проти 5,9 ± 0,9 %; р < 0,05), так і з надлМТ та Ож (14,4 ± 1,3 % проти 9,1 ± 0,9 %; р < 0,002). Кореляційний аналіз у загальній групі хворих зі СПКЯ встановив наявність статистично значущої позитивної залежності між рівнем ІРІ натще та Тзаг. (r = 0,562; р < 0,001), ІВА (r = 0,396; р < 0,001), що підтверджує прямий вплив інсуліну на продукцію андрогенів яєчниками. Наявність кореляційної залежності між вмістом у сироватці крові інсуліну, андрогенів та ІМТ відзначали й інші дослідники [11].
Обговорення
Отже, результати оцінки стану вуглеводного обміну показали, що у хворих зі СПКЯ як із надлМТ та Ож, так і з нормМТ відзначаються однаково спрямовані порушення обміну вуглеводів. Однак при проведенні ПТТГ виявлена вірогідно вища (χ2 = 54,9; р < 0,001) частота змін у хворих з ожирінням 78 (66,1 %) порівняно з пацієнтками з нормМТ 24 (18,8 %), що дозволяє розглядати надлишкову масу тіла як додатковий фактор, який посилює існуючі при СПКЯ порушення вуглеводного обміну. Результати проведеного дослідження вказують на доцільність визначення функціональних навантажувальних коефіцієнтів (Бодуена, Рафальського) для виявлення ранніх порушень вуглеводного обміну. Перевищення нормальних значень одного або обох коефіцієнтів вказує на зниження толерантності до глюкози.
За результатами нашого дослідження, після навантаження глюкозою також відбувається збільшення частоти ГІ порівняно з ГІ натще. Отже, для виключення прихованих порушень вуглеводного обміну необхідним є проведення ПТТГ з одночасним визначенням інсуліну всім хворим із підозрою на СПКЯ незалежно від віку та ІМТ, що відповідає рекомендаціям Міжнародного товариства з гіперандрогенії та СПКЯ [12].
На підставі отриманих результатів можливо зробити висновок, що в 64,3 % хворих зі СПКЯ формується резистентність до інсуліну, частота виникнення якої і ступінь вираженості позитивно корелюють з масою тіла. Вважається, що ІР є одним з патогенетичних факторів формування ГА, однак залишається не зовсім зрозумілим, яким саме чином інсулін стимулює продукцію андрогенів у яєчниках. Ймовірно, механізми формування ГА при інсулінорезистентності є гетерогенними. Притаманна СПКЯ ГА може бути обумовлена надлишковою концентрацією в сироватці крові інсуліну, який, як відомо, чинить стимулюючий вплив на активність цитохрому Р450с17 — ключового ферменту синтезу андрогенів наднирковими залозами та яєчниками [13]. Крім того, інсулін на рівні яєчників збільшує число рецепторів до ЛГ у гранульозних клітинах і потенціює їх стероїдогенну відповідь на гонадотропіни. Незалежно від ЛГ інсулін та інсуліноподібні фактори росту 1 і 2 стимулюють синтез андрогенів тека-клітинами [14]. Інсулін також здатний пригнічувати продукцію ГЗСГ, що призводить до підвищення рівня вільних андрогенів в крові. Зниження рівня ГЗСГ у крові прямо пов’язане з секрецією вільного тестостерону і, відповідно, біологічно активного тестостерону. Унаслідок цього формується стан, який характеризується гіперандрогенією, кістозною трансформацією яєчників, ановуляцією, що й стає основною причиною безпліддя [15].
Висновки
1. Проведення ПТТГ дозволило виявити наявність порушення толерантності до глюкози у 66,1 % хворих зі СПКЯ із надлМТ та Ож і 18,8 % жінок із нормМТ. Для ранньої діагностики порушення всмоктування, резорбції та утилізації глюкози доцільні визначення та оцінка функціональних коефіцієнтів Бодуена та Рафальського.
2. ГІ натще трапляється в 27,3 % жінок із нормМТ і 60,2 % осіб із надлМТ та Ож. У відповідь на навантаження глюкозою реєструється підвищення рівня ІРІ (до 50 і 83 % відповідно), тому для більш вірогідної діагностики ГІ у хворих зі СПКЯ незалежно від ІМТ доцільно оцінювати як базальний, так і стимульований рівні ІРІ. Отримані дані вказують на необхідність проведення ПТТГ усім хворим зі СПКЯ незалежно від віку та ІМТ.
3. ІР спостерігається в 64,3 % хворих зі СПКЯ, при цьому значно частіше трапляється серед пацієнток із налдМТ та Ож — 100 (84,7 %), ніж серед осіб із нормМТ — 58 (45,3%).
4. Наявність ГІ та ІР посилює гормональні порушення, типові для класичного фенотипу СПКЯ — підвищується вміст Тзаг. та Твіл., знижується продукція ГЗСГ, що призводить до збільшення ІВА. У той же час не встановлено кореляційного зв’язку ІРІ з ЛГ, ЛГ/ФСГ, що вказує на гетерогенність механізмів формування ГА за наявності ІР.
Конфлікт інтересів. Автор гарантує відсутність конфлікту інтересів та власної фінансової зацікавленості при виконанні роботи та написанні статті.
Список литературы
1. Misharina EV, Borodina VL, Glavnova OB, Nicolaencov IP, Potin VV, Tarasova MA. Insulin resistance and hyperandrogenism. Journal of obstetrics and woman disease. 2016;65(1):75-86. doi: 10.17816/JOWD65175-86. (in Russian).
2. The Rotterdam ESHRE/ASRM-sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome (PCOS). Hum Reprod. 2004 Jan;19(1):41-7. PMID: 14688154.
3. Malachkova NV, Komarovskaya IV, Kyryliuk ML. Blood glucose level and insulin resistance in patients with type 2 diabetes mellitus, diabetic retinopathy and obesity. Mezhdunarodnyi Endokrinologicheskii Zhurnal. 2017;13(3):129-34. doi: 10.22141/2224-0721.13.3.2017.104108. (in Russian).
4. Members TF, Rydén L, Grant PJ et al. ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: The Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). Eur Heart J. 2013 Oct;34(39):3035-87. doi: 10.1093/eurheartj/eht108.
5. Budrejko EA, Nachetova TA. Features of indexes of carbohydrate metabolism in girls-teenagers with secondary amenorrhea. Nauchnye vedomosti. Serija Medicina. Farmatsia. 2014;27(18):134-38. (in Russian).
6. Karachencev JuI, Lapta SI, Lapta SS, Levchenko TP, Solov’eva OI. Early objective diagnostics of type 2 diabetes mellitus from data of oral glucose tolerance test. Nauchnye trudy SWORLD. 2012;34(3):43-5. (in Russian).
7. Dynnik VA. Carbohydrate metabolism status in patients with abnormal uterine bleeding during puberty. Ukrainian journal of pediatric endocrinology. 2016;3:34-39. (in Russian).
8. Serov VN, Prilepskaja VN, Ovsjannikova TV. Gynaecological endocrinology. Мoscow: MEDpress-inform; 2015. 512 p. (in Russian).
9. Manuhin IB, Gevorkjan MA, Chagaj NB. Anovulation and insulin resistance. Мoscow: GEOTAR-Media; 2006. 416 p. (in Russian).
10. Gevorkjan MA, Manuhin IB, Studenaja LB, Smirnova LI, Manuhina EI. Clinic, diagnostics and treatment of polycystic ovary syndrome. Zhurnal Rossijskogo obshhestva akusherov-ginekologov. 2008;4:35-48. (in Russian).
11. Huang R, Zheng J, Li S, Tao T, Ma J, Liu W. Characteristics and contributions of hyperandrogenism to insulin resistance and other metabolic profiles in polycystic ovary syndrome. Acta Obstet Gynecol Scand. 2015 May;94(5):494-500. doi: 10.1111/aogs.12612.
12. Cassar S, Misso ML, Hopkins WG, Shaw CS, Teede HJ, Stepto NK. Insulin resistance in polycystic ovary syndrome: a systematic review and meta-analysis of euglycaemic-hyperinsulinaemic clamp studies. Hum Reprod. 2016 Nov;31(11):2619-31. doi: 10.1093/humrep/dew243.
13. Yadav R, Petrunak EM, Estrada DF, Scott EE. Structural insights into the function of steroidogenic cytochrome P450 17A1. Mol Cell Endocrinol. 2017 Feb 5;441:68-75. doi: 10.1016/j.mce.2016.08.035.
14. Bremer AA, Miller WL. The serine phosphorylation hypothesis of polycystic ovary syndrome: a unifying mechanism for hyperandrogenemia and insulin resistance. Fertil Steril. 2008 May;89(5):1039-48. doi: 10.1016/j.fertnstert.2008.02.091.
15. Podzolkova NM, Koloda IuA, Podzolkov AV. Infertility therapy in obese patients: modern trends. Problemy reproduktsii. 2012;3:37-41. (in Russian).
/408-1.jpg) . Вірогідність розбіжностей середніх величин визначали за t-критерієм Стьюдента. Розбіжності вважалися значущими при р < 0,05. При порівняльному аналізі відносних величин використовували критерій χ2. Для вивчення зв’язку між показниками застосовували метод кореляції з визначенням коефіцієнтів кореляції Пірсона (r) і встановленням його значущості за t критерієм із 95% рівнем надійності (P < 0,05). Дані наведені як
. Вірогідність розбіжностей середніх величин визначали за t-критерієм Стьюдента. Розбіжності вважалися значущими при р < 0,05. При порівняльному аналізі відносних величин використовували критерій χ2. Для вивчення зв’язку між показниками застосовували метод кореляції з визначенням коефіцієнтів кореляції Пірсона (r) і встановленням його значущості за t критерієм із 95% рівнем надійності (P < 0,05). Дані наведені як /408-2.jpg) .
.
/409-1.jpg)
/410-1.jpg)
/410-2.jpg)
/411-1.jpg)