Журнал «Почки» Том 6, №4, 2017
Визначення рівня субпопуляцій лімфоцитів периферичної крові для діагностики хронічної реакції відторгнення ниркових алотрансплантатів
Авторы: Зограб’ян Р.О., Шелест В.В., Кубашко А.В.
ДУ «Національний інститут хірургії та трансплантології ім. О.О. Шалімова» НАМН України, м. Київ, Україна
Рубрики: Нефрология
Разделы: Клинические исследования
Резюме
Актуальність. Однією з основних причин втрат ниркових алотрансплантатів (НАТ) у віддалені строки після трансплантації є прогресуюча хронічна дисфункція ниркового алотрансплантата (ХДНА), причиною розвитку якої в 20–60 % випадків є хронічне відторгнення (ХВ). Діагностика причин дисфункції трансплантата базується на морфологічному дослідженні, яке через інвазивність має ряд недоліків. Тому великий інтерес являє пошук неінвазивних методів діагностики стану НАТ, зокрема, дослідження клітинної ланки імунної відповіді. Мета. Дослідження відносної кількості субпопуляцій лімфоцитів периферичної крові та їх співвідношення в реципієнтів у віддаленому періоді після трансплантації нирки, оцінювання інформативності цих показників для діагностики ХВ НАТ. Матеріали та методи. Досліджено рівні субпопуляцій лімфоцитів (Т-клітини, Т-хелпери, Т-цитотоксичні, Т-активовані, T-NK-клітини, В-клітини, NK-клітини) у 43 реципієнтів НАТ залежно від перебігу віддаленого післяопераційного періоду та стану алотрансплантата через 1–9 років після алотрансплантації нирки, які були розподілені згідно з морфологічною верифікацією діагнозу на дві групи. Група 1 — 23 хворі із задовільною функцією НАТ без ознак відторгнення; група 2 — 20 хворих із ХДНА, обумовленою хронічною реакцією відторгнення (ХРВ) за даними пункційної біопсії. До контрольної групи увійшли 23 здорові донори, чиї показники становили референтний коридор. Результати. Дані аналізу показали підвищення середніх рівнів Т-активованих лімфоцитів у групах 1 та 2 щодо контрольної (8,9 ± 2,0; 8,4 ± 2,4; 6,8 ± 2,1 відповідно). Також виявлено зниження середніх показників рівнів T-NK-клітин (2,4 ± 2,0) та В-клітин (9,6 ± 2,0) у групі 2 щодо показників групи 1 (5,6 ± 1,8 та 12,4 ± 2,4 відповідно). Аналіз індексів співвідношення між окремими субпопуляційними одиницями лімфоцитів показав статистично вірогідну значущість різниці між індексом Т-клітини/T-NK-клітини (22,53 vs 46,89 в групах 1 та 2 відповідно; p < 0,05) та індексом Т-активовані/В-клітини (1,14 vs 4,17 в групах 1 та 2 відповідно; p < 0,05). При цьому чутливість індексу Т-клітини/T-NK-клітини становила 70 %, специфічність — 60 %. Чутливість індексу Т-активовані/В-клітини дорівнювала 55 %, специфічність — 50 %. Висновки. Зниження рівня T-NK-клітин ближче до нижнього порогового значення референтного коридора і, відповідно, співвідношення Т-клітини/T-NK-клітини в межах 44,49–49,29 (46,89 ± 2,40) у віддаленому післятрансплантаційному періоді може бути додатковою ознакою ХРВ як причини прогресуючої дисфункції НАТ.
Актуальность. Одной из основных причин потерь почечных аллотрансплантатов (ПАТ) в отдаленные сроки после трансплантации является прогрессирующая хроническая дисфункция почечного аллотрансплантата (ХДПА), причиной развития которой в 20–60 % случаев является хроническое отторжение (ХО). Диагностика причин дисфункции трансплантата базируется на морфологическом исследовании, который вследствие инвазивности имеет ряд недостатков. Поэтому большой интерес представляет поиск неинвазивных методов диагностики состояния ПАТ, в частности, исследование клеточного звена иммунного ответа. Цель. Исследование относительного количества субпопуляций лимфоцитов периферической крови и их соотношения у реципиентов в отдаленном периоде после трансплантации почки, оценивание информативности этих показателей для диагностики ХО ПАТ. Материалы и методы. Исследованы уровни субпопуляций лимфоцитов (Т-клетки, Т-хелперы, Т-цитотоксические Т-активированы, T-NK-клетки, В-клетки, NK-клетки) у 43 реципиентов НАТ в зависимости от течения отдаленного послеоперационного периода и состояния аллотрансплантата через 1–9 лет после аллотрансплантации почки (АТП), которые были распределены согласно морфологической верификации диагноза на две группы. Группа 1 — 23 больных с удовлетворительной функцией ПАТ без признаков отторжения; группа 2 — 20 больных с ХДПА, обусловленной хронической реакцией отторжения (ХРО) по данным пункционной биопсии. Контрольную группу составили 23 здоровых донора, чьи показатели составили референтный коридор. Результаты. Данные анализа показали повышение средних уровней Т-активированных лимфоцитов в группах 1 и 2 относительно контрольной (8,9 ± 2,0; 8,4 ± 2,4; 6,8 ± 2,1 соответственно). Также выявлено снижение средних показателей уровней T-NK-клеток (2,4 ± 2,0) и В-клеток (9,6 ± 2,0) в группе 2 относительно показателей группы 1 (5,6 ± 1,8 и 12,4 ± 2,4 соответственно). Анализ индексов соотношения между отдельными субпопуляционными единицами лимфоцитов показал статистически достоверную значимость разницы между индексом Т-клетки/T-NK-клетки (22,53 vs 46,89 в группах 1 и 2 соответственно; p < 0,05) и индексом Т-активированные/В-клетки (1,14 vs 4,17 в группах 1 и 2 соответственно; p < 0,05). Чувствительность индекса Т-клетки/T-NK-клетки составила 70 %, специфичность — 60 %. Чувствительность индекса Т-активированные/В-клетки составила 55 %, специфичность — 50 %. Выводы. Снижение уровня T-NK-клеток ближе к нижнему пороговому значению референтного коридора и, соответственно, соотношение Т-клетки/T-NK-клетки в пределах 44,49–49,29 (46,89 ± 2,40) в отдаленном послетрансплантационном периоде может быть дополнительным признаком ХРО как причины прогрессирующей дисфункции ПАТ.
Background. One of the main causes of renal allografts (RA) failure in the long-term period after transplantation is progressive chronic allograft dysfunction (CAD), the cause of which in 20 to 60 % of cases is chronic rejection (CR). Diagnosis of the causes of graft dysfunction is based on a morphological study, which has several disadvantages through invasiveness. Therefore, of great interest is the search for non-invasive methods for diagnosing the state of RA, in particular, the study of the cellular link of the immune response. To this end, we decided to investigate the relative number of subpopulations of peripheral blood lymphocytes and their ratio in recipients in the long-term period after kidney transplantation and to assess the informative value of these parameters for the diagnosis of CR RA. Materials and methods. The levels of lymphocyte subpopulations (T-cells, T-helpers, T-cytotoxic, T-activated, T-NK-cells, B-cells, NK-cells) were studied in 43 RA recipients depending on the course of the long-term postoperative period and allograft state 1–9 years after transplantation, who were divided into two groups depending on the morphological verification of the diagnosis. Group 1 — 23 patients with satisfactory RA function without signs of rejection; group 2 — 20 patients with CAD caused by a CR according to a puncture biopsy. The control group consisted of 23 healthy donors, whose parameters made up the reference corridor. Results. The analysis showed an increase in the average levels of T-activated lymphocytes in the groups 1 and 2 relative to the control one (8.9 ± 2.0, 8.4 ± 2.4, 6.8 ± 2.1, respectively). There was also a decrease in the mean levels of T-NK cells (2.4 ± 2.0) and B-cells (9.6 ± 2.0) in group 2 as compared to indicators of group 1 (5.6 ± 1.8 and 12.4 ± 2.4, respectively). Analysis of the correlation between specific subpopulation units of lymphocytes showed a statistically significant difference between the T-cell/T-NK-cell index (22.53 vs. 46.89 in the groups 1 and 2, respectively, p < 0.05) and the index of T-activated/β-cell (1.14 vs 4.17 in the groups 1 and 2, respectively, p < 0.05). The sensitivity of the T-cell/T-NK-cell index was 70 %, and the specificity — 60 %. The sensitivity of the T-activated/B-cell index was 55 %, the specificity — 50 %. Conclusions. The decrease in the level of T-NK-cells closer to the lower threshold value of the reference corridor and, accordingly, the ratio of T-cells/T-NK-cells within 44.49–49.29 (46.89 ± 2.40) in the long-term post-transplant period can be an additional sign of a chronic rejection reaction as a cause of progressive renal allograft dysfunction.
Ключевые слова
нирковий алотрансплантат; субпопуляції лімфоцитів; хронічна реакція відторгнення
почечный аллотрансплантат; субпопуляции лимфоцитов; хроническая реакция отторжения
renal allograft; lymphocyte subpopulations; chronic rejection
Вступ
У наш час операція алотрансплантації нирки (АТН) стала методом вибору в лікуванні хворих на термінальну ниркову недостатність. Сучасні схеми імуносупресивної терапії дозволяють досягти високого рівня річного виживання ниркових алотрансплантатів (НАТ). Проте протягом років після операції відбувається кумулятивне ушкодження алотрансплантата внаслідок імунних і неімунних механізмів, що призводить до порушення його функції.
Основними причинами втрат НАТ у віддалені строки після трансплантації є смерть реципієнта з функціонуючим трансплантатом і прогресуюча хронічна дисфункція ниркового алотрансплантата (ХДНА) з виходом у термінальну хронічну ниркову недостатність. Остання є наслідком широкого спектра патологічних процесів, різних за своєю природою, що потребують різних, під час протилежних підходів до лікування [1–5]. Серед таких патологій найбільш поширеними є хронічне відторгнення, асоційована з нефротоксичністю інгібіторів кальциневрину нефропатія, рекурентний та de novo гломерулонефрит трансплантата, вірусні та бактеріальні запальні процеси, викликаний неспецифічними неімунними факторами нефросклероз [6, 8–11]. Варто зауважити, що серед усієї кількості причин розвитку ХДНА хронічне відторгнення становить 20–60 % [9–12].
Реакція відторгнення трансплантата відбувається за участі Т-лімфоцитів, специфічних до антигенів донора, — лімфоцитів CD8 та CD4, які беруть участь в алергічних реакціях уповільненого типу. Однак при дослідженні біоптатів НАТ в інфільтраті виявляють також велику кількість В-лімфоцитів, плазматичних клітин, NK-лімфоцитів та ін. [13–15].
Переважний механізм імунної відповіді (клітинний або гуморальний) і ступінь ушкодження транс–плантата визначаються генетичними відмінностями донора та реципієнта, а також сенсибілізацією.
Деякі автори оцінюють активність відторгнення трансплантата за динамікою вмісту Т-хелперів і Т-супресорів (або Т-цитотоксичних лімфоцитів) у крові. В реакції відторгнення відіграють роль і медіатори клітинного імунітету — цитокіни. Зокрема, інтерлейкін-2 (ІЛ-2) (головний фактор росту Т-лімфоцитів, що стимулює проліферацію цитотоксичних Т-лімфоцитів) виробляється основним типом Т-хелперів — Th1, а тип Th2 виробляє фактори росту В-лімфоцитів (ІЛ-4) [14–16].
Точна діагностика причин дисфункції транс–плантата дозволяє своєчасно вжити відповідних заходів і таким чином подовжити строк його функціонування.
Золотим стандартом діагностики стану НАТ як у ранньому, так і у віддаленому післятрансплантаційному періоді є морфологічне дослідження — прижиттєва пункційна біопсія трансплантата. Однак цей метод має й свої недоліки, а саме небезпеку кровотечі, формування внутрішньониркових артеріовенозних шунтів та інші. Тому неабиякий інтерес являє пошук інших, неінвазивних, методів діагностики стану НАТ [17–19].
З огляду на вищезазначене, цікавим уявляється дослідження клітинної ланки імунної відповіді в реципієнтів НАТ у віддаленому післяопераційному періоді, зокрема, показників рівнів субпопуляцій лімфоцитів периферичної крові.
Мета дослідження — визначення рівнів субпопуляцій лімфоцитів периферичної крові та їх співвідношення у реципієнтів НАТ при хронічному відторгненні трансплантата та можливість застосування цих показників для неінвазивної діагностики даної патології у віддаленому післяопераційному періоді.
Матеріали та методи
У 43 реципієнтів із НАТ, що функціонували понад рік, досліджували рівні субпопуляцій лімфоцитів (Т-клітини (CD3+, CD19–), Т-хелпери (CD3+, CD4+), Т-цитотоксичні (CD3+, CD8+), Т-активовані (CD3+, HLA-DR+), T-NK клітини (CD3+, CD16+/56+), В-клітини (CD3–, CD19+, HLA-DR+), NK-клітини (CD3–, CD16+/56+). Діагностика стану НАТ проводилась на підставі даних клініко-лабораторних та інструментальних методів дослідження, результатів пункційної біопсії.
Рівень субпопуляцій лімфоцитів визначався в сироватках крові на проточному цитофлуориметрі Beckman Coulter: Cytomics FC 500 (США).
Досліджено особливості клітинної ланки імунітету залежно від перебігу віддаленого післяопераційного періоду та стану алотрансплантата у 43 реципієнтів НАТ через 1–9 років після АТН, які були розподілені згідно з морфологічною верифікацією діагнозу на дві групи. У групу 1 увійшли 23 хворі із задовільною функцією НАТ без ознак відторгнення; у групу 2 — 20 хворих із ХДНА, обумовленою хронічною реакцією відторгнення (ХРВ) за даними пункційної біопсії. Контрольну групу становили 23 здорові донори, чиї показники становили референтний коридор. У кожній з груп досліджено відносні рівні субпопуляцій лімфоцитів периферичної крові, виведено їх середні показники, розраховано індекси співвідношення між окремими субпопуляційними одиницями. Проведено статистичну обробку отриманих даних за допомогою програмного продукту Statistica 10.
Результати та обговорення
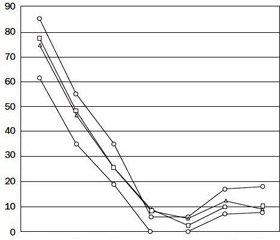
Аналіз показників рівнів субпопуляцій лімфоцитів периферичної крові у реципієнтів НАТ у групах 1 та 2 показав, що всі середні значення рівнів субпопуляційних одиниць не відрізнялися від контрольної, окрім рівнів Т-активованих (CD3+, HLA-DR+) лімфоцитів, які були вірогідно вище в обох групах. Також виявлено зниження середніх показників рівнів T-NK-клітин (CD3+, CD 16+/56+) та В-клітин (CD3–, CD19+, HLA-DR+) в групі 2 щодо показників групи 1. Дані наведені в табл. 1 і на рис. 1.
/42-1.jpg)
/42-2.jpg)
Природні кілерні Т-клітини становлять мінорну субпопуляцію лімфоцитів, що експресують одночасно і маркери Т-лімфоцитів, зокрема молекулу CD3, і антигени природних кілерів, такі як CD16 і CD56. У літературі їх позначають абревіатурою NK-T (natural killer T-cell). У людей NK-T-клітини становлять 0–6 % популяції лімфоцитів крові. Незважаючи на малу кількість, ці клітини виконують важливі імунорегуляторні функції, тому зниження їх рівня може мати суттєві клінічні наслідки, призводячи до розвитку інфекційних, автоімунних, алергічних, імунозапальних і онкологічних уражень. Разом із природними кілерами і так званими природженими лімфоїдними клітинами NK-T-лімфоцити зараховують до лімфоцитарного компартменту природженого імунітету людини, хоча при детальнішому аналізі видається очевидним, що ці клітини займають проміжне положення між системами природженого й адаптивного захисту. NK-T-клітини мають деяку подібність до природних кілерів, однак відрізняються від останніх за способом розпізнавання антигенів і виконанням переважно імунорегуляторних, а не цитотоксичних функцій [20–23].
NK-T-клітини експресують інваріантний α/β Т-клітинний антигенрозпізнавальний рецептор (αβіTCR), що ідентифікує фрагменти патогенів у комплексі з некласичними антигенами гістосумісності, зокрема молекулою CD1d [24].
Ці лімфоцити можуть синтезувати і секретувати цитокіни як Th1-, так і Th2-профілю [24], завдяки чому виконують важливі регуляторні функції, зазвичай обмежуючи інтенсивність запалення та імунної відповіді для уникнення гіперергічних реакцій. A. Goubier і співавт. [25] виявили, що природні кілерні Т-клітини здатні інгібувати розвиток контактного алергічного дерматиту навіть без участі регуляторних Т-лімфоцитів, що експресують молекулу Foxp3, а дефіцит цих клітин призводить до посилення алергічного запалення у шкірі. Як встановили J.Q. Yang і співавт. [26], NK-T-клітини здатні супресувати продукцію антитіл автореактивними В-лімфоцитами через контактний і CD1d-залежний шляхи, водночас посилюючи загальну продукцію IgG та експресію активаційних маркерів на В-клітинах.
Клінічна картина зниження рівня NK-T-клітин безпосередньо визначається функціями, що виконують ці лімфоцити в організмі людини. У цих пацієнтів розвиваються автоімунні, алергічні, імунозапальні ускладнення та синдром пухлинного росту [27].
Аналіз індексів співвідношення між окремими субпопуляційними одиницями лімфоцитів показав статистично вірогідну значущість різниці між індексом Т-клітини/T-NK-клітини (22,53 vs 46,89 в групах 1 та 2 відповідно; p < 0,05) та індексом Т-активовані/В-клітини (1,14 vs 4,17 групах в 1 та 2 відповідно; p < 0,05). При цьому чутливість індексу Т-клітини/T-NK-клітини становила 70 %, специфічність — 60 %. Чутливість індексу Т-активовані/В-клітини дорівнювала 55 %, специфічність — 50 %. Дані наведені в табл. 2 та на рис. 2.
Аналіз показав, що індекс співвідношення між рівнем Т-клітин (CD3+, CD19–) та T-NK-клітин (CD3+, CD16+/56+) є більш презентативним для уявлення про перебіг пізнього післятрансплантаційного періоду та може бути застосованим для неінвазивної діагностики хронічної реакції відторгнення НАТ.
Висновки
Отримані дані дозволяють вважати, що визначення рівня субпопуляційних одиниць лімфоцитів: Т-клітин (CD3+, CD19–) і T-NK-клітин (CD3+, CD16+/56+) та їх співвідношення є інформативним для оцінки стану НАТ у віддаленому післятрансплантаційному періоді.
Зниження рівня T-NK-клітин (CD3+, CD16+/56+) ближче до нижнього порогового значення референтного коридору і, відповідно, співвідношення Т-клітини/T-NK-клітини в межах 44,49–49,29 (46,89 ± 2,40) у віддаленому післятрансплантаційному періоді може бути додатковою ознакою хронічної реакції відторгнення як причини прогресуючої дисфункції НАТ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Рецензенти: академік НАМН України, член-кор. НАН України проф. О.С. Никоненко, проф. В.Є. Дріянська.
Список литературы
1. Horvath P, Capobianco I, Rolinger J, Königsrainer A, Nadalin S, Königsrainer I. Kidney graft salvage strategies for vascular complications during kidney transplantation: a single-center experience. Transplant Proc. 2017;49(6):1331-1335. doi: 10.1016/j.transproceed.2017.02.057.
2. Delgado JF, Serrano M, Morán L, et al. Early mortality after heart transplantation related to IgA anti-β2-glycoprotein I antibodies. Heart Lung Transplant. 2017;pii: S1053-2498(17)31797-7. doi: 10.1016/j.healun.2017.05.016.
3. Mohan M, Buros A, Mathur P, et al. Clinical characteristics and prognostic factors in multiple myeloma patients with light chain deposition disease. Am J Hematol. 2017;92(8):739-745. doi: 10.1002/ajh.24756.
4. Kır O, Zeytinoğlu A, Arda B, Yılmaz M, Aşçı G, Töz H. Impact of prophylaxis vs pre-emptive approach for cytomegalovirus infection in kidney transplant recipients. Transplant Proc. 2017;49(3):537-540. doi: 10.1016/j.transproceed.2017.01.027.
5. Almardini RI, Salita GM, Farah MQ, Katatbeh IA, Al-Rabadi K. Renal impairment and complication after kidney transplant at Queen Rania Abdulla children's hospital. Exp Clin Transplant. 2017;15(Suppl 1):99-103. doi: 10.6002/ect.mesot2016.O95.
6. Chinnakotla S, Verghese P, Chavers B, et al. Outcomes and risk factors for graft loss: lessons learned from 1,056 pediatric kidney transplants at the University of Minnesota. J Am Coll Surg. 2017;224(4):473-486. doi: 10.1016/j.jamcollsurg.2016.12.027.
7. Ayar Y, Ersoy A, Ocakoglu G, et al. Risk factors affecting graft and patient survivals after transplantation from deceased donors in a developing country: a single-center experience. Transplant Proc. 2017;49(2):270-277. doi: 10.1016/j.transproceed.2016.12.009.
8. de Castro Rodrigues Ferreira F, Cristelli MP, Paula MI, et al. Infectious complications as the leading cause of death after kidney transplantation: analysis of more than 10,000 transplants from a single center. J Nephrol. 2017;30(4):601-606. doi: 10.1007/s40620-017-0379-9.
9. Patel MH, Patel RD, Vanikar AV, et al. Invasive fungal infections in renal transplant patients: a single center study. Ren Fail. 2017;39(1):294-298. doi: 10.1080/0886022X.
2016.1268537.
10. Kamel M, Kadian M, Srinivas T, Taber D, Posadas Salas MA. Tacrolimus confers lower acute rejection rates and better renal allograft survival compared to cyclosporine. World J Transplant. 2016;6(4):697-702. doi: 10.5500/wjt.v6.i4.697.
11. Brakemeier S, Dürr M, Bachmann F, Schmidt D, Gaedeke J, Budde K. Risk evaluation and outcome of pneumocystis jirovecii pneumonia in kidney transplant patients. Transplant Proc. 2016;48(9):2924-2930. doi: 10.1016/j.transproceed.2016.05.017.
12. Ban TH, Yu JH, Chung BH, et al. Clinical outcome of rituximab and intravenous immunoglobulin combination therapy in kidney transplant recipients with chronic active antibody-mediated rejection. Ann Transplant. 2017;22:468-474. PMID: 28775248.
13. Abu Jawdeh BG, Govil A. Acute kidney injury in transplant setting: differential diagnosis and impact on health and health care. Adv Chronic Kidney Dis. 2017;24(4):228-232. doi: 10.1053/j.ackd.2017.05.005.
14. Yan Q, Luo H, Wang B, et al. Correlation between PKB/Akt, GSK-3β expression and tubular epithelial-mesenchymal transition in renal allografts with chronic active antibody-mediated rejection. Exp Ther Med. 2017;13(5):2217-2224. doi: 10.3892/etm.2017.4261.
15. Garces JC, Giusti S, Staffeld-Coit C, Bohorquez H1, Cohen AJ, Loss GE. Antibody-mediated rejection: a review. Ochsner J. 2017 Spring;17(1):46-55. PMID: 28331448.
16. Winterberg PD, Ford ML. The effect of chronic kidney disease on T cell alloimmunity. Curr Opin Organ Transplant. 2017;22(1):22-28. doi: 10.1097/MOT.0000000000000375.
17. Park ES, Ahn SS, Jung SM, Song JJ, Park YB, Lee SW. Renal outcome after kidney transplantation in Korean patients with lupus nephritis. Lupus. 2017:961203317725591. doi: 10.1177/0961203317725591.
18. Parajuli S, Reville PK, Ellis TM, Djamali A, Mandelbrot DA. Utility of protocol kidney biopsies for de novo donor specific antibodies. Am J Transplant. 2017;00:1-9. doi: 10.1111/ajt.14466.
19. Angeletti A, Cravedi P. Looking into the graft without a biopsy: biomarkers of acute rejection in renal transplantation. Contrib Nephrol. 2017;190:181-193. doi: 10.1159/000468967.
20. Ghinnagow R, Cruz LJ, Macho-Fernandez E, Faveeuw C, Trottein F. Enhancement of adjuvant functions of natural killer T cells using nanovector delivery systems: application in anticancer immune therapy. Front Immunol. 2017;8:879. doi: 10.3389/fimmu.2017.00879.
21. Duvall MG, Barnig C, Cernadas M, et al. Natural killer cell-mediated inflammation resolution is disabled in severe asthma. Sci Immunol. 2017;2(9). pii: eaam5446. doi: 10.1126/sciimmunol.aam5446.
22. Ribatti D. Historical overview on the morphological characterization of large granular lymphocytes/natural killer cells. Immunol Lett. 2017;190:58-63. doi: 10.1016/j.imlet.2017.07.014.
23. Klatka J, Grywalska E, Hymos A, et al. Cyclooxygenase-2 inhibition enhances proliferation of NKT cells derived from patients with laryngeal cancer. Anticancer Res. 2017;37(8):4059-4066. doi: 10.21873/anticanres.11791.
24. Batista VG, Moreira-Teixeira L, Leite-de-Moraes MC, Benard G. Analysis of invariant natural killer T cells in human paracoccidioidomycosis. Mycopathologia. 2011;172(5):357-63. doi: 10.1007/s11046-011-9451-5.
25. Goubier A, Vocanson M, Macari C, et al. Invariant NKT cells suppress CD8(+) T-cell-mediated allergic contact dermatitis independently of regulatory CD4(+) T cells. J Invest Dermatol. 2013;133(4):980-7. doi: 10.1038/jid.2012.404.
26. Zhang G, Nie H, Yang J, et al. Sulfatide-activated type II NKT cells prevent allergic airway inflammation by inhibiting type I NKT cell function in a mouse model of asthma. Am J Physiol Lung Cell Mol Physiol. 2011;301(6):L975-84. doi: 10.1152/ajplung.00114.2011.
27. Berzins SP, Smyth MJ, Baxter AG. Presumed guilty: natural killer T cell defects and human disease. Nat Rev Immunol. 2011;11(2):131-42. doi: 10.1038/nri2904.

/42-1.jpg)
/42-2.jpg)
/43-1.jpg)
/43-2.jpg)