Резюме
Актуальність. Проведення мікробіологічних досліджень стомованих ділянок кишки є актуальним для підбору адекватних методів профілактики гнійно-септичних ускладнень при проведенні реконструктивно-відновних операцій на тонкій і товстій кишці. Мета: дослідити синдром мальабсорбції та дати характеристику мікрофлори шлунково-кишкового тракту стомованих хворих. Матеріали та методи. Проведено мікробіологічне дослідження та аналіз копрограм 29 стомованих хворих. За рівнем (локалізації) стоми хворі поділені на 3 групи: I група — 7 хворих з ілеостомами при запальних захворюваннях кишечника (неспецифічний виразковий коліт, хвороба Крона); II група — 9 хворих з асцендоколостомою (двоє з цекостомою, у 7 — на рівні печінкового кута товстої кишки); III група — 13 хворих з десцендоколостомою. Хворі II та III груп оперовані з приводу обструктивного раку з гострою кишковою непрохідністю. Результати. Встановлено, що у хворих з ілеоколостомою рН калу перевищував 5,5 тільки в одного хворого, клітковина, крохмаль, нейтральний жир та жирні кислоти, м’язові волокна, слиз, лейкоцити спостерігались у кількості, значно вищій, ніж у хворих з колостомами. М’язові волокна виявляли у 72 % пацієнтів, жир — у 52 %, крохмаль — у 72 %. У пацієнтів з десцендоколостомою: м’язові волокна знайшли тільки у 20 %, жир і жирні кислоти — у 20 %, крохмаль — тільки у 34,5 % пацієнтів. У всіх стомованих хворих діагностовано анаеробний дисбаланс за рахунок підвищення клостридій та умовно-патогенної мікрофлори. Висновки. Встановлено, що стомованим хворим притаманний синдром мальабсорбції, найбільше виражений при ілеостомії, найменше виражений — при десцендоколостомії.
Актуальность. Проведение микробиологических исследований стомированных участков кишки является актуальным для подбора адекватных методов профилактики гнойно-септических осложнений при проведении реконструктивно-восстановительных операций на тонкой и толстой кишке. Цель: исследовать синдром мальабсорбции и дать характеристику микрофлоры желудочно-кишечного тракта стомированных больных. Материалы и методы. Проведено микробиологическое исследование и анализ копрограммы 29 стомированных больных. По уровню (локализации) стомы больные разделены на 3 группы: I группа — 7 больных с илеостомой при воспалительных заболеваниях кишечника (неспецифический язвенный колит, болезнь Крона); II группа — 9 больных с асцендоколостомой (двое с цекостомой, у 7 — на уровне печеночного угла толстой кишки); III группа — 13 больных с десцендоколостомой. Больные II и III групп прооперированы по поводу обструктивного рака с острой кишечной непроходимостью. Результаты. Установлено, что у больных с илеоколостомой рН кала превышал 5,5 только у одного больного, клетчатка, крахмал, нейтральный жир и жирные кислоты, мышечные волокна, слизь, лейкоциты наблюдались в количестве значительно большем, чем у больных с колостомой. Мышечные волокна выявляли у 72 % пациентов, жир — у 52 %, крахмал — у 72 %. У пациентов с десцендоколостомой: мышечные волокна нашли только у 20 %, жир и жирные кислоты — у 20 %, крахмал — только у 34,5 % пациентов. У всех стомированных больных диагностирован анаэробный дисбаланс за счет повышения клостридий и условно-патогенной микрофлоры. Выводы. Установлено, что стомированным больным присущ синдром мальабсорбции, наиболее выраженный при илеостомии, наименее выраженный — при десцендоколостомии.
Background. Microbiological studies of ostomy gut areas are relevant for the selection of adequate methods for the prevention of purulent-septic complications during reconstructive surgeries on the small and large intestine. Our purpose was to investigate the malabsorption syndrome and to give a description of the microflora of the gastrointestinal tract of the patients with stoma. Materials and methods. Microbiological research and analysis of coprograms were performed in 29 patients with stoma. According to the level (localization) of stoma the patients are divided into 3 groups: group I — 7 patients with ileostomy in inflammatory bowel diseases (ulcerative colitis, Crohn’s disease); group II — 9 individuals with ascending colostomy (two with cecostomy, in 7 — at the hepatic level of the colon); group III — 13 patients with descending colostomy. Patients in groups II and III underwent surgeries for obstructive cancer with acute intestinal obstruction. Results. It was found that in patients with ileocolostomy, pH of feces exceeded 5.5 only in one case; fiber, starch, neutral fat and fatty acids, muscle fibers, mucus, leukocytes were observed in a much higher number than in patients with colostomy. Muscle fibers were detected in 72 % of patients, fat — in 52 %, starch — in 72 %. In patients with descending colostomy: muscle fibers were found only in 20 % of cases, fat and fatty acids — in 20 %, starch — only in 34.5 % of patients. Anaerobic imbalance was diagnosed in all patients with stoma due to increased level of clostridia and opportunistic microflora. Conclusions. Patients with stoma have malabsorption syndrome that is most pronounced in ileostomy, the least pronounced in descending colostomy.
Вступ
Життєдіяльність людини неможлива без нормального функціонування єдиного екологічного комплексу макро- й мікроорганізму. Патологія шлунково-кишкового тракту (ШКТ) продовжує посідати одне з провідних місць у структурі захворюваності в людей і не має тенденції до зниження. Немає особливої необхідності зупинятися на негативних сторонах життя колостомованих хворих. Наявність протиприродного ануса призводить до стійкої трудової й соціальної інвалідизації, а часом і моральної деградації пацієнта [3]. Постійне й нерегульоване відходження кишкового вмісту, складності догляду за стомою та деякі інші обставини повністю виключають хворих із суспільного, а іноді й сімейного життя [6]. У зв’язку з цим набуває актуальності проведення мікробіологічних досліджень стомованих ділянок тонкої та товстої кишки для підбору адекватних методів профілактики гнійно-септичних ускладнень при проведенні реконструктивно-відновних операцій.
Мета дослідження: дослідити синдром мальабсорбції та дати характеристику мікрофлори шлунково-кишкового тракту стомованих хворих.
Матеріали та методи
Нами проведено мікробіологічне дослідження та аналіз копрограм 29 стомованих хворих, серед яких жінок — 12, чоловіків — 17, віком від 23 до 69 років. Згідно з рівнем колостоми хворі поділені на 3 групи: I група — 7 хворих з ілеостомами (четверо хворих оперовані з приводу ускладненого перебігу неспецифічного виразкового коліту (НВК), троє — з приводу хвороби Крона (ХК); II група — 9 хворих із колостомами, оперовані з приводу обструктивного раку, і їм накладена асцендоколостома (двоє з цекостомами, у 7 — в ділянці печінкового кута); III група — 13 хворих із десцендоколостомою, оперовані з приводу обструктивного раку на фоні кишкової непрохідності. Також нами проведено мікробіологічне дослідження флори товстого кишечника у 20 осіб контрольної групи, 10 жінок та 10 чоловіків, без патології ШКТ. Вік хворих у контрольній групі — від 20 до 60 років.
Усі дослідження проводились згідно з чинними в Україні нормативними матеріалами (накази, методичні вказівки та рекомендації). Матеріал (випорожнення) забирали стерильним тампоном із транспортним середовищем від стомованих хворих, які перебували на лікуванні, у контейнер і доставляли в мікробіологічну лабораторію протягом 1–2 годин для дослідження мікробіоценозу.
Ідентифікацію виділених штамів ентеробактерій проводили на основі їх біонічної активності за допомогою СІП І і СІП ІІ, ЕНТЕРО-тесту 1 і 2 (Lachema, м. Брно, Чехія). Вид мікроорганізму визначали на основі отриманих біохімічних властивостей згідно з визначником Берджі.
Результати та обговорення
Аналіз фекалій передбачав мікроскопію, хімічне й бактеріологічне дослідження. При вивченні копрограм після різних способів створення єюноколостомій основну увагу звертали на вміст м’язових волокон у фекаліях, нейтрального жиру та жирних кислот, внутрішньо- та позаклітинного крохмалю. На підставі результатів цих досліджень виділено такі копрологічні синдроми. Синдром недостатності перетравлення в тонкій кишці: рідкі жовті фекалії лужної реакції, велика кількість м’язових волокон, нейтрального жиру і йодофільної мікрофлори, значна кількість жирних кислот, дуже високий вміст крохмалю та клітковини (у 4 пацієнтів). Синдром прискореної евакуації з тонкої кишки: рідкі жовті або світло-коричневі фекалії слабо-лужної реакції, значна кількість м’язових волокон, жирних кислот, сполучної тканини, дуже багато нейтрального жиру, крохмалю (у 3 пацієнтів).
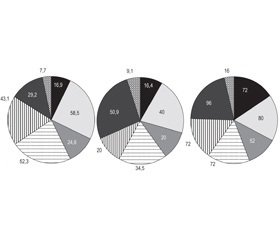
При цьому встановлено, що у хворих, яким виконана ілеостомія, рН калу перевищував 5,5 тільки в одного хворого, клітковина, крохмаль, нейтральний жир та жирні кислоти, м’язові волокна, слиз, лейкоцити спостерігались у кількості, значно вищій, ніж у хворих із колостомами. М’язові волокна виявляли в 72 % пацієнтів, жир — у 52 %, крохмаль — у 72 %. Найменш вираженим синдром мальабсорбції був у пацієнтів із десцендоколостомою: м’язові волокна знайшли тільки у 20 %, жир і жирні кислоти — у 20 %, крохмаль — тільки в 34,5 % пацієнтів (рис. 1).
/6-1.jpg)
Будь-яка операція на ШКТ із виведеннями стоми пов’язана з розвитком у подальшому тяжких патофізіологічних процесів, які реалізуються як порушення травлення й всмоктування їжі — синдром мальабсорбції. Експериментальні дослідження й клінічні спостереження свідчать про те, що найбільших змін зазнає абсорбція жирів. Виражену стеаторею спостерігають у більшості хворих у різні строки оперативного втручання. У перші місяці після операції зниження засвоювання жиру може сягати 60–70 % при нормальному рівні 90–95 %. У наступні роки засвоюваність жиру може покращуватись, однак, на думку більшості авторів, вона ніколи не відповідає нормі [1]. Головною причиною цього розладу є неадекватне змішування їжі із жовчю й панкреатичним соком у зв’язку з втратою моторно-евакуаторної функції ШКТ через зменшення довжини кишечника. При цьому зауважено, що при збільшенні кількості жирів у дієті збільшується їх кількість у калових масах [4]. Абсорбція білка порушується меншою мірою, ніж абсорбція жирів. Протягом перших декількох місяців спостерігається підвищення втрат азоту з калом, але позитивний азотистий баланс при цьому зберігається. До кінця року рівень засвоюваності білка нормалізується й у більш віддалені строки залишається нормальним. Абсорбція вуглеводів після стомування порушується незначною мірою. Але у зв’язку із зниженням абсорбції жиру, а ряді випадків — і білка пацієнти втрачають до 13 % калорій добової дієти [2].
При ілеостомії в ранньому післяопераційному періоді виникає проблема дисфункції стоми, особливо гостро — у хворих із запальними захворюваннями товстої кишки (НВК, ХК). У збірне поняття дисфункції стоми включаються як метаболічні порушення, зумовлені прискореним кишковим транзитом із відсутністю проходження по товстій кишці, дисбіотичні, так і параентеростомічні ускладнення.
Слід врахувати, що при виразковому коліті до 85 % пацієнтів мають порушення всмоктування, а при хворобі Крона ступінь порушень значно більший, і ці питання слід регулювати в післяопераційному періоді. Тому проблема зменшення та регуляції об’єму кишкових випорожнень і відновлення внутрішньокишкової флори у пацієнтів із запальними захворюваннями товстої кишки, що потребують виведення тонкої кишки на передню черевну стінку (ілеостома), у ранньому післяопераційному періоді є актуальною. Метаболічні порушення, що виникають в організмі через відсутність пасажу по товстій кишці, поглиблюють дисфункцію ілеостоми. Загальна кількість таких пацієнтів за останні роки значно зросла як в абсолютних величинах, так і стосовно молодих вікових груп (20–45 років). Цілком очевидно, що завдяки ранньому та досконалому обстеженню пацієнтів кількість оперативних втручань буде неухильно збільшуватись. Враховуючи тяжкий соматичний стан цих пацієнтів на момент госпіталізації в хірургічний стаціонар, задіяність життєво важливих органів та значний об’єм операційного лікування, хірургічні втручання, як правило, проводять у два етапи.
Перший етап (40–60 % пацієнтів), скерований на ліквідацію явищ кишкової непрохідності та зменшення інтоксикації організму, передбачає операційне втручання з формуванням ілеостоми, а другий — відновлення безперервності кишкової трубки. Період функціонування стоми залежить від тяжкості домінуючого захворювання й становить від 2 до 6 місяців. Велике значення має дослідження бактеріальної мікрофлори фекалій для виявлення дисбактеріозу, наявність якого сприяє розвитку ентериту й надалі підтримує його хронічний перебіг. У стомованих хворих виявлено зменшення числа біфідо- і лактобактерій, збільшено число гемолітичних і лактозонегативних ешерихій, патогенного стафілокока, протея, анаеробних клостридій. Відновлення нормальної бактеріальної флори в кишечнику є досить показовим критерієм успішного лікування. При ілеостомі з переважним ураженням тонкої кишки концентрація ентерокінази й лужної фосфатази (ферменти, що беруть участь у процесі всмоктування білка й жирних кислот) значно підвищується в усіх її відділах і фекаліях. Підвищення концентрації ферментів у тонкій кишці пояснюється компенсаторним збільшенням вироблення їх і посиленою десквамацією кишкового епітелію, що містить ці ферменти. Збільшення кількості ферментів у калі обумовлене посиленням моторики кишечника й порушенням процесів дезактивації ферментів у дистальних відділах кишечника внаслідок активації бактеріальної флори.
Отримані нами дані бактеріологічного дослідження виділень зі стом у хворих перед реконструктивно-відновними операціями порівняно зі здоровими людьми виявили значні зміни в кількісному складі мікрофлори товстого кишечника, які на тлі оперативного лікування можуть призвести до гнійно-септичних ускладнень у післяопераційний період. Це обґрунтовує необхідність розробки способів та проведення передопераційної підготовки з використанням місцевої та загальної антибіотикопрофілактики (табл. 1).
/7-1.jpg)
Практично в усіх пацієнтів діагностований анаеробний дисбаланс, переважно за рахунок підвищення кількості клостридій та умовно-патогенної мікрофлори. У пацієнтів із транзверзостомою та десцендостомою виявлено C.difficile та збільшена від норми кількість умовно-патогенних бактерій. Багатофакторний аналіз показав відсутність статистично значимої залежності виявлених змін у мікрофлорі від статі й віку пацієнтів, об’єму й способу оперативних втручань, наявності пухлинного стенозу та інфільтрату (р ≤ 0,05). Доведено, що гнильні й патогенні бактерії виробляють у кишечнику токсичні речовини: ешерихії, клебсієли й клостридії — аміак, аміни, нітрозаміни, феноли, крезоли, індол, вторинні жовчні кислоти, аглікони; протей — аміак, аміни, індол [1,4]. Продукти метаболізму патогенних бактерій чинять токсичну дію на організм людини. Так, аміак є гепато- і нейротоксичним; аміни, феноли, крезоли, інол, скатол, вторинні жовчні кислоти — канцерогенними. У нормі в здорової людини концентрація вказаних токсинів низька.
Значне порушення в мікробіоценозі кишечника, яке притаманне стомованим хворим, призводить до розвитку ендотоксимії, її токсичний вплив на печінку реалізується в розвитку стеатозу печінки та стеатогепатиту. Отже, це збільшує ризик розвитку стеатогепатиту у віддаленому періоді, що може позначатися на основі функції печінки й розвитку інших метаболічних порушень. Гіперендоксимія розвивається у хворих внаслідок порушення мікробіоценозу ШКТ, збільшує ризик розвитку захворювань панкреатодуоденальної зони та серцево-судинних змін [5].
Висновки
1. Синдром мальабсорбції найбільше виражений в хворих з ілеостомою. У копрограмах м’язові волокна виявляли в 72 %, жир — у 52 %, крохмаль — у 72 % проти 20, 20 та 34,5 % відповідно у хворих із десцендоколостомою.
2. Практично в усіх хворих діагностовано анаеробний дисбаланс за рахунок підвищення кількості клостридій та умовно-патогенної мікрофлори. У пацієнтів із трансверзоколостомами та десцендоколостомами виявлено C.difficile на фоні збільшення кількості умовно-патогенної мікрофлори.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Внесок авторів у підготовку статті
Русин В.І. — ідея, контроль процесу дослідження.
Коваль Г.М. — мікробіологічне дослідження.
Лозинський Ю.С. — статистичний аналіз.
Леошик О.В. — аналіз наукової літератури з тематики.
Павук Ф.М. — створення діаграм, дизайну статті, оформлення за вимогами редакції.

/6-1.jpg)
/7-1.jpg)