Вступ
Актуальність гіперчутливості до харчових продуктів загалом та харчової алергії (ХА) зокрема в дитячому віці незаперечна. Проте, незважаючи на тривале вивчення даної проблеми, досі залишаються невирішеними деякі питання. Проблемою є відсутність єдиного протоколу проведення провокаційної проби, високий ризик анафілактичних реакцій. Різняться дози, часові проміжки між ними, ступінь модифікації продукту (наприклад, варене чи сире яйце) [1]. Тому в більшості випадків, особливо у дітей дошкільного віку, частіше використовують більш традиційні альтернативні методики: шкірні прик- та патч-тести, визначення рівнів антитіл. Загальновідомо, що подвійна сліпа плацебо-конт–рольована провокаційна проба визнана золотим стандартом діагностики ХА та не залежить від типу алергічних реакцій, що беруть участь у запаленні (рівень рекомендацій ІV, D). Утім цей метод має низку обмежень, особливо у ранньому дитячому віці, через свою складність, небезпечність, витратність за часом і коштами [1, 2]. Позитивні результати проб та високі рівні імуноглобуліну Е (IgЕ) вказують на реагінові механізми розвитку сенситизацїї до харчових продуктів, але часто не корелюють із клінічними симптомами ХА. Не-IgE-опосередковані імунологічні реакції на їжу належать до тих, які складно виявити у рутинній практиці, і єдиний метод, що може бути використаний у цьому випадку, — це патч-тест [3, 4]. Суперечливість даних виникає через використання нестандартизованих і немолекулярних алергенів та ланцетів, вікові обмеження, фізіологічну варіабельність реактивності шкіри, нестабільність харчових алергенів навіть у свіжих продуктах при контакті з киснем повітря. Рекомендовані до практики як прик-тести з готовими алергенами, так і з самими продуктами (prick-to-prick). З іншого боку, наголошується на необхідності визначення клінічної значущості підвищених рівнів специфічних антитіл і позитивних результатів шкірних тестів, диференційної діагностики дійсно клінічно реактивних пацієнтів від просто сенситизованих [5, 11]. А також диференційної діагностики первинної специфічної гіперчутливості від перехресної реактивності до протеїну зі спільними епітопами, що допоможе уникнути непотрібної елімінаційної дієти та підвищити якість життя пацієнтів [6]. За даними літератури, традиційні методи алергологічного обстеження часто мають нерелевантні результати [7]. Саме тому актуальним лишається пошук найбільш простих та ефективних підходів до їх правильного використання, що мінімізує можливість хибного діагнозу [9]. Можливий ключ до цього знаходиться саме у правильному пов’язанні анамнестичних, клінічних і додаткових методів обстеження. Не менш важливим, на нашу думку, є врахування процесів природного формування оральної толерантності, що може впливати на вікові особливості діагностичних підходів, оскільки попередні результати вивчення специфічної алерговакцинації показали, що дитина може мати як транзиторну, так і тривалу десенситизацію [8].
Мета дослідження: виявити вікові особливості IgE-залежної гіперчутливості до харчових продуктів у дітей різного віку, підтвердженої методом прик- та патч-тестування.
Матеріали та методи
Із 2011 по 2016 рік у дослідження було включено 148 дітей віком від 1 місяця до 18 років зі шкірними проявами харчової гіперчутливості (ХГ). Пацієнтам було проведене шкірне алерготестування методом прик- та патч-тесту зі стандартизованими алергенами (ТОВ «Іммунолог», м. Вінниця), а також визначення загального IgE та специфічних антитіл до харчових алергенів (sIgE) у сироватці крові методом імуноферментного аналізу (ІФА). Обов’язковим для участі у дослідженні була письмова згода батьків і дитини, в разі якщо вона вміє читати та писати. Шкірне алерготестування проводили відповідно до загальноприйнятої методики. Техніка патч-тесту була такою: шкіру спини або передпліччя обробляли 70% спиртом. На її поверхню накладали квадратний відрізок марлі розміром 1 × 1 см з алергеном, зверху його закривали шматком латексного водонепроникного лейкопластиру розміром 2,5 × 2,5 см так, щоб марля не виходила за межі лейкопластиру. Одночасно проводили проби з тест-контрольною рідиною та чистим пластиром. Відстань між пробами була не менше 2,5 см. Читання результатів проводили якісним методом з урахуванням суб’єктивного відчуття дитини через 20 хвилин, 24, 48, 72, 96 годин. Усі пацієнти були попереджені про можливу наявність реакції протягом 7 діб, а в деяких випадках упродовж довшого терміну. Фіксуючий лейкопластир та алергени знімали зі шкіри через 2 доби. Оцінку проводили через 20 хв та 1 год після видалення пластиру, зникнення ознак подразнення та дермографізму. При виникненні аналогічної реакції в контролях (пластир із тест-контрольною рідиною та чистий пластир) реакцію на алергени позитивною не вважали. Прик-тест проводили лише у випадку позитивної реакції на гістамін і негативної — на рідину для розведення алергену. Кількість алергенів для тесту залежала від віку дітей, анамнестичних даних, а також результатів ІФА. Забір крові проводили з ліктьової вени у положенні сидячи за допомогою вакутайнерів у спеціальні охолоджені транспортні пробірки. Транспортування біозразків до лабораторії здійснювалося зі зберіганням холодового ланцюга +2…+8 °С. У зв’язку з тим, що норми кількісних значень загального IgE різняться з віком, у разі збільшення рівня загального IgE вище від референтних значень дитину вважали такою, що має фенотип підвищеного IgE.
Результати та обговорення
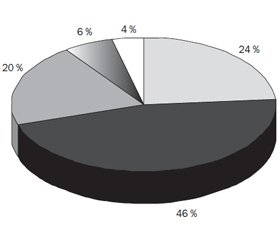
Як і очікувалось, основна кількість дітей була віком до 3 років (48 місяців), тобто 69,5 % (n = 103), що відповідає вітчизняним і світовим даним, згідно з якими основний вік дебюту цієї патології — ранній дитячий вік [4] (рис. 1).
Кількість хлопчиків і дівчаток була приблизно однаковою. Відповідно до дизайну дослідження, 100 % дітей мали рапортовану ХГ за даними анкетування. На першому етапі сім’ї проходили інтерв’ю-анкетування з метою виявлення особливостей перебігу клінічних проявів ХГ.
Шкірні алергологічні тести були проведені 128 дітям серед 148 обстежених, решті (13,5 %) проби не були показані за віком та/або ступенем тяжкості клінічних симптомів. Негативний результат шкірних прик- та/або патч-тестів був виявлений майже у половини пацієнтів, що може свідчити про можливі неімунні механізми клінічних проявів ХГ. При аналізі кількості співвідношення позитивних, негативних результатів шкірних проб залежно від віку виявлено, що найчастіше прик-тест був позитивним у дітей віком до 1 року (31,8 %; n = 7) та до 3 років (22 %; n = 13). Втім у цих вікових групах також частіше зустрічалися діти, яким тест не проводився через різні причини (рис. 2).
Структура сенсибілізації до основних харчових алергенів за даними шкірного тестування подана у табл. 1.
Згідно з табл. 1, серед дітей із позитивними результатами тестів переважала сенситизація до алергенів коров’ячого молока, що відповідає загальноприйнятим віковим особливостям превалентності гіперчутливості, оскільки більша частина дітей, які брали участь у дослідженні, відносилась до групи раннього дитячого віку. Значно менша кількість дітей, як і очікувалось, мала позитивні патч-тести.
Слід відзначити, що у двох дітей з усієї вибірки шкірне тестування було припинено після накладання аплікаційної проби з алергенами молока та яйця через різко позитивний результат із системними проявами у вигляді кропив’янки, яка з’явилася впродовж перших 30 хвилин. Після такої реакції подальше прик-тестування не проводилося.
Отже, серед дітей, у яких у 100 % випадків відповідно до дизайну дослідження було рапортовано клінічні прояви ХГ за самостійним зверненням та/або направленням лікаря, імунну ХГ негайного типу згідно з результатами прик-тестування було виявлено приблизно у кожного шостого пацієнта. Ще майже по 10 % дітей мали позитивні результати патч-тестів, що свідчило про харчову сенситизацію уповільненого типу. Дані особливості були когерентними та відповідали останнім даним літератури щодо розбіжностей між наявністю клініки та підтвердженням імунної природи ХА [4]. В свою чергу, це спонукало нас до подальшого пошуку механізмів розвитку наявних симптомів непереносимості продуктів харчування. Також ця проблема була дотична із прогнозуванням необхідності використання пероральної імунотерапії у дітей груп дослідження для формування оральної толерантності. Низька превалентість IgE-залежних механізмів вказує на необхідність пошуків інших підходів до контролю за захворюванням, оскільки даний вид лікування, за попередніми результатами, може бути призначений лише 1/6 пацієнтів.
З іншого боку, у зв’язку із суперечливими літературними даними стосовно клінічної значущості проведення шкірних проб дітям раннього віку результати прик- та патч-тестування нами розглядалися як такі, що можуть бути хибнопозитивними або хибнонегативними. Саме тому на наступному етапі у пацієнтів визначали рівні сироваткових загального та специфічних IgE для підтвердження наявності сенсибілізації за допомогою ІФА.
Серед 148 дітей, які проходили повний протокол, підвищений рівень загального IgE був виявлений майже у половини (49 %). При цьому важливо відзначити, що приблизно у 1/3 дітей (27 із 64; 42 %) із нормальними рівнями загального IgE специфічні IgE були підвищені (25 із 45; 55,5 %) (табл. 2).
Відповідно до табл. 2, підвищені рівні sIgE до харчових продуктів були виявлені лише у 50,5 % дітей загальної вибірки. Найбільш часто в обох групах виявляли антитіла (sIgE) до алергенів молока та яєць. У той же час sIgE до арахісу, персику, сої значно поступалися кількістю.
При оцінці клінічної значущості проведених лабораторних аналізів звернуло на себе увагу те, що лише приблизно у половини дітей (63 %) із підвищеними рівнями антитіл були виявлені позитивні результати шкірних тестів. Переважна більшість дітей мала полісенситизацію за результатами ІФА. Тільки 5 дітей мали підвищений рівень антитіл до одного харчового алергену (в усіх випадках — молоко). Дані результати перегукуються з поданими в літературі фактами, які свідчать про те, що наявність сенситизації до харчових продуктів, за даними серологічних аналізів, не може автоматично переноситися у рекомендації щодо харчування без аналізу її клінічної значущості [10].
Під час порівняння відсоткової кількості позитивних результатів шкірних проб та sIgE у різних вікових періодах було виявлено такі тенденції. Клінічна значущість специфічних антитіл зі збільшенням віку знижувалася, оскільки зменшувалась кількість позитивних алергологічних проб із харчовими алергенами. Найбільшу кількість не-IgE-залежних реакцій ХГ спостерігали у дошкільному періоді (4–6 років). Але починаючи з раннього шкільного віку, знову зростала частота як позитивних шкірних проб, так і позитивних результатів обстеження методом ІФА (рис. 3).
/12-2.jpg)
Отримані дані є наслідком існування кількості легких клінічних проявів ХГ на шкірі, що пов’язані з не-IgE-залежними механізмами, та з приводу яких пацієнти не звертаються до лікаря. Адже діти були відібрані за зверненням батьків з приводу проблеми, що вивчається. Оскільки загальновідомим є той факт, що з віком кількість клінічно значущих реакцій харчової гіперчутливості, яка пов’язана з білками коров’ячого молока та яєць, зменшується. Даний факт підкреслює необхідність проведення епідеміологічних досліджень істинної поширеності ХГ у загальній популяції дітей із використанням провокаційної проби.
Висновки
Найбільша кількість пацієнтів з імунною ХГ була виявлена у віковій групі до 3 років. Із віком кількість IgE-залежних реакцій, клінічна значущість яких підтверджується ШПТ і патч-тестом, знижується. Тому алгоритм діагностики та лікування ХГ у дітей до та старше 3 років повинен враховувати вікові особливості. Дослідження сироваткових рівнів специфічних антитіл у дітей шкільного віку без урахування результатів шкірних тестів майже в 2 рази збільшувало ймовірність гіпердіагностики, що вказувало на низьку клінічну значущість отриманих рівнів sIgE внаслідок природного формування оральної толерантності. Полісенситизація за результатами ІФА, що виявлялась у переважної більшості дітей, не підтверджувалась результатами шкірних алерготестів. Клінічна значущість специфічних антитіл зі збільшенням віку знижувалась, оскільки зменшувалася кількість позитивних алергологічних проб із харчовими алергенами. Діагностичний алгоритм для дітей дошкільного та шкільного віку повинен відрізнятись, оскільки має бути врахована можливість природного нівелювання специфічних антитіл.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Asero R. Double-blind, placebo-controlled food challenge in adults in everyday clinical practice: a reappraisal of their limitations and real indications [Text] / R. Asero, M. Fernandez-Rivas, A.C. Knulst, C.A. Bruijnzeel-Koomen // Curr. Opin. Allergy Clin. Immunol. — 2009. — Vol. 9(4). — P. 379-385.
2. Keefe W.O. Diagnosis and management of food allergies: new and emerging options: a systematic review [Text] / W.O. Keefe, A.S. DeSchryver, J. Mill, C. Mill, A. Dery, M. Ben-Shoshan // J. Asthma Allergy. — 2014. — Vol. 7. — P. 141-164.
3. Burks A.W. ICON: food allergy [Text] / A.W. Burks, M. Tang, S. Sicherers, A. Muraro, P.A. Eigenmann, M. Ebisawa [et al.] // J. Allergy Clin. Immunol. — 2012. — Vol. 129. — P. 906-920.
4. Muraro A. EAACI food allergy and anaphylaxis guidelines: diagnosis and management of food allergy [Text] / A. Muraro, T. Werfel, K. Hoffmann-Sommergruber [et al.] // Allergy. — 2014. — Vol. 69(8). — P. 1008-1025.
5. Sanz M.L. Microarray of allergenic component-based diagnosis in food allergy [Text] / M.L. Sanz, A.B. Blázquez, B.E. Garcia // Curr. Opin. Allergy Clin. Immunol. — 2011. — Vol. 11(3). — P. 204-209.
6. Caubet J.C. Beyond skin testing: state of the art and new horizons in food allergy diagnostic testing [Text] / J.C. Caubet, H.A. Sampson // Immunol. Allergy Clin. North Am. — 2012. — Vol. 32(1). — P. 97-109.
7. Kattan J.D. Optimizing the Diagnosis of Food allergy [Text] / J.D. Kattan, S.H. Sicherer // Immunology and allergy clinics of North America. — 2015. — Vol. 35(1). — P. 61-76.
8. Hsiao K.-C. Long-term clinical and immunological effects of probiotic and peanut oral immunotherapy after treatment cessation: 4-year follow-up of a randomised, double-blind, placebo-controlled trial [Text] / K.-C. Hsiao, A.-L. Ponsonby, C. Axelrad, S. Pitkin, M.L.K. Tang // The Lancet Child & Adolescent Health. — 2017. — Vol. 1(2). — P. 97-105.
9. Mullin G.E. Testing for food reactions: the good, the bad, and the ugly [Text] / G.E. Mullin, K.M. Swift, L. Lipski, L.K. Turnbull, S.D. Rampertab // Nutr. Clin. Pract. — 2010. — Vol. 25(2). — P. 192-8.
10. Lavine E. Blood testing for sensitivity, allergy or intolerance to food [Text] // CMAJ. — 2012. — № 3. — Vol. 184(6). — P. 666-668.
11. Chauveau A. Skin prick tests and specific IgE in 10-year-old children: Agreement and association with allergic diseases / A. Chauveau, M.-L. Dalphin, F. Mauny [et al.] // Allergy. — 2017. — Vol. 72. — P. 1365-1373.

/11-1.jpg)
/11-2.jpg)
/11-3.jpg)
/12-1.jpg)
/12-2.jpg)