Актуальність
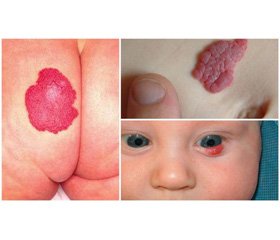
Гемангіоми шкіри є доброякісними пухлинами, що, за даними літератури, становлять до 80 % випадків серед різних пухлинних новоутворень у дітей. Зазвичай гемангіоми супроводжуються прогресивним ростом, особливо в новонароджених, вони зустрічаються у 2,5 % всіх дітей, а до кінця першого року цей показник збільшується до 10,1 %. Близько 10 % пацієнтів із гемангіомами мають деструктивний ріст з утворенням виразок, кровотечі та приєднанням інфекційного компонента [1, 4, 8–10].
За даними Н.А. Дементьєвої, термін «гемангіома» та перша класифікація були запропоновані R. Virchow в 1863 р. та тривалий час використовувалися для позначення різних типів доброякісних судинних уражень. R. Virchow розподілив гемангіоми за макроскопічними ознаками на прості (капілярні), кавернозні та гроноподібні (рацемозні). У подальшому усі класифікації є, по суті, тотожними, модифікують цю першу класифікацію [1, 2, 4, 5].
Таким чином, багатогранність клінічних та морфологічних особливостей, а також локалізації та поширеності недуги потребують постійного пошуку ефективних методів лікування, що не завжди вдається. На сьогодні, зважаючи на науково-технічний прогрес, розроблені нові технології та методики лікування, системної та локальної дії на недугу. Однак, за даними статистики, зберігається низький відсоток ефективності лікувальних заходів [3, 6–8].
З метою лікувальної тактики на сьогодні використовуються дві методики. Системна фармакологічна терапія проводиться кортикостероїдами, рекомбінованим інтерфероном, цитостатиками (системно та локально) та β-адреноблокаторами. Консервативні заходи спрямовані на поступовий розвиток склеротичного процесу в ураженій ділянці, а тому мають тривалий лікувальний ефект. У 2008 році C. Leaute-Labreze et al. виявлена здатність пропранололу (анаприліну) викликати регресію гемангіом у дітей. У подальшому пройшли випробування в дитячих клініках Франції, Німеччини, США, Великої Британії та Нової Зеландії з ефективністю 80–100 %, результати випробувань і лягли в основу лікування гемангіом у всьому світі [2, 5–7, 14, 16, 18].
До локальних методів, що використовуються в дитячій хірургії, відносяться компресійна терапія, емболізація живлячих судин, рентгенотерапія, лазерна деструкція, склерозуюча терапія, електрокоагуляція, кріохірургія, а також хірургічне видалення гемангіом. Однак хірургічне видалення великих кавернозних гемангіом не завжди є можливим з огляду на розміри та локалізацію, а також наслідки проведення операції: деформації та келоїдні рубці, а також рецидиви недуги [3, 12, 15, 18].
Незважаючи до певні досягнення, і по сьогодні йде пошук та розробка нових методів лікування недуги в частини пацієнтів через незадовільні результати та косметичні дефекти [4, 8, 13, 17, 19, 20].
Мета роботи — покращити результати лікування кавернозних гемангіом великих розмірів та складних анатомічних локалізацій.
Матеріали і методи
Обстеження та лікування 16 дітей здійснювалося на базі клінічних хірургічних відділень у період із 2000 по 2015 рік. Вік дітей становив від 10 до 18 років. Дітей жіночої статі було 11 (67,4 %), а чоловічої — 5 (32,6 %). Залежно від локалізації гемангіоми розподілилися таким чином: голови та шиї — у 5 (31,2 %), на спині, а також на грудній і черевній поверхні — у 4 (25 %), у промежині — у 3 (18,8 %), на верхніх та нижніх кінцівках — у 4 (25 %). Репрезентовані дані не відображають істинної кількості хворих дітей із такими недугами, оскільки значна частина дітей лікується як в інших клініках, так і в приватних лікувальних установах. Наведені дані — це презентація досвіду та власного клінічного матеріалу, що має добрий результат. Діти з гемангіомами проходили комплексне обстеження, що включало загальноклінічне, лабораторне, інструментальне, функціональне обстеження з консультацією суміжних спеціалістів, а також проводилося ультразвукове та допплерографічне дослідження судинної мальформації з визначенням живлячих судин. У роботі використана Римська класифікація 1996 року, прийнята на ХІ конгресі з вивчення судинних аномалій в Італії.
Результати та обговорення
Проведений нами аналіз виконаних пластичних операцій за останні 5 років показав, що число таких втручань у практично однакової кількості пацієнтів збільшилось у 10 раз. Підвищилося не тільки число самих втручань, але й кількість способів закриття ранових дефектів. Збільшилась частка складних пластик.
На нашу думку, будь-яке втручання із закриття ранового дефекту необхідно вважати відновною пластичною операцією. Назва оперативного втручання повин–на повністю містити всі хірургічні маніпуляції, що проводились на рані. Її закриття із застосуванням одного з методів пластичної хірургії може бути виконано в будь-яку фазу ранового процесу. У зв’язку з цим за термінами утворення ранового дефекту слід розрізняти такі види пластики:
1) первинна;
2) первинно-відстрочена;
3) вторинна (рання, пізня);
4) пізня.
Первинна шкірна пластика в гнійній хірургії проводиться негайно після виконання хірургічної обробки рани. Вона є заключним відновним етапом операції. Показання до даного втручання в практиці гнійної хірургії досить обмежені. Здійснити дану пластику можна за наявності низки умов: радикальна хірургічна обробка рани; виконання втручань у ранах із задовільним кровопостачанням; відсутність запальних змін у шкірі; адаптація країв ран без натягу; активне дренування ран; адекватна антибіотикотерапія.
Якщо хоча б одна з вищевказаних умов не виконана, пластику необхідно відкласти на 1–6 діб та за можливості провести первинно-відстрочену шкірну пластику і повторну хірургічну обробку з радикальним висіченням вторинних некрозів.
Вторинну шкірну пластику ділять на ранню (зазвичай протягом другого тижня після первинного хірургічного втручання), що виконується в другій фазі ранового процесу в умовах гранулюючої рани, та пізню (зазвичай із третього тижня після виконання первинної хірургічної операції), коли разом із грануляційною тканиною відмічається епітелізація рани.
При первинній та відстроченій шкірній пластиці найбільш часто застосовують пластику місцевими тканинами, при вторинній способи більш різноманітні.
Повну (одномоментну) шкірну пластику нами вдалось виконати у 86,5 % пацієнтів. У 13,5 % хворих рановий дефект у зв’язку з особливостями перебігу ранового процесу, локалізації та розмірами дефекту вдалось закрити лише поетапно.
Первинну та ранню реконструкцію шкірних покривів найчастіше вдавалось виконати при локалізації гнійно-некротичного процесу на голові та верхній кінцівці, де більш сприятливі умови для проведення операції та задовільне кровопостачання тканин. Так, у випадках із флегмоною волосяної ділянки голови в 75 % випадків ми закінчували хірургічну обробку рани первинною реконструкцією скальпа незалежно від мікробної етіології процесу.
При гнійних процесах шиї, верхньої та нижньої кінцівок, тулуба у зв’язку із складними анатомо-топографічними особливостями та масивністю уражень первинну пластику вдалось виконати лише в 3,8 % випадків.
У хворих із ранами верхньої кінцівки здебільшого (54,6 %) нам вдавалось виконати первинно-відстрочену пластику. На нижній кінцівці рани частіше (85,5 %) закривали, застосовуючи різні методи вторинної пластики.
Рання пластика гнійної рани вважається одним із важливих елементів комплексного хірургічного лікування ранових дефектів, ускладнених сепсисом. Ліквідація якомога раніше значних ранових дефектів, через які здійснюється масивна втрата білків, електролітів, відбувається контамінація рани госпітальною поліантибіотикорезистентною флорою, є життєво необхідним заходом, спрямованим на лікування сепсису.
Хірургічна обробка гнійного вогнища є першим етапом для підготовки ранового дефекту до закриття. Санацію слід проводити радикально, але без ураження функціонально значимих тканин. Доступи до гнійного вогнища планувались залежно від його топографії, розмірів, стану шкірних покривів. При виконанні доступу завжди пам’ятали про необхідність наступної реконструкції тканин. Чим простіше доступ, тим легше закрити рану. Виконання розрізів по ходу силових ліній покращує пластику, дає кращий функціональний та косметичний результат. У ділянці згинальних та розгинальних поверхонь суглобів проводили поперечні розрізи для профілактики дерматогенних контрактур.
При виборі способу пластики звертали увагу:
1) на розміри, локалізацію дефекту, стан оточуючих тканин;
2) стан тканин, що підлягають пластиці;
3) інтенсивність кровопостачання тканин;
4) вік пацієнта, наявність супутньої патології.
Для вибору термінів пластики найбільш суттєвим моментом є ліквідація перифокального запалення та місцевої ішемії тканин. Високе обсіменіння рани мікрофлорою, хоча і слугує фактором ризику нагноєння, але ж все-таки не є абсолютним протипоказанням для операції.
Пластика рани місцевими тканинами — найбільш адекватний та простий шлях усунення дефекту шкіри. Під час операції завжди проводили висічення грануляцій, густо населених мікрофлорою, рубцевих тканин. Шкірні та шкірно-фасціальні клапті мобілізували широко, в одному шарі, щоб не пошкодити їх кровопостачання. Важливим моментом операції є усунення залишкових порожнин, для чого рану ушивають пошарово. Проводили ретельний гемостаз, оскільки гематома може викликати нагноєння та розходження швів. Краї рани зближували без натягу. Рану дренували перфорованими наскрізними трубками, виведеними через контрапертури та приєднаними до них пневмоаспіраторами. Зазвичай для аспірації використовували «гармошку».
Шкіра завдяки своїй еластичності здатна до розтягування. У місцях, де до шкіри прилягають значні м’язові масиви (плече, верхня третина передпліччя, передня черевна стінка, сідниці, стегно, верхня третина гомілки), за рахунок вказаних вище можливостей шкіри можна закрити дефекти, діастаз країв яких сягає 10–20 см (гостра дермотензія).
При загрозі сильного натягу тканин, що може викликати розвиток некрозу та нагноєння, а також при широкому діастазі країв рани, яку необхідно було закрити повноцінним клаптем, віддавали перевагу дозованому розтягненню тканин (хронічна дермотензія). Для цього поблизу країв широко мобілізованих шкірно-жирових клаптів товстою ниткою накладали вертикальний П-подібний шов, зав’язаний на бантик. Підтягування швів проводилось щоденно або через день до повної адаптації країв рани. При здійсненні дермотензії нам вдавалось закрити рани кінцівок, діастаз яких сягав 1/3 їх окружності.
На практиці для закриття значних дефектів шкіри нам частіше за все доводилось застосовувати як гостре, так і дозоване розтягнення тканин.
Пласкі, великі ранові дефекти з добре васкуляризованим ложем підлягали дерматомній пластиці розщепленим трансплантатом. При проведенні автодермопластики слід забезпечити висічення грануляцій, надійний гемостаз, адаптацію шкірного трансплантата до країв рани без натягів із виповненням усіх вигинів дна рани та відсутність залишкових порожнин [2]. Трансплантат середньої товщини (0,4–0,6 мм) зазвичай брали дерматомом із передньо-латеральної поверхні стегна, рідше — з гомілки та передньої черевної стінки. За потреби виконання автодермопластики на кістку, без надкістя, проводили тангенційну остеотомію до появи кровотечі з кісткової тканини.
Зазвичай ми користувались перфорованими транс–плантатами, але останнім часом все частіше застосовуємо при автодермопластиці неперфоровані, оскільки вони справляють кращий косметичний ефект, менше зморщуються, рідше інфікуються та швидше приживаються. Площа одномоментно пересаджених перфорованих трансплантатів іноді сягала 1200 см2.
При великих ранових дефектах кінцівок для запобігання грубому рубцевому переродженню клаптів шкірні трансплантати бажано накладати в поперечному напрямку. При локалізації рани в ділянці згинальних та розгинальних поверхонь суглобів для запобігання дерматогенним контрактурам шкірний трансплантат завжди накладали у поперечному напрямку, причому трансплантат розсікали та розташовували так, щоб лінія швів знаходилась в проекції суглобової щілини.
Трансплантат шкіри фіксували до ранового ложа швами, вузли яких зав’язували поверх серветок, змочених розчином антисептика (1% розчин повідон-йоду + 3% розчин борної кислоти). Якщо раньовий дефект закривали кількома клаптями, то проводили їх зшивання один з одним з обов’язковим захватом у шов дна рани. Першу перев’язку зазвичай проводили через 5–7 діб. Значне промокання пов’язки ексудатом, болі та набряк у ділянці операційної рани, стійке підвищення температури тіла були показаннями для більш ранньої її заміни та ревізії рани.
Хірургічна техніка автодермопластики досить проста при відповідному обладнанні операційної та достатньому досвіді хірурга. Нами накопичено досвід 66 пересадок шкіри в пацієнтів, які перенесли тяжкі гнійно-запальні захворювання м’яких тканин. Приживлення шкірних трансплантатів на площі не менше 80 % настало в 93 % пацієнтів.
За потреби закриття повношаровими тканинами незначних дефектів округлої форми чи іншої нелінійної форми застосовували пластику ротаційними клаптями, метод пластики зустрічними трикутниками, фігурними та острівцевими клаптями. Показаннями до закриття рани місцевими та віддаленими повнокровними тканинами, що складались із шкірно-жирових та шкірно-фасціальних клаптів, були:
1) незадовільне кровопостачання оточуючих тканин;
2) розташування на дні рани функціонально значимих тканин (кістки, сухожилля, нерви);
3) необхідність закриття дефекту, що підлягає механічному навантаженню (опорні поверхні ступні, ділянки над кістковими виступами);
4) необхідність ліквідації контурних дефектів.
Клапті на ніжці, викроєні з найближчих тканин, дають найкращі результати, оскільки вони близькі за своєю структурою, товщиною, особливостями кровопо–стачання до тканин дефекту і найкраще здатні закрити наявний дефект [3, 4].
Одним із варіантів місцевої пластики є ротаційний метод. Основними показаннями для ротаційного способу є дефекти шкіри після висічення пухлин, пролежнів крижової ділянки, виправлення деформацій обличчя. На кінцівках застосування ротаційного способу обмежене через малу рухомість шкіри.
Суттєві руйнування тканин виникають при тяжких відмороженнях кінцівок, у результаті хірургічного лікування яких утворюються великі рубцево-виразкові дефекти опорних поверхонь ступень та кистей. Якщо раніше дана проблема вирішувалась шляхом багатоетапної пластики філатовським стеблем та за допомогою італійської пластики, то останнім часом перевагу віддають застосуванню вільної пластики повношаровими клаптями на мікросудинних анастомозах та використанню клаптів з осьовим кровообігом [8].
При некротичних дефектах пальців кистей ми віддавали перевагу пластиці трикутними клаптями на судинно-нервовій ніжці, сформованій із долонної поверхні цього ж пальця. В закордонних публікаціях даний спосіб називають «VY-пластикою». Його широко застосовують при травматичних ампутаціях дистальних кінчиків пальців.
Нами проведено 18 даних операцій. Відмічено повне приживлення судинних клаптів в усіх пацієнтів.
Операції, що виконуються з приводу глибоких відморожень пальців ступні, становлять більше ніж 60 % від кількості втручань, що здійснюються при відмороженнях ступні. Функціональна значимість сформованих кукс пальців на ступні менша, ніж на кисті. Лише при ураженнях І та V пальців принцип зберігання має таке ж значення, що і на кисті.
При відмороженнях дистальної фаланги, м’яких тканин, які залишились на підошовній ділянці ступні, зазвичай достатньо для формування трикутного острівцевого клаптя. В нашій практиці добрі результати при відмороженнях І та V пальців було отримано при пластиці прапорцевим клаптем за методом R. Vilian (1972), що викроювали на тильній поверхні залишків пальців.
Нами виконано 10 операцій із закриття дефектів І пальця ступні із застосуванням прапорцевого клаптя. Ускладнень не було.
Пластика острівцевим переднім чи латеральним клаптем із гомілки є одним із варіантів вибору оперативного лікування для збереження максимальної довжини кісткового сегмента плюсни та передплюсни. Задній шкірно-фасціальний клапоть із гомілки має осьовий кровообіг, тому його можна формувати на довгій ніжці без загрози розвитку крайових некрозів [9].
Даний спосіб пластики було застосовано в 14 пацієнтів із дефектами передньої поверхні ступнів на рівні плюсни та передплюсни, що утворились внаслідок відмороження пальців ІV ступеня. Усім пацієнтам було проведено пластику дефектів острівцевим латеральним клаптем гомілки. Донорську рану було закрито розщепленим шкірним трансплантатом. Ускладнень не було.
На відміну від мікрохірургічних пересадок така пластика менш довготривала. Вона виконується однією бригадою хірургів протягом 2,5–3 годин, що дає можливість її виконати під перидуральною анестезією.
Таким чином, при ранових дефектах пальців ступні пластика острівцевими трикутними та прапорцевими клаптями дозволяє повністю відновити повноцінний шкірний покрив на куксі. Пластика ран після ампутацій на рівні плюсни та передплюсни потребує застосування більш складних острівцевих клаптів гомілки.
Висновки
1. Хірургічна та лікувальна тактика при великих гемангіомах у дітей повинна бути індивідуалізованою, із врахуванням локалізації, обсягу, наявності ускладнень та даних комплексного обстеження.
2. Використання сегментарної резекції гемангіом великих розмірів є доцільним при виникненні ускладнень: виразок із кровотечею та загрозою інфікування і нагноєння.
3. Пропранолол є не тільки методом вибору лікування гемангіом, а й необхідним та доцільним із врахуванням ефективності, безпечності використання у всіх вікових групах.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Боднар А.Б. Клініко-діагностична характеристика гемангіом шкіри на сучасному рівні / А.Б. Боднар, Б.М. Боднар, О.Б. Боднар // Хірургія дитячого віку. — 2017. — № 3(56). — С. 124-125.
2. Бойчук Т.М. Дистанційна діагностика судинних новоутворень шкіри у дітей / Т.М. Бойчук, Б.М. Боднар // Хірургія дитячого віку. — 2017. — № 4(57). — С. 109-110.
3. Вивчарук В.П. Выбор оптимальной тактики в лечении гемангиом у детей / В.П. Вивчарук, Ю.В. Пащенко, О.В. Пионковская // Медичні перспективи. — 2013. — Т. ХVІІІ, № 3, ч. 2. — С. 209-213.
4. Вівчарук В.П. Лікувальна тактика при гемангіомах у дітей / В.П. Вівчарук, Ю.В. Пащенко, Ю.Б. Гречаніна // Хірургія дитячого віку. — 2017. — № 4(57). — С. 41-45.
5. Дементьєва Н.А. Гемангіоми у дітей. Огляд літератури. Пропозиції щодо медичної стратегії / Н.А. Дементьєва, В.А. Дігтяр // Хірургія дитячого віку. — 2013. — № 1(38). — С. 32-36.
6. Ефективність β-адреноблокатора в лікуванні гемангіом у дітей. 7 років застосування / Н.А. Дементьєва, В.А. Дігтяр, О.П. Гладкий, О.Л. Хитрик, Я.І. Білицька // Хірургія дитячого віку. — 2017. — № 4(57). — С. 119-120.
7. Застосування пропранололу у консервативному лікуванні гемангіом у дітей раннього віку / А.С. Кузик, О.І. Могиляк, Б.С. Романишин, І.В. Лукавецький, А.Й. Наконечний, А.В. Синюта, М.Б. Захарусь, І.Ю. Авраменко, М.В. Стегніцька // Хірургія дитячого віку. — 2017. — № 4(57). — С. 35-40.
8. Особливості лікування гемангіом складної локалізації у дітей раннього віку / О.В. Спахі, О.П. Пахольчук, О.Д. Кокоркін, Г.С. Марієв // Хірургія дитячого віку. — 2017. — № 1(54). — С. 49-51. doi: 10.15574/PS.2017.54.49.
9. Пащенко Ю.В. Парциальное иссечение гемангиом критических локализаций у детей / Ю.В. Пащенко, О.В. Пионтковская, В.П. Виварчук // Хірургія дитячого віку. — 2013. — № 1(38). — С. 32-36.
10. Фомін О.О. Виправданість очікування інволюції у програмі лікування гемангіом у дітей / О.О. Фомін, Д.В. Коноплицький, О.О. Калінчук // Хірургія дитячого віку. — 2017. — № 3(56). — С. 114-119. doi: 10.15574/РS.2017.114.
11. Сенаторова А.С. Инновационные технологии в лечении гемангиом у детей / А.С. Сенаторова, М.А. Гончарь, А.И. Страшок // Дитячий лікар. — 2013. — № 3. — С. 5-9.
12. Adverse effects of propranolol when used in the treatment of hemangiomas: a case series of 28 infants / M. de Graaf, J.M. Breur, M.F. Raphaël, M. Vos, C.C. Breugem, S.G. Pasmans // J. Am. Acad. Dermatol. — 2011. — Vol. 65(2). — P. 320-327. doi: 10.1016/j.jaad.2010.06.048.
13. Azzopardi S. Novel strategies for managing infantile hemangiomas: a review / S. Azzopardi, T.C. Wright // Ann. Plast. Surg. — 2012. — Vol. 68(2). — P. 226-228. doi: 10.1097/SAP.0b013e318216b4f8.
14. Chen T.S. A prospective study of infantile hemangiomas with a focus on incidence and risk factors / T.S. Chen, L.F. Eichenfield, Sh.F. Friedlander // Pediatr. Dermatol. — 2011. — Vol. 28(6). — P. 663-669. doi: 10.1111/j.1525-1470.2011.01568.x.
15. Chen T.S. Infantile hemangiomas: an update on pathogenesis and therapy / T.S. Chen, L.F. Eichenfield, Sh.F. Friedlander // Pediatrics. — 2013. — Vol. 131(2). — P. 99-108. doi: 10.1542/peds.2012-1128.
16. Hogeling M. A Randomized Controlled Trial of Propranolol for Infantile Hemangiomas / M. Hogeling, S. Adams, O. Wargon // Pediatrics. — 2011. — Vol. 128(2). — P. 259-266. doi: 10.1542/peds.2010-0029.
17. How should propranolol be initiated for infantile hemangiomas: inpatient versus outpatient? / N.J. Patel, N.M. Bauman // Laryngoscope. — 2014. — Vol. 124(6). — P. 1279-1281. doi: 10.1002/lary.24363.
18. Oral propranolol: an effective, safe treatment for infantile hemangiomas / H. Zaher, H. Rasheed, R.A. Hegazy, D.M. Abdelhalim, H.I. Gawdat // Eur. J. Dermatol. — 2011. — Vol. 21(4). — P. 558-563. doi: 10.1684/ejd.2011.1372.
19. Propranolol and infantile hemangiomas four years later: a systematic review / A.L. Marqueling, V. Oza, I.J. Frieden, K.B. Puttgen // Pediatr. Dermatol. — 2013. — Vol. 30(2). — P. 182-191. doi: 10.1111/pde.12089.
20. Silvestre J.S. Postischemic revascularization: from cellular and molecular mechanisms to clinical applications / J.S. Silvestre, D.M. Smadja, B.L. Levy // Physiol. Rev. — 2013. — Vol. 93(4). — P. 1743-802. doi: 10.1152/physrev.00006.2013.