Резюме
Актуальність. Клітини проток становлять до 30 % від маси підшлункової залози (ПЗ) людини, а збільшення кількості бранчів проток відноситься до одних із перших сонологічних ознак хронічного панкреатиту (ХП). Мета дослідження — визначення морфологічних й імуногістохімічних особливостей протокової системи ПЗ хворих на ХП, яким були виконані резекційні та дренуючі операції з приводу ускладнень хронічного панкреатиту. Матеріали та методи. Проведено імуногістохімічне дослідження операційного матеріалу 40 хворих з ускладненим хронічним панкреатитом з використанням реакцій на α-ізоформу гладком’язового актину (α-SMA), десмін, фібронектин й колаген I типу. Результати. Характерна морфологічна картина розвитку ХП є поєднанням фіброзування з деформацією протокової системи за рахунок перидуктального фіброзу з розширенням міждолькових фіброзних септ, потовщенням інтралобулярних сполучнотканинних тяжів, а також значною звивістістю і розширенням проток з ретенційними кістами. Значна структурна перебудова протокової системи ПЗ у хворих на ХП спостерігалася в 87,5 % випадків, в 17,5 % випадків картина доповнювалася явищами ацинарно-протокової метаплазії з трансформацією ацинарних клітин у протокові і формуванням дрібних дуктулоподібних структур, так званих тубулярних комплексів. У 7,5 % випадків в головній панкреатичній протоці визначалися вогнища атрофії протокового епітелію, які чергувалися з вогнищами папілярної інтраепітеліальної гіперплазії епітелію (PanIN). Розвитку панкреатичного фіброзу при ХП сприяє накопичення α-SMA+-активованих панкреатичних зірчастих клітин, що синтезують надлишок компонентів екстрацелюлярного матриксу, зокрема колагену I типу. Середня площа колагену І типу та інтенсивність його експресії були вірогідно нижче при зниженій експресії α-SMA (p < 0,05) і вірогідно вище у випадках вираженої експресії фібронектину (p < 0,05). Висновки. Вивчення структурних змін протокової системи ПЗ з використанням методів імуногістохімії є одним із способів покращення ранньої діагностики ускладнень ХП.
Актуальность. Клетки протоков составляют до 30 % от массы поджелудочной железы (ПЖ) человека, а увеличение количества бранчей протоков относится к одним из первых сонологических признаков хронического панкреатита (ХП). Цель исследования: определение морфологических и иммуногистохимических особенностей протоковой системы ПЖ больных ХП, которым были выполнены резекционные и дренирующие операции по поводу осложнений хронического панкреатита. Материалы и методы. Проведено иммуногистохимическое исследование операционного материала 40 больных с осложненным хроническим панкреатитом с использованием реакций на α-изоформу гладкомышечного актина (α-SMA), десмин, фибронектин и коллаген I типа. Результаты. Характерная морфологическая картина развития ХП представляет собой сочетание фиброзирования с деформацией протоковой системы за счет перидуктального фиброза с расширением междольковых фиброзных септ, утолщением интралобулярных соединительнотканных тяжей, а также со значительной извитостью и расширением протоков с ретенционными кистами. Значительная структурная перестройка протоковой системы ПЖ у больных ХП наблюдалась в 87,5 % случаев, в 17,5 % случаев картина дополнялась явлениями ацинарно-протоковой метаплазии с трансформацией ацинарных клеток в протоковые и формированием мелких дуктулоподобных структур, так называемых тубулярных комплексов. В 7,5 % случаев в главном панкреатическом протоке определялись очаги атрофии протокового эпителия, которые чередовались с очагами папиллярной интраэпителиальной гиперплазии эпителия (PanIN). Развитию панкреатического фиброза при ХП способствует накопление α-SMA+ активированных панкреатических звездчатых клеток, синтезирующих избыток компонентов экстрацеллюлярного матрикса, в частности коллагена I типа. Средняя площадь коллагена І типа и интенсивность его экспрессии были достоверно ниже при сниженной экспрессии α-SMA (p < 0,05) и достоверно выше в случаях выраженной экспрессии фибронектина (p < 0,05). Выводы. Изучение структурных изменений протоковой системы с использованием методов иммуногистохимии является одним из способов улучшения ранней диагностики осложнений ХП.
Background. Chronic pancreatitis (CP) is characterized by a number of specific changes in the structure and function of the pancreas, including atrophy of functional tissue, fibrosis and ductal degeneration, a decrease in the number of islets. Despite a large number of possible etiological factors, the main pathophysiological mechanisms of CP development have much in common. Thus, with the preservation of secretory activity under obstruction of the ducts and their compensatory expansion, pancreatic secret infiltrates the surrounding tissue with the formation of edema, followed by intrapancreatic activation of digestive enzymes, in particular trypsinogen, which initiates proteolytic necrobiosis of the pancreocytes. The duct cells make up to 30 % of the human pancreas, compared to 1–2 % of endocrine cells. One of the first signs of CP is the abnormal increase in the number of ductal branches. It has also been shown that in the ducts of CP patients, the number of cells containing insulin increases, as well as cells that contain other endocrine and exocrine markers. Modeling chronic, acute and complicated pancreatitis in rats also confirmed that epithelial cells are involved in the regulation of extracellular matrix of the pancreas. Materials and methods. Comprehensive histopathological and immunohistochemical (IHC) study was performed in the laboratory of histological and immunohistochemical diagnosis of the university hospital of Zaporizhia State Medical University on postoperative
material of 40 patients with CP aged 28 to 74 years, who were operated at the clinic of surgery and minimally invasive technologies of Zaporizhia State Medical University. Immunohistochemical examination was carried out according to standard procedures using a mouse monoclonal antibody Alpha Smooth Muscle Actin (Clone 1A4) against the α-isoform of smooth muscle actin (α-SMA) and Desmin (Clone D33) against desmin (DAKO, USA), monoclonal rabbit antibody against collagen I (Clone RAH C11) anti-collagen type 1 (Imtek, RF) and rabbit polyclonal antibodies against fibronectin (DAKO, USA). Quantitative determination of the intensity and the relative area of the markers’ stromal expression was reproduced using the program for medical digital image processing ImageJ v.1.48, embedded plugin Colour Deconvolution analysis circuit and coloring H DAB (hematoxylin + DAB) for determining the area occupied by immunopositive structure in immunohistochemical preparations and optical (densitometric) intensity of immunostaining by patented procedure. Results. Pathohistological study of biopsies with a specific staining of collagen (by Van Gieson and Masson’s trichrome) showed that fibrotic changes in all the patients with CP were characterized by a combination of pronounced perilobular fibrosis, which covered all lobules, widespread intralobular fibrosis, and significant periductal fibrosis near large, sharply defined narrowed and cystically dilated ducts. There was also a pronounced expansion of interlobular fibrosis, a noticeable thickening of intralobular connective tissue strands directed deep into the lobules and connective tissue strands that surrounded some acini, as well as a significant tortuosity and widening of the ducts with retention cysts. In most cases, the deformation of the ductal system was one of the most significant structural changes. Thus, 87.5 % of cases were characterized by the unevenly narrowed and cystic-altered interlobular ducts, pronounced concentric fibrosis, protein plugs and concrements observed in the ducts. In 7.5 % of the cases, in the main pancreatic duct, foci of the epithelium atrophy were present, which alternated with foci of papillary intraepithelial hyperplasia, identified as pancreatic intraepithelial neoplasia. The parenchyma of the pancreas was thus constituted small, atrophic acini, surrounded by dense fibrous strands, with an increased number of gaping ducts of different diameters. Also, in 17.5 % of cases, phenomena of acinar-ductal metaplasia were observed. In the centers of the acinar-ductal metaplasia zones, the transformation of some acinar cells into ductal cells was determined with the formation of small duct-like structures, the so-called tubular complexes, which, according to the literature, are the primary focus of acinar tissue regeneration. In particular, a large number of activated α-SMA + pancreatic stellate cells (PSC) is detected in the zones of fibrosis. The pattern of expression of this marker is characterized by pronounced α-SMA-immunopositive staining of both PSC and their processes, and, in part, of the fibrillar component. Primary statistical processing of morphometry data revealed a direct relationship between the expression of α-SMA and the area of collagen I type, but this relationship was not significant (r = +0.321, p > 0.05). In order to further objectify the statistical studies, we isolated a group of cases characterized by low α-SMA expression (n = 9). A further study using medical statistics methods showed that the average area of type I collagen and the intensity of its expression in this group was significantly lower than in the other biopsy specimens (p < 0.05). In contrast, desmin expression was identified both in connective tissue, which was characterized by a lower intensity of immunostaining, in acinar tissue and in the epithelium of the pancreatic ducts. The pattern of its expression in fibrosis zones in CP was similar to that of α-SMA, but in 27.5 % of cases, the intensity of staining was below the threshold for determination by morphometric methods. We isolated a group of cases characterized by high expression of fibronectin (n = 9). A further study using medical statistics showed that the average area of type I collagen and the intensity of its expression in this group was significantly higher than in the other biopsy specimens (p < 0.05). Thus, IHC study of the material obtained from patients with CP showed that a large number of activated PSC expressing α-SMA and desmin are concentrated in the pancreatic ductal zones. Also, in these zones, a significant accumulation of fibronectin was found, which is synthesized in excess by activated PSC. The pattern of IHC staining of type I collagen in the zones of severe pancreatic fibrosis is characterized by a weak and moderate intensity with a average level of its expression. Conclusions. A characteristic morphological picture of the CP development is a combination of fibrosis with deformation of the ductal system due to periductal fibrosis with the expansion of interlobular fibrosis, thickening of intralobular connective tissue strands, as well as considerable tortuosity and widening of the ducts with retention cysts. Significant structural reorganization of the pancreatic duct system in patients with CP was observed in 87.5 % of cases, in 17.5 % of cases, the picture was supplemented by phenomena of acinar-ductal metaplasia with the transformation of acinar cells into ductal cells and the formation of small duct-like structures, the so-called tubular complexes. In 7.5 % of cases, in the main pancreatic duct, foci of atrophy of the epithelium were identified, which alternated with foci of papillary intraepithelial epithelial hyperplasia (PanIN). The development of pancreatic fibrosis in CP is facilitated by the accumulation of α-SMA+ activated pancreatic stellate cells synthesizing an excess of components of the extra-cellular matrix, in particular type I collagen. The mean area of type I collagen and the intensity of its expression were significantly lower with reduced α-SMA expression (p < 0.05), and significantly higher in cases of pronounced fibronectin expression (p < 0.05).
Введение
Хронический панкреатит (ХП) характеризуется рядом специфических изменений в структуре и функции поджелудочной железы (ПЖ), в числе которых атрофия функциональной ткани (уменьшение объема ПЖ), фиброз и дегенерация протоков [1–3], снижение количества островков Лангерганса [1]. Несмотря на большое количество возможных этиологических факторов, основные патофизиологические механизмы развития ХП имеют много общего. Так, при сохранении секреторной деятельности в условиях обструкции протоков возникает их компенсаторное расширение, и панкреатический секрет инфильтрирует окружающую ткань с формированием отека железы, за которым следует интрапанкреатическая активация пищеварительных ферментов, в частности трипсиногена, что инициирует протеолитический некробиоз панкреоцитов [4].
В дальнейшем это приводит к образованию белковых пробок панкреатических протоков вследствие повышенной секреции белков ПЖ, которые являются очагами кальцификации и приводят к образованию конкрементов в протоковой системе ПЖ [5]. В результате поражается эпителий протоков, который образует слепки и закупоривает протоки, тем самым вызывая воспалительные изменения и потерю функционирующей паренхимы ПЖ вследствие фиброза [4, 6, 7].
Клетки протоков составляют до 30 % от массы ПЖ человека по сравнению с 1–2 % эндокринных клеток [8]. Одним из первых признаков ХП является именно анормальное увеличение количества бранчей протоков, которое выявляется на ретроградной холангиопанкреатографии [9]. Также доказано, что у пациентов с ХП в протоках увеличивается число клеток, содержащих инсулин, а также клеток, которые содержат другие эндокринные и экзокринные маркеры [10]. При моделировании хронического, острого и осложненного панкреатита в эксперименте на крысах было получено подтверждение того, что клетки эпителиального происхождения участвуют в процессах регуляции экстрацеллюлярного матрикса (ЭЦМ) ПЖ [11].
С биохимической точки зрения, ЭЦМ состоит из четырех основных классов макромолекул — коллагенов, протеогликанов, структурных гликопротеинов и эластина [12, 13]. Структурная прочность и функциональное единство белков ЭЦМ играют важную роль в поддержании органоспецифической функции ПЖ [12, 14]. Значительный прогресс в понимании развития фиброза при ХП связан с идентификацией панкреатических звездчатых клеток (ПЗК), которые способны продуцировать ЭЦМ, в том числе и избыточный [15].
Впервые липидосодержащие клетки были обнаружены в ПЖ человека, крыс и мышей в 1982 году. Хотя потенциальная роль этих клеток в фиброгенезе уже тогда обсуждалась, прошло еще 8 лет, пока ученые смогли их изолировать и охарактеризовать [16]. ПЗК расположены в интралобулярном и интраацинарном пространстве человеческой ПЖ и имеют характеристики миофибробластов: экспрессия α-изоформы гладкомышечного актина, синтез коллагена и фибронектина [17]. Также ПЗК экспрессируют промежуточные филаменты, которые свойственны миоцитам (например, десмин).
Известны три базовых механизма, по которым может происходить активация ПЗК при ХП: механический стресс, продукция цитокинов и изменения ЭЦМ [15]. Содержание жировых капель обратно пропорционально экспрессии SMA и синтезу ЭЦМ. Переход с латентной липидосодержащей формы в миофибробластообразную с высокими пролиферативными свойствами связывают с потерей капель ретинола, развитием эндоплазматического ретикулума и увеличением синтеза белков ЭЦМ. В отличие от латентной формы активная, или синтезирующая, характеризуется синтезом больших объемов коллагена первого типа и фибронектина [12, 18].
За активацией ПЗК следует их пролиферация и миграция. В клеточной культуре активированные ПЗК быстро пролиферируют и мигрируют под управлением хемотаксиса в сторону поврежденной ткани [19]. Кроме этого, в дополнение к активной миграции в поврежденный сектор их отсутствие в нормальной ткани контролируется апоптозом. При активации ПЗК происходит ряд морфологических изменений, включая изменения до миофибробластоподобного фенотипа, который синтезирует и секретирует большое количество коллагена I типа и фибронектина [20]. Сдвиг в саморегуляции ПЗК приводит к избыточному накоплению ЭЦМ и/или сниженной скорости его разрушения, вовлечению здоровых функционально-значимых структур ПЖ в процесс фиброзирования [15, 21].
Таким образом, вероятность развития клинически значимой эндо- и экзокринной недостаточности ПЖ постепенно увеличивается с течением времени и зависит от разрушения паренхимы ПЖ. Процент клинических проявлений варьирует в зависимости от этиологии, наличия кальцификатов в протоках ПЖ и длительности заболевания, также влияет на него продолжающееся потребление алкоголя [22, 23] и конституционно обусловленная тканевая резистентность, которая встречается у лиц с ожирением и гиперлипидемией [24]. Ожидаемая продолжительность жизни сокращается, смерть наступает в основном из-за последствий злоупотребления алкоголем и никотином (сердечно-сосудистые заболевания, злокачественные опухоли и т.д.), и только в редких случаях — от панкреатита или диабета (в основном от гипогликемии) [22].
Целью исследования было определение морфологических и иммуногистохимических (ИГХ) особенностей протоковой системы ПЖ больных ХП, которым были выполнены резекционные и дренирующие операции по поводу осложнений хронического панкреатита.
Материалы и методы
Комплексное патогистологическое и иммуногистохимическое исследование было выполнено в лаборатории патогистологической и иммуногистохимической диагностики университетской клиники Запорожского государственного медицинского университета на послеоперационном материале 40 пациентов в возрасте от 28 до 74 лет, страдающих ХП, которые были оперированы в клинике кафедры хирургии и малоинвазивных технологий ГУ «Запорожская медицинская академия последипломного образования Министерства здравоохранения Украины».
Для выполнения гистологических исследований био–птаты ПЖ фиксировали в 10,0% растворе нейтрального формалина, обезвоживали в спиртах восходящей концентрации и заливали в парафин. Гистологические срезы толщиной 3–5 мкм окрашивали гематоксилином и эозином по методике ван Гизона и Маллори — трихром.
Иммуногистохимическое исследование проводили по стандартной методике [25] с использованием моноклональных мышиных антител Alpha Smooth Muscle Actin (Clone 1A4) против α-изоформы гладкомышечного актина (α-SMA) и Desmin (Clone D33) против десмина (DAKO, США), моноклональных кроличьих антител Collagen I
(Clone RAH C11) против коллагена I типа («Имтек», РФ) и поликлональных кроличьих антител Fibronectin против фибронектина (DAKO, США). Для этого после депарафинации, высокотемпературной демаскировки антигенов в трис-ЭДТА буфере с рН = 9 и блокированием активности эндогенной пероксидазы в 3% растворе перекиси водорода проводили инкубацию с первичными антителами согласно рекомендациям фирмы-производителя, с последующей визуализацией продукта иммуногистохимической реакции с помощью системы детекции EnVision FLEX с диаминобензидином (DAKO, США).
Оценку результатов иммуногистохимической реакции с фотодокументацией проводили с использованием микроскопа Axioplan 2 (Carl Zeiss, Германия) и цифровой фотокамеры C5060WZ (Olympus, Япония). Для фотоморфометричного исследования в каждом случае фотографировали 10 полей зрения. Для унификации полученных данных фотосъемку проводили в стандартизованных условиях: увеличение микроскопа × 200, цвет (температура) освещения 3200 К, параметры фотокамеры F3.2 (диафрагма), 1/400 (выдержка), ISO 100 (светочувствительность), ручной баланс белого «в одно касание».
Количественное определение уровней интенсивности и относительной площади экспрессии исследуемых стромальных маркеров проводили с помощью медицинской программы для обработки цифровых изображений ImageJ v.1.48 с использованием встроенного плагина Colour Deconvolution и схемы анализа окраски H DAB (гематоксилин + DAB) для определения площади, которую занимают иммунопозитивные структуры в иммуногистохимических препаратах, и оптической (денситометрической) интенсивности иммуноокрашивания по запатентованной методике [26]. Для морфометрического вычисления количественного содержания искомых компонентов использовали автоматически построенную гистограмму 8-битного полутонального изображения отфильтрованного DAB-канала с программным вычислением оптической плотности (Mean) и стандартного отклонения (StdDev). Для последующего морфометрического измерения относительной площади в полутональном изображении дополнительно устанавливали стандартный порог чувствительности (инструмент Threshold) — Default для вычисления экспрессии α-SMA и коллагена І, и Reniy Entropy — для вычисления экспрессии десмина и фибронектина. Вследствие этой процедуры происходила сегментация цифрового изображения, которая преду–сматривает разделение всех пикселей изображения на два типа — черные и белые. Затем проводили вычисление процентного соотношения числа пикселей цифрового изображения иммунопозитивной реакции (черных) к общему числу пикселей в изображении.
Результаты и обсуждение
Одной из важных особенностей, связанных с ходом ХП, является очередность развития характерных микроструктурных изменений ПЖ. Так, по мере прогрессирования фиброза объемная доля экзокринной ткани уменьшается, формирование фиброзной ткани начинается от протоков, с последующим привлечением перилобулярного пространства и проникновением внутрь долек [3].
При патогистологическом исследовании препаратов со специфической окраской коллагена (по ван Гизону и Маллори — трихром) фибротические изменения у всех исследованных больных ХП характеризовались сочетанием выраженного перилобулярного фиброза, который охватывал все дольки, распространенного интралобулярного фиброза (рис. 1А), а также выраженного перидуктального фиброза возле больших четкообразных суженных и кистозно-расширенных протоков.
Также было отмечено выраженное расширение меж–дольковых фиброзных септ, заметное утолщение интралобулярных соединительнотканных тяжей, направленных вглубь долек, и соединительнотканных тяжей, которые окружали отдельные ацинусы, а также значительная извитость и расширение протоков с ретенционными кистами (рис. 1Б).
В большинстве случаев деформация протоковой системы относилась к числу наиболее заметных структурных изменений. Так, в 87,5 % случаев возле неравномерно суженных и кистозно-измененных междольковых протоков определялся выраженный концентрический фиброз, в отверстиях протоков наблюдались белковые пробки и конкременты. В 7,5 % случаев в главном панкреатическом протоке определялись очаги атрофии протокового эпителия, которые чередовались с очагами папиллярной интраэпителиальной гиперплазии эпителия, так называемой панкреатической интраэпителиальной неоплазии PanIN.
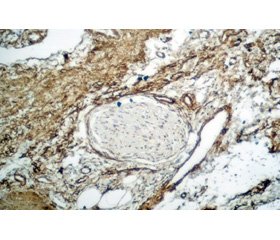
Среди ацинусов определялись островки Лангерганса, как интактные (рис. 2А), так и плотно окруженные фиброзной тканью (рис. 2Б). Данные последних исследований указывают на то, что панкреатические островки начинают разрушаться только на последних этапах фиброзирования поджелудочной железы [27]. В нашей работе вовлечение островков Лангерганса в процесс фиброзирования наблюдалось лишь в случаях, когда окружающие ацинусы были практически полностью замещены соединительной тканью.
Увеличение числа бранчей протоков при морфологическом исследовании определялось в виде роста протоков по двум основным типам, которые характерны для фиброзирования других паренхиматозных органов: продолженного, с формированием большого количества параллельных бранчей мелкого и среднего диаметра (рис. 3А), и отростчатого, который отличается деформацией стенки и расширением участка протока, с формированием многочисленных ответвлений мелкого диаметра (рис. 3Б).
Паренхима ПЖ, таким образом, представляла собой небольшие атрофичные ацинусы, окруженные плотными фиброзными муфтами, с увеличенным количеством зияющих протоков разного диаметра. Также в 17,5 % случаев наблюдались явления ацинарно-протоковой метаплазии (рис. 3В).
В очагах так называемой ацинарно-протоковой метаплазии определялась трансформация некоторых ацинарных клеток в протоковые клетки с формированием мелких дуктулоподобных структур, так называемых тубулярных комплексов, которые, согласно литературным данным, представляют собой первичный очаг регенерации ацинарной ткани [3, 27].
В зонах фиброза определялись немногочисленные очаговые иммуноклеточные инфильтраты, более характерные для острой фазы заболевания. В 45 % случаев в исследованных препаратах отмечалось наличие периневрального фиброза (рис. 4), который потенциально усугубляет болевую реакцию при ХП.
Проведенные иммуногистохимические и морфометрические исследования показали, что в зонах выраженного фиброза при ХП экспрессируется ряд клеточных и фибриллярных маркеров. Результаты представлены в табл. 1.
В частности, в зонах фиброза определяется большое количество активированных α-SMA+-панкреатических звездчатых клеток. Паттерн экспрессии данного маркера характеризуется выраженным α-SMA-иммунопозитивным окрашиванием как ПЗК и их отростков, так и, частично, фибриллярного компонента (рис. 5).
Первичная статистическая обработка данных морфометрии позволила обнаружить наличие прямой связи между экспрессией α-SMA и площадью коллагена І типа, однако данная связь не была достоверной (r = +0,321; p > 0,05). С целью последующей объективизации статистических исследований нами была выделена группа случаев, характеризующихся низкой экспрессией α-SMA (n = 9). Дальнейшее исследование с использованием методов медицинской статистики показало, что средняя площадь коллагена І типа и интенсивность его экспрессии в данной группе была достоверно ниже, чем в остальных биоптатах (p < 0,05).
В отличие от неактивных ПЗК, локализованных вокруг долек ПЖ и во внешнем слое стенки главного панкреатического протока, активированные α-SMA-позитивные ПЗК играют ключевую роль в развитии фиброза ПЖ при ХП [1, 3], секретируя, помимо коллагена, большое количество других компонентов ЭЦМ, среди которых важную роль играют фибронектин (протеин внеклеточного матрикса) и десмин (протеин промежуточных филаментов).
В нашем исследовании отмечалась визуализация фибронектина в соединительной ткани, не затрагивающая ацинусы, островки и эпителий крупных протоков (рис. 6).
В противоположность этому десмин определялся как в соединительной ткани, где характеризовался меньшей интенсивностью иммуноокрашивания, так и в ацинарной ткани и ткани эпителия протоков ПЖ (рис. 7). Паттерн его экспрессии в зонах фиброза при ХП был сходным с таковым для α-SMA, однако в 27,5 % случаев интенсивность окрашивания была ниже порога для определения морфометрическими методами.
/24-1.jpg)
Фибронектин, который синтезируется практически всеми видами клеток и присутствует в ПЖ в нерастворимой форме в виде фибриллярной сети на клеточной поверхности и во внеклеточном матриксе [13], связывается с агрегирующимися проколлагеновыми фибриллами и меняет кинетику образования фибрилл в перицеллюлярном матриксе. Нами была выделена группа случаев, характеризующихся высокой экспрессией фибронектина (n = 9). Дальнейшее исследование с использованием методов медицинской статистики показало, что средняя площадь коллагена І типа и интенсивность его экспрессии в данной группе были достоверно выше, чем в остальных биоптатах (p < 0,05).
Таким образом, при ИГХ-исследовании материала больных ХП установлено, что в зонах панкреатического фиброза сосредоточено большое количество активированных ПЗК, экспрессирующих α-SMA и десмин. Также в этих зонах обнаружено значительное накопление фибронектина, который в избытке синтезируется активированными ПЗК. Паттерн ИГХ окрашивания коллагена I типа в зонах тяжелого панкреатического фиброза характеризуется слабой и умеренной интенсивностью с умеренным уровнем его экспрессии.
Проведенные иммуногистохимические исследования показали, что наличие значительного числа α-SMA-положительных ПЗК, а также значительное количество фибронектина свидетельствуют об активности фиброзного процесса. Полученные данные морфологических изменений ткани ПЖ при исследовании операционного материала у больных с осложнениями ХП согласуются с последними данными, полученными при изучении процессов фиброзирования в ПЖ и других паренхиматозных органах [11, 17, 20]. Выявленная периневральная инфильтрация и периневральный фиброз в паренхиме ПЖ еще раз подтверждают данные о сложном механизме болевого синдрома у данной группы больных, который не может быть объяснен только центральной протоковой панкреатической гипертензией.
Процесс активации ПЗК связан со структурными нарушениями протоковой системы и разрушением ацинусов [3, 27], что согласовывается с данными нашего исследования, в котором выраженная картина вовлечения протоковой системы в процесс фиброзирования наблюдалась в 87,5 % случаев. Кроме того, очаги панкреатической интраэпителиальной неоплазии PanIN у больных с ХП еще раз показывают, что ХП является факультативным предраковым состоянием. При этом неоплазия начинается именно с протокового эпителия, чаще главного панкреатического протока, что впоследствии может привести к развитию протоковой аденокарциномы ПЖ. Этот факт обосновывает выполнение вирсунгэктомии при хирургическом лечении ХП.
Выводы
1. Характерная морфологическая картина развития ХП представляет собой деформацию протоковой системы на фоне фиброзирования со значительной извитостью и расширением протоков за счет перидуктального фиброза с расширением междольковых фиброзных септ, утолщением интралобулярных соединительнотканных тяжей и ретенционными кистами.
2. Выраженная структурная перестройка протоковой системы ПЖ у больных ХП наблюдалась в 87,5 % случаев, в 17,5 % случаев картина дополнялась явлениями ацинарно-протоковой метаплазии с трансформацией ацинарных клеток в протоковые и формированием мелких дуктулоподобных структур, так называемых тубулярных комплексов. В 7,5 % случаев в главном панкреатическом протоке определялись очаги атрофии протокового эпителия, которые чередовались с очагами папиллярной интраэпителиальной гиперплазии эпителия (PanIN).
3. Развитию панкреатического фиброза при ХП способствует накопление α-SMA+-активированных панкреатических звездчатых клеток, синтезирующих избыток компонентов экстрацеллюлярного матрикса, в частности коллагена I типа. Средняя площадь коллагена І типа и интенсивность его экспрессии были достоверно ниже при сниженной экспрессии α-SMA (p < 0,05) и достоверно выше в случаях выраженной экспрессии фибронектина (p < 0,05).
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Lew D. Chronic Pancreatitis: Current Status and Challenges for Prevention and Treatment / D. Lew, E. Afghani, S. Pandol // Digestive Diseases and Sciences. — 2017. — № 62. — С. 1702-1712.
2. Yadav D. The epidemiology of pancreatitis and pancreatic cancer / D. Yadav, A.B. Lowenfels // Gastroenterology. — 2013. — № 144. — С. 1252-1261.
3. Pathogenic mechanisms of pancreatitis / M. Manohar, A.K. Verma, S.U. Venkateshaiah et al. // World Journal of Gastrointestinal Pharmacology and Therapeutics. — 2017. — № 8. — Р. 10-25.
4. Маев И.В. Хронический панкреатит / И.В. Маев, А.Н. Казюлин, Ю.А. Кучерявый. — М.: Медицина, 2005. — 240 с.
5. Pancreatic stellate cell: Pandora’s box for pancreatic disease biology / R.R. Bynigeri, A. Jakkampudi, R. Jangala et al. // World Journal of Gastroenterology. — 2017. — № 23. — Р. 382-405.
6. Isolation and culture of primary human pancreatic stellate cells that reflect the context of their tissue of origin / O. Strobel, N. Dadabaeva, K. Felix et al. // Langenbecks Arch. Surg. — 2016. — № 401. — Р. 89-97.
7. Pancreatic stellate cells and pancreas cancer: current perspectives and future strategies / J. Haqq, L.M. Howells, G. Garcea et al. // Eur. J. Cancer. — 2014. — № 50. — С. 2570-2582.
8. Fibroblast activation protein-α-expressing fibroblasts promote the progression of pancreatic ductal adenocarcinoma / T. Kawase, Y. Yasui, S. Nishina et al. // BMC Gastroenterol. — 2015. — № 15. — Р. 109.
9. Diagnosis of mild chronic pancreatitis (Cambridge classification). Comparative study using secretin injection-magnetic resonance cholangiopancreatography and endoscopic retrograde pancreatography / Jin Kan Sai, Masafumi Suyama, Yoshihiro Kubokawa et al. // World J. Gastroenterol. — 2008. — № 14(8). — Р. 1218-1221.
10. Inhibition of Jak/STAT signaling reduces the activation of pancreatic stellate cells in vitro and limits caerulein-induced chro–nic pancreatitis in vivo / H.M. Komar, G. Serpa, C. Kerscher et al. // Scientific. Reports. — 2017. — № 7. — Р. 1787.
11. Establishment of animal models for three types of pancreatitis and analyses of regeneration mechanisms / Y. Sakaguchi, M. Inaba, K. Kusafuka et al. // Pancreas. — 2006. — № 33(4). — Р. 371-381.
12. The Role of Fibroblasts in Pancreatic Cancer: Extracellular Matrix Versus Paracrine Factors / S. Cigolla, U.A. Wittel, U.T. Hopt et al. // Transl. Oncol. — 2017. — № 10. — Р. 578-588.
13. Role of Extracellular Matrix in Pancreatic Diseases / T.M. Gress, A. Menke, M. Bachem et al. // Digestion. — 1998. — № 59. — Р. 625-637.
14. Patel M. Fibrogenesis in the pancreas after acinar call injury / M. Patel // Scandinavian Journal of Surgery. — 2005. — № 94. — Р. 108-111.
15. Pancreatic stellate cell: physiologic role, role in fibrosis and cancer / M. Apte, R.C. Priola, J.S. Wilson // Cur. Opin. Gastroenterol. — 2015. — № 31(5). — Р. 416-423.
16. Identification, culture, and characterization of pancreatic stellate cells in rats and humans / Bachem M.G., Schneider E.,
Gross H. et al. // Gastroenterology. — 1998. — № 115. — Р. 421-432.
17. Pancreatic stellate cells in pancreatic cancer: In focus / M. Allam, A.R. Thomsen, M. Gothwal et al. // Pancreatology. — 2017. — № 3(17). — Р. 30485-4.
18. Сіренко О.Ю. Панкреатичні зірчасті клітини як морфологічна основа розвитку фіброзу підшлункової залози / О.Ю. Сіренко // Морфологія. — 2010. — № 4(1). — C. 5-12.
19. Expression and Clinical Significance of Cancer Stem Cell Markers CD24, CD44, and CD133 in Pancreatic Ductal Adenocarcinoma and Chronic Pancreatitis / L. Durko, W. Wlodarski, O. Stasikowska-Kanicka et al. // Disease Markers. — 2017. — № 17. — Р. 3276806.
20. Apte M.V. Pancreatic stellate cells: a starring role in normal and diseased pancreas / M.V. Apte, R.C. Pirola, J.S. Wilson. // Front. Physiol. — 2012. — № 3. — Р. 344.
21. The role of stromal cancer-associated fibroblasts in pancreatic cancer / D. Ahrens, T.D. Bhagat, D. Nagrath et al. // Journal of Hematology & Oncology. — 2017. — № 10. — Р. 76.
22. Patel M.R. Hereditary pancreatitis for the endoscopist / M.R. Patel, A.L. Eppolito, F.F. Willingham // Therap. Adv. Gastroenterol. — 2013. — № 6. — Р. 169-79.
23. An optimised mouse model of chronic pancreatitis with a combination of ethanol and cerulein / A. Ahmadi, B. Nikkhoo, A. Mokarizadeh et al. // Cent. Eur. J. Immunol. — 2016. — № 41(1). — Р. 54-63.
24. Губергриц Н.Б., Беляева Н.В. Экзо- и эндокринная функции поджелудочной железы: один шаг от дуэта до дуэли / Н.Б. Губергриц, Н.В. Беляева // Сучасна гастроентерологія. — 2006. — № 4(30). — С. 18-30.
25. Dabbs D.J. Diagnostic immunohistochemistry / D.J. Dabbs. — 3rd ed. — New York: Ch. Livingstone, 2010. — 941 p.
26. Пат. 99314 Україна, МПК (2015) G01N 21/00, G06K 9/00. Спосіб фотоцифрової морфометрії імуногістохімічних препаратів / Туманський В.О., Євсєєв А.В., Коваленко І.С., Зубко М.Д.; заявник та патентовласник Запорізький держ. мед. ун-т. — № u 2014 14 103; Заявл. 29.12.2014; Опубл. 25.05.15, Бюл. № 10.
27. Oshmyanska N.Y. Death and regeneration of the pancreatic islets in relation to the development of fibrosis in patients with chronic pancreatitis / N.Y. Oshmyanska // Гастроентерологія. — 2014. — № 4(54). — Р. 88-95.

/22-1.jpg)
/23-1.jpg)
/24-1.jpg)