Резюме
Актуальність. Своєчасна діагностика стеатозу підшлункової залози (ПЗ) є необхідною умовою виявлення раннього метаболічного ризику та зниження захворюваності на хронічну гастроентерологічну патологію. Мета. Вивчення клініко-інструментальних особливостей стеатозу ПЗ у дітей із надмірною вагою та ожирінням. Матеріали та методи. У 53 дітей із функціональними розладами шлунково-кишкового тракту визначали наявність стеатозу ПЗ за допомогою ультразвукового дослідження. Розподіл за групами відбувся на основі наявності стеатозу ПЗ, ожиріння та надмірної ваги: 1 групу становили 24 пацієнти зі стеатозом ПЗ, ожирінням та надмірною вагою, 2 групу — 18 дітей з ожирінням і надмірною вагою без ознак стеатозу ПЗ, контрольну групу — 11 пацієнтів без стеатозу ПЗ, які мали нормальну вагу. Результати. Клінічна картина у дітей зі стеатозом ПЗ у більшості пацієнтів пояснювалась наявністю супутньої гастроентерологічної патології; 29,1 % хворих основної групи скаржились на біль у лівому підребер’ї. При аналізі диспептичних скарг слід відзначити, що пацієнти зі стеатозом ПЗ частіше скаржились на нудоту (58,3 %), метеоризм (45,8 %) проти пацієнтів, які мали нормальну вагу, однак значущість відмінностей не була достатньою. У пацієнтів 1 групи частіше виявлялась болісність при пальпації за ходом кишечника проти пацієнтів 2 групи. Болісність при пальпації в панкреатичних точках була вірогідно вищою у пацієнтів 1 групи (54,1 %) проти 3 групи. Підвищення ехогенності печінки в 2,4 раза частіше зустрічалось у пацієнтів 1 групи проти 2 групи та в 7 раз частіше, ніж у 3 групі. Зокрема, зміни зернистості печінки втричі частіше зустрічались у пацієнтів зі стеатозом ПЗ (p < 0,05), ніж у пацієнтів без стеатозу та з трофічними розладами, а також дітей, які мають нормальну вагу. Зміни ПЗ при її стеатозі проявлялись не лише змінами ехогенності, але й у майже половини пацієнтів (45,8 %) наявністю нечітких контурів органу, підвищенням зернистості (65,5 %). Об’єм і товщина стінки жовчного міхура були вірогідно вищими у групі дітей зі стеатозом ПЗ проти контрольної групи. Ознаки біліарного сладжу вдвічі частіше зустрічались у дітей зі стеатозом проти групи дітей без стеатозу та в 4 рази частіше, ніж у дітей, які мають нормальну вагу (43,87 % у 1 групі, 21 % у 2 групі та 9 % у 3 групі). Висновки. Клінічні та сонологічні зміни у пацієнтів зі стеатозом ПЗ свідчать про можливість запальних змін у паренхімі залози, що пов’язані із системним запаленням на фоні стеатозу та супутньою патологією органів шлунково-кишкового тракту.
Актуальность. Своевременная диагностика стеатоза поджелудочной железы (ПЖ) является необходимым условием определения раннего метаболического риска и снижения заболеваемости хронической гастроэнтерологической патологией. Цель. Изучение клинико-сонографических особенностей стеатоза ПЖ у детей с избыточным весом и ожирением. Материалы и методы. У 53 детей с функциональными расстройствами желудочно-кишечного тракта определяли наличие стеатоза ПЖ с помощью ультразвукового исследования. Распределение по группам проводилось на основе наличия стеатоза ПЖ, ожирения и избыточного веса: 1 группу составили 24 пациента со стеатозом ПЖ, ожирением и избыточным весом, 2 группу — 18 детей с ожирением и избыточным весом без признаков стеатоза ПЖ, контрольную группу — 11 пациентов без стеатоза ПЖ с нормальным весом. Результаты. Клиническая картина у детей со стеатозом ПЖ объяснялась наличием сопутствующей гастроэнтерологической патологии; 29,1 % больных основной группы жаловались на боль в левом подреберье. Пациенты со стеатозом ПЖ чаще жаловались на тошноту (58,3 %), метеоризм (45,8 %) по сравнению с пациентами, имевшими нормальный вес, однако значимость различий не была достаточной. У пациентов 1 группы чаще выявлялась болезненность при пальпации по ходу кишечника по сравнению с пациентами 2 группы. Болезненность при пальпации в панкреатических точках была достоверно более частым симптомом у пациентов 1 группы (54,1 %) по сравнению с 3 группой. Повышение эхогенности печени в 2,4 раза чаще встречалось у пациентов 1 группы по сравнению со 2 группой и в 7 раз чаще, чем у пациентов 3 группы. Изменения зернистости печени втрое чаще встречались у пациентов со стеатозом ПЖ (p < 0,05) по сравнению как с пациентами без стеатоза и с трофическими расстройствами, так и с детьми, имеющими нормальный вес. Изменения ПЖ при ее стеатозе проявлялись не только изменениями эхогенности, но и наличием нечетких контуров органа почти у половины пациентов (45,8 %), повышением зернистости (65,5 %). Объем и толщина стенки желчного пузыря в группе детей со стеатозом ПЖ достоверно превышали показатели контрольной группы. Признаки билиарного сладжа вдвое чаще встречались у детей со стеатозом по сравнению с группой детей без стеатоза и в 4 раза чаще, чем у детей с нормальным весом (43,87, 21 и 9 % соответственно). Выводы. Таким образом, клинические и сонографические данные пациентов со стеатозом ПЖ свидетельствуют о возможности воспалительных изменений в паренхиме железы, связанных с системным воспалением на фоне стеатоза и сопутствующей патологией органов желудочно-кишечного тракта.
Background. Early diagnosis of pancreatic steatosis is essential for the early metabolic risk detection and chronic gastroenterological morbidity reduction. The purpose was to examine the clinical and sonographic features of pancreatic steatosis in children with overweight and obesity. Materials and methods. The presence of pancreatic steatosis was determined by ultrasonography in 53 children with functional disorders of the gastrointestinal tract. Division in groups was performed on the basis of pancreatic steatosis and obesity/overweight presence: group 1 consisted of 24 patients with pancreatic steatosis and obesity/overweight, group 2 included 18 children with obesity/overweight with no signs of pancreatic steatosis, the control group consisted of 11 patients without pancreatic steatosis and with normal weight. Results. The clinical picture in children with pancreatic steatosis may be explained by concomitant gastroenterological diseases, but 29.1 % of group 1 patients complained of pain in the left upper quadrant. Patients with steatosis often complained of nausea (58.3 %), flatulence (45.8 %) in comparison to patients who had normal weight, but the significance of the differences was not sufficient. Group 1 patients often reported pain on palpation of the intestine compared with other 2 groups. Pain on palpation in pancreatic points was significantly higher in group 1 patients (54.1 %) compared to group 3. Increased liver echogenicity was found 2.4 times more often in group 1 patients compared with group 2. In particular, changes in liver grains were three times more common in patients with steatosis (p < 0.05), as compared to the obese patients without steatosis and to the children with normal weight. Pancreatic changes in steatosis manifested not only by the changes in echogenicity, but also by fuzzy contours of the pancreas, increased grain (65.5 %) in almost half of patients (45.8 %). Gallbladder volume and wall thickness were significantly higher in the group of children with steatosis compared to the control group. Symptoms of biliary sludge were twice more common in children with steatosis compared to children without steatosis and 4 times more likely than in children with normal weight (43.87 % in group 1; 21 % in group 2, and 9 % in group 3). Conclusions. Thus, clinical and sonographic features in patients with steatosis indicate the possibility of inflammatory changes in the parenchyma associated with systemic inflammation due to steatosis and concomitant diseases of the gastrointestinal tract.
Вступ
Поширеність дитячого ожиріння та метаболічного синдрому зростає в усьому світі, набуваючи характеру епідемії [1]. Останніми роками спостерігається глобальна тенденція до зростання патології підшлункової залози (ПЗ) [2]. Поєднання стеатозу ПЗ із компонентами метаболічного синдрому (ожирінням, дисліпідемією, порушенням толерантності до вуглеводів, артеріальною гіпертензією) за винятком вторинних причин стеатозу свідчить про наявність неалкогольної жирової хвороби ПЗ [3].
Стеатоз ПЗ зазвичай має тривалий безсимптомний перебіг і є випадковою знахідкою під час проведення ультразвукового дослідження (УЗД) [4]. Клінічні наслідки стеатозу ПЗ включають β-клітинну дисфункцію, екзокринну недостатність, розвиток хронічного панкреатиту, підвищений ризик післяопераційних ускладнень у пацієнтів, які перенесли оперативне втручання на ПЗ, а також обтяження перебігу гострого панкреатиту [5]. За даними дослідників, цей патологічний стан може бути асоційований із субклінічним атеросклерозом і передувати появі стеатозу печінки [3]. Стеатоз ПЗ рідко має ізольований перебіг, адже в пацієнтів з ожирінням виявляється різноманітна супутня патологія органів черевної порожнини, що може сприяти реактивному запаленню ПЗ. З іншого боку, жирова інфільтрація органу може призводити до запалення залози з розвитком стеатопанкреатиту [3, 5].
Гіперехогенність ПЗ у осіб з ожирінням переважно пояснюється наявністю стеатозу ПЗ [5]. За даними популяційного дослідження, проведеного в Японії, у загальній популяції наявність гіперехогенності ПЗ незалежно асоційована з підвищеним індексом маси тіла (ІМТ), інсулінорезистентністю та зниженим рівнем адипонектину [6].
УЗД є найбільш доступним методом діагностики стеатозу ПЗ, чутливість якого варіює від 37 до 94 %, а специфічність — від 48 до 100 % [4]. З метою виявлення стеатозу ПЗ запропоновані різні методики, що базуються на порівнянні ехогенності ПЗ з ехогенністю печінки, нирок, селезінки та заочеревинної жирової тканини [3, 6]. Методика, заснована на порівнянні ехогенності ПЗ з ехогенністю печінки, піддається критиці, тому що у значної частини пацієнтів з ожирінням спостерігається підвищення ехогенності печінки, пов’язане зі стеатозом органу [5]. J. Lee та співавт. запропоновано класифікацію стеатозу ПЗ за ступенями згідно з даними трансабдомінального УЗД, яка визначає три ступені стеатозу ПЗ при попарному порівнянні ехогенності ПЗ з ехогенністю нирок і заочеревинного жиру [7, 8].
Наявність дифузних змін ПЗ при сонологічному обстеженні дитини з ожирінням або надмірною вагою ставить перед лікарем непросте завдання. Адже встановлення клінічного діагнозу та розроблення лікувальної тактики у даному випадку не регламентується існуючими протоколами та клінічними настановами. Отже, є потреба у комплексній оцінці клінічної симптоматики та структурних змін ПЗ у дітей з ожирінням і надмірною вагою.
Мета: вивчення клінічних та структурних змін, що характеризують перебіг стеатозу ПЗ у дітей.
Матеріали та методи
Під нашим спостереженням перебувало 53 дитини, які лiкувались у дитячому відділенні ДУ «Інститут гастроентерології НАМН України» м. Дніпро в 2016 році. Всім обстеженим проведені антропометричні дослідження з визначенням ІМТ. Оцінку стану трофіки проводили за рекомендаціями Всесвітньої організації охорони здоров’я згідно з центильними таблицями значень ІМТ відповідно до віку й статі [9]. При перевищенні показника ІМТ у межах від 1 до 2 стандартних відхилень діагностували надлишкову вагу. При збільшенні ІМТ понад 2 стандартних відхилення діагностували ожиріння. Здійснювали вимірювання окружності талії, стегна і збіг отриманих значень з даними центильних таблиць, рекомендованих Міжнародною діабетичною федерацією (IDF) [10]. УЗД органів черевної порожнини проводили за загальноприйнятою методикою на апараті Toshiba Xario (Японія) у режимі реального часу за стандартними умовами: зранку, натще, в горизонтальному положенні та на лівому/правому боці. Наявність стеатозу ПЗ визначалась за допомогою методики, що була запропонована J. Lee і співавт. (2009): легкий ступінь стеатозу ПЗ встановлювався, коли ехогенність ПЗ перевищувала ехогенність нирок, але була значно нижчою від ехогенності заочеревинного жиру; середній ступінь — при ехогенності ПЗ, що перевищувала ехогенність нирок, але була незначно нижчою від ехогенності заочеревинного жиру; тяжкий ступінь — якщо ехогенність ПЗ була подібною до ехогенності заочеревинного жиру [8].
Залежно від наявності стеатозу ПЗ та нутритивного статусу було сформовано 3 групи: 1 група — 24 дитини, які мали стеатоз ПЗ та ожиріння або надмірну вагу; 2 група — 18 дітей, які мали ожиріння або надмірну вагу та не мали ознак стеатозу ПЗ; 3 група — 11 дітей з нормальною вагою без ознак стеатозу ПЗ.
Середній вік пацієнтів становив (11,27 ± 2,76) року. Групи були однорідними за віковим і статевим розподілом.
Статистичний аналіз отриманих даних проведено за допомогою пакета прикладних програм Statistica 7.0. Для статистичного аналізу даних використовували дескриптивну статистику; для порівняння середніх значень змінних використовували непараметричний метод (U-критерій Манна — Уїтні). Відмінності визнавались значущими при р ≤ 0,05.
Результати
За віковими характеристиками вірогідних відмінностей пацієнти у групах не мали. Але слід зауважити, що стеатоз ПЗ частіше виявлявся у групі дітей старше 10 років (рис. 1а).
За гендерним складом співвідношення хлопчиків і дівчат вірогідної різниці між групами не мало, проте у групі дітей зі стеатозом ПЗ більше половини хворих (66,6 %) були представники чоловічої статі (рис. 1б).
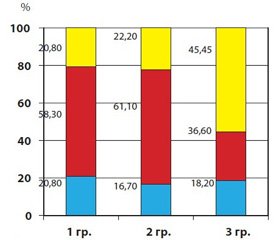
При аналізі антропометричних даних виявлено, що серед пацієнтів 1 групи 20 (83,3 %) пацієнтів мали ожиріння, 4 (16,7 %) — надмірну вагу (табл. 1).
/33-1.jpg)
У 2 групі половину хворих (50,0 %) становили пацієнти з ожирінням. Середні показники ІМТ у хворих 1 та 2 груп не мали статистично значущих відмінностей (25,61 ± 3,70 та 24,59 ± 2,60 відповідно) та були вірогідно вищими за показники ІМТ 3 групи (18,73 ± 1,26). Однак виявлено вірогідні відмінності між середніми показниками окружності талії (ОТ) пацієнтів зі стеатозом ПЗ і пацієнтів з ожирінням без стеатозу (88,00 ± 10,17 у 1 групі та 79,70 ± 6,88 у 2 групі). У 3 групі середній показник ОТ становив (63,27 ± 5,85) і був вірогідно нижчим за показник 1 та 2 груп. Абдомінальний тип розподілу жирової тканини, визначений за перевищенням ОТ значень 95 перцентилю для відповідного віку та статі, частіше зустрічався у пацієнтів зі стеатозом ПЗ (79,2 %) порівняно з 38,8 % у хворих із надмірною вагою без стеатозу ПЗ (p = 0,04). У 3 групі показники ОТ жодного пацієнта не перевищували 95 перцентиль для відповідного віку та статі (табл. 1). Співвідношення ОТ до окружності стегна (ОС) було вірогідно вищим у 1 групі порівняно з відповідним показником 2 та 3 груп.
При аналізі скарг хворих виявлено, що переважна більшість пацієнтів мала больовий і диспептичний синдроми. Найчастіше пацієнти скаржились на біль у верхній половині живота та навколопупковій ділянці без суттєвих відмінностей між групами. Майже половина хворих (45,8 %) зі стеатозом ПЗ скаржились на біль в епігастрії та навколопупковій ділянці, третина хворих (29,1 %) — на біль у лівому підребер’ї, 20 % хворих зі стеатозом ПЗ пред’являли скарги на біль у правому підребер’ї та 16,7 % скаржились на біль в гіпогастрії. Аналогічні тенденції спостерігались у групі хворих з ожирінням та надмірною вагою без стеатозу ПЗ, однак скарги на біль у лівому підребер’ї зустрічались рідше (5,5 % хворих) (p > 0,1).
Під час аналізу диспептичних скарг пацієнти зі стеатозом ПЗ частіше скаржились на нудоту (58,3 %), метеоризм (45,8 %) проти пацієнтів, які мали нормальну вагу (27,27 та 9,09 % відповідно), однак значущість відмінностей не була достатньою.
Аналіз даних об’єктивного огляду виявив, що у пацієнтів 1 групи частіше спостерігалась болісність при пальпації за ходом кишечника (45,83 % пацієнтів, p < 0,05) проти пацієнтів 2 групи (16,67 %). Частота виявлення болісності при пальпації в панкреатичних точках була вірогідно вищою у пацієнтів 1 групи (54,1 %) проти хворих 3 групи (9,09 %). Гепатомегалія та болісність у точці Кера при клінічному огляді частіше зустрічались у хворих основної групи (рис. 2).
/34-1.jpg)
Аналіз даних ультразвукового дослідження органів черевної порожнини виявив, що зміни зернистості печінки втричі частіше зустрічались у пацієнтів зі стеатозом ПЗ (p < 0,05), як порівнюючи з пацієнтами із надмірною вагою без стеатозу, так і з дітьми, які мали нормальну вагу. Зміни ехогенності печінки (а саме її підвищення) в 2,4 раза частіше зустрічались у пацієнтів 1 групи проти 2 групи та в 7 разів частіше проти 3 групи. У третини пацієнтів 1 групи (29,1 %) та лише в 1 пацієнта з ожирінням без стеатозу ПЗ спостерігалось дистальне затухання ультразвуку, але значущість відмінностей між частотою виявлення цієї ознаки між групами не була достатньою. Середні розміри печінки у представників 1 групи були вірогідно вищими проти 3 та 2 груп, але значущість відмінностей проти 2 групи не була достатньою (табл. 2).
/35-1.jpg)
Для стеатозу ПЗ характерним було підвищення ехогенності паренхіми ПЗ. Було виявлено, що серед пацієнтів 1 групи 8 (33,3 %) дітей мали 1 ступінь стеатозу, 13 (54,1 %) дітей — 2 ступінь, 3 (12,5 %) дитини — 3 ступінь. Зміни ПЗ при її стеатозі проявлялись не лише змінами ехогенності, але й наявністю нечітких контурів органу майже у половини пацієнтів (45,8 %), підвищенням зернистості (65,5 %).
Середні розміри головки, тіла та хвоста ПЗ були вищими у представників 1 групи, виявлено вірогідні відмінності у розмірах головки та хвоста ПЗ у дітей 1 групи проти дітей 3 групи (табл. 2). Середні розміри хвоста ПЗ у представників 2 групи були вірогідно вищими порівняно з 3 групою.
Об’єм жовчного міхура був вірогідно вищим у групі дітей зі стеатозом, як проти дітей із трофічними розладами без стеатозу, так і проти контрольної групи. Товщина стінки жовчного міхура була вірогідно вищою у 1 групі порівняно з 3 групою — (1,8 ± 0,4) мм проти (1,41 ± 0,43) мм. Ознаки біліарного сладжу вдвічі частіше зустрічались у дітей зі стеатозом проти групи дітей без стеатозу та в 4 рази частіше, ніж у дітей із нормальною вагою (42,22 та 9 % відповідно).
Обговорення
Виявлення стеатозу ПЗ зростає з віком і тривалістю перебігу ожиріння. За нашими даними, маніфестація ектопічного накопичення жиру у переважній більшості пацієнтів відбувається у віці понад 8 років, частота виявлення стеатозу ПЗ зростає у групі дітей віком від 10 років. Гендерні відмінності розподілу вісцерального жиру були продемонстровані у дослідженні J. Lee та співавт. [8], які виявили підвищення вмісту жирової тканини ПЗ у представників чоловічої статі незалежно від ІМТ. Такий розподіл, імовірно, пов’язаний із впливом естрогенів на жировий обмін у хворих жіночої статі, протекторна активність яких щодо прогресування стеатогепатиту вже доведена у клінічних дослідженнях [11–13]. У нашому дослідженні не виявлено вірогідних відмінностей гендерного складу досліджуваних груп, але спостерігалась тенденція до переважання представників чоловічої статі серед пацієнтів зі стеатозом ПЗ.
Отримані нами дані свідчать, що пацієнти зі стеатозом ПЗ відрізняються від пацієнтів з ожирінням без стеатозу ПЗ вищими середніми показниками ОТ та співвідношенням ОТ/ОС при подібних показниках ІМТ. У дітей зі стеатозом ПЗ показник ОТ перевищував 95 перцентиль для відповідного віку та статі у 3/4 досліджуваних, що разом із відповідним показником співвідношення ОТ/ОС свідчить про центральне ожиріння у пацієнтів даної групи. Саме центральний тип ожиріння, за літературними джерелами, тісно асоційований з інсулінорезистентністю [11]. ІМТ, який використовується в клінічній практиці для діагностики ожиріння, не несе інформації про розподіл жиру в організмі. Отже, діти і підлітки з нормальним ІМТ можуть страждати від абдомінального ожиріння, а діти з підвищеним ІМТ можуть мати «метаболічно здорове ожиріння» (МЗО). До категорії МЗО зараховують осіб, які страждають від ожиріння та не мають резистентності до інсуліну, дисліпідемії або гіпертонії. Численні дослідження демонструють, що 10–25 % пацієнтів із надмірною вагою можуть бути класифіковані як MЗO [15, 16]. Тому, в наш час Міжнародна федерація вивчення діабету рекомендує використовувати показник ОТ у дітей як обов’язковий діагностичний компонент [10], що виявив свою інформативність також як фактор ризику стеатозу ПЗ.
Больовий синдром у дітей зі стеатозом ПЗ у нашому дослідженні проявлявся скаргами на біль у лівому підребер’ї (у третини хворих) та болісністю при пальпації в панкреатичних точках (у половини хворих основної групи). Для ізольованого стеатозу ПЗ больовий синдром не є характерним. Можна припустити, що особливості больового синдрому у пацієнтів зі стеатозом ПЗ пояснюються наявністю реактивного стеатопанкреатиту. Больовий синдром при патології ПЗ зазвичай пов’язаний із порушенням відтоку панкреатичного соку та протоковою гіпертензією, запаленням внутрішньопанкреатичних нервових стовбурів з розвитком перипанкреатичного запалення й залученням до процесу дванадцятипалої кишки. Панкреатичний біль на фоні супутньої патології шлунково-кишкового тракту також може пояснюватись вісцеро-вісцеральним рефлексом і обмежуватись тимчасовим набряком ПЗ [17, 19]. Відомо, що у пацієнтів з ожирінням спостерігається підвищення внутрішньочеревного тиску, що може сприяти рефлюксу вмісту дванадцятипалої кишки в головну панкреатичну протоку з подальшою активацією протеаз, що може призвести до розвитку панкреатиту. Для пацієнтів з ожирінням, що було підтверджено у нашому дослідженні, характерним є наявність біліарного сладжу та жовчнокам’яної хвороби, що також є фактором ризику ураження ПЗ [17, 18].
Як було показано у нашій попередній роботі, клінічні симптоми, що спостерігались у пацієнтів зі стеатозом ПЗ (нудота, метеоризм, болісність при пальпації за ходом кишечника), можуть пояснюватись синдромом надмірного бактеріального росту, який вірогідно частіше спостерігається у пацієнтів зі стеатозом ПЗ, що, в свою чергу, може бути обумовлено порушенням інтестинальної мікрофлори на фоні відносної зовнішньосекреторної недостатності ПЗ [20].
Структурні зміни органів черевної порожнини у дітей зі стеатозом ПЗ не обмежувались змінами її ехогенності. УЗД виявило вірогідне збільшення розмірів печінки при наявності стеатозу ПЗ (р < 0,05) за рахунок всіх часток проти дітей, які мали нормальну вагу. Стеатоз ПЗ супроводжувався підвищенням ехогенності та змінами структури печінки, що свідчить на користь наявності стеатозу печінки у досліджуваних. Лише в 1 пацієнта з ожирінням без ознак стеатозу (5,5 %) та у третини хворих (29,2 %) зі стеатозом ПЗ при сонографії печінки спостерігався феномен дистального затухання ультразвуку. Характерні ознаки стеатозу печінки, за даними УЗД, мали 35,7 % дітей з ожирінням та надмірною вагою, а ознаки стеатозу ПЗ — 57,1 %. Ці дані свідчать, що стеатоз ПЗ може передувати розвитку стеатозу печінки і виступати як ранній маркер метаболічного ризику. Так, за даними літературних джерел, поєднання УЗ-ознак неалкогольної жирової хвороби печінки і стеатозу ПЗ відзначається в 68 % випадків, стеатозу ПЗ і нормальної УЗ-картини печінки — в 30 % випадків і лише в 2 % ознаки стеатозу печінки не асоціюються зі стеатозом ПЗ [21]. Uygun et al. спостерігали поєднання стеатозу ПЗ і неалкогольного стеатогепатиту у 51,2 % випадків [22].
При аналізі змін з боку жовчного міхура (ЖМ) виявлено, що у пацієнтів зі стеатозом ПЗ спостерігається збільшення об’єму та товщини стінки ЖМ. Біліарний сладж частіше зустрічався у дітей зі стеатозом ПЗ проти групи дітей без стеатозу та з ожирінням і дітей з нормальною вагою. Відомо, що перенасичення жовчі холестерином і утворення кристалів жовчі, а також вісцеральне ожиріння пов’язані з ростом патології ПЗ. У 35–56 % випадків патологія жовчовивідних шляхів визнана фактором, що призводить до загострення хронічного панкреатиту. При холелітіазі та біліарному сладжі жовч містить значну кількість продуктів перекисного окислення ліпідів, що й надає їй особливі агресивні властивості при рефлюксі до панкреатичних протоків [18]. Існують дослідження, що свідчать про збільшення вмісту ліпідів у стінці ЖМ у пацієнтів з ожирінням та стеатозом печінки, яке асоційоване зі зниженням скоротливої здатності ЖМ [23]. Отже, зміни об’єму та товщини стінки ЖМ у дітей зі стеатозом ПЗ можуть свідчити про супутню жирову інфільтрацію ЖМ у цих пацієнтів.
Нами були виявлені зміни не лише ехогенності, а й зернистості, контурів і розмірів ПЗ. При УЗД органа зі стеатозом наявність багатьох невеликих вкраплень краплеподібної форми призводить до того, що ультразвук, падаючи по дотичній та багатократно відбиваючись в різних напрямках, не може проникнути на велику глибину, отже, підвищення розсіювання призводить до зниження звукопровідності та підвищення ехогенності. Підвищення ехогенності ПЗ також спостерігається при хронічному панкреатиті, однак у цьому випадку є плямистим і неоднорідним на відміну від нормального гомогенного посилення ехоструктури внаслідок жирового заміщення залозистої тканини [24]. При хронічному панкреатиті існує декілька УЗ-ознак патологічного процесу в ПЗ: збільшення або зменшення залози у розмірах, виражена неоднорідність структури, наявність звапнення, дуоденостаз, нерівність контурів, нечітка межа з навколишніми тканинами, формування кіст, розширення панкреатичної протоки [25].
Пацієнти з ожирінням без стеатозу вірогідно відрізнялись розмірами хвостової частини ПЗ проти пацієнтів із нормальною вагою, в той час як пацієнти зі стеатозом ПЗ мали більші розміри головки та хвоста ПЗ, якщо порівняти з пацієнтами, які мають нормальну вагу; однак розміри ПЗ не виходили за межі вікової норми. Класичними УЗ-ознаками гострого запалення ПЗ є дифузне збільшення залози із загальним зниженням її ехогенності. При гострому панкреатиті можливим є гіпоехогенне вогнищеве збільшення ПЗ, яке виявляють звичайно у головці [25]. Таким чином, зміни контурів і розмірів, збільшення зернистості й ехогенності свідчать на користь наявності супутнього запального процесу в залозі у групі дітей зі стеатозом ПЗ.
Більшість дослідників сходяться в тому, що морфофункціональний стан ПЗ при ожирінні та метаболічному синдромі можна характеризувати як дисметаболічну панкреатопатію (стеатоз, ліпогенний панкреатит, неалкогольну жирову хворобу ПЗ), що полягає в дифузному розвитку жирової тканини в усіх відділах органу і поєднується з низькорівневим запаленням [21, 26].
Отже, клінічні та сонологічні зміни у пацієнтів зі стеатозом ПЗ свідчать про можливі запальні зміни у паренхімі залози, що пов’язані із системним запаленням на фоні стеатозу та супутньою патологією органів шлунково-кишкового тракту.
Висновки
1. Абдомінальний тип розподілу жирової тканини пов’язаний із підвищенням ризику розвитку стеатозу ПЗ, тому вимірювання ОТ у дітей з ожирінням повин–но виступати як обов’язковий компонент діагностичного алгоритму.
2. Больовий і диспептичний синдроми, характерні для дітей зі стеатозом ПЗ, можуть пояснюватись існуванням реактивного запалення залози та синдрому надмірного бактеріального росту.
3. У дітей зі стеатозом ПЗ частою супутньою патологією є неалкогольна жирова хвороба печінки та патологія біліарного тракту у вигляді біліарного сладжу й стеатозу жовчного міхура.
4. Сонологічна характеристика хворих зі стеатозом ПЗ свідчить про те, що стеатоз її може супроводжуватись запальними змінами, а саме змінами контурів, зернистості та ехогенності залози.
Додаткова інформація. УЗ-обстеження органів черевної порожнини проводилось н.с. відділу міні-інвазивних ендоскопічних втручань та інструментальної діагностики ДУ «Інститут гастроентерології НАМН України» І.С. Коненко.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Weiss R. What is metabolic syndrome, and why are children getting it? / R. Weiss, A.A. Bremer, R.H. Lustig // Annals of the New York Academy of Sciences. — 2013. — № 1281(1). — P. 123-140. doi: 10.1111/nyas.12030.
2. Маев И.В. Хронический панкреатит: Учебное пособие / Маев И.В., Казюлин А.Н., Дичева Д.Т., Кучерявый Ю.А. — М.: ВУНМЦ МЗ РФ. — 2007. — 80 с.
3. Exploring the metabolic syndrome: Nonalcoholic fatty pancreas disease / R. Catanzaro, B. Cuffari, A.A. Italia [et al.] // World Journal of Gastroenterology. — 2016. — Vol. 22(34). — P. 7660-7675. doi: 10.3748/wjg.v22.i34.7660.
4. Самсонова Н.Г. Клинико-функциональное состояние поджелудочной железы при метаболическом синдроме / Н.Г. Самсонова, Л.А. Звенигородская // ЭиКГ. — 2012. — № 11. — С. 96-100.
5. Smereczyński A. Is a fatty pancreas a banal lesion? / A. Smereczyński, K. Kołaczyk // Journal of Ultrasonography. — 2016. — Vol. 16(66). — P. 273-280. doi: 10.15557/JoU.2016.0027.
6. Pancreatic hyperechogenicity associated with hypoadiponectinemia and insulin resistance: A Japanese population study / Makino N., Shirahata N., Honda T. [et al.] // World Journal of Hepatology. — 2016. — Vol. 8(33). — P. 1452-1458. doi: 10.4254/wjh.v8.i33.1452.
7. Pancreatic steatosis and its association with nonalcoholic fatty liver disease evaluated by ultrasonography / Luis Jesuino de Oliveira Andrade, Laryssa Rocha Guimarães, Raissa Brito Fernandes Cadete [et al.] // Brazilian Journal of Medicine and Human Health. — 2015. — № (2). — Р. 37-43.
8. Clinical implications of fatty pancreas: correlations between fatty pancreas and metabolic syndrome / J.S. Lee, S.H. Kim, D.W. Jun [et al.] // World J. Gastroenterol. — 2009. — № 15. — Р. 1869-75.
9. World Health Organization: Growth reference 5–19 years. BMI-for-age (5-19 years). — Режим доступу: http://www.who.int/growthref/who2007_bmi_for_age/en/
10. Waist circumference percentiles in nationally representative samples of African-American, European-American, and Mexican-American children and adolescents / J.R. Fernández, D.T. Redden, A. Pietrobelli, D.B. Allison // J. Pediatr. — 2004. — № 145(4). — Р. 439-44.
11. Pancreatic fat accumulation and its relationship with liver fat content and other fat depots in obese individuals / G. Targher, A.P. Rossi, G.A. Zamboni [et al.] // J. Endocrinol. Invest. — 2012. — № 35. — P. 748-753. doi: 10.3275/8011
12. Abdominal fat distribution and peripheral and hepatic insulin resistance in type 2 diabetes mellitus / Miyazaki Y., Glass L., Triplitt C. [et al.] // Am. J. Physiol. Endocrinol. Metab. — 2002. — № 283. — Р. 1135-1143.
13. Gender-based differences in the relationship between fatty liver disease and atherosclerosis / Hyun-Jin Kim, Chae-wan Lim, Jae hyuk Lee [et al.] // Cardiovasc. J. Afr. — 2016. — Vol. 27. — online publication doi: 10.5830/CVJA-2016-014
14. Amalia Gastaldelli Ectopic fat: a target for cardiometabolic risk management / Amalia Gastaldelli, Melania Gaggini // Expert Review of Cardiovascular Therapy. — 2016. — Vol. 14, № 12 — Р. 1301-1303. doi: 10.1080/14779072.2016.1256773
15. Kim D. Nonobese Fatty Liver Disease / D. Kim, W.R. Kim // Clin. Gastroenterol. Hepatol. — 2016. — Vol. 1542-3565(16). — P. 30608-5. doi: 10.1016/j.cgh.2016.08.028.
16. The prevalence of metabolic syndrome and metabolically healthy obesity in Europe: a collaborative analysis of ten large cohort studies / Van Vliet-Ostaptchouk J.V., Nuotio M.-L., Slagter S.N., Doiron [et al.] // BMC Endocrine Disorders. — 2014. — Vol. 14. — P. 9. http://doi.org/10.1186/1472-6823-14-9
17. Бабінець Л.С. Клініко-патогенетичні аспекти хронічного панкреатиту біліарного генезу та ожиріння / Л.С. Бабінець, К.Ю. Кицай // Гастроентерологія. — 2016. — № 1(59). — C. 86-92.
18. Степанов Ю.М. Хронічний панкреатит: біліарний механізм, чинники та перебіг / Ю.М. Степанов, Н.Г. Заіченко // Запорожский медицинский журнал. — 2012. — №1 (70). — С. 46-50.
19. Белоусов Ю.В. Панкреатит и панкреатопатия: классификационные характеристики, принципы диагностики и лечения у детей // Здоровье ребенка. — 2012. — № 8(43). — С. 129-133.
20. Степанов Ю.М. Клініко-інструментальні особливості стеатозу підшлункової залози у дітей з надмірною вагою та ожирінням / Ю.М. Степанов, Н.Ю. Звгородня, О.Ю. Лук’яненко // Гастроентерологія. — 2017. — № 1.
21. Самсонова Н.Г. Клинико-диагностические особенности стеатоза поджелудочной железы у больных с метаболическим синдромом // ЭиКГ. — 2012. — № 7.
22. The effect of fatty pancreas on serum glucose parameters in patients with nonalcoholic steatohepatitis / A. Uygun, A. Kadayifci, H. Demirci [et al.] // Eur. J. Intern. Med. — 2015. — Vol. 26. — P. 37-41.
23. Di Ciaula A. Gallbladder and gastric motility in obese newborns, pre-adolescents and adults / A. Di Ciaula, D.Q. Wang, P. Portincasa // J. Gastroenterol. Hepatol. — 2012. — Vol. 27, № 8. — P. 1298-1305. doi: 10.1111/j.1440-1746.2012.07149.x.
24. Эхография органов брюшной полости и забрюшинного пространства / Н.П. Булгак, О.П. Прокопенко, А.И. Голунов, Н.В. Колодяжная. — СПб.: Судостроение, 1996. — 160 с.
25. Уніфіковані клінічні протоколи медичної допомоги дітям із захворюваннями органів травлення / Наказ Міністерства охорони здоров’я України від 29.01.2013 р. № 59.
26. Звенигородская Л.А. Функциональные и клинико-морфологические изменения поджелудочной железы при метаболическом синдроме / Л.А. Звенигородская, Н.Э. Хачатурян // Consilium Medicum. — 2016. — № 8. — C. 51-58.
/35-1.jpg)

/33-1.jpg)
/34-2.jpg)
/34-1.jpg)