Вступ
Про вплив печінки на психічний стан людини було відомо з давніх часів. В античності печінку вважали джерелом передбачення та використовували назву, що означає «душа» або «настрій». У давньокитайскій медицині (1000 р. до н.е.) печінку розглядали як орган, що зберігав кров та вміщував в собі душу. В 460–370 рр. до н.е.
Гіппократ описав хворого на гепатит, який «гавкав, як собака, не міг зупинитись та говорив речі, які не можна було зрозуміти». Німецький клініцист та патолог Frerichs так описав кінцеві психічні зміни у хворих з ураженням печінки: «Я спостерігав випадки, коли особи, які впродовж довгого часу хворіли на цироз печінки, неочікувано впадали в безпам’ять, з наступним розвитком делірію, який переходив в глибоку кому, і в такому стані вони помирали». На сьогодні встановлено, що нейропсихічні порушення такого типу можуть ускладнювати різні хвороби печінки та обумовлювати розвиток коми та смерть хворого. Так було сформульоване поняття печінкової енцефалопатії (ПЕ) [1].
Печінкова енцефалопатія — це патологічні зміни функцій головного мозку незапального генезу, що проявляються синдромом вторинних неврологічних і когнітивних розладів, спричинених комплексом глибоких метаболічних порушень, в результаті гострої печінкової недостатності, хронічних захворювань печінки або портосистемного шунтування крові. Даний синдром має потенційно оборотний характер в початкових стадіях та необоротний — у кінцевих стадіях [2].
Патогенез цього стану до кінця нез’ясований. Запропоновано чимало гіпотез розвитку ПЕ. Визнається роль функціональних і структурних порушень астраглії, ендогенних нейротоксинів (аміак, меркаптан, фенол, індол, коротко- та середньоланцюгові жирні кислоти та ін.), несправжніх нейромедіаторів та нейромедіаторних систем (ГАМКергічна, глутамат/глутамінова, серотонінова, бензодіазепінергічна та ін.), амінокислотного дисбалансу, медіаторів запалення, дефіциту мікроелементів (цинку) [3].
У 2002 р. на Світовому конгресі гастроентерологів [4, 5] було розроблено критерії розподілу ПЕ на три підтипи. Підтип А (acute) розвивається внаслідок гострої або підгострої печінкової недостатності. Підтип В (bypass) — внаслідок портосистемного обходу в умовах відсутності печінкової недостатності. Цей підтип відповідає терміну «портосистемна енцефалопатія». Вважається, що причиною цього виду енцефалопатії є не органічне ураження печінки, а лише її виключення зі шляху кровообігу та циркуляції речовин, які потребують знешкодження, наприклад тромбоз судин портальної системи або нециротичний фіброз печінки. За таких умов кров, що надходить з кишечника по системі ворітної вени, лише частково проходить та знешкоджується печінкою. Підтип C (cirrhosis) встановлюється за наявності цирозу печінки або портальної гіпертензії із портосистемним шунтуванням [5]. Так, при портосистемному шунтуванні ПЕ розвивається лише у 25–40 % хворих. При поєднанні ураження печінки з портосистемним шунтуванням клінічні прояви ПЕ відмічаються у 30–50 % хворих, у такої ж кількості пацієнтів цей стан перебігає субклінічно [6].
Діагностика ПЕ засновується на клінічному обстеженні з використанням клінічних шкал для оцінки тяжкості ПЕ. Золотим стандартом є критерії West Haven [7], що оцінюють п’ять елементів: психічний стан; наявність та інтенсивність астериксису; час, який потрібен для виконання тестів інтелектуального функціонування (наприклад, тест зв’язку чисел); рівень аміаку у венозній крові; відхилення за даними енцефалографії (табл. 1). Тим не менше вони є суб’єктивними, з обмеженою надійністю оцінки, особливо для ранньої діагностики мінімальної (раніше — субклінічної) ПЕ та ПЕ 1 ступеня [8].
Мінімальна ПЕ є початковим етапом розвитку енцефалопатії, що не має клінічних неврологічних симптомів, у зв’язку із чим є достатньо складною для діагностики, але визначається у 20–80 % хворих на ЦП [9].
Діагностика когнітивних порушень при мінімальній ПЕ та ПЕ 1 ступеня можлива лише на підставі психометричних тестів [10], орієнтованих на оцінку уваги, робочої пам’яті, швидкості психомоторної та зорово-просторової орієнтації, нейрофізіологічних (електрофізіологічних та ін.) функціональних тестів оцінки діяльності мозку [11, 12].
Чутливість тесту зв’язку чисел в діагностиці ПЕ досягає 80 %. Електроенцефалографія (ЕЕГ) дозволяє зафіксувати уповільнення альфа-ритмів на ранніх стадіях, появу дельта- та тета-активності на більш пізніх стадіях ПЕ. В міру прогресування ПЕ спостерігається зниження частоти та збільшення амплітуди до появи у IV стадії трифазних хвиль. Пізніше амплітуда зменшується, а в термінальній стадії хвилі на ЕЕГ зникають. На думку групи авторів, чутливість ЕЕГ при ПЕ становить не більше 30–40 %, часто зміни ЕЕГ не корелюють з тяжкістю перебігу захворювання та мають лише допоміжне значення [13].
Флікер-тест спочатку був розроблений як офтальмологічний тест для вимірювання гостроти зору та скринінгу ураження зорового нерва. В діагностиці ПЕ він має високу специфічність (79 %), але досить помірну чутливість (69 %), тому може застосовуватися як додатковий тест для оцінки мінімальної енцефалопатії [14].
Американською асоціацією з вивчення хвороб печінки (AASLD) до найбільш діагностично значимих тестів включені: тест синдрому портосистемної енцефалопатії (PSE), що складається з 5 тестів оцінки психомоторних і когнітивних функцій, таких як тести зв’язку чисел, ліній та фігур, психофізіологічний тест критичної частоти мерехтіння (CFF) (флікер-тест), тест реакції на слуховий подразник (CRT), комп’ютеризований інгібіторний контрольний тест (ICT), Stroop тест розпізнавання кольору, SCAN тест розпізнавання цифр, ЕЕГ [9].
Хоча вищезазначені тести найчастіше використовуються для оцінки ПЕ, вони мають слабку кореляцію між собою [15]. Тому для встановлення ПЕ консенсус Міжнародного товариства з печінкової енцефалопатії та азотного метаболізму (ISHEN) рекомендує використання щонайменше двох із вказаних тестів: один — з тесту синдрому портосистемної енцефалопатії (PSE) та один — з комп’ютеризованих (CRT, ІСТ, SCAN або Stroop) чи нейрофізіологічних (CFF або ЕЕГ) тестів [16].
Мета дослідження: оцінити ефективність тесту зв’язку чисел, флікер-тесту та електроенцефалографії в діагностиці енцефалопатії у хворих з печінковою та позапечінковою формою портальної гіпертензії.
Матеріали та методи
Об’єктом дослідження стали 70 осіб з ознаками портальної гіпертензії, які були розподілені на 3 групи. До І групи було включено 50 хворих з печінковою формою портальної гіпертензії віком від 21 до 76 (48,0 ± 2,7) років. Серед них були 21 жінка (42 %) та 29 чоловіків (58 %). Другу групу становили 30 хворих з позапечінковою портальною гіпертензією віком від 19 до 81 (47,1 ± 3,2) року. Жінок — 60 % обстежених групи, чоловіків — 40 %. До ІІІ групи ввійшли 25 осіб (76 % жінок та 24 % чоловіків) без ознак портальної гіпертензії віком від 29 до 60 (45,1 ± 2,4) років.
Для діагностики ПГ проводили сонографічне дослідження органів черевної порожнини та серця, фіброгастродуоденоскопію; загальноклінічне обстеження, загальний та біохімічний аналізи крові. Для встановлення наявності та ступеня ПЕ використовували психометричні тести: тест зв’язку чисел та флікер-тест, проводили ЕЕГ.
Тест зв’язку чисел дозволяє оцінити здатність до здійснення когнітивних рухів. Проведення тесту передбачає послідовне поєднання чисел від 1 до 25 однією безперервною лінією. Час, витрачений на проведення даного тесту, менший ніж 30 секунд (с), вказує на відсутність ПЕ, час від 31 до 45 с — на мінімальний ступінь ПЕ, від 46 до 60 с — на 1 ступінь ПЕ, від 61 до 80 с — на 2 ступінь ПЕ, від 81 до 120 с — на 3 ступінь ПЕ, більше 120 с — на 4 ступінь ПЕ [17].
Флікер-тест проводили за допомогою апарата Hepatonorm Analyzer (Німеччина). Сутність методу полягає у використанні безперервного світлового потоку, що подається через спеціальні оптичні окуляри, з поступовим зниженням частоти мерехтіння світлового потоку від 60 до 25 Гц. Реєстрація 9 таких вимірювань дозволяє вирахувати середнє та стандартне відхилення, забезпечує високу чутливість та специфічність даного методу. Результат тесту оцінювали як відсутність ПЕ, якщо пацієнт відмічав мерехтіння світла при частоті більше 39 Гц, мінімальну ПЕ встановлювали при частоті мерехтіння у межах від 36 до 39 Гц, тяжку ПЕ — при частоті мерехтіння менше 36 Гц [14, 18].
Електроенцефалографію проводили за допомогою апарата DX-5000 practic 2010. Метод полягає в оцінці домінуючих хвиль та кількості їх циклів за 1 секунду.
Статистична обробка даних проводилася з використанням програм MS Excel 2003 і SPSS 16.0. Усереднені показники подані як М ± m (середнє значення ± стандартна помилка середнього). При аналізі якісних даних визначали n (абсолютне значення) та показник частоти (%). Для порівняння показників в групах використовували критерій χ2 (хі-квадрат) та критерій Манна — Уїтні. Відмінності показників вважали значущими при р < 0,05.
Результати та обговорення
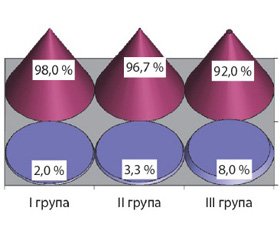
За результатами тесту зв’язку чисел наявність ПЕ різного ступеня діагностована у 98 % хворих І групи, 96,7 % пацієнтів з позапечінковою портальною гіпертензією та 92 % хворих без портальної гіпертензії (рис. 1).
Печінкова енцефалопатія за рахунок мінімального ступеня встановлена у 23 (100 %) пацієнтів без портальної гіпертензії, що частіше в 3,3 раза порівняно з І групою (χ2 = 15,1; р < 0,01) та 1,8 раза — з ІІ (c2 = 5,1; р < 0,05), (рис. 2).
У І групі хворих з печінковою портальною гіпертензією за показниками тесту зв’язку чисел ступінь порушень мозкової діяльності був більш вираженим. Так, в цій групі спостерігали 11 (22,5 %) та 8 (16,3 %) випадків ПЕ 2 та 3 ступенів відповідно, у той час як в ІІ та ІІІ групах таких тяжких проявів ПЕ встановлено не було. У пацієнтів з позапечінковою формою портальної гіпертензії найчастіше діагностували ПЕ 1 ступеня — 17 з 29 (58,6 %), що в 1,9 раза частіше, ніж в І групі (χ2 = 6,24; р < 0,05).
Аналіз швидкості виконання тесту зв’язку чисел в обстежених хворих показав, що в середньому по групі найдовше тест виконували хворі І групи через наявність ПЕ 2 та 3 ступенів (табл. 2).
Разом із тим час, витрачений на проведення тесту, у пацієнтів без портальної гіпертензії становив (36,5 ± 1,3) с і був в 1,6 раза меншим, ніж в І групі (р < 0,01), та в 1,2 раза — порівняно з ІІ групою (р > 0,05).
У хворих з позапечінковою портальною гіпертензією швидкість виконання тесту за середнім показником по групі була в 1,3 раза вище, ніж в І групі (р < 0,05), що пов’язано з незначними змінами — наявністю ПЕ мінімального та 1 ступеня. Час, витрачений на виконання тесту, при одному і тому самому ступені ПЕ між групами не відрізнявся.
Таким чином, проведення тесту зв’язку чисел дозволило встановити наявність ПЕ в усіх групах, однак прояви цих змін як за частотою, так і вираженістю переважали у хворих І групи з печінковою портальною гіпертензією.
Проведення флікер-тесту показало, що ПЕ не спостерігалась в жодного з обстежених ІІІ групи без ознак портальної гіпертензії (рис. 3). Тяжкі порушення мозкової діяльності були зафіксовані лише у хворих І групи з печінковою портальною гіпертензією та становили 6 % випадків, а мінімальна ПЕ виявлена в 1,5 раза частіше порівняно з пацієнтами з позапечінковою формою портальної гіпертензії (χ2 = 10,1; р < 0,01).
Середні по групі показники сприйняття частоти миготіння світла були вищими у пацієнтів без портальної гіпертензії — (44,8 ± 0,8) проти (40,1 ± 1,4) Гц у хворих з позапечінковою та (38,1 ± 0,9) Гц — з печінковою формами портальної гіпертензії (р < 0,05 та р < 0,01 відповідно). При цьому показники сприйняття частоти миготіння світла при одному і тому самому ступені ПЕ між групами не відрізнялися (табл. 3).
Проведення ЕЕГ у обстежених хворих дозволило оцінити домінуючий ритм (табл. 4). Так, у хворих без портальної гіпертензії у 88 % випадків спостерігалось домінування альфа-ритму, що в 1,8 раза більше, ніж в ІІ та 1,6 раза — ніж в І групах (χ2 = 8,94; р < 0,01 та χ2 = 7,68; р < 0,01 відповідно). Дельта-, бета- та тета-ритми, що характеризують зниження функціональної активності мозку при більш виражених стадіях ПЕ, визначались у 44 % хворих з печінковою ПГ, у 50 % пацієнтів з позапечінковою портальною гіпертензією та в 3 (12 %) обстежених ІІІ групи.
При аналізі ЕЕГ у хворих залежно від вираженості ПЕ порушення біоелектричної активності головного мозку відбилося переважно на параметрах α-ритму. Так, у І групі серед 28 хворих з домінуванням альфа-ритму у 21 (75,0 %) виявлено α-ритм з частотою 8,5–12 коливань за 1 с, у 4 (14,3 %) пацієнтів цей ритм був визначений на тлі поліморфної дисритмії з частотою 8,5–12 коливань за 1 с. У 2 (7,1 %) випадках мало місце уповільнення α-ритму, що дорівнювало 7–8 коливанням за 1 с, у 1 (3,6 %) хворого частота коливань становили 5–7 коливань за 1 с.
У пацієнтів з позапечінковою ПГ із 15 обстежених α-ритм з частотою 8,5–12 коливань за 1 с був зареєстрований в 80 % випадків. У 20 % пацієнтів цієї групи відмічали α-ритм з частотою 7–8 коливань за 1 с.
У ІІІ групі хворих без портальної гіпертензії α-ритм з частотою 8,5–12 коливань за 1 с встановлено у 22 (100 %) випадках. Пацієнтів з уповільненням α-ритму в цій групі відзначено не було.
При зіставленні результатів тесту зв’язку чисел та ЕЕГ було встановлено, що при мінімальній ПЕ, за даними тесту зв’язку чисел, в усіх групах за частотою переважав альфа-ритм. При 1 ступені ПЕ у пацієнтів з позапечінковою портальною гіпертензією в 1,9 раза частіше, ніж в І групі, спостерігали дельта-ритм (75 проти 40 %). При 2 ступені ПЕ в групі з печінковою формою ПГ частота виявлення дельта-ритму була в 1,2 раза більшою, ніж при 3 ступені. Водночас дельта- та тета-ритми зафіксовані при 3 ступені ПЕ в однаковій кількості випадків, що становило 37,5 % (рис. 4).
При порівнянні тесту зв’язку чисел, флікер-тесту, ЕЕГ щодо визначення ПЕ в І групі виявлено, що в 12 (24 %) випадків одночасно було діагностовано мінімальну ПЕ, у 3 (6 %) обстежених трьома методами встановлено більш виражені ступені ПЕ та в одному випадку — відсутність ПЕ. Тобто відсоток збігу в цій групі становив 32 %.
У групі з позапечінковою портальною гіпертензією встановлено збіг в 15 випадках (50 %) — у 1 пацієнта з відсутньою ПЕ та 14 хворих із мінімальною ПЕ.
У ІІІ групі у двох з обстежених трьома методами встановлено відсутність ПЕ, тобто в 8 % випадків мало місце співпадіння результатів.
Висновки
Таким чином, простий у виконанні і доступний тест зв’язку дозволив встановити ПЕ різних ступенів майже в усіх хворих як з ПГ печінкової та позапечінкової етіології, так і у хворих без портальної гіпертензії при відсутності явної клінічної неврологічної симптоматики. Прояви ПЕ як за частотою, так і вираженістю переважали у хворих І групи з печінковою ПГ.
Дослідження ПЕ за допомогою флікер-тесту дещо відрізнялось від результатів тесту зв’язку чисел та дозволило діагностувати наявність мінімальної ПЕ у 96 % хворих з печінковою ПГ та 60 % хворих з позапечінковою ПГ.
Зміни альфа-ритму, поява дельта- та тета-активності при проведенні ЕЕГ визначило наявність ПЕ у 60 % хворих з печінковою ПГ, 50 % хворих з позапечінковою ПГ та 12 % хворих без портальної гіпертензії.
Співставлення ефективності діагностичних тестів показало, що простий у виконанні і доступний тест зв’язку чисел є найбільш ефективним, однак і інші тести мають свої позитивні сторони в клінічній оцінці печінкової енцефалопатії у хворих з портальною гіпертензією.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Опыт применения псиллиума в лечении печеночной энцефалопатии у больных с хроническими заболеваниями печени / Р.С. Оксакова, Л.Ю. Ильченко, Е.А. Луговкина и др. // Архивъ внутренней медицины. — 2012. — № 5(7). — С. 19-25.
2. Бабак О.Я. Цирроз печени / О.Я. Бабак, Е.В. Колесникова. — К., 2011. — 575 c.
3. Ардатская М.Д. Современные подходы к диагностике и лечению печеночной энцефалопатии / М.Д. Ардатская, О.Н. Минушкин // Consilium Medicum. — 2012. — № 8. — С. 41-47.
4. Hepatic encephalopathy-definition, nomenclature, diagnosis, and quantification: final report of the working party at the 11th World Congresses of Gastroenterology, Vienna, 1998 / Ferenci P., Lockwood A., Mullen Ket et al. // Hepatology. — 2002. — № 35. — Р. 716-721. — DOI: 10.1053/jhep.2002.31250.
5. Ягмур В.Б. Діагностика мінімальної печінкової енцефалопатії за допомогою нейропсихометричних тестів / В.Б. Ягмур, С.Л. Меланіч, Н.В. Недзвецька // Гастроентерологія. — 2015. — № 2. — С. 33-37.
6. Дамулин И.В. Печеночная энцефалопатия: патогенетические, клинические и терапевтические аспекты / И.В. Дамулин // Гастроентерология. — 2006. — № 2. — С. 54-59.
7. Cash W.J. Current concepts in the assessment and treatment of Hepatic Encephalopathy / W.J. Cash, P. McConville, E. MCdermott et al. // Q.J. Med. — 2010. — № 103. — Р. 9-16. — https://doi.org/10.1093/qjmed/hcp152.
8. Montagnese S. Methods for diagnosing hepatic encephalopathy in patients with cirrhosis: a multidimensional approach / Montagnese S., Amodio P., Morgan M.Y. // Metab. Brain. Dis. — 2004. — № 19. — Р. 281-312. — https://doi.org/10.1093/qjmed/hcp152.
9. Hepatic Encephalopathy in Chronic Liver Disease: 2014 Practice Guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver / H. Vilstrup, P. Amodio, J. Bajaj et al. // Hepatology. — 2014. — Р. 715-735. — DOI: 10.1002/hep.27210.
10. Characteristics of minimal hepatic encephalopathy / Amodio P., Montagnese S., Gatta A., Morgan M.Y. // Metab. Brain. Dis. — 2004. — № 19. — Р. 253-267. — DOI: https://doi.org/10.1023/B:MEBR.0000043975.01841.de.
11. Neurophysiological investigations of hepatic encephalopathy: ISHEN practice guidelines / Guerit J.M., Amantini A., Fischer C. et al. // Liver Int. — 2009. — № 29. — Р. 789-796. — DOI: 10.1111/j.1478-3231.2009.02030.x.
12. Neuropsychological assessment of hepatic encephalopathy: ISHEN practice guidelines / Randolph C., Hilsabeck R., Kato A. et al. // Liver Int. — 2009. — № 29. — Р. 629-635.
13. Пат. 2468745 RU МПК A 61 B 5/0452. Способ диагностики печеночной энцефалопатии латентной стадии у больных хроническими заболеваниями печени / Козлов В.К., Радченко В.Г., Тетерина Л.А. Ярилов С.В. (RU).; патентообладатель: ГБОУ ВПО СЗГМУ им. И.И. Мечникова Минздравсоцразвития России (RU). — http://www.findpatent.ru/patent/ 246/2468745.html.
14. Torlot F.J. Meta-analysis: the diagnostic accuracy of critical flicker frequency in minimal hepatic encephalopathy / F.J. Torlot, M.J.W. McPhail, S.D. Taylor-Robinson // Aliment. Pharmacol. Ther. — 2013. — № 37. — Р 527-536. — DOI: 10.1111/apt.12199.
15. Different biochemical correlates for different neuropsychiatric abnormalities in patients with cirrhosis / Montagnese S., Biancardi A., Schiff S. et al. // Нepatology. — 2010. — № 53. — Р. 558-566. — DOI: 10.1002/hep.24043.
16. Review article: the design of clinical trials in hepatic encephalopathy — an International Society for Hepatic Encephalopathy and Nitrogen Metabolism (ISHEN) consensus statement / Bajaj J.S., Cordoba J., Mullen K.D. et al. // Aliment. Pharmacol. Ther. — 2011. — № 33. — Р. 739-747. — DOI: 10.1111/j.1365-2036.2011.04590.x.
17. Надинская М.Ю. Тест связи чисел: Руководство для врачей. — М., 2000. — 11 с.
18. Critical flicker frequency and continuous reaction times for the diagnosis of minimal hepatic encephalopathy: a comparative study of 154 patients with liver disease / Lauridsen M.M., Jepsen P, Vilstrup H. // Metab. Brain. Dis. — 2011. — № 26(2) Jun. — Р. 135-139.
Отримано 25.11.2017

/41-1.jpg)
/42-1.jpg)
/43-1.jpg)
/44-1.jpg)
/45-1.jpg)