Резюме
Актуальність. Ураження колінного суглоба (КС) при ревматоїдному артриті (РА) супроводжується формуванням контрактур і розвитком дискордантних деформацій нижніх кінцівок, які, в свою чергу, призводять до часткової або повної втрати функції кінцівки. Аналіз даних вітчизняної та зарубіжної літератури свідчить, що питанню пато- і механогенеза фронтальних деформацій КС у хворих на РА приділяється недостатня увага, умови функціонування ендопротеза КС за наявності вальгусних і варусних деформацій кінцівки у хворих на РА мало вивчені. Мета роботи. Вивчення можливостей функціонування ендопротеза КС при компенсації дефектів виростків великогомілкової кістки за допомогою кісткових трансплантатів або металевих аугментів за різних величин варусної деформації у хворих на РА. Завдання дослідження — вивчити поведінку біомеханічної моделі «кістка — ендопротез» при компенсації дефекту внутрішнього виростка великогомілкової кістки кістковим автотрансплантатом або металевим аугментом 5, 10 та 15 мм та на підставі отриманих даних визначити можливість розвитку ранньої нестабільності тибіального компонента ендопротеза. Матеріали та методи. На основі КТ-сканів створені імітаційні комп’ютерні моделі КС, що налічували елементи з різними механічними властивостями — стегнова кістка, феморальний компонент ендопротеза, поліетиленова вставка, тибіальний компонент ендопротеза та великогомілкова кістка. За допомогою програмного пакета SolidWorks побудовано імітаційні моделі КС в умовах його варусної деформації з наявністю трансплантата виростка великогомілкової кістки 5, 10 та 15 мм з кісткової тканини та металу (аугмент). Подальші розрахунки напружено-деформованого стану моделі здійснювали методом скінченних елементів у програмному пакеті ANSYS (чисельний метод). Результати. Наявність кісткового трансплантата 5 мм та збільшення його розміру до 15 мм призводили до значного зростання показників напружень на плато великогомілкової кістки на 51 % — при 5 мм та майже у 2,3 раза — при 10 та 15 мм. Ці значення напружень перевищують межі міцності спонгіозної кісткової тканини у цій ділянці, що може супроводжуватись її руйнуванням вже при статичному навантаженні 1 масою тіла при застосуванні кісткового трансплантата 10 мм та 15 мм. Застосування металевого аугмента 5 мм і збільшення його розміру до 10 та 15 мм призводило до розвантаження цієї ділянки, що проявлялося зниженням показників напружень на 21 % — при 5 мм, на 8 % та 5 % — при 10 та 15 мм. Висновки. Застосування кісткового трансплантата 10 мм та 15 мм є фактором можливого руйнування кісткової тканини у ділянці ложа тибіального компонента ендопротеза з розвитком явищ його нестабільності. Розвантаження цієї ділянки, при заміщенні великих дефектів 10 та 15 мм, досягається використанням металевого аугмента.
Актуальность. Поражение коленного сустава (КС) ревматоидным артритом (РА) сопровождается формированием контрактур и развитием дискондартных деформаций нижних конечностей, которые, в свою очередь, приводят к частичной или полной потере функции конечности. Анализ данных оте-чественной и зарубежной литературы свидетельствует о том, что вопросу пато- и механогенеза фронтальных деформаций КС у пациентов с РА уделяется недостаточное внимание, условия функционирования эндопротеза КС при наличии вальгусной и варусной деформаций конечности у больных РА мало изучены. Цель. Изучение возможностей функционирования эндопротеза КС при компенсации дефектов мыщелков большеберцовой кости с помощью костных трансплантатов или металлических аугментов при различных величинах варусной деформации у больных РА. Задачи исследования — изучить поведение биомеханической модели «кость — эндопротез» при компенсации дефекта внутреннего мыщелка большеберцовой кости костным аутотрансплантатом или металлическим аугментом 5, 10 и 15 мм и на основании полученных данных определить возможность развития ранней нестабильности тибиального компонента эндопротеза. Материалы и методы. На основе КТ-сканов созданы имитационные компьютерные модели КС, которые насчитывали элементы с различными механическими свойствами — бедренная кость, феморальный компонент эндопротеза, полиэтиленовая вставка, тибиальный компонент эндопротеза и большеберцовая кость. С помощью программного пакета SolidWorks созданы имитационные модели КС в условиях его варусной деформации с наличием трансплантата мыщелка большеберцовой кости 5, 10 и 15 мм из костной ткани и металла (аугмент). Дальнейшие расчеты напряженно-деформированного состояния модели осуществляли методом конечных элементов в программном пакете ANSYS (числовой метод). Результаты. Наличие костного трансплантата 5 мм и увеличение его размера до 15 мм приводило к значительному росту показателей напряжений на плато большеберцовой кости на 51 % — при 5 мм и почти в 2,3 раза — при 10 и 15 мм. Эти значения напряжений превышают предел прочности спонгиозной костной ткани в этой области, что может сопровождаться ее разрушением уже при статической нагрузке 1 массой тела при применении костного трансплантата 10 и 15 мм. Применение металлического аугмента 5 мм и увеличение его размера до 10 и 15 мм приводило к разгрузке этого участка, что проявлялось снижением показателей напряжений на 21 % — при 5 мм, на 8 и 5 % — при 10 и 15 мм. Выводы. Применение костного трансплантата 10 и 15 мм является фактором возможного разрушения костной ткани в области ложа тибиального компонента эндопротеза с развитием явлений его нестабильности. Разгрузка этого участка, при замещении обширных дефектов 10 и 15 мм, достигается использованием металлического аугмента.
Background. The defeat of the knee joint (KJ) in rheumatoid arthritis is accompanied by the formation of contractures and the development of discordant deformities of the lower limbs, which in turn lead to a partial or complete loss of limb function. Analysis of the data of domestic and foreign literature suggests that the issue of pathogenesis and mechanogenesis of frontal deformities of knee joints in patients with RA is not paid enough attention, conditions for the functioning of the endoprosthesis of the KJ in the presence of valgus and varus deformities of the limb in rheumatoid arthritis patients have been poorly studied. The purpose was to examine the possibilities of functioning of the endoprosthesis of the KJ with compensation of defects of the tibial condyles with the help of bone grafts or metallic augments at different values of varus deformity in patients with rheumatoid arthritis, as well as to study the work of “bone — endoprosthesis” biomechanical model when compensating the defect of the medial condyle of tibia with bone graft or metal augmentation of 5, 10 and 15 mm, and based on the obtained data to determine the risk of the early instability of the tibial component of the endoprosthesis. Materials and methods. Imitation computer models of the knee were created on the basis of CT scans, which consisted of elements with different mechanical properties — the femur, the femoral component of the endoprosthesis, the polyethylene insert, the tibial component of the endoprosthesis and the tibia. Using SolidWorks software package, simulation models of the knee have been created in the conditions of its varus deformity with the presence of a bone graft and 5-, 10- and 15-mm metal (augment). Further calculations of the model’s stress and strain were carried out by the finite element method (FEM) in the software package ANSYS (a numerical method). Results. The presence of 5-mm bone graft and an increase in its size to 15 mm resulted in a significant increase in the stresses on the tibial plateau by 51 % at 5 mm and almost 2.3 times — at 10 and 15 mm. These values of stress exceed the strength of spongy bone tissue in this area, which may be accompanied by its destruction even at a static load of body weight only when using 10- and 15-mm bone graft. The use of a metal augment of 5 mm and an increase in its size to 10 and 15 mm resulted in the unloading of this site, which was shown by a decrease in stresses by 21 % — at 5 mm, by 8 and by 5 % at 10 and 15 mm, respectively. Conclusions. Application of 10- and 15-mm bone graft is a factor of possible destruction of bone tissue in the area of the tibial component of the endoprosthesis with the development of its instability. Unloading this site when replacing large defects (10 and 15 mm) is achieved using a metal augment.
Вступ
Ревматоїдний артрит (РА) як системне автоімунне захворювання сполучної тканини організму, що супроводжується прогресуючим хронічним перебігом із переважним ураженням суглобів, розвитком тяжких необоротних деформацій, значними порушеннями їх функції, призводить до втрати працездатності та інвалідності [1].
Останніми роками в Україні спостерігається зростання кількості хворих на РА. Річна захворюваність становить близько 0,02 %, а після 10 років хвороби 50 % хворих втрачають працездатність внаслідок ортопедичних проявів, серед них 20 % прикуті до ліжка та потребують постійного нагляду. Переважно хворіють жінки середнього віку (в 3–4 рази частіше за чоловіків). Кількість випадків захворювання збільшується з віком. Збільшення випадків смертності обумовлене високою частотою супутніх захворювань (артеріальна гіпертензія, атеросклеротичне ураження судин, остеопоротичні переломи, інфекції та ін.)
До появи нових методів лікування понад 40 % хворих на РА протягом перших 5 років ставали інвалідами.
За даними різних авторів [2–5], ураження колінного суглоба (КС) у хворих на РА спостерігається від 10 до 30 % у термін до 5 років від початку захворювання.
Ураження КС при РА супроводжується формуванням контрактур і розвитком дискордантних деформацій нижніх кінцівок, які, в свою чергу, призводять до часткової або повної втрати функції кінцівки [5]. Вальгусна та варусна деформація КС належить до числа складних фронтальних деформацій нижньої кінцівки. Фронтальні деформації з часом (залежно від ступеня деформації) призводять до руйнування зовнішньої або внутрішньої пари виростків КС (стегнова та великогомілкова кістки) з подальшою інвалідизацією хворих [6, 7]. Етіологічні фактори виникнення та прогресування вальгусної та варусної деформації різноманітні. Проте, як відзначалося багатьма дослідниками [2, 8, 9], останніми роками найчастішою причиною розвинення фронтальних деформацій КС є порушення рівноваги між біологічною усталеністю тканин і механічним їх навантаженням. Стан тканин суглоба залежить здебільшого від величини навантаження на них, ніж від метаболічних причин, що було підтверджено рядом дослідників. Дослідження віт-чизняних і закордонних авторів [5, 6, 10–13] свідчать, що при розвитку функціонально невигідних деформацій КС значення хірургічної допомоги суттєво збільшується. На пізніх стадіях захворювання усунути численні деформації та відновити опорно-рухову функцію КС і нижніх кінцівок можливо лише за допомогою ендопротезування. Аналіз даних літератури свідчить, що питання функціонування ендопротеза КС в умовах вальгусних і варусних деформацій КС при заміщенні дефекту у хворих на РА висвітлені недостатньо.
Мета роботи — вивчити можливості функціонування ендопротеза КС при компенсації дефекту виростка великогомілкової кістки за допомогою кісткових трансплантатів або металевих аугментів за різних величин варусної деформації у хворих на РА.
Матеріали та методи
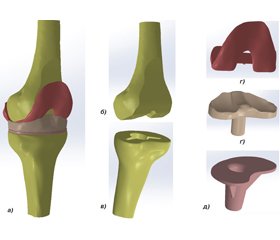
Методом математичного моделювання на основі КТ-сканів створені імітаційні комп’ютерні моделі КС (рис. 1а), які налічували елементи з різними механічними властивостями — стегнова кістка (рис. 1б), феморальний компонент ендопротеза (рис. 1в), поліетиленова вставка (рис. 1г), тибіальний компонент ендопротеза (рис. 1ґ) та великогомілкова кістка (рис. 1д). М’якотканинні структури КС у моделі не враховувались.
На наступному етапі за допомогою програмного пакета SolidWorks побудовано імітаційні моделі КС в умовах його варусної деформації з наявністю замісного трансплантата виростка великогомілкової кістки 5, 10 та 15 мм з кісткової тканини та металу (аугмент).
Подальші розрахунки напружено-деформованого стану (НДС) моделі здійснювали методом скінченних елементів у програмному пакеті ANSYS. У розрахунках застосовували фізичні властивості та межі міцності кісткової тканини, медичної сталі та поліетилену, які отримані з літературних джерел [14–17] (табл. 1). Перевищення цих показників відповідного елемента моделі свідчить про його можливу руйнацію.
У програмному середовищі ANSYS у напівавтоматичному режимі згенеровано скінченно-елементну модель КС (рис. 2), яка налічувала 478 303 вузли та 286 093 елементи, що є достатнім для забезпечення необхідної точності розрахунків. У найбільш важливих перехідних ділянках моделі з різними механічними властивостями скінченно-елементна сітка згущувалась для підвищення точності розрахунків.
Для моделі завдано такі граничні умови (рис. 3):
— по площині (А) введено жорстке закріплення;
— по площині (В) модель навантажено силою 700 Н, що відповідає масі тіла людини в 70 кг.
Аналогічні моделі побудовано для визначення НДС в умовах варусної деформації нижньої кінцівки для різних вертикальних розмірів дефекту виростка великогомілкової кістки (5, 10, 15 мм) із застосуванням трансплантата з кісткової тканини та аугмента (рис. 4).
Результати та обговорення
На початковому етапі проведено розрахунки НДС моделі КС з ендопротезом без фронтальних деформацій кінцівки (рис. 5), отримані значення яких взято для проведення порівняльного аналізу при застосуванні трансплантата 5, 10, 15 мм з кісткової тканини та металу (аугмент). На рис. 5 можна спостерігати локалізацію максимальних напружень на загальній моделі КС без фронтальних деформацій кінцівки з показниками σmах = 29,15 МРа на феморальному компоненті ендопротеза, в зоні його контакту з поліетиленовою вставкою по передній поверхні КС. Максимальні деформації (рис. 5б) також зосереджені в тій самій ділянці контакту, але локалізуються на поліетиленовій вставці — εmах = 0,0007 мм, тому що її модуль пружності є набагато меншим, ніж у сталі.
На інших елементах моделі КС напруження та деформації розподілилися так.
Стегнова кістка (рис. 6) — показники максимальних напружень — σmах = 10,67 МРа, локалізуються у ділянці латерального виростка в місці контакту стегнової кістки з краєм феморального компонента ендопротеза, вони є локальними (точковими), а в цілому на моделі напруження не перевищують показник 1,84 МРа. Показники максимальних деформацій локалізуються у тій самій ділянці моделі з показниками — εmах = 0,0006 мм.
Феморальний компонент ендопротеза (рис. 7) — показники максимальних напружень — σmах = 29,15 МРа локалізуються в ділянці контакту внутрішнього краю феморального компонента ендопротеза зі стегновою кісткою, вони є локальні (точкові), а в цілому на моделі напруження не перевищують 4,16 МРа. Показники максимальних деформацій локалізуються у тій же ділянці моделі з показниками εmах = 0,00015 мм.
Поліетиленова вставка (рис. 8) — показники максимальних напружень — σmах = 1,43 МРа рівномірно розподілені по площі контакту з феморальним компонентом ендопротеза і варіюють у діапазоні 0,34–1,43 МРа, що не перевищує межі міцності матеріалу. Показники максимальних деформацій — εmах = 0,0007 мм (рис. 8б).
Тибіальний компонент ендопротеза (рис. 9) — показники максимальних напружень — σmах = 9,71 МРа локалізуються у ділянці контакту металу з великогомілковою кісткою, що не перевищує межі міцності матеріалу. На рисунку 9б можна спостерігати локалізацію максимальних деформацій на даному елементі моделі з показниками εmах = 0,00004 мм.
Великогомілкова кістка (рис. 10) — показники максимальних напружень — σmах = 4,91 МРа локалізуються у метадіафізарній ділянці великогомілкової кістки по її медіальній поверхні. На рисунку 10б можна спостерігати локалізацію максимальних деформацій у тій самій ділянці моделі з показниками εmах = 0,0003 мм.
Плато великогомілкової кістки (рис. 11) — показники максимальних напружень — σmах = 1,85 МРа локалізуються по задньому краю плато медіального виростка великогомілкової кістки і зменшуються до центру моделі, що не перевищує межі міцності кісткової тканини. На рисунку 11б можна спостерігати локалізацію максимальних деформацій у тій же ділянці моделі з показниками εmах = 0,0001 мм.
На рисунку 12а подані максимальні значення загальних переміщень (Total Deformation) усієї моделі Δ = 0,089 мм та максимальні значення переміщень тибіального компонента ендопротеза Δ = = 0,035 мм.
Отже, при ендопротезуванні КС без фронтальних деформацій кінцівки показники напружень та деформацій розподілені рівномірно по всіх елементах моделі КС, не перевищують межі міцності матеріалу, а показники переміщень відображають стабільність біомеханічної системи «кістка — ендопротез». Отримані значення НДС взято за референтні для подальшого порівняльного аналізу.
Локалізація максимальних значень НДС на цільній моделі КС з ендопротезом із заміщенням дефекту виростка великогомілкової кістки 5, 10, 15 мм кістковим трансплантатом та аугментом при варусній деформації кінцівки подано на рис. 13. При застосуванні трансплантата 5 мм з кісткової тканини максимальні значення напружень зменшились порівняно з моделлю без трансплантата з σmах = 29,15 МРа до σmах = 22,53 МРа. Це можна пояснити тим, що кістковий трансплантат дає моделі більшу податливість з розвантаженням інших ділянок. Збільшення розміру кісткового трансплантата до 10 мм призвело до зростання показників напружень до σmах = 31,61 МРа, а збільшення розміру трансплантата до 15 мм зменшило значення напружень до σmах = 29,38 МРа.
/114-1.jpg)
При застосуванні трансплантата 5 мм з металу максимальні значення напружень збільшились до σmах = 47,43 МРа, що зумовлено прямим контактом металевих елементів моделі. Напруження зростають саме на металевих конструкціях моделі, з деяким розвантаженням її кісткових елементів. Значення напружень менші від допустимих. Зі збільшенням розміру металевого трансплантата до 10 мм збільшилися і показники напружень на моделі до σmах = 49,93 МРа, а збільшення розміру трансплантата до 15 мм збільшило значення напружень до σmах = 51,99 МРа, що, як і у попередній задачі, зумовлено прямим контактом металевих елементів моделі для трансплантата з металу.
Зміни значень напружень на кожному з елементів моделі окремо при збільшенні розміру кісткового або металевого трансплантата з 5 до 15 мм подані в табл. 2.
Локалізація максимальних значень НДС на кожному елементі моделі КС з ендопротезом із заміщенням дефекту виростка великогомілкової кістки 15 мм кістковим трансплантатом та аугментом при варусній деформації кінцівки подана на рис. 14, 15.
На рис. 17, 18 можна спостерігати перерозподіл напружень на елементах моделі залежно від величини трансплантата з кісткової тканини та металевого аугмента.
/117-1.jpg)
Під дією навантаження наявність кісткового трансплантата призводила до зменшення значень напружень на стегновій кістці від 47 % при 5 мм до 25 % при 15 мм, тобто цей елемент моделі розвантажується. На феморальному компоненті ендопротеза значення напружень зменшувались на 22 % при наявності 5 мм кісткового трансплантата; зі збільшенням його розміру до 10 мм значення напружень, навпаки, зростали на 8 %, а при 15 мм — наближалися до значень моделі КС без фронтальних деформацій. На поліетиленовій вставці показники напружень при наявності 5 мм кісткового трансплантата зменшувались на 19 %, а збільшення його розміру до 10 та 15 мм призводило до зростання показників напружень на 18 та 22 % відповідно. На тибіальному компоненті ендопротеза при наявності 5 мм кісткового трансплантата показники напружень збільшувались на 21 % та майже у 2 раза при збільшенні його розміру до 10 мм (на 94 %) та 15 мм (на 99 %). Отже, при наявності кісткового трансплантата розміром 10 та 15 мм відбувався перерозподіл навантаження з його переносом на тибіальний компонент ендопротеза. На гомілковій кістці наявність кісткового трансплантата 5 мм призводила до зменшення значень напружень на 33 %, при його розмірі 10 мм — відповідала значенням моделі КС без фронтальних деформацій, а при збільшенні розміру трансплантата до 15 мм відбувалося зростання показників напружень на 15 %. Локалізація напружень — метадіафізарна зона кортикальної кістки. На плато гомілкової кістки наявність кісткового трансплантата 5 мм та збільшення його розміру до 15 мм призводили до значного зростання показників напружень на 51 % — при 5 мм та майже у 2,3 раза — при 10 та 15 мм. Такі значення напружень перевищують межі міцності спонгіозної кісткової тканини у цій ділянці, що може супроводжуватись її руйнуванням вже при статичному навантаженні 1 масою тіла при застосуванні кісткового трансплантата 10 та 15 мм. Зростання значень напружень власне на кістковому трансплантаті, при збільшенні його розміру з 5 до 15 мм, не призводило до його перевантаження. Ці показники НДС не перевищували межі допустимих для кісткової тканини.
Під дією навантаження наявність металевого аугмента для заміщення дефекту медіального виростка великогомілкової кістки розміром 5 та 10 мм призводила до зростання значень напружень на стегновій кістці на 20 %, з подальшим їх зниженням до показників моделі КС без фронтальних деформацій — при розмірі аугмента 15 мм. На феморальному компоненті ендопротеза при наявності металевого аугмента 5 та 10 мм значення напружень зменшувались майже у 2 рази, з подальшим їх зростанням до показників моделі КС без фронтальних деформацій — при розмірі аугмента 15 мм. На поліетиленовій вставці при наявності 5 та 10 мм металевого аугмента відбувалось зростання показників напружень на 20 %, а збільшення його розміру до 15 мм, навпаки, призводило до зменшення показників напружень на 5 % порівняно з показниками моделі КС без фронтальних деформацій. На тибіальному компоненті ендопротеза наявність металевого аугмента розміром 5, 10 та 15 мм обумовила значне зростання показників напружень — у 5 разів. Таким чином, відбувався перерозподіл навантаження з його перенесенням на тибіальний компонент ендопротеза. На гомілковій кістці наявність металевого аугмента розміром 5 мм призводила до зменшення значень напружень на 43 %, при його розмірі 10 мм — на 40 %, а при збільшенні розміру трансплантата до 15 мм — на 8 %. Локалізація напружень — метадіафізарна зона кортикальної кістки. На плато гомілкової кістки наявність металевого аугмента 5 мм та збільшення його розміру до 10 та 15 мм призводили до розвантаження цієї ділянки, що проявлялося зниженням показників напружень на 21 % — при 5 мм, на 8 та 5 % — при 10 та 15 мм. Зростання значень напружень власне на металевому аугменті при збільшенні його розміру з 5 до 15 мм не призводило до його перевантаження. Ці показники НДС не перевищували межі допустимих для матеріалу зі сталі.
Критичною зоною моделі була ділянка плато великогомілкової кістки, що являла собою спонгіозну кісткову тканину під тібіальним компонентом ендопротеза, де власне і розміщувався кістковий трансплантат або металевий аугмент. Зростання показників напружень з перевищенням гранично допустимих значень у цій ділянці при застосуванні кісткового трансплантата розміром 10 та 15 мм є фактором можливого руйнування кісткової тканини з розвитком явищ нестабільності тибіального компонента ендопротеза. Зростання показників напружень на моделі відбувається в основному за рахунок переносу навантаження на металеві елементи ендопротеза та металевий аугмент. Незважаючи на це, значення напружень не сягають межі допустимих, і тому можна стверджувати, що вони повністю задовольняють умовам міцності матеріалів моделі.
Зміни показників загальних переміщень як для цільної моделі, так і для тибіального компонента ендопротеза не відображали будь-яких суттєвих відмінностей при застосуванні кісткового трансплантата або металевого аугмента розміром 5, 10 та 15 мм, тобто суттєвої втрати стабільності біомеханічної моделі «кістка — ендопротез» не відбувалося.
Зазначені показники НДС відображують ті значення, що виникають при навантаженні 1 масою тіла під час одноопорного стояння (статичні умови). При ходьбі (динамічні умови) за рахунок дії м’язових сил КС навантажується додатково, сягаючи значень 3,5–4 мас тіла. З огляду на лінійність задачі визначення показників НДС моделі КС згідно зі збільшенням навантаження в динаміці при ходьбі буде відбуватись пропорційне збільшення показників НДС на елементах моделі, сягаючи значень, що перевищують межі міцності тканин на відповідних ділянках.
Висновки
1. При ендопротезуванні КС без фронтальних деформацій кінцівки показники напружень та деформацій розподілені рівномірно по всіх елементах моделі КС, не перевищують межі міцності матеріалу, а показники переміщень відображають стабільність біомеханічної системи «кістка — ендопротез».
2. Застосування кісткового трансплантата для заміщення дефекту виростка великогомілкової кістки понад 7,3 мм при варусній деформації кінцівки, призводить до значного зростання значень напружень з перевищенням межі міцності спонгіозної кісткової тканини у ділянці ложа тибіального компонента ендопротеза, що може супроводжуватись її руйнуванням вже при статичному навантаженні 1 масою тіла та розвитком явищ нестабільності ендопротеза.
3. При застосуванні для заміщення дефекту виростка великогомілкової кістки металевого аугмента 5, 10 та 15 мм показники загальних переміщень моделі зростають повільніше, а значення напружень зменшуються порівняно з використанням кісткового трансплантата аналогічних розмірів. У цих умовах біомеханічна конструкція «кістка — ендопротез» є більш стабільною.
4. Для заміщення дефекту виростка великогомілкової кістки до 5 мм при ендопротезуванні КС у хворих на РА доцільне застосування кісткового трансплантата. Дефекти понад 7,3 мм при варусній деформації кінцівки потребують застосування металевого аугмента.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Ганджа І.М., Коваленко В.М., Лисенко Г.І., Свінціцький А.С. Ревматологія: Підручник. — К., 2011. — 43 с.
2. Герасименко С.І. Ортопедичне лікування ревматоїдного артриту при ураженнях нижніх кінцівок. — К.: Преса України, 2000. — 159 с.
3. Accuracy of image-free computer navigated total knee arthroplasty is not compromised in severely deformed varus knees / Maniwa K., Ishibashi Y., Tsuda E. [et al.] // J. Arthroplasty. — 2013. — Vol. 28(5). — P. 802-806.
4. Annual trends in knee and hip arthroplasty in rheumatoid arthritis 1998–2007 / Manrique Arija S., López Lasanta M., Jiménez Núñez F. G. [et al.] // Reumatol. Clin. — 2011. — Vol. 7(6). — P. 380-384.
5. Эндопротезирование крупных суставов нижних конечностей, при их одновременном поражении, у больных ревматоидным артритом / С.И. Герасименко, М.В. Полулях, А.С. Герасименко // Мат-лы IV Евразийского конгр. травматологов-ортопедов (Бишкек, 27–30 авг., 2014 г.) // Центр.-Азиат. журн. сердечно-сосуд. хирургии. Спецвып. — 2014. — № 12. — С. 199-200.
6. Особливості ендопротезування колінних суглобів при нестабільності в сагітальній площині / Зазір-
ний І.М., Євсєєнко В.Г. // Збірник наукових праць ХV з’їзду ортопедів-травматологів України. — Д.: Ліра, 2010. — С. 169.
7. Зміни динамічних характеристик у суглобах нижньої кінцівки до та після ендопротезування колінного суглоба у хворих на ревматоїдний артрит / Герасименко С.І., Полулях М.В., Рой І.В. [та ін.] // Травма. — 2015. — № 16, № 5. — С. 53-58.
8. Опыт 500 тотальных эндопротезирований коленного сустава / Чрагян Г.А., Загородний П.В., Нуждин В.И. [и др.] // Вестник травматол. и ортопедии им. Н.Н. Приорова. — 2012. — № 2. — С. 40-47.
9. Особливості формування контрактур та деформацій великих суглобів нижніх кінцівок у хворих на ревматоїдний артрит / Герасименко С.І., Полу-
лях М.В., Бабко А.М. [та ін.] // Актуальні питання сучасної ортопедії та травматології: Мат-ли ІІ Укр. наук. симпоз. з біомеханіки. — Дніпропетровськ, 2015. — С. 111-112.
10. Clinical comparison of valgus and varus deformities in primary total knee arthroplasty following midvastus approach / Chou P.H., Chen W.M., Chen C.F. [et al.] // J. Arthroplasty. — 2012. — Vol. 27(4). — P. 604-612.
11. Complex Primary Total Knee Arthroplasty: Long-Term Outcomes / [Martin J.R., Beahrs T.R., Stuhlman C.R., Trousdale R.T.] // J. Bone Joint. Surg. Am. — 2016. — Vol. 98(17). — P. 1459-1470.
12. Effects of Reduction Osteotomy on Gap Balancing During Total Knee Arthroplasty for Severe Varus Deformity / Niki Y., Harato K., Nagai K. [et al.] // J. Arthroplasty. — 2015. — Vol. 30(12). — P. 2116-2120.
13. Fewer and older patients with rheumatoid arthritis need total knee replacement / Skyttä E.T., Honkanen P.B., Eskelinen A. [et al.] // Scand. J. Rheumatol. — 2012. — Vol. 41(5). — P. 345-349.
14. Maganaris C.N., Paul J.P. In vivo human tendon mechanical properties // Journal of Physiology. — 1999. — 521, 1. — P. 307-313.
15. Kubichek М., Florian Z. Stress strain analysis of Knee joint // Engineering Mechanics. — 2009. — 5(16). — P. 315-322.
16. http://www.camelotplast.ru/info/polietilen-visokogo-davleniya.php
17. Сompressive strength of tibial cancellous bone / Hvid I., Christensen P., Andergaard J., Christensen P.B., Larsen C.G. // Acta Orthop. Scand. — 1983. — 54. — 819-825.

/108-1.jpg)
/111-1.jpg)
/112-1.jpg)
/113-1.jpg)
/114-1.jpg)
/110-1.jpg)
/115-1.jpg)
/116-1.jpg)
/117-1.jpg)