Введение
В последние годы отмечается рост удельного веса женщин, беременность которых протекает на фоне хронических инфекционных заболеваний верхних дыхательных путей, желудочно-кишечного тракта, мочевыделительной и половой систем [1], что обу–словливает высокую частоту осложнений во время беременности и родов [2]. Так, у женщин с очагами хронической, латентной, инфекции достоверно чаще отмечаются случаи преждевременной родовой деятельности, аномалий сократительной деятельности матки, преждевременной отслойки нормально расположенной плаценты [3]. Бактериальная и вирусная инфекция у матери занимает ведущие позиции среди факторов, приводящих к плацентарной недостаточности, частота которой, по данным различных ученых, составляет в среднем 50–70 % [4, 5]. Наличие у беременной очагов инфекции, особенно скрытой, является фактором риска развития различных патологических состояний у плода и новорожденного.
Escherichia coli — факультативно-анаэробный компонент нормальной толстокишечной флоры. Однако эти непатогенные штаммы Escherichia coli при определенных условиях могут проявлять целый ряд своих патогенных свойств. Чаще всего транслокация эшерихий имеет место при массивной антибиотикотерапии, химиотерапии, гормональной и иммунодепрессивной терапии, подавляющей индигенную флору и способствующей селективной пролиферации coli-бактерий с высокой лекарственной резистентностью. Escherichia coli может вызвать сепсис, менингит, перитонит, простатит и др. [6]. Инфекции мочевыводящих путей относятся к наиболее распространенным заболеваниям среди женщин, основной причиной возникновения которых в 80 % случаев является Escherichia coli [7].
Проведенный нами анализ данных литературы не позволил выявить информацию о влиянии пролонгированного инфекционного процесса в организме матери, вызванного Escherichia coli, на морфологические особенности почек их потомства. Выявление специфических морфологических изменений, обусловленных действием какого-либо биологического фактора, диктует необходимость проведения экспериментальных исследований. Представленное авторами экспериментальное исследование является весьма актуальным, значимым, перспективным и имеющим большое практическое значение.
Цель исследования: выявление морфологических особенностей почек плодов и новорожденных от матерей с экспериментальным абдоминальным подост–рым инфекционно-воспалительным процессом, вызванным Escherichia coli.
Материалы и методы
В ходе данного исследования был проведен эксперимент. В качестве экспериментальных животных были выбраны крысы линии WAG, что обусловлено экономичностью, простотой содержания их в условиях вивария, коротким сроком беременности, их высокой плодовитостью, а также тем, что строение почек у данных животных и их антенатальное развитие имеют черты, сходные с почкой человека [8].
Моделирование подострого инфекционно-воспалительного процесса в брюшной полости на 4 половозрелых самках крыс линии WAG массой 250–300 г выполняли следующим образом: животных предварительно сенсибилизировали путем однократного подкожного введения в область бедра 0,1 мл взвеси убитых нагреванием в течение 1 часа при температуре 80 °С клеток референтного штамма Escherichia coli (ATCC 25922 (F50)) плотностью 1,0 ед. по шкале McFarland. Через 10 суток животным внутрибрюшинно вводили 0,1 мл взвеси суточной культуры штамма Escherichia coli в 20% растворе маннитола, которая содержала 1,5 × 109 микробных клеток, при предварительном раздражении брюшины введением в брюшную полость мясо-пептонного бульона. Инфицирование животных повторяли при аналогичных условиях через 10 и 20 дней. После моделирования инфекционно-воспалительного процесса самок оплодотворяли с целью получения потомства [9].
В данном исследовании были сформированы следующие группы: группа I (группа контроля) — беременные крысы-самки (n = 3) не подвергались каким-либо манипуляциям, при этом 1 самку выводили из эксперимента на поздних сроках гестации с целью извлечения плодов (n = 7), а от 2 самок получали потомство (n = 11), которое в первые сутки с момента рождения выводилось из эксперимента; группа II (исследуемая группа) — беременные крысы-самки (n = 4) с подострым абдоминальным инфекционно-воспалительным процессом, вызванным Escherichia coli, при этом 2 самок на поздних сроках гестации выводили из эксперимента для получения плодов (n = 10), а от 2 самок получали потомство (n = 13), которое в первые сутки с момента рождения выводилось из эксперимента.
Материалом исследования явилась ткань почки плодов и новорожденных. Полученный материал фиксировался в 10% растворе формалина. Уплотнение тканей, фиксированных в формалине, достигалось проводкой через спирты увеличивающейся концентрации, целлоидин, хлороформ и заливкой в парафин. Из приготовленных блоков для окрашивания гематоксилином и эозином, пикрофуксином по Ван Гизону готовились серийные срезы толщиной 4–5 × 10–6 м. Микропрепараты изучали на микроскопе Olympus ВХ-41 с последующей обработкой программой Olympus DP-soft version 3.1, с помощью которой проводилось морфометрическое исследование.
Средние значения показателей в группах сравнивали с помощью t-критерия Стьюдента и U-критерия Манна — Уитни. Значимость различий между показателями принималась при уровне значимости p < 0,05. Статистические расчеты проводили с использованием программы Statistic Soft 6.0.
Результаты и обсуждение
При микроскопическом исследовании гистологических срезов почек плодов и новорожденных групп I и II определялась местами четкая, местами нечеткая дифференцировка на корковый и мозговой слои. В обеих группах ткань почек состояла из паренхиматозного, представленного клубочковым и канальцевым аппаратами, и стромального компонентов. В корковом слое почек плодов и новорожденных групп I и II определялись клубочковый и канальцевый аппараты, а также стромальный компонент, а в мозговом слое — канальцевый аппарат и стромальный компонент.
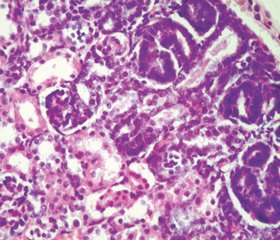
В почках плодов и новорожденных обеих групп на периферии коркового слоя определялась в виде сплошной полосы нефрогенная зона (рис. 1), характеризующаяся наличием почечных телец, находящихся на ранних стадиях развития, канальцев, среди которых практически невозможно было идентифицировать их сегментарную принадлежность, сосудов, клеточных элементов и немногочисленных соединительнотканных волокон. В нефрогенной зоне среди клеточных элементов, располагающихся диффузно, были выявлены малодифференцированные клетки, которые многими учеными названы камбиальными нефрогенными клетками [10], клетки фибробластического ряда, а также иммунные клетки. В большинстве полей зрения в нефрогенной зоне значительный объем приходился на зачатки нефрона, что совпадает с данными других ученых [10]. Интересно то, что в нефрогенной зоне почек плодов и новорожденных группы II отмечалось снижение количества и плотности расположения зачатков как гломерулярного, так и тубулярного компонентов нефрона, что свидетельствовало о задержке процессов нефрогенеза.
Проведенное морфометрическое исследование установило, что в группах I и II среднее значение толщины нефрогенной зоны было значимо (p < 0,05) меньшим у новорожденных (группа I — 130,49 ± 1,60 мкм, группа II — 159,11 ± 2,02 мкм) по сравнению с плодами (группа I — 162,01 ± 3,95 мкм, группа II — 175,73 ± 1,75 мкм), что обусловлено закономерными процессами уменьшения количества незрелых структур в почке с увеличением возраста. Многими учеными отмечено, что с увеличением возраста плода размеры нефрогенной зоны снижаются на фоне увеличения размеров коркового и мозгового слоев почки [11].
В литературе имеются противоречивые данные относительно сроков исчезновения нефрогенной зоны в почках. Некоторые ученые отмечают, что нефрогенная зона в почках у плодов уменьшается с увеличением сроков гестации и полностью исчезает в 36 недель гестации [11]. Другие ученые выявили нефрогенную зону в почках у доношенных новорожденных и считают данный факт вариантом нормы. Описано, что нефрогенная зона может регрессировать, подвергаться склерозу либо становиться митотически активной [12].
При сравнении средних значений толщины нефрогенной зоны в почках плодов и новорожденных обеих групп было выявлено значимое (p < 0,05) преобладание данного морфометрического показателя в группе II по сравнению с группой I, что свидетельствовало о задержке процессов нефрогенеза.
Гломерулярный аппарат почек плодов и новорожденных группы II по сравнению с группой I характеризовался количественными и качественными изменениями. В группах I–II при подсчете абсолютного количества клубочков в поле зрения микроскопа × 200 были получены следующие показатели: в группе I у новорожденных среднее значение количества клубочков составило 20,00 ± 0,39, у плодов — 13,36 ± 0,34; в группе II у новорожденных — 11,04 ± 0,26, у плодов — 6,95 ± 0,25. При анализе полученных показателей в обеих группах нами было отмечено, что с возрастом, то есть от плода к новорожденному, происходило значимое (p < 0,05) увеличение среднего значения абсолютного количества клубочков, что совпадает с данными литературы [13]. У плодов и новорожденных группы II средние значения абсолютного количества клубочков были значимо (p < 0,05) меньшими по сравнению с соответствующими показателями группы I, что свидетельствует о задержке процессов гломерулогенеза.
Число клубочков у крыс, согласно данным литературы, увеличивается не только во внутриутробном периоде, но и в первые дни — недели постнатальной жизни, а в дальнейшем изменяется незначительно [14].
В литературе нет четких данных относительно постнатального образования и развития нефронов у людей. В части публикаций отмечено, что у людей формирование нефронов завершается примерно на 32–34-й неделе гестации, и поэтому любой дефицит количества нефронов, возникающий при рождении, не может быть компенсирован путем усиленного нефрогенеза после рождения [15, 16]. В то же время имеются публикации, где указано, что у недоношенных детей нефрогенез наблюдается до 40-го дня после рождения [15, 17].
В процессе развития почечных телец у крыс, как известно, выделяют следующие стадии: клеточных уплотнений и пузырьков (стадия I), S-образного тела (стадия II), зачатка почечного тельца (стадия III), молодого почечного тельца (стадия IV), зрелого почечного тельца (стадия V) [18].
В нашем исследовании в почках плодов и новорожденных групп I и II определялись все вышеуказанные стадии развития почечного тельца, при этом количественные характеристики клубочков, находящихся на различных стадиях развития, отличались в группах, что представлено в табл. 1. В обеих группах с увеличением возраста, то есть от плода к новорожденному, в почках отмечались процессы созревания клубочкового аппарата, что проявлялось значимым (p < 0,05) увеличением относительного количества молодых (стадия IV) и зрелых (стадия V) почечных телец, уменьшением относительного количества клубочков, находящихся на стадии клеточных уплотнений и пузырьков (стадия I) и S-образного тела (стадия II). У новорожденных по сравнению с плодами в группе I среднее значение относительного количества клубочков, находящихся на III стадии развития (стадия зачатка почечного тельца), значимо (p > 0,05) не отличалось, а в группе II имело тенденцию (p > 0,05) к увеличению.
При сравнении показателей относительного количества клубочков, находящихся на различных стадиях развития, у плодов и новорожденных обеих групп в группе II было выявлено замедление процессов созревания клубочкового аппарата почек. Так, в группе II по сравнению с группой I у плодов было выявлено значимое (p < 0,05) увеличение относительного количества клубочков, находящихся на I стадии развития, тенденция (p > 0,05) к увеличению относительного количества клубочков, находящихся на II стадии развития, тенденция (p > 0,05) к уменьшению относительного количества клубочков, находящихся на III стадии развития, значимое (p < 0,05) уменьшение относительного количества клубочков, находящихся на IV и V стадиях развития; у новорожденных — значимое увеличение относительного количества клубочков, находящихся на I и II стадиях развития, тенденция (p > 0,05) к уменьшению относительного количества клубочков, находящихся на III стадии развития, значимое (p < 0,05) уменьшение относительного количества клубочков, находящихся на IV и V стадиях развития (табл. 1).
/30-1.jpg)
При исследовании микропрепаратов почек плодов и новорожденных в группе I почечные тельца равномерно располагались в корковом слое, а в группе II обращало на себя внимание неравномерное их расположение, местами с наличием участков с агломерулярностью. В группе I молодые и зрелые почечные тельца увеличивались в размерах от плода к новорожденному, в группе II данная особенность практически не определялась. Кроме того, в группе II молодые и зрелые почечные тельца были более мелких размеров по сравнению с группой I, что также свидетельствует о задержке процессов созревания клубочкового аппарата почек. В группе II среди молодых и зрелых почечных телец были выявлены единичные почечные тельца без сосудистых клубочков, в молодых и зрелых почечных тельцах было выявлено полнокровие и стаз части гломерулярных капилляров (рис. 2), расширение мочевого пространства, наличие кровоизлияний, уменьшение количества и компактности расположения капиллярных петель. Необходимо отметить, что в группе II выявленные структурные изменения в клубочковом аппарате почек нарастали с возрастом, то есть от плода к новорожденному.
В канальцевом аппарате почек плодов и новорожденных группы II также были выявлены структурные изменения. В корковом слое почек плодов и новорожденных канальцы нефронов имели более суженный просвет и маленькие размеры, в то время как в мозговом слое канальцы были больших размеров и с более расширенным просветом. У всех животных данной группы местами было выявлено очаговое утолщение базальных мембран канальцев. Во всех отделах канальцевой системы нефрона отмечались очаговые дистрофические и некротические изменения эпителиальной выстилки (рис. 1, 2). В просвете некоторых канальцев были обнаружены скопления десквамированных и разрушенных эпителиальных клеток. Местами просветы канальцев были резко сужены, принимали щелевидную форму за счет набухания эпителиальной выстилки в связи с развившимися в ней дистрофическими изменениями. В части полей зрения в корковом и мозговом слоях почек плодов и новорожденных определялись единичные резко расширенные канальцы, принимающие кистовидные очертания, эпителиальная выстилка которых была истончена.
/31-1.jpg)
В почках новорожденных и особенно плодов группы I были выявлены немногочисленные недифференцированные канальцы, которые по своим структурным особенностям невозможно было отнести ни к одному из отделов канальцевой системы нефрона, что является вариантом нормы и отмечено в публикациях различных ученых [19]. В группе II в почках у новорожденных и особенно у плодов было выявлено значительно больше полей зрения с наличием недифференцированных канальцев, что свидетельствовало о задержке развития канальцевого отдела нефрона. Интересно то, что выявленные структурные изменения в тубулярной части нефрона у животных группы II нарастали от плода к новорожденному.
Стромальный компонент почек плодов и новорожденных обеих групп был представлен рыхлой соединительной тканью, сосудами и клеточными элементами. В группе I в строме почек отмечено возрастное утолщение волокон соединительной ткани и уменьшение количества клеточных элементов, среди которых определялись клетки фибробластического ряда и иммунные клетки, при этом сам стромальный компонент в почках от плода к новорожденному уменьшался. Снижение удельного объема соединительной ткани в почках плодов с увеличением их возраста также отметили в своих исследованиях и другие ученые [20].
/31-2.jpg)
В группе II в почках плодов и новорожденных также отмечалось возрастное утолщение волокон соединительной ткани и уменьшение стромального компонента, однако по сравнению с группой I соединительнотканный компонент был более выраженным, что происходило за счет склеротических изменений и приводило к увеличению стромы данного органа (рис. 3); клеточный компонент у данных животных с возрастом увеличивался, был более выраженным по сравнению с группой I и характеризовался наличием клеток фибробластического ряда и иммунных клеток. Выявленное нами нарастание инфильтрации иммунными клетками свидетельствует, скорее всего, о напряженности местного иммунитета в почках и усилении барьерной функции лимфоидных образований у плодов и новорожденных в связи с антигенной стимуляцией, обусловленной наличием в организме матери абдоминального подострого инфекционно-воспалительного процесса, вызванного Escherichia coli. Кроме того, в данной группе определялись полнокровные сосуды, локализующиеся в строме коркового и мозгового слоев почек, а также мелкоочаговые кровоизлияния (рис. 3). В почках у животных группы II выявленные склеротические изменения, клеточная инфильтрация стромы и гемодинамические нарушения нарастали от плода к новорожденному, причем гемодинамические нарушения были более выраженными в мозговом слое почек по сравнению с корковым.
При морфометрическом исследовании (табл. 2) в группах I и II у новорожденных по сравнению с плодами в корковом слое почек отмечалось возрастное значимое (p < 0,05) увеличение удельного объема клубочков и канальцев, уменьшение удельного объема стромы; в мозговом слое — возрастное значимое (p < 0,05) увеличение удельного объема канальцев и уменьшение удельного объема стромы. При этом у новорожденных и плодов обеих групп удельные объемы канальцев и стромы были значимо (p < 0,05) большими в мозговом слое по сравнению с корковым слоем.
/32-1.jpg)
В группе II по сравнению с группой I у плодов и новорожденных в корковом слое почек удельные объемы клубочков и канальцев были значимо (p < 0,05) меньшими, а удельный объем стромы — значимо (p < 0,05) большим; в мозговом слое удельный объем канальцев был значимо (p < 0,05) меньшим, а удельный объем стромы — значимо (p < 0,05) большим. Выявленное в данной группе уменьшение удельного объема паренхимы, то есть клубочков и канальцев, свидетельствовало о задержке процессов развития клубочкового и канальцевого аппаратов почек, а увеличение удельного объема стромы происходило за счет склеротических процессов, которые нами были отмечены при обзорной микроскопии и могли также приводить к атрофии паренхиматозного компонента.
Отмеченные нами в ходе проведенного исследования гистологические и морфометрические изменения в почках плодов и новорожденных возникли в связи с наличием у их матерей экспериментального абдоминального подострого инфекционно-воспалительного процесса, вызванного Escherichia coli, который привел к развитию хронической плацентарной недостаточности, выявленной нами в ранее проведенных морфологических исследованиях [21, 22]. Хроническая плацентарная недостаточность, развитие которой в данном случае обусловлено постоянным антигенным дрейфом и наличием чрезвычайно широкого спектра факторов патогенности Escherichia coli [6], как известно, приводит к развитию хронической внутриутробной гипоксии плода [23].
Структурные изменения, как известно, влекут за собой нарушения функций [8]. Выявленные нами морфологические изменения в почках плодов и новорожденных от матерей с подострым абдоминальным инфекционно-воспалительным процессом, вызванным Escherichia coli, приведут в дальнейшем к тому, что данные органы будут характеризоваться сниженным функциональным резервом и становиться более восприимчивыми к действию различных повреждающих факторов.
Выводы
1. Абдоминальный подострый инфекционно-воспалительный процесс в организме матери, вызванный Escherichia coli, приводит к гистологическим и морфометрическим изменениям в гломерулярном, тубулярном отделах нефрона, а также в стромальном компоненте почек плодов и новорожденных.
2. Гломерулярный аппарат почек плодов и новорожденных характеризуется неравномерным расположением в корковом слое, задержкой развития, изменением формы, гемодинамическими изменениями, расширением мочевого пространства, отсутствием сосудистых клубочков, уменьшением количества и компактности расположения капиллярных петель в некоторых молодых и зрелых почечных тельцах. Структурные изменения в клубочковом аппарате почек нарастают по направлению от плода к новорожденному.
3. Тубулярный аппарат почек плодов и новорожденных характеризуется задержкой развития, изменением формы и очаговым утолщением базальных мембран отдельных канальцев, очаговыми дистрофическими, некротическими и десквамативными изменениями эпителиальной выстилки. Гистологические изменения в канальцевом отделе нефрона также нарастают по направлению от плода к новорожденному.
4. У новорожденных по сравнению с плодами в стромальном компоненте почек нарастают склеротические изменения, гемодинамические нарушения, клеточная инфильтрация, характеризующаяся наличием клеток фибробластического ряда и иммунных клеток. В мозговом слое почек гемодинамические нарушения более выраженные по сравнению с корковым слоем.
5. Развившиеся в почках плодов и новорожденных гистологические и морфометрические изменения, обусловленные наличием у матери экспериментального подострого инфекционно-воспалительного процесса в брюшной полости, вызванного Escherichia coli, приведут в будущем к сниженным функциональным возможностям почек как гомеостатического органа и развитию различной нефрологической патологии у таких детей.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Рецензенты: Дядык Е.А. — д.м.н., профессор, зав. кафедрой патологической и топографической анатомии НМАПО имени П.Л.Шупика; Туманский В.А. — д.м.н., ЗДН Украины, проректор по науке Запорожского государственного медицинского университета, профессор кафедры патанатомии и судебной медицины.
Список литературы
1. Перинатальная смертность: причины, факторы риска, пути снижения / В.В. Симрок, Ю.Н. Слепичко, Т.П. Жмурко [и др.] // Таврический медико-биологический вестник. — 2012. — Т. 15, № 2, ч. 1(58). — С. 280-282.
2. Самохвалова А.В. Особливості раннього неонатального періоду у новонароджених дітей від матерів з репродуктивними втратами та TORCH-інфекціями / А.В. Самохвалова // Актуальні питання педіатрії, акушерства та гінекології. — 2013. — № 1. — С. 97-99.
3. Ким Е.И. Состояние здоровья детей раннего возраста из группы риска развития внутриутробных инфекций: Автореф. дис... на соискание учен. степени канд. мед. наук: спец. 14.00.09 «Педиатрия» / Е.И. Ким. — Хабаровск, 2007. — 26 с.
4. Иотенко Б.А. Влияние инфекции на развитие хронической недостаточности плаценты / Б.А. Иотенко, Т.Н. Демина, О.К. Межова // Новости медицины и фармации. Гинекология (тематический номер). — 2008. — № 253. — Режим доступа: http://www.mif-ua.com/archive/article/5949.
5. Фетоплацентарная недостаточность инфекционного генеза: роль хламидийной инфекции / И.О. Макаров, Е.И. Боровкова, Т.В. Шеманаева [и др.] // Репродуктивная эндокринология. — 2012. — № 6(8). — С. 79-82.
6. Жабченко И.А. Уропатогенные штаммы Escherichia coli: особенности функционирования, факторы вирулентности, значение в клинической практике / И.А. Жабченко // Таврический медико-биологический вестник. — 2013. — Т. 16, № 2, ч. 2(62). — С. 201-206.
7. Инфекции мочевыводящих путей в акушерстве и гинекологии / Е.В. Шипицына, Т.А. Хуснутдинова, А.М. Савичева и др. // Журнал акушерства и детских болезней. — 2015. — Т. LXIV, вып. 6. — С. 91-104.
8. Морфофункциональная характеристика почек у матери, плода и потомства при воздействии вибрации промышленной частоты во время беременности / Ю.И. Скляров, Г.В. Правоторов, О.И. Балуева и др. // Морфология. — 2005. — Т. 128, № 4. — С. 29-32.
9. Спосіб моделювання внутрішньоутробного інфікування плода та новонародженого як наслідку підгострого інфекційно-запального процесу матері / В.Д. Марковський, І.В. Сорокіна, М.С. Мирошниченко, О.М. Плітень, М.М. Мішина, А.С. Шапкін, О.В. Калужина. — Патент на винахід № а 2014 00681; Заявл. 24.01.2014; Опубл. 10.06.2014; Бюл. № 11.
10. Баринов Э.Ф. Морфометрическая характеристика нефрогенной зоны почек новорожденных крысят / Э.Ф. Баринов, О.Н. Сулаева // Морфология. — 2003. — Т. 123, № 2. — С. 77-79.
11. A study of histogenesis of human fetal kidney / K.C. Tank, S.S. Saiyad, A.M. Pandya et al. // International Journal of Biologi–cal and Medical Research. — 2012. — № 3(1). — P. 1315-1321.
12. Nephrogenic rests, nephroblastomatosis and associated lesions of the kidney / G.J. Lonergan, M.I. Martínez-León, G.A. Agrons et al. // RadioGraphics. — 1998. — Vol. 18, № 4. — P. 947-968.
13. Quaggin S.E. Development of the renal glomerulus: good neighbors and good fences / S.E. Susan, J.A. Kreidberg // Deve–lopment. — 2008. — № 135. — P. 609-620.
14. Онтогенетические изменения структурных показателей почек крыс / У.В. Доржу, К.А. Шошенко, В.М. Беличенко и др. // Фундаментальные исследования. — 2014. — № 12. — С. 1201-1206.
15. Абдуллина Г.А. Клиническая физиология почек у недоношенных: роль динамического наблюдения / Г.А. Абдуллина, А.И. Сафина, М.А. Даминова // Вестник современной клинической медицины. — 2014. — Т. 7, вып. 6. — С. 9-13.
16. Influence of birth weight on the renal development and kidney diseases in adulthood: experimental and clinical evidence / M.C.P. Franco, V. Oliveira, B. Ponzio et al. // International journal of nephrology. — 2012. — URL: http://dx.doi.org/10.1155/2012/608025.
17. Histomorphometric analysis of postnatal glomeruloge–nesis in extremely preterm infants / M.M. Rodríguez, A.H. Gómez, C.L. Abitbol et al. // Pediatric and Developmental Pathology. — 2004. — № 7(1). — P. 17-25.
18. Виноградова М.С. Особенности пренатального онтогенеза почек крыс Вистар и вазопрессин-дефицитных крыс Браттлборо / М.С. Виноградова, А.Р. Боярская, Л.Н. Иванова // Вестник НГУ. Серия: Биология, клиническая медицина. — 2010. — Т. 8, вып. 1. — С. 45-50.
19. Последовательность дифференцировки канальцев нефронов окончательной почки человека во внутриутробном развитии / Д.В. Баженов, Л.В. Вихарева, С.М. Пантелеев и др. // Морфология. — 2011. — Т. 140, № 5. — С. 18-21.
20. Histogenesis of human fetal renal cortex / R.K. Ukey, A.R.A. Waheed, M. Laeeque et al. // International Journal of Recent Trends in Science and Technology. — 2014. — Vol. 9(3). — P. 378-385.
21. Инфекционная патология матери и ее влияние на антропометрические показатели новорожденных / В.Д. Марковский, И.В. Сорокина, М.С. Мирошниченко и др. // Аннали Мечниковського інституту. — 2014. — № 1. — С. 27-32.
22. Моделювання підгострого (пролонгованого) інфекційно-запального процесу у самиць щурів лінії WAG / В.Д. Марковський, І.В. Сорокіна, М.М. Мішина та ін. // Неонатологія, хірургія та перинатальна медицина. — 2014. — Т. IV, № 4(14). — С. 60-65.
23. Intrauterine hypoxia: clinical consequences and therapeutic perspectives / L.P. Thompson, S. Crimmins, B.P. Telugu et al. // Research and Reports in Neonatology. — 2015. — № 5. — P. 79-89.

/30-1.jpg)
/31-1.jpg)
/31-2.jpg)
/32-1.jpg)