В 1919 году во время эпидемии гриппа американский врач и патофизиолог Эрнест Уильям Гудпасчер (Goodpasture E.W.) описал сочетание тяжелого поражения легких (геморрагического альвеолита) и быстропрогрессирующего гломерулонефрита у пациента 18 лет [10]. Спустя 39 лет, в 1958 году, по предложению М. Stanton и J. Tange, описавших уже 7 подобных случаев, данное заболевание было названо синдромом Гудпасчера. Это системный капиллярит с преимущественным поражением альвеол легких и базальных мембран гломерулярного аппарата почек по типу геморрагических пневмонита и гломерулонефрита [2]. Особенностью этого синдрома считают наличие антител к компонентам базальной мембраны альвеол и почечных клубочков (анти-БМК-антител; anti-glomerular basement membrane — anti-GBM), обусловливающих их одновременное поражение [11]. В 1950-х годах C.A. Krakower и S.A. Greenspon [15] идентифицировали базальную мембрану альвеол и почечных клубочков (GBM) как антиген. Анти-GВМ-антитела направлены против неколлагенового (NC-1) домена α-3 цепи коллагена IV типа, который в наиболее высокой концентрации находится в базальных мембранах почечных и легочных капилляров [9]. Преимущественное вовлечение в иммунопатологический процесс именно альвеолярной и гломерулярной мембраны объясняется, с одной стороны, максимальной степенью представления в них α-3 цепей коллагена, с другой — наибольшей структурной доступностью для фиксации циркулирующих антител [7, 11].
Некоторые исследователи расширяют понятие синдрома Гудпасчера, по существу отождествляя его с легочно-почечным синдромом, который наблюдают не только при гиперпродукции анти-GBM-антител, но и при АНЦА-ассоциированных системных васкулитах, а также при тромботических микроангиопатиях и синдроме диссеминированного внутрисосудистого свертывания крови [8]. Ряд нефрологов объединяют сочетание циркулирующих анти-GBM-антител, поражения почек и легких в понятие «болезнь Гудпасчера», а при отсутствии циркулирующих антител — в «синдром Гудпасчера» [1]. Однако в материалах Международной согласительной конференции по номенклатуре васкулитов в Chapel Hill (2012) термин «болезнь Гудпасчера» не упоминается вообще, а под синдромом Гудпасчера (отмечая, что этот эпоним использовался в прошлом) понимают комбинированное поражение легких и почек при болезни анти-GBM-антител [14]. Именно последний термин — anti-GBM disease — участники консенсуса подают в номенклатуре и считают предпочтительным: таким, который охватывает связанные с осаждением анти-GBM-антител повреждения либо гломерулярных капилляров, либо легочных капилляров, либо и того, и другого вместе. При этом авторы отмечают неточность названия anti-GBM disease, поскольку анти-GBM-антитела реагируют не только с базальной мембраной почечных клубочков, но также и с базальными мембранами альвеолярных капилляров, но все же предлагают его сохранить, отдавая дань сложившейся терминологической традиции.
Синдром Гудпасчера является редким заболеванием: 0,5–1 случай на 1 млн в год. Пик заболеваемости приходится на возраст до 30 и после 60 лет, несколько чаще болеют мужчины. Без своевременной диагностики и лечения заболевание может привести к массивному легочному кровотечению, острой почечной недостаточности и даже к смерти [2, 11]. Ранее синдром Гудпасчера считался смертельным заболеванием [22], внедрение агрессивной иммуносупрессивной терапии в сочетании с плазмаферезом, применение хронического гемодиализа повысили уровень годичной выживаемости до 86,9 % [13], 5-летней — до 80 % [22].
Наиболее частое клиническое проявление синдрома Гудпасчера — быстропрогрессирующий гломерулонефрит с неуклонным снижением почечных функций вплоть до развития терминальной стадии хронической почечной недостаточности, с гематурией и протеинурией разной степени выраженности (протеинурия нефротического уровня встречается редко). Морфологически при световой микроскопии визуализируют появление полулуний в более 50 % клубочков, фибрина в мочевом пространстве; часто встречаются разрывы базальной мембраны боуменовой капсулы и выход клеток и фибрина из полулуний в окружающий интерстиций. Поражение легких клинически проявляется либо кровохарканьем, либо кровотечениями, которые наиболее часто и определяют прогноз заболевания. Морфологически изменения описывают как некротизирующий геморрагический интерстициальный пульмонит с острыми очаговыми некрозами альвеолярных стенок и с внутриальвеолярными кровоизлияниями, фиброзированием перегородок, гипертрофией выстилающих септы клеток и организацией крови в пределах альвеолярных пространств [1, 6].
Анализ групп больных c синдромом Гудпасчера с различной степенью выраженности почечной недостаточности позволил обозначить факторы, которые определяют неблагоприятный почечный прогноз: уровень креатинина в сыворотке крови более 600 мкмоль/л, олигоанурия, ранняя потребность в диализе, отсутствие нормальных клубочков в биоптате и высокий процент полулуний, циркуляция антител к GBM [16, 18].
Цель данного клинического отчета — описать и обсудить случай быстропрогрессирующего поражения почек и легких у молодого пациента с выявленными антителами к базальной мембране клубочков (анти-GBM-антител), успешно леченого ритуксимабом.
Пациент К., 1991 года рождения, житель Винницкой области, поступил в клиническую больницу «Феофания» ГУД 28.07.2017 года в крайне тяжелом состоянии, обусловленном дыхательной недостаточностью на фоне субтотального поражения легких, анурией и острой почечной недостаточностью.
Из анамнеза известно, что в период с 22.06 по 29.06.2017 отмечалось значительное переохлаждение с эпизодом озноба, в дальнейшем повышения температуры не было. С 30.06.2017 беспокоил кашель; лечился самостоятельно отхаркивающими препаратами. В этот период отмечался эпизод злоупотребления спиртными напитками в течение недели. Приблизительно 17.07.2017 появилось кровохарканье (неинтенсивное, 1 плевок бурого цвета). С этими симптомами (кашель и кровохарканье) обратился в центральную районную больницу, где после проведения рентгенографии органов грудной клетки была заподозрена полисегментарная пневмония, назначена антибактериальная терапия. Однако состояние больного прогрессивно ухудшалось — нарастали слабость и одышка, появилось более обильное кровохарканье, рентгенологически расширялись границы поражения легочной ткани. Через 3 дня после начала антибактериальной терапии пациент отметил эпизод ночной гематурии со снижением уровня гемоглобина до 70 г/л. Еще через 3 дня развилась анурия.
24.07 пациент доставлен в Винницкую областную клиническую больницу (ОКБ), где консилиум врачей на основании клинических данных впервые заподозрил синдром Гудпасчера. С этого момента течение болезни становится критически быстропрогрессирующим.
При поступлении в Винницкую ОКБ у пациента К. наблюдались следующие лабораторные показатели: гемоглобин — 70 г/л, эритроциты — 2,89 × 1012/л, лейкоциты — 9,0 × 109/л, палочко–ядерные — 10 %, скорость оседания эритроцитов (СОЭ) — 20 мм/ч. Общий белок — 61 г/л, мочевина — 8,0 ммоль/л, креатинин — 94 мкмоль/л, билирубин — 16,6 мкмоль/л, аланинаминотрансфераза — 45 ед/л, аспартатаминотрансфераза — 38 ед/л. В общем анализе мочи: белок — 0,066 ‰, эритроциты — 20–30 в поле зрения (п/з), лейкоциты — 6–7 в п/з. Цитологическое исследование мокроты: в препарате эритроциты, альвеолоциты, фагоциты — до 15 в п/з, лейкоциты — 2–8 в п/з, лимфоциты — 0–1 в п/з. Прокальцитонин — 0,18 нг/мл (норма — до 0,5 нг/мл). Исключены туберкулез легких, ВИЧ, вирусные гепатиты В и С, взяты анализы на антитела к базальным гломерулярным мембранам. В динамике у пациента прогрессировала дыхательная и почечная недостаточность, анемия (гемоглобин — 60 г/л), нарастали показатели креатинина (до 446 мкмоль/л, 576 мкмоль/л) и мочевины (12,1 ммоль/л, 18,7 ммоль/л). Проводилась инфузия свежезамороженной плазмы, отмытых эритроцитов, в связи с прогрессированием уремии проведено 3 сеанса гемодиализа. Нарастающая дыхательная недостаточность потребовала применения СРАР-терапии (Continuous Positive Airways Pressure). Во время пребывания в Винницкой ОКЛ пациенту проведена пульс-терапия метилпреднизолоном в дозе 500 мг — без существенного клинико-лабораторного эффекта. Для дальнейшего лечения больной реанимобилем на вентиляции в СРАР-режиме перевезен в клиническую больницу «Феофания» (г. Киев).
При поступлении состояние пациента крайне тяжелое. Объективно: астенического телосложения. В сознании, адекватен. Кожные покровы бледные, высыпаний на коже в данное время и в анамнезе нет. Слизистые оболочки чистые. Периферические лимфоузлы, доступные пальпации, не увеличены. Мышцы хорошо развиты, миалгий нет. Суставы внешне без патологических изменений. Пациент дышит через маску с кислородом, при ее снятии быстро наступает чувство нехватки воздуха. SaO2 (без маски) — 72 %. На дополнительной вентиляции в режиме СРАР и подаче 70% кислорода сатурация капиллярной крови 98 %. Незначительный цианоз губ. Экскурсия грудной клетки сохранена. Аускультативно: резко ослабленное везикулярное дыхание на всем протяжении с фокусами отсутствия дыхания, влажные хрипы не выслушиваются, на выдохе рассеянные сухие свистящие хрипы. Обильное кровохарканье. Сердечные тоны звучные, патологические шумы не выслушиваются. Частота сердечных сокращений — 88 уд/мин, при разговоре возрастает до 100 уд/мин. Артериальное давление — 130/90 мм рт.ст. Живот мягкий, безболезненный, принимает участие в акте дыхания. Печень выступает из-под края реберной дуги на 1,5 см. Пальпируется нижний край селезенки. Отрезки кишечника без особенностей. Стул до 2 раз в день без патологических примесей. Анурия. Отеки на нижних конечностях отсутствуют.
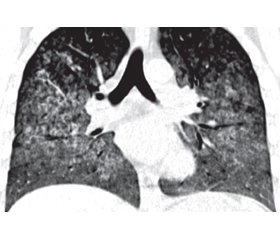
Пациенту было проведено комплексное обследование для уточнения диагноза. При ультразвуковом исследовании органов брюшной полости: размеры правой почки — 127 × 54 мм; левой — 140 × 58 мм, паренхима толщиной в правой почке 17 мм, в левой — 19 мм, дифференцированная, корковый слой диффузно повышенной эхогенности; небольшое количество свободной жидкости во фланках. Эхокардиография: без существенных изменений, фракция выброса — 60 %. Клапанный аппарат без изменений, локальных нарушений сократимости, признаков легочной гипертензии и наличия свободной жидкости в полости перикарда не выявлено. Допплеровское исследование сосудов верхних и нижних конечностей — без диагностически значимых симптомов. Мультиспиральная компьютерная томография (МСКТ) органов грудной клетки от 31.07: на аксиальных и корональных КТ-срезах обоих легких субтотально, кроме самых крайних периферических отделов, определяется значительное снижение пневматизации легочной паренхимы по типу «матового стекла» и альвеолярного компонента (диффузное альвеолярное кровоизлияние). Проходимость трахеобронхиального дерева не нарушена (рис. 1).
/90-1.jpg)
С целью дифференциальной диагностики были проведены следующие лабораторные и иммунологические исследования: антинуклеарные антитела IgG (ANA) — 0,24 (< 1,0 — негативный). Осмотическая резистентность эритроцитов: min — 0,50 % (норма — 0,48–0,46 %), max — 0,30 % (норма — 0,34–0,32 %. Протеиназа-3 (PR-3), антитела IgG < 0,2 (негативный при < 1,0). Миелопероксидаза (МРО), антитела IgG < 0,2 (негативный при < 1,0). G-6-FDG (глюкозо-6-фосфатдегидрогеназа) — 22 Ед/гр Hb (норма — 6,6–17,2).
Иммунограмма: лейкоциты — 18,9 × 109/л, лимфоциты — 1,56 × 109/л (8,3 %), Т-лимфоциты (CD3+) — 0,59 × 109/л (38,1 %), Т-хелперы (CD4+) — 0,33 × 109/л (21,5 %), Т-супрессоры (CD8+) — 0,14 × 109/л (9,2 %), NK-клетки (CD16+ и CD56+) — 0,13 × 109/л (8,6 %), В-лимфоциты (CD19+) — 0,76 × 109/л (48,8 %), циркулирующий иммунный комплекс (ЦИК) — 9 усл.ед., IgG — 6,36 г/л, IgM — 3,5 г/л, IgA — 1,42 г/л. Наблюдается лимфопения, снижение количества Т-лимфоцитов за счет CD8+, высокий уровень В-лимфоцитов (CD19+) — 48,8 % (норма — 5–17 %; 0,07–0,37 × 109/л), снижение уровня IgG и повышение IgM, снижение комплементарной активности сыворотки крови (40 при норме 54,9–67,5).
Повторно взяты анализы на антитела к базальной мембране гломерулярного аппарата.
В общем анализе крови наблюдалась тяжелая анемия (колебания гемоглобина от 65 до 80 г/л), несмотря на отсутствие видимых источников кровотечения, скудное кровохарканье и проведение постоянных гемотрансфузий. Анемическая панель лабораторных исследований: фолиевая кислота — 1,4 ng/mL (3,1–20,5 ng/mL), витамин В12 —
302,0 pg/mL (187,0–883,0 pg/mL), ферритин > 1500 ng/mL (28,0–365,0 ng/mL), сывороточное железо — 14,2 мкмоль/л, эритропоэтин —
192,0 mIU/mL (5,4–31,0 mIU/mL). Прямая и непрямая реакции Кумбса — отрицательные.
Наблюдалась анурия без позитивных сдвигов, проводилась заместительная почечная терапия — интермиттирующие гемодиализы на аппарате АК 95, а позднее непрерывная (48 часов подряд) заместительная почечная терапия на аппарате Prizmaflex: уровень мочевины — 28 ммоль/л, креатинин — 566 мкмоль/л, калий — 4,7 ммоль/л, натрий — 132 ммоль/л. Общий белок — 43 г/л; альбумин — 29 г/л; билирубин общий — 17,7 мкмоль/л, глюкоза — 7,0 ммоль/л. Проводилась также постоянная СРАР-терапия на аппарате DRAEGER. Состояние больного оставалось тяжелым вследствие почечной и дыхательной недостаточности, которые в динамике прогрессировали.
В ожидании результата анализа крови на антитела к базальной мембране почечных клубочков, по результатам консультаций специалистов и консилиумов, с учетом сочетания легочной и почечной патологии, наличия кровохарканья, прогрессирующего течения заболевания с развитием дыхательной и почечной недостаточности, субтотального поражения легких, по данным МСКТ, отсутствия других системных проявлений [12] пациенту К. был выставлен предварительный диагноз «синдром Гудпасчера».
Была назначена синхронная комбинированная пульс-терапия: последовательные сеансы каскадной плазмофильтрации на аппарате Spectra Optia с использованием каскадных плазмофильтров Evaflux 2A20 (c обработкой за каждый сеанс по 1 ОЦП) через день № 3 с последующим введением циклофосфана 800 мг и метилпреднизолона по 1000 мг в течение 3 дней подряд внутривенно. После завершения пульс-терапии — переход на пероральный прием глюкокортикоидов в дозе 32 мг, а позднее 48 мг в день. Одновременно проводилась симптоматическая терапия, лечение дыхательной и почечной недостаточности. По мнению многих исследователей, именно сочетание плазмафереза, циклофосфамида и глюкокортикодов с последующим переходом на алкилирующий иммунодепрессант является золотым стандартом лечения синдрома Гудпасчера [19, 26].
После проведения синхронной комбинированной пульс-терапии состояние больного продолжало оставаться тяжелым: сохранялись симптомы дыхательной и почечной недостаточности без позитивной динамики, кровохарканье, периодически с усилением, нарастал анемический синдром, присоединилась тромбоцитопения, потребовавшая неоднократных переливаний тромбоцитарной массы, наблюдалась значительная гипопротеинемия.
06.08.2017 был получен первый анализ антител IgG к базальной мембране гломерулярного аппарата (GBM) от 27.07.2017 — 4,2 АИ (негативный при < 1,0). Повторный анализ (от 02.08.2017) продемонстрировал более высокий показатель — 5,2 АИ. Полученные иммунологические данные позволили подтвердить диагноз синдрома Гудпасчера.
Таким образом, на основании изолированного нетоксического и неинфекционного поражения двух органов — легких и почек по типу быстропрогрессирующего гематурического гломерулонефрита и геморрагического альвеолита, высоких титров антител к базальной мембране гломерулярного аппарата (дважды), отсутствия повышения титров других антител, специфичных для системных заболеваний соединительной ткани и системных васкулитов, пациенту был выставлен диагноз «синдром Гудпасчера, острое течение, анти-GBM-позитивный, с поражением легких (геморрагический альвеолит, легочная недостаточность 3-й ст., корригированная СРАР-терапией), почек (быстропрогрессирующий гломерулонефрит, анурия с 27.07.2017, уремия, корригированная пролонгированной заместительной терапией на аппарате Prizmaflex). Вторичная анемия, тромбоцитопения».
Основываясь на критически тяжелом состоянии пациента, критической зависимости от СРАР-терапии, критически низком уровне тромбоцитов (48 × 109/л), тяжелой анемии (гемоглобин — 64 г/л), выраженной гипопротеинемии (общий белок — 46,8 г/л), было принято решение воздержаться от проведения биопсии почек и легких.
Пациенту, безусловно, была показана терапия циклофосфамидом или азатиоприном совместно с глюкокортикоидной терапией, однако ее проведение возможно только после достижения уровня тромбоцитов выше 100 × 109/л. Поэтому консилиум принял решение на фоне продолжающейся реанимационной жизнеподдерживающей терапии вернуться к иммуносупрессивной терапии: провести пульс-терапию метилпреднизолоном по 1000 мг 5 дней подряд с переходом на пероральную дозу 64 мг/сутки. Ввиду невозможности продолжения лечения циклофосфамидом из-за цитопении в качестве иммуносупрессорного агента было решено использовать ритуксимаб, который доказал свою эффективность при АНЦА-ассоциированных системных васкулитах [24] и волчаночном нефрите [4, 17]. Обоснованием для применения ритуксимаба при синдроме Гудпасчера явились данные литературы, описание клинических случаев [3, 19, 27], а также повышение у пациента К. уровня CD19+ более чем вдвое, высокий уровень антител к базальной мембране гломерулярного аппарата (анти-GBM-антител), неэффективность предыдущей иммуносупрессивной терапии.
В 2002 году К. Arzoo et al. [5] сообщили об использовании ритуксимаба для лечения пациента с рецидивирующим синдромом Гудпасчера, которому первоначально проводили традиционное лечение циклофосфамидом. Пациент получил шесть недельных доз ритуксимаба с выраженным улучшением симптомов и исчезновением GBM-антител в крови. Сообщалось также, что у пациента сохранялась ремиссия через 10 месяцев после лечения. E. Wechsler et al. (2008) [28] сообщили о применении ритуксимаба для лечения пациента с позитивным GBM-статусом и ВИЧ-инфицированием, который восстановил почечную функцию с исчезновением антител против GBM после лечения глюкокортикоидами, микофенолата мофетилом и ритуксимабом. Y. Shah et al. (2012) [23] сообщилии о трех случаях, когда ритуксимаб применялся для лечения синдрома Гудпасчера. В описанных случаях у двух из трех пациентов отмечен благоприятный исход почечной недостаточности, и у всех трех пациентов после лечения не обнаруживались патологические уровни GBM-антител. В одном случае пациент изначально имел тяжелую почечную недостаточность и требовал диализа; первоначально ему проводилось лечение однократной дозой циклофосфамида, а затем он был переключен на ритуксимаб из-за цитопении. Хотя уровни GBM-антител исчезли, пациент оставался диализзависимым. Еще в одном недавнем исследовании сообщалось о пациенте с анти-GBM-болезнью, у которого развилась тромбоцитопеническая пурпура на стандартной схеме тройной терапии. Когда пациент был переведен с циклофосфамида на ритуксимаб, его клиническое состояние существенно улучшилось, уровни анти-GBM-антител не определялись, хотя пациент так и не восстановил почечную функцию [25].
Наибольший опыт применения ритуксимаба — у 8 пациентов (2 мужчин, 6 женщин, средний возраст — 26,0 ± 13,1 года) описан в работе M. Touzot et al. (2015) [27]. Все пациенты исходно получали иммуносупрессивное лечение циклофосфамидом, глюкокортикоидами и плазмаферезом. Терапия ритуксимабом была начата в течение 2 месяцев после постановки диагноза. Все пациенты, кроме одного, получили 4 еженедельные дозы ритуксимаба 375 мг. Полная ремиссия наблюдалась у 7 из 8 пациентов, в основном через 3 месяца после терапии ритуксимабом. После наблюдения за пациентами в течение 25,6 месяца (диапазон 4–93 мес.) выживаемость пациентов составила 100 %, однако применение ритуксимаба не улучшило скорость клубочковой фильтрации. Антитела против GBM оставались неопределяемыми у всех пациентов в течение всего периода наблюдения.
Пациенту К. была проведена инфузия ритуксимаба по 1000 мг дважды с 2-недельным перерывом между введениями (15.08 и 01.09.2017) на фоне продолжающейся терапии пероральными глюкокортикоидами. Было отмечено существенное улучшение как клинического состояния пациента, так и лабораторных показателей. У пациента остановилось кровохарканье, возобновилась способность к спонтанному дыханию (пациент был отключен от СРАР-терапии на 5-й день после первой инфузии ритуксимаба), в том числе при обычных физических нагрузках, исчезла одышка в покое и при физической нагрузке, при аускультации легких — отсутствие патологических звуковых феноменов. Нормализовался уровень тромбоцитов, возросли количество эритроцитов и уровень гемоглобина, повторный анализ крови на антитела к GBM (от 30.08.2017) зафиксировал их отсутствие. Так, в общем анализе крови от 01.09.2017: эритроциты — 2,69 × 1012/л, гемоглобин — 92 г/л, лейкоциты — 8,9 × 109/л, тромбоциты — 141 × 109/л, СОЭ — 3 мм/ч. В иммунограмме также произошли позитивные сдвиги: лейкоциты — 14,2 × 109/л, лимфоциты — 1,16 × 109/л (8,2 %), Т-лимфоциты (CD3+) — 1,07 × 109/л (92,1 %), Т-хелперы (CD4+) — 0,74 × 109/л (63,5 %), Т-супрессоры (CD8+) — 0,33 × 109/л (28,8 %), соотношение Тх/Тс — 2,2, В-лимфоциты (CD19+) — 0,002 × 109/л (0,2 %), ЦИК — 27 усл.ед., IgG — 6,75 г/л, IgM — 1,02 г/л, IgA — 0,76 г/л. Выраженное снижение количества В-лимфоцитов (CD19+) практически до нуля в совокупности с исчезновением анти-GBM-антител уже через 2 недели после первой инфузии ритуксимаба отражает быстро наступивший В-клеточно-деплеционный эффект препарата, сыгравший ключевую роль в радикальном изменении клинической ситуации. При контрольном проведении МСКТ органов грудной клетки наблюдалась разительная позитивная динамика инфильтративных изменений, симптом «матового стекла» значительно регрессировал: отмечалось уменьшение альвеолярного компонента и появление уплотнения междолевых перегородок, что формируют участки неравномерного фиброза легких (рис. 2). Однако функция почек не была восстановлена, пациент продолжал проходить сеансы гемодиализа. Была сформирована артериовенозная фистула, пациент подготовлен для прохождения программного гемодиализа по месту жительства.
/92-1.jpg)
Пациент К. был выписан из стационара клинической больницы «Феофания» ГУД 14.09.2017 в стабильном состоянии, без признаков дыхательной недостаточности, с необходимостью продолжения почечно-заместительной терапии. Пациент продолжал принимать метилпреднизолон 48 мг в день с постепенным снижением дозы, препараты кальция с витамином D3, нефропротекторную терапию.
В настоящее время пациент продолжает почечно-заместительную терапию, рассматривается вопрос о трансплантации почки.
Данный клинический случай демонстрирует развитие быстропрогрессирующих поражений легких и почек, приведших к критическому состоянию пациента, острой дыхательной и почечной недостаточности в течение 10 дней от момента обращения за медицинской помощью. Необходимо отметить, что синдром Гудпасчера был заподозрен в самом начале заболевания, что потребовало обоснованного неотложного назначения активной терапии иммуносупрессантами. Согласно литературным данным [11], применение тройной терапии — плазмаферез, глюкокортикоиды и циклофосфамид — позволяет существенно улучшить прогноз при синдроме Гудпасчера. В данном случае эта терапия оказалась неэффективной, кроме того, развившаяся (вероятно, вследствие применения циклофосфамида) критичная тромбоцитопения сделала невозможным дальнейшее применение цитостатических иммуносупрессантов. В такой ситуации «терапией отчаяния» явилось применение off-label препарата ритуксимаб, способного оказывать радикальное воздействие на ключевые механизмы иммунопатогенеза — удалять активированные В-клетки, продуцирующие ответственные за почечно-легочные поражения анти-GBM-антитела. Терапия ритуксимабом, проведенная в первый месяц от момента постановки диагноза синдрома Гудпасчера, способствовала позитивному перелому в течении болезни, практически полной реверсии поражения легких, ликвидации жизнеугрожающей цитопении и, в конечном итоге, сохранению жизни пациента. Как и в ряде других клинических наблюдений [20, 21, 23, 25, 27], лечение ритуксимабом оказалось неэффективным в плане восстановления функции почек.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Благодарности. Авторский коллектив, врачи клинической больницы «Феофания» высказывают искренние слова благодарности врачам Винницкой ОКБ за проведенные лечебные и диагностические мероприятия, стабилизацию состояния пациента при подготовке к транспортировке, профессору Винницкого национального медицинского университета им. Н.И. Пирогова Н.А. Станиславчуку за точно высказанное предположение о синдроме Гудпасчера на ранней стадии болезни только по клиническим показателям (без иммунологического подтверждения), зам. главного врача клинической больницы «Феофания» А.Н. Строканю за «мозговой штурм» и анализ литературы по проблеме, зам. главного врача клинической больницы «Феофания» В.Ю. Сакуну за общее руководство коллективом и организацию медицинской помощи, профессору Национальной медицинской академии последипломного образования им. П.Л. Шупика Д.Д. Иванову за подтверждение диагноза болезни Гудпасчера и определение тактики ведения, к.м.н. доценту С.А. Ротовой за консультативную помощь в подготовке пациента к плановому гемодиализу и определении объемов нефропротективной терапии, к.м.н., врачу отделения интерстициальных заболеваний легких Института пульмонологии и фтизиатрии им. Ф.Г. Яновского О.В. Шадриной за помощь в проведении дифференциальной диагностики и оценке степени поражения легких, всем врачам, которые присоединились к лечению пациента, к проведению консилиумов, за интеллектуальную помощь в постановке диагноза и выборе методов лечения. Благодаря совместному мультидисциплинарному подходу к ведению больного и всеобщей поддержке пациент жив, продолжает сеансы почечно-заместительной терапии по месту жительства.
Ранняя диагностика и применение ритуксимаба как залог успешного лечения синдрома Гудпасчера
(комментарий к статье Головач И.Ю. и соавт. «Клинический случай успешного лечения синдрома Гудпасчера ритуксимабом»)
Бевзенко Т.Б.,
доктор медицинских наук, доцент кафедры нефрологии и ПЗТ НМАПО имени П.Л. Шупика, г. Киев, Украина
Болезнь против базальной мембраны гломерулярного клубочка (БМК, анти-БМК-болезнь) — орфанное аутоиммунное заболевание, которое обычно представляет собой быстро прогрессирующий гломерулонефрит, характеризующийся гломерулярными клеточными полумесяцами и линейными отложениями IgG вдоль БМК [2, 4]. Геморрагический пневмонит может возникать либо самостоятельно, либо вместе с поражением почек; последняя ситуация называется синдромом Гудпасчера и представлена в клиническом случае. В связи с редкостью патологии каждый случай синдрома Гудпасчера представляет большой теоретический и практический интерес.
При отсутствии лечения синдром Гудпасчера имеет неблагоприятный прогноз для жизни, также тяжесть прогноза определяет наличие поражения почек. Считается, что изначально наблюдаются высокий уровень креатинина в сыворотке крови (более 600 мкмоль/л), олигоанурия, ранняя потребность в диализе, отсутствие нормальных клубочков и высокий процент полулуний в биоптате почки, циркуляция антител к БМК в высоком титре [3]. Именно такие неблагоприятные факторы были выявлены у пациента, что определило тяжесть течения болезни и необходимость раннего начала почечно-заместительной терапии.
Важной детерминантой ответа на терапию и долгосрочного прогноза является ранняя диагностика. В описанном клиническом случае, несмотря на невозможность проведения нефробиопсии с учетом типичного быстро прогрессирующего течения, приведшего к почечно-заместительной терапии, диагноз был поставлен своевременно: заподозрен на самом раннем этапе и подтвержден иммунологическими данными в течение первого месяца заболевания. В представленном клиническом случае классическая терапия: глюкокортикоид, иммунодепрессант и плазмаферез — продемонстрировала слабую эффективность, отсутствие редукции клинических симптомов, а применение циклофосфамида привело к клинически значимой цитопении. Поэтому выбор препарата для дальнейшего лечения заболевания был сделан обоснованно и свое–временно. Моноклональное химерное антитело к CD20-антигену (ритуксимаб) может представлять дополнительную и/или альтернативную терапию при индукционном лечении синдрома Гудпасчера. Поскольку заболевание является редким и во многих случаях молниеносным, данные о безопасности и эффективности альтернативных методов лечения являются эпизодическими и представлены главным образом в описании клинических случаев. Хотя болезнь против БМК считается прототипом опосредованного аутоантителами заболевания, изменения клеточного иммунитета также играют важную роль в его патогенезе. Так, ритуксимаб, нацеливаясь на В-клетки, продуцирующие антитела против БМК, приводит к длительному истощению В-лимфоцитов, деструкции их в периферической крови и уменьшению количества антител против БМК. Большинство описанных клинических случаев лечения анти-СD20 моноклональными антителами показывают полный ответ у пациентов с легочным кровотечением и слабую редукцию почечной недостаточности. В представленном клиническом варианте терапия ритуксимабом была связана с полным контролем дыхательной недостаточности без эволюции скорости клубочковой фильтрации и в конечном счете повлияла на выживаемость пациента. Данное клиническое сообщение подтверждает возможность альтернативной терапии в случаях рефрактерной болезни или для пациентов с серьезными побочными эффектами циклофосфамида, а также демонстрирует, что конкретно ритуксимаб может быть альтернативным терапевтическим вариантом для индукционного лечения, являться адъювантом для ускорения клиренса антител против БМК [1, 5]. Несомненно, необходимы проспективные клинические исследования для дальнейшей оценки места ритуксимаба в терапевтической стратегии синдрома Гудпасчера.
Особенностями представленного клинического наблюдения можно считать следующее:
— очень быстрое и неуклонно прогрессирующее развитие заболевания;
— почти одновременное критическое поражение легких и почек, что сформировало полную типичную картину синдрома Гудпасчера и позволило врачам на раннем этапе заподозрить это заболевание;
— определение антител к базальным мембранам гломерулярных клубочков в высоком титре;
— неэффективность классической схемы лечения синдрома Гудпасчера — плазмаферез, иммуносупрессивная и глюкокортикоидная терапия;
— развитие цитопении как осложнения терапии циклофосфамидом, что создало сложности в выборе последующей иммуносупрессивной терапии;
— эффективность ритуксимаба в восстановлении дыхательной функции и отсутствие эффекта в плане восстановления почечной функции.
Несмотря на яркую клиническую картину болезни, установление диагноза синдрома Гудпасчера представляет значительные трудности. Тем ценнее клинический опыт специалистов, поставивших диагноз в первый месяц заболевания (со своевременным иммунологическим подтверждением), что позволило применить иммуносупрессивную терапию на ранней стадии заболевания, добиться реверсии поражения легких и сохранить жизнь пациенту.
Список литературы
1. Bandak G., Jones B.A., Li J. et al. Rituximab for the treatment of refractory simultaneous anti-glomerular basement membrane (anti-GBM) and membranous nephropathy // Clin. Kidney J. — 2014. — № 7(1). — Р. 53-56. — doi: 10.1093/ckj/sft152.
2. Kluth D.C., Rees A.J. Anti-Glomerular Basement Membrane Disease // JASN. — 1999. — № 10(11). — Р. 2446-2453.
3. Levy J.B., Turner A.N., Rees A.J. et al. Long-term outcome of anti-glomerular basement membrane antibody disease treated with plasma exchange and immunosuppression // Ann. Intern. Med. — 2001. — № 134. — 1033.
4. McAdoo S.P., Pusey Ch.D. Anti-Glomerular Basement Membrane Disease // Clin. J. Am. Soc. Nephrol. — 2017. — № 12(7). — Р. 1162-1172. — doi: 10.2215/CJN.01380217.
5. Narayanan M., Casimiro I., Pichler R. A unique way to treat Goodpasture's disease // BMJ Case Report. — 2014. — № 24. — 2014. — doi: 10.1136/bcr-2014-206220.
Список литературы
1. Ардашев В., Потехин Н., Малышева С., Борисов А. Синдром Гудпасчера // Врач. — 2006. — № 6. — С. 8-11.
2. Мухин Н.А. Синдром Гудпасчера // Клин. фармакол. тер. — 2012. — № 21(5). — С. 39-44.
3. Овсянников Д.Ю., Волков М.Ю., Гитинов Ш.А. с соавт. Синдром Гудпасчера в детском возрасте: обзор литературы и клиническое наблюдение // Трудный пациент. — 2015. — № 13(8–9). — С. 45-48.
4. Arce-Salinas C.A., Rodrıguez-Garcıa F., Gоmez-Vargas J.I. Long-term efficacy of anti-CD20 antibodies in refractory lupus nephritis // Rheumatol. Int. — 2012. — № 32. — Р. 1245-1249. — doi: 10.1007/s00296-010-1755-0.
5. Arzoo K., Sadeghi S., Liebman H.A. Treatment of refractory antibody mediated autoimmune disorders with an anti-CD20 monoclonal antibody (rituximab) // Ann. Rheum. Dis. — 2002. — № 61. — Р. 922-924.
6. Chan A.L., Louie S., Leslie K.O. et al. Cutting edge issues in Goodpasture’s disease // Clin. Rev. Allergy Immunol. — 2011. — № 41(2). — Р. 151-162. — doi: 10.1007/s12016-010-8222-2.
7. Dammacco F., Battaglia S., Gesualdo L., Racanelli V. Goodpasture’s disease: a report of ten cases and a review of the literature // Autoimmun. Rev. — 2013. — № 12(11). — Р. 1101-1108. — doi: 10.1016/j.autrev.2013.06.014.
8. Fernandes R., Freitas S., Cunha P., Alves G., Cotter J. Goodpasture’s syndrome with absence of circulating anti-glomerular basement membrane antibodies: a case report // J. Med. Case Rep. — 2016. — № 10. — 205. — doi: 10.1186/s13256-016-0984-6.
9. Fervenza F.C., Terreros D., Boutaud A. et al. Recurrent Goodpastur’s disease due to a monoclonal IgA-kappa circulating antibody // Am. J. Kidney Dis. — 1999. — 34(3). — Р. 549-555.
10. Goodpasture E.W. The significance of certain pulmonary lesions in relation to the etiology of pneumonia // Am. J. Med. Sci. — 1919. — № 158. — Р. 863-870. — doi: 10.1097/00000441-191911000-00012.
11. Greco A., Rizzo M.I., De Virgiio A. et al. Goodpasture’s syndrome: a clinical update // Autoimmun. Rev. — 2015. — № 14(3). — Р. 246-253. — doi: 10.1016/j.autrev.2014.11.006.
12. Hellmark T., Segelmark M. Diagnosis and classification of Goodpasture’s disease (anti-GBM) // J. Autoimmun. — 2014. — № 48–49. — Р. 108-112. — doi: 10.1016/j.jaut.2014.01.024.
13. Huart A., Josse A-G., Chauveau D. et al. Outcomes of patients with Goodpasture syndrome: A nationwide cohort-based study from the French Society of Hemapheresis // J. Autoimmun. — 2016. — № 73. — Р. 24-29. — doi: 10.1016/j.jaut.2016.05.015.
14. Jennette J.C., Falk R.J., Bacon P.A. et al. 2012 Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides // Arthr. Rheum. — 2013. — № 65. — Р. 1-11. — doi: 10.1002/art.37715.
15. Krakower C.A., Greenspon S.A. Localization of the nephrotoxic agent within the isolated renal glomerulus // AMA Arch. Pathol. — 1952. — № 51. — Р. 629-639.
16. Levy J.B., Turner A.N., Rees A.J. et al. Long-term outcome of anti-glomerular basement membrane antibody disease treated with plasma exchange and immunosuppression // Ann. Intern. Med. — 2001. — № 134. — 1033.
17. Lu T.Y., Ng K.P., Cambridge G. et al. A retrospective se–ven-year analysis of the use of B cell depletion therapy in systemic lupus erythematosus at University College London Hospital: the first fifty patients // Arthritis Rheum. — 2009. — № 61. — Р. 482-487. — doi: 10.1002/art.24341.
18. Merkel F., Pullig O., Marx M. et al. Course and prognosis of anti-basement membrane antibody (anti-BM-Ab)-mediated disease: report of 35 cases // Nephrol. Dial. Transplant. — 1994. — № 9(4). — Р. 372-376.
19. Narayanan M., Casimiro I., Pichler R. A unique way to treat Goodpasture’s disease // BMJ Case Report. — 2014. — № 24. — 2014. — doi: 10.1136/bcr-2014-206220.
20. Sauter M., Schmid H., Anders H.J. et al. Loss of a renal graft due to recurrence of anti-GBM disease despite rituximab therapy // Clin. Transplant. — 2009. — № 23(1). — Р. 132-136. — doi: 10.1111/j.1399-0012.2008.00912.x.
21. Schless B., Yildirim S., Beha D. et al. Rituximab in two cases of Goodpasture’s syndrome // NDT Plus. — 2009. — № 2(3). — Р. 225-227. — doi: 10.1093/ndtplus/sfp020.
22. Shah M.K., Hugghins S.Y. Characteristics and outcomes of patients with Goodpasture’s syndrome // South. Med. J. — 2002. — № 95. — Р. 1411-1418.
23. Shah Y., Mohiuddin A., Sluman C. et al. Rituximab in anti-glomerular basement membrane disease // QJM. — 2012. — № 105. — Р. 195-7. — doi: 10.1093/qjmed/hcr001.
24. Stone J.H., Merkel P.A., Spiera R. et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis // N. Engl. J. Med. — 2010. — № 363. — Р. 221-32. — doi: 10.1056/NEJMoa0909905.
25. Syeda U.A., Singer N.G., Magrey M. Anti-glomerular basement membrane antibody disease treated with rituximab: a case-based review // Semin. Arthritis Rheum. — 2013. — № 42. — Р. 567-572. — doi: 10.1016/j.semarthrit.2012.10.007.
26. Tanna A., Pusey C.D. B-cell-targeted therapy in adult Glomerulonephritis // Expert Opin Biol. Ther. — 2013. — № 13. — Р. 1691-706. — doi: 10.1517/14712598.2013.851191.
27. Touzot M., Poisson J., Faquer S. et al. Rituximab in anti-GBM disease: A retrospective study of 8 patients // J. Autoimmun. — 2015. — № 60. — Р. 74-79. — doi: 10.1016/j.jaut.2015.04.003.
28. Wechsler E., Yang T., Jordan S.C. et al. Anti-glomerular basement membrane disease in an HIV-infected patient // Nat. Clin. Pract. Nephrol. — 2008. — № 4. — Р. 167-171. — doi: 10.1038/ncpneph0724.

/90-1.jpg)
/92-1.jpg)