Резюме
Актуальність. На сьогодні понад 80 % населення планети використовують лікарські препарати рослинного походження. Комплексно впливаючи на організм, вони реалізують декілька лікувальних ефектів. На підставі чітких наукових критеріїв, даних клінічних випробувань підтверджена ефективність і добра переносимість препаратів на основі Pelargonium sidoides. Мета: вивчення клінічної ефективності та безпечності рослинного препарату Папалор (Pelargonium sidoides) у лікуванні дітей, хворих на гострі респіраторні вірусні інфекції (ГРВІ). Матеріали та методи. У клінічне дослідження було включено 67 хлопчиків і 53 дівчинки віком від 1 до 12 років із діагнозом ГРВІ. Усі діти були розподілені на три вікові підгрупи: 1–2, 3–5 та 6–12 років. Пацієнти основної групи (n = 60) приймали препарат Папалор, пацієнти контрольної групи (n = 60) одержували лише симптоматичне лікування. Серед хворих на ГРВІ частка дітей віком 3–5 років була найбільшою. Нозологічні прояви гострого респіраторного вірусного захворювання спостерігались у вигляді назофарингіту, гострого бронхіту та риносинуситу. У рамках дослідження було проведено 3 контрольні візити. Результати. Аналіз загальних критеріїв ГРВІ виявив, що середня тривалість лихоманки у хворих в основній групі становила 2,7 дня, у контрольній — 3,4 дня, симптомів інтоксикації — 2,2 і 2,9 дня відповідно. Катаральні явища (нежить, кашель, біль у горлі) у хворих основної групи в середньому тривали 4,2 дня, у контрольній — 4,6 дня. Понад 60 % пацієнтів обох груп мали прояви гострого бронхіту. На початку лікування середній рівень показника шкали тяжкості бронхіту (Bronchitis severity score, BSS) в обох групах був практично однаковим. Уже через 3–5 днів спостерігалась вірогідна різниця на користь основної групи (p < 0,001), а на кінець лікування (7-й день) вона була ще більш вираженою. З моменту початку терапії і до її завершення індекс BSS покращився на 7,4 ± 1,8 у групі, що отримувала Pelargonium sidoides, порівняно з показником 5,2 ± 1,7 у дiтей групи контролю. Висновки. Проведене клінічне дослідження ефективності препарату Папалор на основі Pelargonium sidoides у лікуванні ГРВІ у дітей дозволило отримати клінічно вірогідні результати. Виражений противірусний, помірний бактеріостатичний ефекти, а також мукоциліарні, протизапальні та імуномодулюючі властивості препарату Папалор дозволяють застосовувати його як у комплексному лікуванні, так і в монотерапії.
Актуальность. На сегодняшний день более 80 % населения планеты используют лекарственные препараты растительного происхождения. Комплексно воздействуя на организм, они реализуют несколько лечебных эффектов. На основании четких научных критериев, данных клинических испытаний подтверждена эффективность и хорошая переносимость препаратов на основе Pelargonium sidoides. Цель: изучение клинической эффективности и безопасности растительного препарата Папалор (Pelargonium sidoides) в лечении детей, больных острыми респираторными вирусными инфекциями (ОРВИ). Материалы и методы. В клиническое исследование было включено 67 мальчиков и 53 девочки в возрасте от 1 до 12 лет с диагнозом ОРВИ. Все дети были разделены на три возрастные подгруппы: 1–2 года, 3–5 и 6–12 лет. Пациенты основной группы (n = 60) принимали препарат Папалор, пациенты контрольной группы (n = 60) получали только симптоматическое лечение. Среди болеющих ОРВИ доля детей в возрасте 3–5 лет была наибольшей. Нозологические проявления ОРВИ наблюдались в виде назофарингита, острого бронхита и синусита. В рамках исследования было проведено 3 контрольных визита. Результаты. Анализ общих критериев ОРВИ показал, что средняя продолжительность лихорадки у больных в основной группе составила 2,7 дня, в контрольной — 3,4 дня, симптомов интоксикации — 2,2 и 2,9 дня соответственно. Катаральные явления (насморк, кашель, боль в горле) у больных основной группы в среднем продолжались 4,2 дня, в контрольной — 4,6 дня. Более 60 % пациентов обеих групп имели проявления острого бронхита. В начале лечения средний уровень показателя шкалы тяжести бронхита (Bronchitis severity score, BSS) в обеих группах был практически одинаковым. Уже через 3–5 дней наблюдалась достоверная разница в пользу основной группы (p < 0,001), а к концу лечения (7-й день) она была еще более выраженной. С момента начала терапии и до ее завершения индекс BSS улучшился на 7,4 ± 1,8 в группе, получавшей Pelargonium sidoides, по сравнению с показателем 5,2 ± 1,7 у детей группы контроля. Выводы. Проведенное клиническое исследование эффективности препарата Папалор в лечении ОРВИ у детей позволило получить достоверные клинические результаты. Выраженный противовирусный, умеренный бактериостатический эффекты, а также мукоцилиарные и противовоспалительные свойства препарата Папалор позволяют применять его как в комплексном лечении, так и в качестве монотерапии.
Background. Today, more than 80 % of the world population use herbal medicines. They have different therapeutic effects influencing the whole body. The good efficiency and tolerability of drugs containing Pelargonium sidoides is confirmed by clear scientific criteria and clinical trial data. The purpose of our research was to study the clinical efficiency and safety of the herbal medicine Papalor (Pelargonium sidoides) in the treatment of children with acute respiratory viral infections. Materials and methods. The clinical study included 67 boys and 53 girls aged 1 to 12 years. All children were divided into three age groups: 1–2, 3–5 and 6–12 years. Patients of the main group (n = 60) received Papalor, patients of the control group (n = 60) took only symptomatic treatment. The greatest number of children aged 3 to 5 years. Nosological manifestations of acute respiratory viral infections were nasopharyngitis, acute bronchitis and sinusitis. According to the study design, there were three control visits. Results. Analysis of the general criteria of acute respiratory viral infections revealed that the average duration of fever in patients of the main group was 2.7 days, in the control group — 3.4 days, symptoms of intoxication — 2.2 days and 2.9 days, respectively. Catarrhal presentations (runny nose, cough, sore throat) lasted for 4.2 days in patients of the main group, in controls — 4.6 days. More than 60 % of patients in both groups had acute bronchitis. At the beginning of treatment, the average level of Bronchitis Severity Score in both groups was almost the same. Already in 3–5 days, there was a significant difference in favor of the main group (p < 0.001), and by the end of treatment (day 7), it was even more expressed. From the start of therapy to its completion, Bronchitis Severity Score improved by 7.4 ± 1.8 in Pelargonium sidoides group compared with 5.2 ± 1.7 in the control group. Conclusions. A clinical study of Papalor effectiveness in the treatment of acute respiratory viral infections in children has shown reliable clinical results. The pronounced antiviral, moderate bacteriostatic effects, as well as mucociliary and anti-inflammatory properties of Papalor allowed using it both in comprehensive treatment and as a monotherapy.
Вступ
Гострі респіраторні вірусні інфекції (ГРВІ) протягом останніх десятиліть посідають одне з перших місць у структурі інфекційної патології в дітей, їх частка сягає близько 90 %. Різноманітність і численність збудників інфекційних захворювань, з якими постійно стикається слизова оболонка респіраторного тракту, передбачає наявність складної системи організації локального захисту дихальної системи. У 2017 році ВООЗ переглянула перелік головних лікарських засобів, зокрема тих, які можна застосовувати в педіатрії (WHO Model List of Essential Medicines; WHO Model Listof Essential Medicines for Children). Основна частина рекомендацій надана через призму глобальної стратегії стримування антибіотикорезистентності. Антибактеріальні засоби чітко розподілені на 3 групи: доступу (access) — пріоритетні для використання при лікуванні поширених інфекцій за наявності відповідних показань); спостереження (watch) — антибіотики вибору та резерву для певних інфекцій; резерву (reserve) — препарати останнього ряду для лікування вкрай тяжких інфекцій, коли інші антимікробні засоби є неефективними [1].
Безумовно доречними є на сьогодні рекомендації фахівців Асоціації з інфекційного контролю та епідеміологічного нагляду (The Association for Professionals in Infection Control and Epidemiology (APIC), 2014), які наголошують, що антибіотик необхідно призначати тільки після конкретної відповіді на запитання, чи дійсно він потрібен. Адже недоцільно призначати антибактеріальні засоби дітям при вірусних інфекціях, зокрема гострому назофарингіті, риносинуситі, у більшості випадків гострого бронхіту. Але поряд з цим украй важливими залишаються рекомендації з догляду за дитиною, можливість застосування симптоматичних засобів, зокрема антипіретиків, і на окрему увагу заслуговує фітотерапія із доведеною ефективністю як достатньо безпечний спосіб лікування в педіатрії.
На сьогодні понад 80 % населення планети застосовують лікарські засоби рослинного походження (Development Center of Biotechnology). Рослинні препарати більш природні для організму, ніж синтетичні, а їх склад обумовлює безпеку й кращу переносимість за рахунок різноманіття активних речовин. Найчастіше вони реалізують декілька лікувальних ефектів, можуть комплексно впливати на організм, їх можна використовувати тривалий час. Для формування довіри до фітопрепаратів необхідні певні умови, однією з них є наявність доказової бази щодо клінічної ефективності. Власне це передбачає концепція фітонірингу (від phyto — «рослинний» і neering — «технології»). Кредит довіри сформувати нелегко, необхідно мати дані про якість сировини, стандартизацію виробництва, термін перебування препарату на ринку, результати проведених досліджень тощо [2].
На підставі чітких наукових критеріїв, даних клінічних випробувань, а також з огляду на принципи доказової медицини підтверджена ефективність і добра переносимість препаратів на основі Pelargonium sidoides [3–5]. Це екстракт з коренів пеларгонії очиткової, рослини південноафриканського походження, що проявляє виражену противірусну, антибактеріальну, імуномодулюючу, муколітичну, цитопротекторну дію, є ефективним на всіх стадіях патогенезу ГРВІ, а також запобігає прогресуванню й розвитку ускладнень.
Існують дані, що демонструють ефективність Pelargonium sidoides у профілактиці загострень бронхіальної астми на фоні вірусної інфекції [6]. Клінічна ефективність препарату зумовлена дією основних компонентів, що входять до його складу: флавоноїди (кверцетин, галокатехін, кемпферол тощо); кумарини (умкалін, скополін, скополетин), а також фенолокислоти (галова кислота та інші). Антибактеріальна активність препарату проявляється відносно різних грампозитивних (Staphylococcus aureus, Streptococcus pneumoniae, інші Streptococcus spp.), а також грамнегативних бактерій. Вплив на неспецифічну імунну відповідь полягає в стимуляції фагоцитарної активності макрофагів та вивільненні з них NO, підвищенні експресії CD11b‑адгезії молекул на поверхні нейтрофілів, інгібуванні лейкоцитарного хемотаксису.
Pelargonium sidoides сприяє активізації механізмів очищення дихальних шляхів, що поліпшує виведення в’язкого слизу [7]. Крім того, фенолокислоти стимулюють ендогенну систему противірусного захисту, сприяють синтезу інтерлейкінів, інтерферону, захищають клітини від ураження при інфекціях, спричиняючи тим самим позитивну дію на процес лікування.
Мета дослідження: вивчення клінічної ефективності та безпечності рослинного препарату Папалор при лікуванні дітей із гострими респіраторними інфекціями.
Матеріали та методи
Проведено відкрите нерандомізоване клінічне дослідження «Ефективність та безпечність застосування екстракту рослини Pelargonium sidoides у вигляді препарату Папалор у дітей із гострими респіраторними вірусними інфекціями». Набір пацієнтів здійснювався з вересня по грудень 2017 року двома клінічними центрами порівну (1 : 1):
— Полтавська обласна дитяча клінічна лікарня, кафедра педіатрії № 2 Вищого державного навчального закладу України «Українська медична стоматологічна академія», м. Полтава; головний дослідник — професор Крючко Т.О.;
— КЗ «Дніпропетровська міська дитяча клінічна лікарня № 1» Дніпропетровської обласної ради, кафедра педіатрії 1 та медичної генетики ДЗ «Дніпропетровська медична академія МОЗ України», м. Дніпро; головний дослідник — професор Абатуров О.Є.
Дизайн дослідження був аналогічний в обох клініках, загалом включено 120 пацієнтів віком від 1 до 12 років з діагнозом ГРВІ (60 дітей — основна група, 60 дітей — контрольна). Дещо відрізнявся розподіл пацієнтів у центрах за віком: окрім спільної вікової групи (3–5 років), у клініці у м. Полтава у дослідження були включені діти 6–12 років, у м. Дніпро — 1–2 років. Діти основної групи отримували препарат Папалор на основі Pelargonium sidoides і симптоматичне лікування, діти контрольної групи отримували тільки симптоматичне лікування. У рамках дослідження було проведено 3 контрольні візити: на етапі скринінгу — 1-й візит, після завершення 7-денної терапії — 2-й візит, після закінчення 14-денного періоду спостереження — 3-й візит. Пацієнти з гострим бронхітом робили додатковий візит між 3-м та 5-м днем лікування (візит 1а). Періодичність обстеження пацієнтів і реєстрація отриманих даних відповідали наведеному нижче плану.
Візит 1 (скринінг):
— надання пацієнту й батькам дитини усної та письмової інформації про препарат та одержання інформованої згоди на його застосування;
— оцінка відповідності пацієнта критеріям включення/виключення;
— об’єктивне обстеження;
— видача пацієнту на руки досліджуваного препарату.
Візит 2 (завершення терапії):
— об’єктивне обстеження;
— лабораторне обстеження за потребою (загальний аналіз крові, загальний аналіз сечі);
— реєстрація можливих побічних явищ.
Візит 3 (завершення спостереження):
— оцінка наявності та характеру ускладнень;
— об’єктивне обстеження;
— виявлення та реєстрація можливих побічних реакцій;
— оцінка проведеної терапії.
Ефективність препарату Папалор на основі Pelargonium sidoides визначалася за такими критеріями:
— вираженість клінічних проявів захворювання після 7 днів терапії, а також динаміка регресу клінічних ознак захворювання протягом періоду лікування досліджуваним препаратом;
— тривалість гарячкового періоду з температурою понад 37,5 °С;
— частота застосування жарознижуючих засобів протягом 5 днів терапії;
— тривалість симптомів захворювання з вираженістю понад 1 бал;
— наявність/відсутність і характер ускладнень у період лікування та спостереження.
Результати та обговорення
У клінічне дослідження були включені 67 хлопчиків та 53 дівчинки віком від 1 до 12 років. Усі діти були розподілені на три вікові підгрупи: 1–2, 3–5 та 6–12 років. Розподіл дітей у групах за статтю та віком наведено в табл. 1.
Дані табл. 1 демонструють, що найбільший відсоток дітей, які хворіли на ГРВІ, був у підгрупі 3–5 років, що в першу чергу пов’язано з початком відвідування організованих дитячих колективів.
Включаючи пацієнтів, ми враховували дані анамнезу та наявність супутньої патології, яка була у фазі ремісії, що не суперечило критеріям відбору й не перешкоджало участі дітей у дослідженні. Розподіл хворих за частотою супутніх захворювань поданий у табл. 2 і 3.
Характеризуючи наявність супутньої патології, варто відмітити, що серед дітей раннього віку частіше спостерігалась легка анемія, дещо рідше — функціональна диспепсія. У дітей шкільного віку більш частою супутньою патологією були функціональні розлади жовчного міхура.
Нозологічні прояви гострого респіраторного вірусного захворювання подані в табл. 4: у включених у дослідження дітей була клініка назофарингіту, гострого бронхіту та риносинуситу.
Усі пацієнти звернулися до лікаря протягом 48 годин від початку захворювання з характерними гострими проявами респіраторної інфекції (слабкість, нездужання, головний біль, зниження апетиту, підвищення температури тіла). При огляді спостерігалась блідість або гіперемія шкірних покривів, слизові виділення з носу, місцеві зміни в носоглотці та ротоглотці (гіперемія слизової стінок зіву, гіпертрофія піднебінних мигдаликів), лімфаденопатія, а в ряді випадків при аускультації легень вислуховувалось жорстке дихання, сухі й вологі провідні хрипи.
Стан пацієнтів оцінювався за такими клінічними ознаками: жорстке дихання при аускультації легень (є/немає), гіперемія слизової стінок зіву (є/немає), збільшення підщелепних і/або задньошийних лімфатичних вузлів (є/немає), підвищення температури тіла (37,5–38,0 °С або > 38,1 °С), тахікардія (є/немає).
Аналізувались загальні критерії ГРВІ: середня тривалість лихоманки у хворих в основній групі становила 2,7 дня, у контрольній — 3,4 дня, симптоми інтоксикації (загальне нездужання, головний біль) — 2,2 і 2,9 дня відповідно. Катаральні явища (нежить, кашель, біль у горлі) у хворих основної групи в середньому тривали 4,2 дня, у контрольній — 4,6 дня. Характеризуючи динаміку реактивної лімфаденопатії, слід зауважити, що різниця між групами була практично відсутня: у 70 % дітей обох груп вона регресувала до закінчення терапії, а в решти (30 %) — до закінчення періоду спостереження.
Понад 60 % пацієнтів обох груп мали прояви гострого бронхіту. Для оцінки ефективності проведеної терапії була використана шкала тяжкості бронхіту (Bronchitis severity score (BSS)) як одна з об’єктивних та вірогідних систем оцінки ступеня тяжкості гострого бронхіту, що може застосовуватися як у дітей, так і в дорослих [8]. Уперше BSS була запропонована L. Dome, R. Schuster у 1996 році, а у 2003 році Heinrich Matthys та ін. ввели цей термін у наукову літературу, і з того часу він зустрічається в багатьох публікаціях. У 2013 році був опублікований системний аналітичний огляд досліджень, у яких використовували шкалу BSS [9, 10]. Практично всі наведені дослідження та масштабний Кокранівський метааналіз демонструють, що ця проста шкала є об’єктивним інструментом як для загальної оцінки регресу симптомів гострого бронхіту за певний період часу (початковий, під час лікування та після його закінчення), так і для аналізу окремих підрозділів: «кашель» і «мокротиння» [11]. Оцінка проводиться в певний момент часу, тому BSS повинна заповнюватись лікарями в присутності пацієнта, оскільки вона містить запитання для обох сторін.
Згідно з обраною шкалою нами оцінювались п’ять критеріїв, характерних для гострого бронхіту: кашель, відходження мокротиння, хрипи під час аускультації, біль у грудній клітці під час кашлю й диспное. Ці симптоми оцінювались за 5-бальною шкалою Likert: 0 — відсутній, 1 — помірний, 2 — середньої тяжкості, 3 — тяжкий і 4 — дуже тяжкий. Максимальна кількість балів — 20.
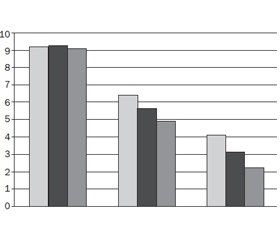
Динаміка окремих симптомів гострого бронхіту за загальним кількісним показником BSS, а також інші задані дослідженням результати були помітно кращими в основній групі лікування. На початку лікування середній рівень показника BSS в обох групах був практично однаковим. Уже через 3–5 днів спостерігалась вірогідна різниця на користь основної групи (p < 0,001), а на кінець лікування (7-й день) вона була ще більш вираженою (p < 0,0001). Після початку терапії і до її завершення індекс BSS покращився на 7,4 ± 1,8 у групі, що отримувала досліджуваний засіб, порівняно з показником 5,2 ± 1,7 у дiтей із групи контролю (рис. 1).
Постійне зменшення середнього загального кількісного показника BSS у період між початком та закінченням лікування спостерігалось в обох дослідницьких групах, при цьому вірогідно краща динаміка спостерігалась у групі дітей, які отримували препарат Папалор (p < 0,0001). Аналіз динаміки двох найбільш валідних показників — «кашель» та «мокротиння» показав, що вона була більш виражена в пацієнтів основної групи, особливо після закінчення лікування (p < 0,0001). Між початком та 3–5-м днем терапії різниця була менш помітною. Швидкість зникнення симптомів гострого бронхіту й швидкість їх регресу на 7-й день була майже в 3 рази вищою в групі дітей, які отримували препарат Папалор.
Кількість пацієнтів, які звітували про настання ефекту лікування між 2-м і 3-м днем (21,7 % проти 15,0 %) та 4-м і 5-м днем (41,7 % проти 23,3 %), була більшою в групі дітей, які отримували фітопрепарат Папалор, порівняно з групою контролю. Відповідно, настання результату в основній групі відбувалося значно раніше, ніж у групі порівняння (p < 0,0001).
Характеризуючи динаміку індексу BSS за віком, слід відмітити, що в дітей 6–12 років спостерігався більш швидкий регрес клінічної симптоматики, що пов’язано, на нашу думку, із станом імунної системи та покращенням адаптивних можливостей (рис. 2).
Оскільки одним із критеріїв ефективності була відсутність симптомів ГРВІ до закінчення курсу лікування, була розрахована частка пацієнтів у групах, у яких клінічні ознаки респіраторної інфекції після 7-денної терапії повністю регресували (табл. 5).
Характеризуючи залишкові явища, слід відмітити, що в основній групі залишились клінічні ознаки ГРВІ у вигляді помірної ринореї, а в групі контролю були пацієнти з кашлем, лімфаденопатією, жорстким диханням при аускультації легень.
У процесі лікування за потребою проводився загальний лабораторний аналіз крові та сечі. Для пацієнтів із гострим бронхітом вони призначались на візиті 1а (3–5-й день лікування), для всіх інших — на візиті 2 (7-й день). Додатковому обстеженню перш за все підлягали діти з гнійними виділеннями з порожнини носа, болем у ділянці обличчя, у грудній клітці, попереку, черевній порожнині, зі змінами лімфатичних вузлів (у випадку їх збільшення, болючості, почервоніння) та лихоманкою. Загалом частка пацієнтів, яким призначались вказані вище лабораторні аналізи, становила 13 % (16 дітей). Для них були характерні зміни периферичної крові помірного запального характеру, що не потребувало додаткової корекції лікування, окрім двох дітей з групи порівняння, які були переведені на антибактеріальну терапію. Результати загального аналізу сечі у випадках призначення були в межах норми.
Через 14 днів, під час завершального візиту, стан був задовільним у всіх дітей, однак один пацієнт контрольної групи був інфікований повторно, тоді як в основній групі повторних ГРВІ не спостерігалося.
Аналізуючи безпечність лікування, слід зазначити, що в трьох дітей (5 % пацієнтів основної групи) на фоні застосування препарату Папалор виникла гостра кропив’янка. На другий день лікування з’явились уртикарні висипи на тулубі, руках, ногах без порушення загального стану. Після відміни препарату протягом 3 днів на фоні прийому антигістамінних засобів стан пацієнтів нормалізувався. Ця реакція є помірною за клінічним перебігом та передбачуваною, адже описана в інструкції до застосування препарату Папалор. Провівши аналіз причинно-наслідкового зв’язку між клінічними проявами побічної реакції та клініко-фармакологічною характеристикою лікарського засобу, дійшли висновку, що дана реакція може бути класифікована як ймовірна (Центр моніторингу побічних реакцій лікарських засобів ВООЗ, м. Уппсала, Швеція, отримав 34 повідомлення про випадки алергічних реакцій, які пов’язують з використанням екстракту пеларгонії). Інших негативних явищ під час дослідження виявлено не було. Варто зазначити, що екстракт Pelargonium sidoides, що є діючою речовиною препарату Папалор, на фармацевтичному ринку Європи представлений із 1983 року. Загалом препарат Папалор належить до групи лікарських засобів, які на сьогодні визнані одними із найбезпечніших, адже відсоток можливих побічних реакцій у ході лікування в десятки разів менший, ніж у хіміопрепаратів, що дозволяє широко застосовувати їх у медицині.
Висновки
Проведене клінічне дослідження ефективності препарату Папалор на основі Pelargonium sidoides у лікуванні ГРВІ у дітей дозволило отримати клінічно вірогідні результати. Доведено, що Папалор дозволяє скоротити середню тривалість лихоманки, суттєво прискорює зворотний розвиток захворювання. Виражений противірусний, помірний бактеріостатичний ефекти, а також мукоциліарні, протизапальні та імуномодулюючі властивості препарату Папалор дозволяють застосовувати його як у комплексному лікуванні, так і в монотерапії, тим самим вирішуючи проблему поліпрагмазії при лікуванні дітей із гострими респіраторними інфекціями. Завдяки удосконаленню активних інгредієнтів фітопрепаратів сьогодні вдалося досягнути оптимального балансу між ефективною та безпечною терапією, що є надзвичайно важливою й пріоритетною в педіатрії [13].
Конфлікт інтересів. Не заявлений.
Список литературы
1. Кривопустов С.П. Антибіотикорезистентність у педіатрії. Роль фітотерапії з доведеною ефективністю // Medical Nature. — 2017. — № 2(22). — С. 25-27.
2. Зупанец И.А., Сахарова Т.С., Безуглая Н.П. Бренды и генерики среди растительных лекарственных средств // Новини медицини і фармації. — 2016. — № 10(584). — С. 10-11.
3. Майданник В.Г. Клініко-лабораторні показники ефективності та безпечності фітотерапевтичного лікування гострого бронхіту у дітей з позиції доказової медицини / В.Г. Майданник, І.О. Мітюряєва, В.В. Абабков, І.О. Борзенко, Н.В. Молочек, О.В. Рибачок // Проблеми екологічної та медичної генетики і клінічної імунології. — 2012. — Вип. 2. — С. 377-390.
4. Riley D.S., Lizogub V.G., Zimmermann A., Funk P., Leh–macher W. Efficacy and Tolerability of High-dose Pelargonium Extract in Patients With the Common Cold // Altern. Ther. Health Med. — 2017 Oct 21. pii: AT5618. PMID: 29055287.
5. Gail P., Hickner J. This obscure herb works for the common cold // J. Fam. Pract. — 2008 Mar. — 57(3). — 157-61. PMCID: PMC3183890.
6. Tahan F., Yaman M. Can the Pelargonium sidoides root extract EPs® 7630 prevent asthma attacks during viral infections of the upper respiratory tract in children? // Phytomedicine. — 2013 Jan 15. — 20(2). — 148-50. doi: 10.1016/j.phymed.2012.09.022.
7. Matthys H., Funk P. Pelargonium sidoides preparation EPs 7630 in COPD: health-related quality-of-life and other patient-reported outcomes in adults receiving add-on therapy // Curr. Med. Res Opin. — 2018 Jan 18. — 1-7. doi: 10.1080/03007995.2017.1416344.
8. Lehrl S., Matthys H., Kamin W., Kardos P. The BSS — A Va–lid Clinical Instrument to Measure the Severity of Acute Bronchitis // J. Lung Pulm. Respir. Res. — 2014. — 1(3). — 00016. DOI: 10.15406/jlprr.2014.01.00016.
9. Matthys H., Kamin W. Positioning of the Bronchitis Severity Score (BSS) for standardised use in clinical studie // Curr. Med. Res Opin. — 2013 Oct. — 29(10). — 1383-90. doi: 10.1185/03007995.2013.832183.
10. Kardos P., Lehrl S., Kamin W., Matthys H. Assessment of the effect of pharmacotherapy in common cold/acute bronchitis — the Bronchitis Severity Scale // Pneumologie. — 2014 Aug. — 68(8). — 542-6. doi: 10.1055/s-0034-1377332.
11. Timmer A., Günther J., Rücker G., Motschall E., Antes G., Kern W.V. Pelargonium sidoides extract for acute respiratory tract infections // Cochrane Database Syst. Rev. — 2013 Oct 22. — 10. — CD006323. doi: 10.1002/14651858.CD006323.pub3.
12. de Boer H.J., Hagemann U., Bate J., Meyboom R.H. Allergic reactions to medicines derived from Pelargonium species // Drug Saf. — 2007. — 30(8). — 677-80. PMID: 17696580.
13. Абатуров А.Е., Кривопустов С.П., Крючко Т.А. Фитониринговый менеджмент острых респираторных инфекций у детей // Здоров’я України. — 2016. — № 1(374). — С. 18-19.

/61-1.jpg)
/62-1.jpg)
/63-1.jpg)