Газета «Новости медицины и фармации» №5 (654), 2018
Вернуться к номеру
Аналіз ускладнень перебігу гострого інсульту у хворих на цукровий діабет
Авторы: Галушко О.А.
Національна медична академія післядипломної освіти імені П.Л. Шупика, м. Київ, Україна
Разделы: Клинические исследования
Версия для печати
Вступ
У запобіганні гострому інсульту (ГІ) виділяють чотири важливих фактори стилю життя: куріння, вживання алкоголю, фізичну активність, дієту, а також шість факторів ризику: артеріальну гіпертензію, інфаркт міокарда, фібриляцію передсердь, цукровий діабет (ЦД), гіперліпідемію й безсимптомний стеноз сонної артерії [1]. ЦД являє собою один з провідних факторів розвитку множинних лакунарних інфарктів [2], є одним із факторів ризику розвитку постінсультних когнітивних розладів і деменції [3, 4].
Ускладнення ГІ є однією з причин того, що лише 60–70 % випадків ГІ перебігають типово [5, 6]. Наявність ЦД погіршує перебіг інсульту, збільшує ризик розвитку ускладнень і летального кінця [7, 8]. Тому дослідження особливостей виникнення й розвитку ускладнень інсульту у хворих на ЦД є актуальною сучасною проблемою.
Мета: проаналізувати частоту виникнення та особливості перебігу ускладнень гострого інсульту у хворих із ЦД та іншими порушеннями вуглеводного обміну.
Матеріали та методи
З метою реалізації поставленої мети було проведено ретроспективний аналіз історій хвороби пацієнтів, які перенесли гострий інсульт. Ретроспективно в архівах було проаналізовано 416 історій хвороби пацієнтів, які перебували на лікуванні у відділеннях інтенсивної терапії (ВІТ) у 2010–2013 роках.
Оцінка історій хвороби проводилась шляхом вивчення паспортних та анамнестичних даних, об’єктивного обстеження, лабораторних та інструментальних методів дослідження, ефективності та результатів лікування. Були проаналізовані частота виявлення ускладнень, їх тяжкість, особливості перебігу, відповідь на терапію та необхідність оптимізації методів терапії.
Хворі досліджувалися в трьох групах: хворі зі встановленим до початку інсульту ЦД, хворі з уперше виявленим ЦД та хворі без ЦД. Основні антропометричні показники груп подано в табл. 1.
Хворі, дані яких увійшли до ретроспективного огляду, були віком від 31 до 92 років, середнього зросту та мали дещо підвищену вагу (ІМТ коливався в межах 26,0–29,4 кг/м2). Статистично значущих відмінностей у загальних і антропометричних показниках між хворими різних груп виявлено не було. Серед хворих в усіх групах дещо переважали жінки (по групах — 57,2; 60,4 і 62,3 % відповідно), хоча й за цим показником вірогідної різниці не виявлено.
Результати та обговорення
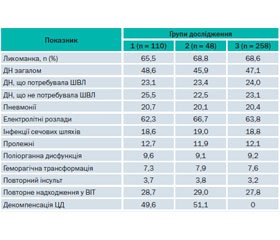
Аналіз історій хвороби дозволив виявити особливості перебігу ГІ та показати ускладнення, що виникали під час лікування. У табл. 2 відображені основні ускладнення, що виникали у хворих під час лікування.
Отже, найчастішим ускладненням, що зустрічалося у хворих усіх груп (у межах 65,5–68,8 %), була лихоманка.
Лихоманка
Згідно з аналізом температурних листків і записів у листках інтенсивної терапії, у частини хворих лихоманка виникала в перші 24 год (27 хворих, 6,5 %) і корелювала з тяжкістю клінічних проявів ГІ (пряма залежність). У частини хворих лихоманка виникала з 3-ї доби і не залежала від об’єму й тяжкості ураження, а була пов’язана з виникненням інфекційних вогнищ (пневмонія тощо). Розподіл хворих по групах залежно від наявності порушень за часом появи і ступенем вираженості лихоманки поданий у табл. 3.
Ступінь вираженості лихоманки також різнився, він коливався в межах від субфебрилітету до гіперпірексії. Проте лише у трьох хворих (0,72 %) рівень лихоманки одразу досягнув гіперпірексичного.
Аналіз листків інтенсивної терапії дозволив також прослідкувати тривалість лихоманкового періоду, тривалість гіперпірексії, середні показники температури за перші 7 днів перебування в стаціонарі і зв’язок їх з результатами лікування. Ці показники відображені в табл. 4.
Аналіз табл. 4 підтверджує відомі літературні дані про те, що лихоманка й гіперпірексія, особливо тривалі, несприятливо впливають на прогноз захворювання у хворих на ГІ. Цікаво, що у хворих із супутнім ЦД лихоманка виникала рідше, а її наслідки не були настільки катастрофічними, як у хворих без ЦД. Ми можемо пояснити цей факт тим, що у хворих на ЦД наявність лихоманки могла свідчити про збереження імуноопосередкованих реакцій і більш активного імунного захисту.
Дихальна недостатність
Розлади дихання також спостерігалися в багатьох хворих на ГІ в усіх групах. Багато хворих надходили до ВІТ у стані порушеної свідомості, зі зниженими показниками зовнішнього дихання (сатурації, РСО2 тощо). Респіраторна підтримка надавалася цим хворим згідно з Наказами МОЗ України та Національного уніфікованого протоколу (2012). Методи респіраторної підтримки, що застосовувалися в досліджених групах хворих, подано в табл. 5.
Час початку ШВЛ коливався від 0 годин (при надходженні) до 4–5-ї доби. У 26 випадках (6,25 %) стан хворих потребував термінової інтубації та переведення на ШВЛ. Згідно із записами анестезіологів, причинами інтубації та переводу на ШВЛ були стани, подані в табл. 6.
Отже, найчастішими причинами інтубації трахеї та переводу на ШВЛ були неефективність зовнішнього дихання та пригнічення свідомості нижче від 8 балів за шкалою коми Глазго.
Звертає на себе увагу висока летальність хворих, яким проводилася ШВЛ (близько 33,7 %), що свідчить і про тяжкість ураження, і про глибину порушення свідомості. І в той же час говорить про необхідність удосконалення традиційних підходів до респіраторної підтримки в цієї категорії пацієнтів ВІТ.
Документально (рентгенологічно) підтверджені пневмонії були зареєстровані загалом у 24 (5,8 %) пацієнтів. У хворих на ГІ на тлі ЦД пневмонії виникали вірогідно раніше (на 1–2 доби), що можна пояснити зниженням імунітету у хворих на ЦД. У хворих на ЦД також частіше реєструвалися позагоспітальні пневмонії, які виявляли вже при надходженні пацієнта в лікарню.
Електролітні розлади та їх корекція
Аналіз результатів ретроспективного дослідження показав наявність лише порушень обміну натрію, калію та хлору, які рутинно визначаються у відділеннях інтенсивної терапії. Це обумовлено особливостями ретроспективного дослідження, коли можливо лише констатувати факт проведених досліджень, але немає можливості перевірити наявність інших електролітних порушень.
З огляду на те, що рівень електролітів (натрію, калію, хлору) в сироватці крові хворих вимірювали в різні терміни перебування в стаціонарі, враховували всі відхилення, що виникали в перші 7 днів, незалежно від часу їх появи. Із 416 хворих 67 було переведено з відділення інтенсивної терапії раніше від сьомого дня, тому в остаточний аналіз увійшли результати 349 пацієнтів, які перебували у ВІТ щонайменше 7 діб. У загальному вигляді порушення електролітного обміну, виявлені в цих хворих, підсумовано в табл. 7.
Порушення обміну основних електролітів, які рутинно визначаються у ВІТ, трапляються у хворих із ГІ досить часто. Загалом той або інший вид електролітних порушень виявлено у 73,9 % випадків (258 із 349). Причому у хворих із ЦД 2-го типу (ЦД2) виявлено вірогідно більшу частоту електролітних порушень, ніж у хворих без ЦД: у 82 (81,2 %) та у 36 (83,7 %) хворих 1-ї та 2-ї груп відповідно проти 134 (65,4 %) у групі контролю (р < 0,05).
Проведене дослідження показало, що найчастіше виникав дисбаланс обміну натрію та калію. Так, гіпокаліємія (рівень K+ < 3,5 ммоль/л) траплялася у 35,7 % хворих із наявним ЦД2 та 37,2 % хворих з уперше виявленим ЦД2, тоді як у хворих без ЦД2 вона реєструвалася лише в 15,1 % випадків. Ця різниця набула рівня статистичної значущості. Вірогідно частіше у хворих без ЦД2 реєстрували нормальні показники каліємії (83,4 % проти 60,4 і 58,2 % випадків у групах діабету). Іншу особливість відзначено у хворих з уперше виявленим ЦД2. Так, у цих пацієнтів вірогідно частіше виникала гіпонатріємія (27,9 проти 17,5 % випадків у пацієнтів без ЦД), і, відповідно, частка хворих без порушень обміну натрію становила 51,2 %, тоді як у хворих без ЦД цей показник був 68,7 % (р < 0,05). Цікаво, що частота порушень обміну калію та натрію була дещо вищою в групі з уперше виявленим ЦД2, ніж у групі хворих з раніше встановленим ЦД2, хоча ця різниця не була вірогідною.
Декомпенсація ЦД
У хворих з наявним ЦД декомпенсація вуглеводного обміну спостерігалася доволі часто. Але на фоні своєчасної діагностики й адекватного лікування порушення вуглеводного обміну не мали катастрофічного характеру. Зокрема, середній рівень глікемії у цих хворих рідко перевищував показник 20 ммоль/л. Проте у хворих з уперше виявленим ЦД рівень глікемії часто перевищував зазначену межу, а параметри декомпенсації й субкомпенсації вуглеводного обміну тривалий час трималися на підвищеному рівні. Ці факти можна пояснити тим, що за відсутності ЦД в діагнозі специфічне протидіабетичне лікування (інсулін, антикетогенні засоби тощо) призначалося запізно, не проводився достатній і повний моніторинг вуглеводного обміну, що призводило до поглиблення декомпенсації вуглеводного обміну.
Варіанти діабетичних невідкладних станів, що спостерігалися у хворих, подано в табл. 8.
Найбільш частим невідкладним станом у хворих дослідженої когорти виявився діабетичний кетоацидоз (ДКА). Цей факт дещо суперечить уявленням про те, що до ДКА схильні хворі з абсолютним дефіцитом інсуліну, тобто з ЦД 1-го типу. А в наших хворих реєструвався лише ЦД2. На нашу думку, це не суперечить розумінню патогенезу ЦД2, тому що відомо, що будь-яке захворювання на тлі ЦД2 може спровокувати у хворого розвиток кетоацидозу.
Натомість у наших хворих було мало випадків гіперосмолярної коми й гіперосмолярного стану (ГОС), які якраз і є патогенетичними у хворих на ЦД2. Ми пояснюємо цей факт тим, що для розвитку ГОС потрібні час і тривале обмеження надходження рідини в організм пацієнта. А наші хворі, у яких розвивався ГІ, переважно надходили в стаціонар у першу добу захворювання, їм налагоджували інфузійну терапію та (за можливості) ентеральне живлення, корекцію гіперглікемії. Тому в цих пацієнтів не створювалося умов для розвитку тяжкої дегідратації та ГОС.
Гіпоглікемії частіше виникали у хворих з уперше виявленим ЦД, а також реєструвалися у хворих без діагностованих вуглеводних порушень, але з транзиторними гіперглікеміями. Усі ці нечисленні випадки пов’язані з порушеннями в розрахунку дози або певною непередбачуваністю дії інсуліну у хворих у гострих станах.
Діагноз лактатацидозу не виставлявся хворим в історіях хвороби, але наявність результатів дослідження лактату та показників КОС дала нам можливість виявити й діагностувати лактатацидоз ретроспективно.
Транзиторні гіперглікемії
У хворих на ГІ без наявного в анамнезі ЦД при надходженні на лікування часто реєструвалася гіперглікемія. Після проведення обстеження частині хворих виставлявся вперше виявлений ЦД, але в більшості хворих порушень вуглеводного обміну в подальшому не діагностувалося. У цієї частини пацієнтів гіперглікемія вважається транзиторною. У 168 хворих спостерігалися короткочасні гіперглікемії. Деякі особливості цих гіперглікемій наведено в табл. 9.
Аналіз даних табл. 9 дозволяє зробити такі висновки. У 139 хворих з 168, у яких спостерігалися одиночні епізоди гіперглікемії при надходженні до 11,1 ммоль/л, це були дійсно прояви транзиторної, або стресової, гіперглікемії. Але в інших випадках, що наведені в табл. 9, це вже були прояви порушень вуглеводного обміну. При цьому у 18 пацієнтів слід думати про недіагностований ЦД, а в 11 пацієнтів (останній рядок) — про стани предіабету — порушеної толерантності до глюкози або гіперглікемії натще. Отже, ми можемо констатувати, що у 29 пацієнтів цукровий діабет та стани предіабету виявлені не були.
Висновки
1. Перебіг ГІ у хворих з уперше виявленим ЦД більш тяжкий, а ускладнення розвиваються частіше, ніж у хворих з уже встановленим ЦД або без ЦД.
2. Уперше виявлені ускладнення вуглеводного обміну були в 48 хворих (11,5 % від усіх хворих на ГІ).
3. У 29 хворих діагноз ЦД не був встановлений (і відповідні лікувальні заходи не були проведені), незважаючи на наявні клініко-лабораторні ознаки. А стани предіабету — порушеної толерантності до глюкози або гіперглікемії натще не були діагностовані в 11 пацієнтів.
4. Своєчасна діагностика ЦД та інших порушень вуглеводного обміну допомагає визначити раціональну програму інтенсивної терапії та уникнути небажаних ускладнень.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. The European Stroke Organisation (ESO) Executive Committee; ESO Writing Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008 // Cerebrovasc. Dis. — 2008. — № 25(5). — Р. 457-507. doi: 10.1159/000131083.
2. Парфенов В.А., Хасанова Д.Р. Ишемический инсульт. — М.: Медицинское информационное агентство, 2002. — 288 с.
3. Стаднік С.М. Сучасні підходи до превентивно-терапевтичної корекції постінсультних когнітивних розладів // Гострі та невідкладні стани в практиці лікаря. — 2017. — № 1(64). — С. 32-38.
4. Зозуля І.С., Головченко Ю.І., Онопрієнко О.П. Інсульт. Тактика, стратегія ведення, профілактика, реабілітація та прогнози (посібник для лікаря-практика). — К.: Світ успіху, 2010. — 320 с.
5. Hill MD. Stroke and diabetes mellitus // Handb. Clin. Neurol. — 2014. — 126. — 167-74. doi: 10.1016/B978-0-444-53480-4.00012-6.
6. Jovanovic A., Stolic R.V., Rasic D.V., Markovic-Jovanovic S.R., Peric V.M. Stroke and diabetic ketoacidosis — some diagnostic and therapeutic considerations // Vasc. Health Risk Manag. — 2014 Apr 8. — 10. — 201-4. doi: 10.2147/VHRM.S59593. eCollection 2014.
7. Chen R., Ovbiagele B., Feng W. DiabetesandStroke: Epidemiology, Pathophysiology, Pharmaceuticals and Outcomes // Am. J. Med. Sci. — 2016 Apr. — 351(4). — 380-6. doi: 10.1016/j.amjms.2016.01.011.
8. Goldstein L.B. Modern medical management of acute ischemic stroke // Methodist Debakey Cardiovasc. J. — 2014 Apr-Jun. — 10(2). — 99-104. Review. PubMed PMID: 25114761; PubMedCentral PMCID: PMC4117327.

/14_u.jpg)
/14_u2.jpg)
/15_u.jpg)