Вступ
Жовчнокам’яна хвороба (ЖКХ) — одне з найпоширеніших захворювань органів травлення, що має тенденцію до зростання й розширення вікового діапазону в бік омолодження [1–3].
Добре відомо, що ЖКХ розглядається як довготривалий багатоступеневий процес, при якому стадії каменеутворення передують зміни метаболізму, фізико-хімічні зміни в складі жовчі й зниження скоротливої здатності жовчного міхура, що призводить до збільшення літогенності жовчі. Збільшення літогенності жовчі в дітей найчастіше проявляється порушенням співвідношення холестерину, жовчних кислот і фосфоліпідів. При перевищенні рівня холестерину жовч не підтримується в солюбілізованому стані і, отже, здатна до збереження у вигляді кристалів моногідрату холестерину, створюючи основу для утворення біліарного сладжу (БС), що становить IА стадію жовчнокам’яної хвороби [3–5].
Терміном «біліарний сладж» позначається будь-яка неоднорідність жовчі, що виявляється при ультразвуковому обстеженні. З латинської biliaris перекладається як «жовчний», sludge (англ.) — «осад». У пусковому механізмі формування БС у дітей ключовими чинниками є збільшення синтезу холе–стерину або зменшення синтезу жовчних кислот, що веде до перенасичення жовчі холестерином. Перенасичення жовчі холестерином — результат порушення складних біохімічних процесів, головним з яких є посилення активності 3-гідрокси-3-метилглютарил-КоА-редуктази, що призводить до збільшення синтезу холестерину, або зниження активності холестерин-7а-гідроксилази, що супроводжується зменшенням синтезу жовчних кислот. Ці два чинники є ключовими в пусковому механізмі формування холестеринових каменів. При збереженій скоротливій активності жовчного міхура агломеровані частки евакуюються в дванадцятипалу кишку.
Дисфункціональні порушення жовчного міхура (ЖМ) та сфінктера Одді (СО), здебільшого гіпотонія жовчного міхура та/або гіпертонус сфінктера Одді, сприяють формуванню й прогресуванню БС. Цьому ж сприяє дисфункція СО і жовчного міхура, в основі яких лежать запальні процеси в шлунку й дванадцятипалій кишці, що супроводжуються дуоденостазом [5–8].
Також важливу роль у розвитку БС відіграє порушення ентерогепатичної циркуляції жовчних кислот, які синтезуються гепатоцитами печінки, виводяться в складі жовчі в ДПК, використовуються в метаболізмі жирів, реабсорбуються в кишечнику, транспортуються кровотоком в печінку і повторно використовуються в секреції жовчі [6, 8, 9]. Порушення ентерогепатичної циркуляції жовчних кислот також відбувається при порушенні градієнта тиску, що провокується дуоденостазом на фоні захворювань дванадцятипалої кишки, підшлункової залози й зміни складу мікрофлори кишечника, що виражається в збільшенні активності анаеробних популяцій мікроорганізмів, які беруть участь в 7а-дегідроксилюванні жовчних кислот.
Голодування, дотримання низькокалорійних дієт, парентеральне харчування сприяють зниженню моторики жовчного міхура, стазу жовчі, підвищенню тонусу СО, що також провокує розвиток БС [5, 6, 9].
Основним методом діагностики БС є ультра–звукове дослідження (УЗД) жовчного міхура, у тому числі з визначенням скоротливої функції ЖМ і СО.
Виділяють 3 основних типи БС, що мають найбільш характерну ехографічну картину [5, 6, 10]:
— 1-й тип — мікролітіаз: суспензія гіперехогенних частинок у вигляді точкових, одиничних або множинних рухливих утворень, що не дають акустичної тіні й виявляються після зміни положення тіла;
— 2-й тип — замазкоподібна жовч із наявністю згустків різної щільності, що зміщуються й не дають акустичної тіні;
— 3-й тип — поєднання замазкоподібної жовчі з мікролітами.
Ці типи визначають давність і динаміку утворення осаду, можуть змінювати один одного при прогресуванні захворювання. Однак на даному етапі, коли великих каменів ще не утворюється, процес є оборотним [5, 6, 10].
Виділення й лікування БС має важливе значення не тільки для коректного формулювання та діагностування, вибору найбільш раціональної терапевтичної тактики, це також відкриває широкі перспективи для первинної й вторинної профілактики холелітіазу [5, 10, 11].
До числа факторів, що позитивно впливають на динаміку утворення осаду в дитини, входить пролонгована фізіологічна жовтяниця, під час якої в складі жовчі підвищується рівень вільного білірубіну. Це порушення, а також штучне вигодовування й несвоєчасне введення прикорму вважаються першопричинами появи суспензії в дітей раннього віку [12].
У дітей сладж може проявитися на фоні стресу, порушень роботи травного тракту, недостатнього надходження мікроелементів і жовчогінних продуктів натурального походження, ожиріння, низькокалорійної дієти, порушення моторної діяльності жовчного міхура, хронічного запалення стінок жовчного міхура, звуження вивідного протока жовчного міхура, парентерального й зондового харчування, порушень функціонування органів травлення, ендокринних захворювань, прийому деяких лікарських препаратів, що призводять до перенасичення жовчі кальцієм або холестерином, у результаті чого спостерігається зниження моторики жовчного міхура й поява осаду.
При цирозах печінки, вірусних гепатитах, пігментних гепатозах також можливе утворення БС у зв’язку з тим, що порушення функції гепатоцитів проявляється порушенням процесів жовчоутворення [12–17].
Якщо початкові форми сладжу при адекватній терапії можуть бути повністю еліміновані, то запущена форма й прогресування патології неодмінно призведуть до утворення каменів і появи відповідної симптоматики. У деяких випадках, при виключенні сприяючих факторів, сладж може бути зведений до мінімуму або зникнути зовсім. Отже, пацієнти з БС становлять різнорідну групу — як із сприятливим прогнозом (спонтанні зникнення), так і з несприятливим (утворення жовчних каменів) [18].
Клінічні прояви БС досить різноманітні. У деяких випадках діагноз БС є випадковою знахідкою при УЗД. Але в більшості випадків діти скаржаться на нудоту після їжі, відрижку зі смаком гіркоти, ниючий біль у верхній частині живота та/або правому підребер’ї, що виникає через 40–60 хвилин після прийому їжі. При пальпації може бути виявлений помірний біль у проекції жовчного міхура [18, 19].
Причинами болю при БС можуть бути як вплив механічних структур, складових самого сладжу, так і дисфункції сфінктерного апарату жовчних шляхів, що в цій ситуації є вторинними [20].
При гіперкінетичній формі дисфункції жовчного міхура періодично в правому підребер’ї з’являється колькоподібний біль з іррадіацією в спину, під праву лопатку, у праве плече, рідше в епігастральну ділянку й ділянку серця, що посилюється при глибокому вдиху. Біль, як правило, є короткостроковим і зазвичай виникає відразу після помилок у раціоні харчування, приймання холодних напоїв, фізичних навантажень, стресових ситуацій. У деяких випадках причина болю не може бути встановлена. Серед загальних симптомів зустрічаються дратівливість, втомлюваність, пітливість, головний біль, порушення сну, тахікардія й інші прояви неврологічного характеру [18–21].
При гіпокінетичній і гіпотонічній дисфункції жовчного міхура з’являється тупий біль у правому підребер’ї, відчуття здавлювання, розпирання, що посилюються при нахилах тіла. Часто мають місце диспептичні розлади у вигляді нудоти, гіркоти в роті, а також здуття живота, запор [18–21].
Тривала персистенція БС і постійний пасаж його у дванадцятипалу кишку визначають поліморфізм клінічної картини, сприяють формуванню різноманітних ускладнень,таких як гострий холецистит, «відключений» жовчний міхур, гнійний холангіт, стриктури термінального відділу загальної жовчної протоки, стенозуючий папіліт, гострий панкреатит [18–21].
Проблема терапії БС є надзвичайно актуальною через багатофакторність етіології. Незалежно від етіологічного чинника патогенетичним підходом до медичної корекції БС є зниження синтезу холестерину в гепатоциті; збільшення видалення холестерину з жовчі; відновлення скорочувальної функції жовчного міхура [5, 10, 20, 22].
Усім цим вимогам відповідає урсодеоксихолієва кислота (УДХК), вона є багатофункціональною — вирівнює рівновагу «холестерин — жовчні кислоти»; здатна гальмувати всмоктування холестерину в кишечнику, утворювати рідкі кристали з холестерином, завдяки чому гальмується процес розвитку сладжу. Зокрема, УДХК, впливаючи на КоА-редуктазу, зменшує утворення холестерину в гепатоциті. Усе це приводить до зниження літогенності жовчі.
Поряд з літолітичною дією УДХК має й численні специфічні ефекти: антихолестатичний, холеретичний, цито-/гепатопротективний, антиапоптичний, імуномодулюючий, гіпохолестеринемічний, антифібротичний, антиоксидантний, антинеопластичний [22–24].
Прийом УДХК зумовлює підвищення бактерицидності жовчі й кишкового вмісту, зменшення бродильної й гнильної диспепсії, забезпечує метаболічний ефект, сприяючи зниженню сироваткового рівня глюкози, інсуліну й індексу НОМА, регулює метаболізм ліпідів, гомеостаз жовчних кислот, а також проліферацію й диференціацію холангіоцитів [22–29].
Отже, призначення УДХК є патогенетично обґрунтованим методом не тільки в лікуванні БС, вона також може використовуватися з метою запобігання розвитку жовчнокам’яної хвороби.
В Україні зареєстровано лікарський препарат Укрлів у вигляді суспензії для перорального прийому. Суспензія Укрлів належить до групи препаратів жовчних кислот, основна діюча речовина яких — урсодеоксихолієва кислота.
Згідно з інструкцією й опублікованими результатами проведених досліджень, суспензія Укрлів чинить мембраностабілізуючу й гепатопротекторну дію, має імуномодулюючу активність, знижує концентрацію токсичних для гепатоцитів жовчних кислот, індукує жовчоутворення (холерез) із високим вмістом бікарбонатів, що сприяє збільшенню пасажу жовчі, зменшує літогенність жовчі.
Показання до призначення препарату Укрлів у вигляді суспензії: розчинення рентгеннегативних холестеринових жовчних каменів розміром не більше від 15 мм у діаметрі у хворих із функціонуючим жовчним міхуром, незважаючи на наявність у ньому одного чи декількох жовчних каменів. Застосовується дітям з народження.
Метою роботи було вивчення клінічної ефективності, переносимості й безпеки при лікуванні препаратом Укрлів у формі суспензії в дітей у патогенетичній терапії біліарного сладжу.
Матеріали та методи
Дослідження проводилось співробітниками кафедри педіатричної гастроентерології та нутриціології Харківської медичної академії післядипломної освіти, що розташована на базі КЗОЗ «Харківська міська дитяча клінічна лікарня № 19».
У дослідження були включені 60 пацієнтів, необхідною умовою була наявність БС за даними УЗД. В обстежених дітей були вивчені особливості клінічного перебігу БС залежно від чинників їх розвитку, біохімічні показники функціонування печінки.
Критеріями для включення пацієнтів у дослідження були такі: вік від 1 місяця до 8 років; встановлений діагноз із наявністю БС.
Критеріями для виключення були визначені: наявність гострих захворювань у процесі дослідження, які можуть мати значний вплив на результати; участь у будь-яких інших клінічних дослідженнях.
Отримані результати ретельно проаналізовані й інтерпретовані в їх взаємозв’язку з даними літератури, сучасного стану проблеми, з урахуванням теоретичної та практичної значущості. Для обробки результатів дослідження були використані клініко-статистичні й клініко-інформаційні методи. Середню помилку альтернативних показників визначали за допомогою таблиць В.С. Генеса щодо вірогідних відмінностей між групами спостережень за якісними ознаками.
Під наглядом перебували діти віком від 4 місяців до 8 років, з яких 42 дівчинки й 18 хлопчиків. Кожному хворому були проведені лабораторні дослідження для виявлення вірусних гепатитів, автоімунного гепатиту, первинних холестатичних і спадкових (дефіцит α-1-антитрипсину, хвороба Вільсона — Коновалова, гемохроматоз) захворювань печінки.
До диференціальної діагностики були також включені рідкісні спадкові хвороби накопичення (хвороба Німана — Піка типу В, хвороба Гоше, глікогенози, дефіцит лізосомної кислої ліпази). Беручи до уваги відсутність цитопенії, скелетної дисплазії, захворювань легень, нирок, ураження нервової системи в дітей, які перебували під спостереженням, майже всі перераховані хвороби накопичення було виключено, у неясних випадках були проведені високоспецифічні діагностичні тести. Розподіл дітей за ймовірною причиною розвитку БС подано в табл. 1.
Клінічна симптоматика БС у дітей, що перебували під нашим наглядом, була різноманітною й неспецифічною, що обумовлено різнорідними причинами виникнення сладжу. У більшості пацієнтів БС мав латентний перебіг. Майже половина дітей (29 із 60) не пред’являла ніяких скарг.
Під час об’єктивного огляду живіт був м’який, безболісний, розміри печінки, її щільність та рухомість були в межах норми, і тільки при плановому обстеженні дітей було виявлено БС.
При наявності клінічної картини БС проявлявся нудотою, гіркотою в роті, тяжкістю в правому підребер’ї та/або тупим болем у правому підребер’ї, почуттям тиску, розпирання, що збільшувалося при нахилі тулуба, здуттям живота, запором.
Діти старшого віку (5–8 років) скаржились на дратівливість, втомлюваність, пітливість, головний біль, порушення сну, тахікардію; у незначній кількості випадків діти скаржилися на колькоподібний біль у правому підребер’ї з іррадіацією в спину, праву лопатку, праве плече, в одному випадку — в епігастральну ділянку й ділянку серця, що посилювався при глибокому вдиху.
При пальпації майже в половини дітей відмічався помірний біль у правому підребер’ї, точках проекції жовчного міхура, незначне збільшення розмірів печінки до 2–3 см.
У клінічному аналізі крові в усіх дітей показники були в межах референтних значень. Відхилення від норми в загальному аналізі сечі й калу не встановлені.
У біохімічному аналізі крові зафіксоване підвищення рівня переважно прямої фракції білірубіну, проте не більше ніж 20 ммоль/л. Рівень трансаміназ і заліза — у нормі, склад фракцій глобулінів та імуноглобулінів сироватки не перевищував верхню межу норми, не було виявлено антинуклеарних і антигладком’язових антитіл, а також антитіл до мікросом печінки й нирок. Не виявлено змін у показниках обміну міді (церулоплазмін, мідь) у крові й сечі.
При лабораторному дослідженні в більшості дітей були визначені маркери холестазу, перш за все підвищений рівень екскреторних ферментів: білірубіну (пряма фракція), лужної фосфатази; у 9 дітей (з цукровим діабетом, ожирінням, гіперхолестеринемією) були діагностовані порушення ліпідного обміну: збільшення рівня холестерину, ліпопротеїдів низької щільності і дуже низької щільності.
Усім пацієнтам було виконане ультразвукове дослідження органів черевної порожнини з визначенням скоротливої функції жовчного міхура та сфінктера Одді. Для оцінки скоротливої функції ЖМ спочатку оцінювали базальний обсяг жовчного міхура, а потім виконували оцінку через 15 і 60 хвилин після стандартного пробного сніданку. При збереженій скоротливій функції коефіцієнт спорожнення становив не менше від 50 %.
У всіх дітей, які перебували під спостереженням, було виявлено функціональні порушення жовчного міхура та СО: усі мали порушення функціональної активності жовчного міхура, які проявлялися його гіпофункцією, у більшості (62 %) тонус СО було збережено, і тільки в незначної частини пацієнтів мали місце спазм СО (20 %) або його недостатність (15 %). Функціональний стан біліарної системи за даними УЗД подано в табл. 2.
При УЗД було виявлено три типи БС:
— 1-й тип — мікролітіаз: маленькі, до 4–5 мм, гіперехогенні включення без акустичної тіні, виявляються після зміни положення тіла — у 14 дітей;
— 2-й тип — замазкоподібна жовч з наявністю в рідині одного або декількох вузлів високої щільності, найчастіше фіксованих до задньої стінки жовчного міхура — у 39 дітей;
— 3-й тип — комбінований, наявність мікролітів і замазкоподібної жовчі — у 7 дітей.
Усіх дітей методом випадкової вибірки було розподілено на 2 групи. Розподіл дітей залежно від типу БС подано в табл. 3. Більшість дітей (19 основної групи та 20 групи порівняння) мали замазкоподібну жовч, значно менше — мікролітіаз, поодинокі мали комбіновані порушення.
Майже в половини дітей, які перебували під нашим наглядом, тривалість захворювання становила менше від року. Розподіл дітей залежно від тривалості захворювання подано в табл. 4, проте необхідно враховувати той факт, що майже в половини дітей (29), що становило 48 %, виявлення БС було випадковою знахідкою, тому давність захворювання в цих дітей має суб’єктивний характер.
З огляду на наявність виявленого БС у всіх дітей, які перебували під спостереженням, нами було прийнято рішення дітям основної групи провести таргетну терапію препаратом урсодеоксихолієвої кислоти — суспензією Укрлів у дозі 10 мг/кг/добу протягом 1 місяця.
Результати та обговорення
Крім лікування основного захворювання, на фоні якого розвинувся сладж, усім дітям було рекомендовано регулярне дотримання принаймні чотириразового харчування й була призначена дієта з обмеженим вживанням тваринних жирів, збільшено вміст овочів, була проведена корекція мітохондріальних порушень і дефіциту жиророзчинних вітамінів, збільшено в харчуванні кількість поліненасичених та ω-3 жирних кислот.
Ефективність терапії препаратом Укрлів вивчали шляхом оцінки проявів основних клінічних симптомів, результатів біохімічного та ультразвукового досліджень. Після призначення препарату Укрлів клінічні симптоми оцінювались щодня протягом усього періоду перебування дитини в лікарні, а потім через місяць після початку лікування, біохімічні показники визначали перед початком лікування і через місяць (табл. 5), УЗД проводили перед початком лікування та через місяць.
Вже через два тижні після початку терапії в пацієнтів відзначалося зменшення скарг (зникли нудота, гіркота в роті, тяжкість у правому підребер’ї, біль у верхній частині живота та/або правому підребер’ї, що виникали через 40–60 хвилин після прийому їжі).
Виражена позитивна динаміка відмічалась в групі дітей, які отримували Укрлів. У дітей із групи порівняння відмічалась незначна позитивна динаміка. Динаміка клінічних симптомів у дітей основної групи, які отримували Укрлів, і групи порівняння подана в табл. 6.
Позитивна клінічна динаміка в групі дітей, які отримували суспензію Укрлів, супроводжувалась позитивною динамікою лабораторних показників: у всіх дітей з основної групи мала місце нормалізація маркерів холестазу й показників білково-ліпідного обміну на відміну від дітей із групи порівняння.
Діти з групи порівняння не досягли вираженої позитивної лабораторної динаміки. У першу чергу йдеться про рівні лужної фосфатази та білірубіну (прямої/кон’югованої фракції), які залишилися підвищеними в 50 та 24 % дітей відповідно, також не було істотних змін рівня холестерину, ліпопротеїдів низької та дуже низької щільності.
Ультразвуковий контроль ефективності лікування проводився через місяць після початку терапії, мала місце чітка позитивна динаміка в більшості пацієнтів, які отримували суспензію Укрлів.
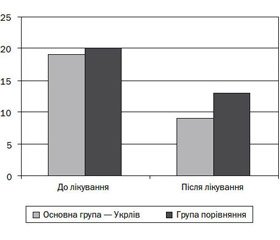
В основній групі на фоні прийому препарату –Укрлів у формі суспензії в усіх дітей зафіксоване розчинення (60 ± 9 % ) або зменшення БС, на той час як тільки у 8 із 30 дітей групи порівняння було зафіксовано спонтанне зникнення БС.
За результатами нашого дослідження найбільш резистентним до літолітичної терапії виявився БС 3-го типу, що, на наш погляд, потребує корекції (підвищення) дози препарату, який призначається, а також пролонгації терапії.
Навіть у тих випадках, коли в дітей залишився БС, мало місце зменшення ступеня неоднорідності вмісту жовчного міхура порівняно з вихідними даними.
На жаль, серед дітей із групи порівняння тільки у 27 ± 8 % відбулася елімінація БС. Результати ультразвукового дослідження подані в табл. 7 та на рис. 1–3, де зафіксована кількість дітей основної й контрольної групи до та після лікування залежно від типу БС.
Переносимість Укрліву добра, жодного випадку негативної реакції не відмічалось. Побічних ефектів не було.
Висновки
Отже, динамічне спостереження за дітьми, які отримували Укрлів, дозволило відмітити практично в усіх клінічне, біохімічне покращення й позитивну ультразвукову динаміку, що дозволяє зробити такі висновки:
1. Пацієнти з БС становлять різнорідну групу — як із сприятливим прогнозом (спонтанне зникнення), так і з несприятливим (утворення жовчних каменів).
2. Таргетна терапія дітей препаратом УДХК Укрлів сприяє елімінації або зменшенню об’єму БС, що допомагає запобігти прогресуванню захворювання й відкриває перспективи профілактики жовчнокам’яної хвороби.
3. Застосування препарату урсодеоксихолієвої кислоти Укрлів характеризується ефективною елімінацією БС за короткий проміжок часу, зникненням холестазу й нормалізацією білково-холестеринового обміну.
4. Укрлів добре переноситься хворими, не викликає побічних реакцій, зручний у застосуванні.
5. Рекомендована тривалість терапії препаратом Укрлів у дітей із БС становить 4 тижні.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. A population-based study on the epidemiology of functional gastrointestinal disorders in young children / A. Chogle, C. A. Velasco-Benitez, I.J. Koppen [et al.] // J. Pediatr. — 2016. — Vol. 179. — P. 139.e1–143.e1. — DOI: 10.1016/j.jpeds.2016.08.095. — PMID: 27726867.
2. Prevalence of functional gastrointestinal disorders in children and adolescents / M.L. Lewis, O.S. Palsson, W.E. Whitehead, M.A. van Tilburg // J. Pediatr. — 2016. — Vol. 177. — P. 39.e3-43.e3. — DOI: 10.1016/j.jpeds.2016.04.008. — PMID: 27156185.
3. Gallbladder and Sphincter of Oddi Disorders / [P.B. Cotton, G.H. Elta, C.R. Carter та ін.] // Gastroenterology. — 2016. — № 150. — Р. 1420-1429. doi: 10.1053/j.gastro.2016.02.033.
4. Ko C.W. Biliary sludge and cholecystitis / C.W. Ko, S.P. Lee // Best Practice & Research Clinical Gastroenterology. — 2003. — № 17. — Р. 383-396. — https://doi.org/10.1016/S1521-6918(03)00026-X.
5. EASL Clinical Practice Guidelines on the prevention, diagnosis and treatment of gallstones / European Association for the Study of the Liver (EASL) // J. Hepatol. — 2016. — Vol. 65, № 1. — P. 146-181. — doi: 10.1016/j.jhep.2016.03.005.19.
6. Jüngst C. Microlithiasis and sludge / C. Jüngst, G. Kullak-Ublick, D. Jüngst // Best Practice & Research Clinical Gastroentero–logy. — 2006. — № 20. — Р. 1053-1062. https://doi.org/10.1016/j.bpg.2006.03.007.
7. Prediction of symptom improvement in children with biliary dyskinesia / [J.B. Mahida, J.P. Sulkowski, J.N. Cooper et al.]. // The Journal of surgical research. — 2015. — № 198. — Р. 393-399. doi: 10.1016/j.jss.2015.03.056.
8. Kalra S. Biliary sludge and recurrent ketoacidosis: a case report / S. Kalra, B. Kalra, A. Thakur // Diabetology & Metabolic Syndrome. — 2009. — № 1. — С. 28. https://doi.org/10.1186/1758-5996-1-28.
9. Parenteral nutrition associated cholestasis [Електронний ресурс] / S. Costa, G. Barone, P. Catenazzi, C. Romagnoli // Italian Journal of Pediatrics. — 2015. — Режим доступу: http://www.ijponline.net/content/41/S1/A4. https://doi.org/10.1186/1824-7288-41-S1-A4.
10. EASL Clinical Practice Guidelines: Management of cholestatic liver diseases // Journal of Hepatology. — 2009. — № 51. — Р. 237-267. https://doi.org/10.1016/j.jhep.2009.04.009.
11. Denise H. High rate of complicated idiopathic gallstone di–sease in pediatric patients of a North American tertiary care center / H. Denise, G. Bouchard // World Journal of Gastroenterology. — 2008. — № 14. — Р. 1544-1548. doi:10.3748/wjg.14.1544.
12. Brumbaugh D. Conjugated Hyperbilirubinemia in Children / D. Brumbaugh, C. Mack // Pediatrics in Review. — 2012. — № 33. — Р. 291-302. doi: 10.1542/pir.33-7-291.
13. Gallbladder Function and Hepatic Structural Changes in Children with Nonalcoholic Fatty Liver Disease [Електронний ресурс] / N.Y. Zavgorodnya, O.Y. Lukianenko, V.B. Yagmur, I.S. Konenko // Gastroenterology. — 2016. — Режим доступу: http://gastro.zaslavsky.com.ua/article/view/74731. https://doi.org/10.22141/2308-2097.2.60.2016.74731 (in Ukrainian).
14. Restriction fragment length polymorphism effectively identifies exon 1 mutation of UGT1A1 gene in patients with Gilbert’s Syndrome / [T. Shiu, H. Huang, H. Lin et al.] // Liver International. — 2015. — № 35. — Р. 2050-2056. doi: 10.1111/liv.12785.
15. Nobili V. Pediatric non-alcoholic fatty liver disease: Preventive and therapeutic value of lifestyle intervention / V. Nobili, A. Alisi, M. Raponi // World Journal of Gastroenterology. — 2009. — № 15. — Р. 6017-6022. doi:10.3748/wjg.15.6017.
16. Pacifico L., Anania C., Martino F. [et al.] Management of metabolic syndrome in children and adolescents // Nutr.Metab. Cardiovasc. Dis. — 2011. — № 21. — P. 455-466. doi: 10.1016/J.nu–mecd.2011.01.011.
17. Бабаджанян О.М., Шутова О.В., Волошина Л.Г., Ганзій О.Б., Каафарані Аббас, Слободянюк О.Л. Таргетна терапія синдрому Жильбера // Здоровье ребенка. — 2017. — Т. 12, № 2.1. — С. 219-224. doi: 10.22141/2224-0551.12.2.12017.100984.
18. Santos J. Cholestatic Liver Disease in Children / J. Santos, M. Choquette, J. Bezerra // Current Gastroenterology Reports. — 2010. — № 12. — Р. 30-39. doi:10.1007/s11894-009-0081-8.
19. Clinical Characteristics and Risk Factors for Symptomatic Pediatric Gallbladder Disease / [S. Mehta, M.E. Lopez, B.P. Chumpitazi et al.]. // Pediatrics. — 2012. — № 112. — Р. 82-88. doi: 10.1542/peds.2011-0579.
20. Уніфіковані клінічні протоколи медичної допомоги дітям із захворюваннями органів травлення [Електронний ресурс]: Наказ № 59 від 29.01.2013 // Міністерство охорони здоров’я України: офіційний веб-сайт. — Режим доступу: http://www.moz.gov.ua/docfiles/dod59_2_2013.pdf (дата звернення: 27.12.2017). — Назва з екрана.
21. Шутова Е.В. Оптимизация диагностики ранней стадии желчнокаменной болезни у детей / Е.В. Шутова, Белоусова О.Ю., Павленко Н.В. // Современная педиатрия. — 2015. — № 2(66). — С. 88-91. — doi 10.15574/SP.2015.65.88.
22. Paumgartner G. Ursodeoxycholic acid in cholestatic li–ver disease: Mechanisms of action and therapeutic use revisited / G. Paumgartner, U. Beuers. // Hepatology. — 2002. — № 36. — Р. 525-531. doi: 10.1053/jhep.2002.36088.
23. Ursodeoxycholic acid therapy in gallbladder disease, a story not yet completed / [M. Guarino, S. Cocca, A. Altomare та ін.] // World Journal of Gastroenterology. — 2013. — № 19. — Р. 5029-5034. doi: 10.3748/wjg.v19.i31.5029.
24. Matsuzaki Y. Ursodeoxycholic acid: Mechanism of action and novel clinical applications / Yasushi Matsuzaki // He–patology research: the official journal of the Japan Society of Hepatology. — 2007. — 38. — Р. 123-131. doi: 10.1111/j.1872-034X.2007.00297.x.
25. Kumar D. Use of ursodeoxycholic acid in liver disea–ses / D. Kumar, R. Tandon // Journal of Gastroenterology and Hepatology. — 2001. — № 16. — Р. 3-14. doi: 10.1046/j.1440-1746.2001.02376.x.
26. Pusl T. Ursodeoxycholic acid treatment of vanishing bile duct syndromes / T. Pusl, U. Beuers // World J. Gastroenterol. — 2006. — № 12. — Р. 3487-3495. doi: 10.3748/wjg.v12.i22.3487.
27. Cheng K. Ursodeoxycholic acid for Cystic Fibrosis-related liver disease (Cochrane Review) [Електронний ресурс] / K. Cheng, D. Ashby, R. Smyth // The Cochrane Library, Cochrane Database Syst. Rev. — 2014. — Режим доступу: http://www.cochranelibrary.com/enhanced/exportCitation/doi/10.1002/14651858.CD000222.pub3.
28. The Therapeutic Role of Ursodeoxycholic Acid in Digestive Diseases [Електронний ресурс] / [A. Gamboa, C. Tian, J. Massaad et al.] // Annals of gastroenterology & hepatology. — 2011. — Режим доступу: http://lifewithnogallbladder.com/wp-content/uploads/2015/01/gallstone-dissolving1.pdf.
29. Wang J. Ursodeoxycholic Acid for the Treatment of Liver Diseases / J. Wang, S. Wu // Liver Pathophysiology. Section VI: Therapies in Liver Disease. — 2017. — Р. 767-779. https://doi.org/10.1016/B978-0-12-804274-8.00055-2.

/58-1.jpg)
/59-1.jpg)
/60-1.jpg)
/61-1.jpg)
/61-2.jpg)