Вступ
Синдром портальної гіпертензії (ПГ), або синдром підвищення тиску у ворітній вені, не є самостійним захворюванням. А втім, він часто зустрічається при патологічних процесах, коли порушується циркуляція крові в системі ворітної вени [1–3].
Проведені останнім часом дослідні роботи з вивчення особливостей портального кровотоку при хронічних дифузних захворюваннях печінки, хронічній серцевій недостатності свідчать про те, що розлади печінкового кровотоку у даних категорій хворих виникають вже на ранніх стадіях захворювання і передують іншим порушенням [4, 5].
Для диференційної діагностики ПГ використовують комплексний підхід, що включає аналіз даних лабораторних та інструментальних методів досліджень [6]. Основними завданнями діагностики є визначення ступеня компенсації функції печінки, активності процесу, встановлення особливостей портопечінкового кровообігу, наявності синдрому гіперспленізму або його відсутності [7].
Відомо, що ультразвукове дослідження (УЗД) з імпульсною й кольоровою допплерографією дає змогу візуалізувати структурні зміни ворітної вени та її гілок, визначати позапечінкову або печінкову форми портальної гіпертензії, наявність тромбозу ворітної вени та його стадію. На відміну від хворих на цироз печінки з портальною гіпертензією, у яких в отворах портальних судин візуалізується однорідний допплерівський сигнал, при тромбозі ворітної вени визначаються ознаки внутрішньопросвітної патології судин [8].
Однак значна варіабельність кількісних показників портального кровотоку при хронічному гепатиті, цирозі печінки, хронічній серцевій недостатності, хворобі Бадда — Кіарі підтверджує необхідність подальшого пошуку клініко-гемодинамічних особливостей при різних формах ПГ.
Мета дослідження: визначити зв’язок між допплерографічними показниками портальної системи, клінічними даними та основними маркерами цитолітичного, холестатичного та мезенхімально-запального синдромів у хворих на печінкову та позапечінкову ПГ.
Матеріали та методи
Під спостереженням перебували 240 хворих із дифузними захворюваннями печінки та патологією вен печінки, які були розподілені на групи: 1 — становили 165 пацієнтів із печінковою ПГ (цироз печінки) віком (53,5 ± 1,2) року, серед яких було 79 (47,9 %) жінок і 86 (52,1 %) чоловіків; 2 — 40 хворих на позапечінкову ПГ (тромбоз ворітної вени, хвороба Бадда — Кіарі, ішемічна хвороба серця (ІХС), кардіосклероз, стан після хірургічних втручань на органах черевної порожнини) віком (33,8 ± 2,1) року, чоловіків було 25 (62,5 %), жінок — 15 (37,5 %); 3 — 35 осіб без ПГ (хворі на хронічний гепатит різної етіології) віком (45,1 ± 1,8) року, серед яких було 20 (57,1 %) чоловіків і 15 (42,9 %) жінок.
Усім пацієнтам проведені загальноклінічні обстеження. При встановленні діагнозу й оцінці тяжкості перебігу хвороб користувалися Уніфікованою клініко-статистичною класифікацією хвороб органів травлення (відомча інструкція, затверджена Міністерством охорони здоров’я (МОЗ) України в 2004 р.). Ведення пацієнтів здійснювали за уніфікованими клінічними протоколами вторинної (спеціалізованої) медичної допомоги, згідно з наказом МОЗ України від 28.09.2012 р. № 751. До початку дослідження всі пацієнти були поінформовані щодо проведення відповідних досліджень. Усі виконані дослідження відповідали законодавству України та етичним нормам Гельсінської декларації прав людини.
Серед показників цитолітичного синдрому вивчали активність аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), уміст загального білірубіну. Холестатичний синдром характеризували за вмістом лужної фосфатази (ЛФ), гаммаглутамілтранспептидази (ГГТП). Синдром гепатоцелюлярної недостатності оцінювали за показниками загального білка, протромбінового індексу (ПТІ) та рівнем фібриногену. Показники імунозапального синдрому включали тимолову пробу та загальний білок [9].
Сонографічні дослідження виконувалися на ультразвуковому сканері експертного класу Siemens Acuson X150 з використанням допоміжних опцій, а саме допплерівського та енергетичного картування судин портальної системи. Допплерографічна характеристика портального кровотоку включала оцінку ворітної, селезінкової, печінкових вен, печінкової та селезінкових артерій. У кожній судині вимірювали діаметр, визначали середню лінійну швидкість кровотоку, розраховували спектральні індекси [10].
Статистичну обробку даних здійснювали з використанням програм MS Excel 2007 і SPSS 16.0. Для порівняння показників у групах використовували критерій χ2 (хі-квадрат) та критерій Манна — Уїтні. Кореляційний аналіз проводили за Спірменом. Відмінності показників вважали значущими при р < 0,05 [11].
Результати та обговорення
При аналізі клінічної симптоматики встановлено, що симптоми астеновегетативного синдрому (загальна слабкість, швидка втомлюваність, головний біль, порушення сну) виявляли у 100 % обстежених хворих на ПГ, майже з однаковою частотою у пацієнтів як із печінковою її формою, так і позапечінковою ПГ (рис. 1). У 3 групі частота виявлення основних проявів астеновегетативного синдрому була дещо меншою.
Больовий синдром був у всіх (100 %) хворих 1 групи, у 31 (77,5 %) — 2 та у 29 (82,9 %) хворих 3 групи (табл. 1). Показники 2 та 3 груп статистично вірогідно відрізняються від даних 1 групи ( x2 = 38,8; р < 0,01 та x2 = 29,2; р < 0,01 відповідно). Частіше хворих 1 та 3 груп непокоїв біль у правому підребер’ї ( x2= 16,5; р < 0,001 та x2 = 6,8; р < 0,001 відповідно, проти 2 групи). Пацієнтів із позапечінковою формою ПГ у 2,4 раза частіше, ніж хворих 1 групи, турбував біль в епігастрії, не пов’язаний із прийомом їжі ( x2= 11,3; р < 0,001).
/24-1.jpg)
Диспептичний синдром спостерігали у 100 % хворих трьох груп. Найчастіше він проявлявся метеоризмом — у 85 (51,5 %) хворих 1 групи, 17 (42,5 %) — 2 та 15 (42,9 %) хворих 3 групи. Відчуття важкості в правому підребер’ї відзначили 49,1 % пацієнтів із печінковою формою ПГ та 40,0 % — без ПГ, що в 2 рази частіше, ніж серед хворих 2 групи ( x2= 9,2; р < 0,001 порівняно з 1 групою). В групі пацієнтів із позапечінковою формою ПГ другим за рангом проявом диспептичного синдрому виявилося відчуття важкості в епігастрії (27,5 % випадків), що у 2,5 та 1,6 раза більше порівняно з 1 ( x2 = 6,1; р < 0,05) та 3 (р > 0,05) групами. Майже половина обстежених 1 та 3 груп скаржилися на зниження апетиту без суттєвої різниці між цими групами, проте хворі 2 групи зниження апетиту відмічали майже у 2 рази рідше ( x2 = 4,7; р < 0,05 порівняно з 1 групою).
Клінічні ознаки синдрому жовтяниці майже з однаковою частотою спостерігали у хворих 1 та 3 груп (рис. 2). Водночас у групі хворих із позапечінковою формою ПГ ознаки синдрому жовтяниці виявляли значно рідше (р < 0,05).
Серед пацієнтів із печінковою формою ПГ прояви коагулопатії у вигляді носових кровотеч, кровоточивості ясен, судинних зірочок і кровотеч з варикозно розширених вен стравоходу в анамнезі відзначали у 2 рази частіше, ніж серед хворих 2 групи.
Частота збільшеної печінки була найвищою у пацієнтів із печінковою формою ПГ, що становило 163 (98,8 %) випадки. У хворих 2 групи гепатомегалія відзначена в 2 рази рідше — в 20 (50,0 %) випадках. У групі обстежених без ПГ спостерігали збільшення печінки у 20 (57,1 %) пацієнтів. Селезінка була збільшеною при пальпації в усіх хворих на ПГ.
Ознаки набряково-асцитичного синдрому, що проявлявся набряком нижніх кінцівок, наявністю асциту різного ступеня вираженості, також були найбільш виражені та найчастіше мали місце у пацієнтів із печінковою формою ПГ — 74 (44,8 %) випадки.
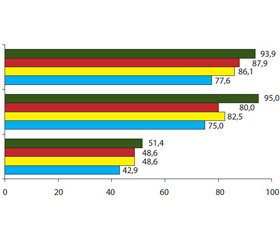
Аналіз ферментів цитолізу у хворих без ПГ показав, що гіпераланінамінотрансфераземія спостерігалась у 51,4 % хворих цієї групи до (83,0 ± 28,5) Од/л, що в 2,8 раза перевищує контроль (р < 0,01) та свідчить про мінімальний ступінь запалення гепатоцитів (рис. 3). Підвищення активності АСТ у 2,3 раза (р < 0,05) встановлено менше ніж у половини хворих 3 групи.
Ознаки холестазу, за даними ГГТП, визначались у 20,0 % хворих, зростання рівня загального білірубіну та ЛФ не встановлено в жодного пацієнта. Порушення синтетичної функції печінки, коагулопатія та імунозапальний синдром були встановлені у поодиноких випадках.
У хворих 1 групи цитолітичний синдром виявлений практично в усіх групах обстежених внаслідок підвищення активності АЛТ у 3,7 раза (р < 0,001). Збільшення активності АСТ у хворих із печінковою формою ПГ визначалось в 2,0 раза частіше, ніж у 3 групі (р < 0,05), та було максимальним серед усіх груп — в 4,8 раза у порівнянні з контрольним показником (р < 0,001), що в 2,7 раза перевищувало значення 2 групи (р < 0,05) та 2,6 раза — 3 групи (р < 0,05). Це вказує на найбільш глибоке ураження гепатоцитів із руйнуванням мітохондріальних структур.
Зростання активності ЛФ і ГГТП, загального білірубіну як ознак печінкового холестазу у хворих 1 групи також спостерігалось найчастіше серед усіх груп та було найбільш вираженим. Так, підвищення рівня ГГТП у 4 рази (р < 0,001) діагностовано у 80,0 % хворих. Гіпербілірубінемія до 2,4 норми (р < 0,001) спостерігалась майже у п’ятої частини хворих. Підвищення тимолової проби визначалось у чверті хворих та було максимальним серед усіх груп — у 3,2 раза (р < 0,01).
Ознаки гепатоцелюлярної недостатності та порушень синтетичної функції печінки, за даними ПТІ та фібриногену, у хворих 1 групи також спостерігались частіше, ніж в інших групах. Зниження ПТІ в 1,2 раза (р < 0,001) діагностувалось менше ніж у половини обстежених. Недостатність вмісту фібриногену визначалась більше ніж у половини пацієнтів. Такі зміни є прогностично несприятливим фактором ризику розвитку кровотеч. Схильність до гіперкоагуляції, за даними ПТІ, визначалась в 4,3 раза рідше, ніж у 2 групі (р < 0,05).
Аналіз ферментів цитолізу у хворих із позапечінковою формою ПГ показав, що гіпераланінамінотрансфераземія спостерігалась у 20,0 % хворих цієї групи до (75,4 ± 14,3) Од/л, що в 2,5 раза перевищує контроль (р < 0,01). Підвищення активності АСТ встановлено лише в 15,0 % випадків. Серед показників холестазу зростання рівня загального білірубіну та ЛФ не встановлено в жодного пацієнта, однак активність ГГТП підвищувалась в 1,3 раза у 15,0 % обстежених.
Аналіз показників системи гемостазу довів, що рівень ПТІ був незначно зниженим лише в 2 випадках. Схильність до гіпо- та гіперкоагуляції за рівнем фібриногену встановлена в поодиноких випадках. Підвищення тимолової проби в 2,1 раза (р < 0,01), що характеризує імунозапальний синдром, встановлено у четвертої частини хворих.
При оцінці артеріальної складової печінкового кровотоку встановлено, що у всіх пацієнтів із ПГ спостерігалося збільшення діаметра печінкової артерії, більшою мірою у хворих 1 групи (на 42,6 % проти групи без ПГ (р < 0,05)). У пацієнтів із позапечінковою формою відзначено збільшення діаметра печінкової артерії на 25,0 % порівняно із хворими 3 групи (р < 0,05). Діаметр селезінкової артерії вірогідно між групами не відрізнявся (табл. 1).
При ультразвуковій допплерографії у хворих 1 групи спостерігалося суттєве збільшення лінійної швидкості кровотоку в печінковій і селезінковій артеріях порівняно з пацієнтами без ПГ у середньому на 75,7 та 39,5 % (р < 0,05). У хворих із позапечінковою формою ПГ ці показники суттєво від даних 3 групи не відрізнялися. Проте середня лінійна швидкість кровотоку в печінковій і селезінковій артеріях на 30,6 та 18,8 % була меншою при порівнянні з 1 групою (р < 0,05).
Індекси резистентності та пульсативності в печінковій і селезінковій артеріях у хворих на ПГ вірогідно не відрізнялися від пацієнтів без ПГ.
При аналізі печінково-селезінкового артеріального індексу (ПСАІ) встановлено, що у хворих 1 групи цей показник був в 2,5 раза вищим, ніж у пацієнтів без ПГ (р < 0,05). Отже, у хворих із печінковою формою ПГ спостерігалося підвищення артеріального кровотоку в печінковій артерії порівняно з селезінковою.
На відміну від пацієнтів 1 групи у хворих із позапечінковою формою ПГ при збільшенні кровотоку в печінковій артерії при підпечінковій її формі та зменшенні його при надпечінковій ПГ відношення печінкового та селезінкового кровотоку суттєво не відрізнялося від значення ПСАІ в 3 групі. А це означає, що такий перерозподіл кровотоку між печінковою та селезінковою артеріями у бік першої може бути диференціальним критерієм саме печінкової форми ПГ.
Порівняння результатів допплерографії і біохімічних показників у хворих із печінковою формою ПГ виявило високий ступінь кореляції між діаметром печінкової артерії та рівнем АЛТ (r = 0,741; р < 0,05), помірний — з концентрацією АСТ (r = 0,622; р < 0,05), слабкий — з рівнем загального білка (r = 0,338; р < 0,05) і альбуміну (r = 0,351; р < 0,05). ПСАІ мав помірний кореляційний зв’язок із рівнем АСТ (r = 0,633; р < 0,05) та АЛТ (r = 0,491; р < 0,05), слабкий — з концентрацією загального білка (r = 0,312; р < 0,05), альбуміну (r = 0,367; р < 0,05), білірубіну (r = 0,377; р < 0,05) і ЛФ (r = 0,325; р < 0,05).
Проведене комплексне багатокомпонентне дослідження венозного кровотоку дозволило виявити різнонаправлені тенденції в портальній гемодинаміці у хворих із печінковою та позапечінковою формами ПГ. Так, у пацієнтів із печінковою формою ПГ спостерігалося значне збільшення діаметра печінкової вени як у порівнянні з групою хворих із позапечінковою формою ПГ (в 1,5 раза; р < 0,05), так і з пацієнтами без ПГ (в 1,6 раза; р < 0,01). Також мало місце збільшення діаметра ворітної вени на 46,3 % порівняно з показником 3 групи (р < 0,01).
Найбільший діаметр селезінкової вени спостерігали у пацієнтів із позапечінковою формою ПГ (р < 0,05 та р < 0,01 порівняно з показниками в 1 та 3 групах відповідно).
Для хворих на ПГ характерним також було зниження лінійної швидкості кровотоку у ворітній вені: в групі з печінковою формою на 47,9 % порівняно з 3 групою (р < 0,01), у пацієнтів із позапечінковою формою — на 37,5 % (р < 0,01). Водночас порівняно з хворими без ПГ спостерігалося підвищення лінійної швидкості кровотоку в печінковій вені у хворих 1 групи (р < 0,05) та зниження цього показника у пацієнтів 2 групи (р < 0,05). Показник лінійної швидкості в селезінковій вені суттєво зменшувався у хворих із позапечінковою формою ПГ — на 51,1 % порівняно з 3 групою (р < 0,01) та на 36,6 % порівняно з 1 групою (р < 0,05).
Індекс резистентності в печінковій вені був суттєво меншим у пацієнтів 2 групи: на 59,4 та 64,1 % проти хворих 1 та 3 груп відповідно (р < 0,01). В селезінковій вені цей індекс також мав тенденцію до зниження серед хворих із позапечінковою формою ПГ.
Відзначено вірогідне зниження індексу пульсативності в печінковій вені у хворих 2 групи порівняно як із пацієнтами з печінковою формою ПГ (у 6,1 раза; р < 0,01), так і з хворими без ПГ (у 5,1 раза; р < 0,01). Аналогічно спостерігали зниження серед пацієнтів 2 групи цього індексу і в селезінковій вені на 31,4 та 40,0 % відповідно (р < 0,05). Значення індексу пульсативності у ворітній вені суттєво не відрізнялись між групами.
Гепатофугальний потік кровотоку був діагностований у 66 (40,0 %) хворих 1 групи та у 23 (57,5 %) — 2 групи. Спленофугальний кровоток відзначено у 30 (18,2 %) пацієнтів із печінковою формою ПГ та у 31 (77,5 %) хворого із позапечінковою формою ПГ. Реканалізація пупкової вени спостерігалася в 68 (41,2 %) випадках у 1 групі та 6 (15,0 %) випадках у 2 групі.
У хворих із печінковою формою ПГ портокавальні та гастроренальні анастомози встановлені в 44 (26,7 %) випадках. Серед пацієнтів 2 групи частота діагностики анастомозів становила 17 (42,5 %) випадків. У хворих без ПГ анастомозів виявлено не було.
Серед кореляційних взаємозв’язків у хворих із печінковою формою ПГ звертає на себе увагу залежність активності АСТ від віку хворих (r = 0,441; р < 0,05). Рівень загального білірубіну корелював із діаметром портальної вени (r = 0,522; р < 0,05), наявністю асциту (r = 0,437; р < 0,05), рівнем ПТІ (r = –0,562; р < 0,05). Вміст фібриногену мав негативний зв’язок із діаметром ворітної вени (r = –0,528; р < 0,05) та наявністю асциту (r = –0,456; р < 0,05), ГГТП (r = –0,622; р < 0,01). Рівень ПТІ також залежав від діаметра ворітної вени (r = –0,428; р < 0,01), наявності асциту (r = –0,453; р < 0,05) та вмісту фібриногену (r = 0,538; р < 0,01).
Висновки
1. У хворих із печінковою ПГ були виявлені найбільші зміни допплерографічних показників як венозного, так і артеріального кровотоку одночасно зі значною вираженістю маркерів цитолізу та холестазу, а виявлені вірогідні кореляційні зв’язки свідчать про їх асоціативний характер.
2. Характерною рисою позапечінкової ПГ була відсутність ознак печінкової недостатності або їх менша вираженість; не виявлено паралелізму між біохімічними та гемодинамічними показниками при цій формі ПГ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/22-1.jpg)
/24-1.jpg)
/23-1.jpg)
/25-1.jpg)