Вступ
Трофологічна недостатність (ТН) — синдром, що характеризується дисбалансом між потребами організму та надходженням поживних речовин, що спостерігається при недостатньому споживанні їх із їжею та/або при порушенні утилізації в організмі.
Традиційно ТН поділяють на два основних типи — первинну (дефіцит надходження харчових речовин) і вторинну (розвивається на тлі якого-небудь захворювання).
Хронічний панкреатит (ХП) належить до захворювань із тяжким перебігом, він призводить надалі до порушення всіх видів обміну, схильний до рецидиву і прогресування, вражає людей найбільш працездатного віку.
Підшлункова залоза (ПЗ) — це орган, який при тривалому впливі етіологічного фактора на тлі ішемії і гіпоксії реагує зниженням функціональної активності, що виявляється від незначної зміни структури до суттєвої дегенерації залози, що сприяє атрофії структурних одиниць органа, прогресуванню фіброзу тканин залози та формуванню ХП [1–3]. Суттєво, що ПЗ має колосальні компенсаторні особливості, тому тривала прогресуюча зовнішньосекреторна недостатність (ЗСН) спочатку клінічно проявляється синдромом мальабсорбції, а виражена ТН стає очевидною тільки при тяжкому ураженні ПЗ. Хронічним вважається панкреатит, при якому морфологічні зміни ПЗ зберігаються після припинення дії етіологічного агента. Приблизно у 1/3 хворих на ХП внаслідок ураження всіх клітин острівкового апарату ПЗ розвиваються розлади вуглеводного та білкового обміну, що при прогресуванні патологічного процесу призводить до дисбалансу мінерального та вітамінного обміну і формування вторинної ТН [4, 5].
Мінеральний обмін — сукупність процесів всмоктування, засвоєння, перетворення та виведення речовин, що знаходяться в організмі переважно у вигляді неорганічних (мінеральних) сполук. Функціонально ці речовини в організмі пов’язані з білками, вуглеводами, ліпідами, у тому числі ліпідами біологічних мембран. Порушення мінерального обміну призводить до розвитку тяжких патологічних станів — остеопорозу, остеомаляції, фосфат-діабету, рахіту, підвищення нервово-м’язової збудливості тощо. Концентрація багатьох мінеральних речовин у крові та сечі є істотною діагностичною ознакою низки захворювань, зокрема ХП [6, 7].
Функції кожної мінеральної речовини в організмі специфічні, що обумовлює різноманіття механізмів регуляції мінерального обміну, дисбаланс якого, у свою чергу, веде до маніфестації запальних процесів у спровокованих органах, зокрема і в ПЗ. Підвищення вмісту магнію в крові, наприклад, відзначають при уремії, гіпотиреозі, метаболічному ацидозі, гіпертонічній хворобі, артритах, рахіті; зниження концентрації магнію в крові спостерігається при закупорці жовчовивідних шляхів, тиреотоксикозі, гіперальдостеронізмі. Гіпомагніємію відмічають при хронічному алкоголізмі, порушенні процесів всмоктування магнію в кишечнику, що часто є наявним у хворих на ХП, а також у вагітних і при стресових ситуаціях [1, 6, 8]. Кальцій є важливим компонентом фізіологічного збудження секретуючих клітин (наприклад, ацинарних клітин ПЗ або секретуючих епітеліоцитів слизової оболонки шлунка). При порушенні обміну кальцію секретуюча паренхіма різних органів знаходиться в стані гіперфункції, що особливо відбивається на кислотозалежних органах, що, у свою чергу, сприяє формуванню пептичної виразки шлунка або дванадцятипалої кишки, маніфестації гострого або хронічного панкреатиту [9–12].
На сьогодні висока захворюваність на ХП осіб молодого працездатного віку, висока летальність при деструктивних формах гострого панкреатиту викликають інтерес учених до розробки нових методів діагностики і пошуку ефективних способів лікування. У зв’язку з цим актуальним і перспективним напрямом у вирішенні цієї проблеми є подальше вивчення механізмів патогенезу і формування трофологічної недостатності (зокрема, мінеральної та вітамінної недостатності) при ХП із подальшою розробкою комплексних програм їх корекції за допомогою лікувального харчування, медикаментозного і немедикаментозного лікування.
Мета роботи — лабораторне дослідження низки показників вітамінного та мінерального обміну в крові пацієнтів із ХП залежно від їх біологічного віку.
Матеріали та методи
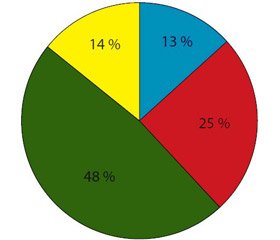
Під нашим спостереженням у період 2014–2017 рр. перебували 218 хворих на ХП віком від 18 до 72 років, які взяті на диспансерний облік в поліклінічному відділенні Одеського обласного клінічного медичного центру, в Центрі первинної медичної допомоги м. Тернополя, поліклінічному відділенні Тернопільської міської комунальної лікарні № 2. Аналіз проводився за даними медичної карти амбулаторного хворого (ф. 025/у) і медичної карти стаціонарного хворого (ф. 003/у). Розподіл усіх хворих за віком згідно з критеріями Всесвітньої організації охорони здоров’я поданий на рис. 1.
/29-1.jpg)
Дослідження мінерального обміну проводилося шляхом визначення рівня макро- і мікроелементів у сироватці крові хворих на ХП із застосуванням нижченаведених методик. Кальцій у сироватці крові визначали в реакції на іони Ca2+ при нейтральному значенні pH із арсеназо (ІІІ) кольорового комплексу (N — 2,20–2,55 ммоль/л). Неорганічний фосфор у сироватці крові визначали за допомогою біотестів Lachema в реакції фосфорної кислоти з ванадатом і молібдатом амонію з утворенням сполуки жовтого кольору та подальшою фотометрією при довжині хвилі 410 нм (N — 0,81–1,48 ммоль/л). Магній у сироватці крові (N — 0,65–1,03 ммоль/л) визначали за допомогою реакції з калмагітом, при якій утворюється кольоровий комплекс, що оцінюється фотометрично. Рівень сироваткового заліза визначали у реакції з батофенантроліном. Нормою вважали рівень 14,3–26,0 мкмоль/л і 10,7–21,5 мкмоль/л для чоловіків і жінок відповідно. Калій у сироватці крові визначали реакцією з тетрафенілборатом із утворенням каламутної суспензії, нормою вважали рівень 3,6–4,8 ммоль/л. Натрій визначали після осадження його уранілацетатом магнію. Ураніл-іони, що випали в осад, утворювали з тіогліколятом забарвлений комплекс. Концентрація натрію була пропорційна різниці між контрольною і досліджуваною пробами. Нормою вважали рівень 135–150 ммоль/л [13]. Рівень деяких мікроелементів (Cu, Zn, Pb, Cd) визначали методом атомно-адсорбційної спектрометрії (ААС), апаратом фірми Perkin Elmer, модель 603, за допомогою безелектродної газорозрядної лампи, детектор якої перетворює світловий потік у електричний сигнал, який після первинної обробки на виході ААС реєстрували як певну величину поглинання.
Головні характеристики визначення для апарата ААС фірми Perkin Elmer, модель 603 (межа визначення — сопр., лінійна робоча область — ср.обл., оптимальна довжина хвилі (д.в.)) для досліджуваних мікроелементів: кадмій: д.в. — 228,8 нм; сопр. — 0,001 мкг/мл; ср.обл. — 2 мкг/мл; мідь: д.в. — 324,8 нм; сопр. — 0,002 мкг/мл; ср.обл. — 5 мкг/мл; свинець: д.в. — 283,3 нм; сопр. — 0,01 мкг/мл; ср.обл. — 20 мкг/мл; цинк: д.в. — 213,9 нм; сопр. — 0,001 мкг/мл; ср.обл. — 1 мкг/мл [14].
Про рівень кальцитріолу 1,25(OH)2D3, активного метаболіту вітаміну D, в організмі хворих на ХП судили за рівнем 25-OHD, який є основним циркулюючим метаболітом вітаміну D і більш інформативним для визначення статусу даного вітаміну, що дає можливість діагностики гіповітамінозу. Визначали його, використовуючи імуноферментні набори «25-OHD» комерційної фірми Immundiagnostic (Німеччина). За даними фірми-виробника, нормальним вважається діапазон значень 25–125 нмоль/л.
Метод визначення ретинолу в плазмі крові ґрунтується на лужному гідролізі й екстракції ретинолу з плазми крові за допомогою органічних розчинників і подальшому спектрофотометричному вимірюванні поглинання світла розчином при довжині хвилі 328 нм. За норму вважали рівень ретинолу 1,05–2,44 мкмоль/л [14].
Метод визначення токоферолу ґрунтується на окисленні токоферолів хлорним залізом і визначенні двовалентного заліза, що утворилось у вигляді забарвленого у рожево-червоний колір комплексу з 2-2-дипіридилом. Отримані результатами оцінювали за калібрувальним графіком [14].
Результати та обговорення
Під час обстеження було констатовано, що серед усіх хворих, які увійшли до дослідження, жінок було 140 (64,2 %), чоловіків — 78 (35,8 %). Різниця за гендерною ознакою була статистично вірогідною (р < 0,001). Отриману тенденцію можна пояснити тим, що дослідження проходило в умовах поліклініки; частіше зверталися жінки середнього і літнього віку, які більше уваги приділяють своєму здоров’ю.
Для аналізу показників зовнішньосекреторної недостатності ПЗ чоловіків із ХП, які увійшли до обстеження, ми розподілили пацієнтів по вікових групах. Аналіз показав, що в групі дослідження була найбільша кількість молодих чоловіків (до 45 років), а також чоловіків працездатного віку (до 60 років — понад 92 %), що доводить надзвичайну актуальність дослідження, яке проводиться. Для жінок, на наш погляд, точнішим буде аналіз параметрів зовнішньосекреторної недостатності ПЗ (особливо стани кісткового метаболізму) в групах за станом репродуктивної функції. Розподіл поданий у табл. 1.
У групі жінок, що були обстежені, більша частина знаходилася в стані постменопаузи до 10 років (понад 50 %), а також відносилася до працездатного віку (понад 80 %). Отже, соціально-медична актуальність проблеми не викликає сумніву.
Намагаючись визначити предиктори формування вітамінної та мінеральної недостатності при ХП, ми проаналізували досліджувані показники в різних вікових групах (табл. 2 і 3).
Згідно з даними табл. 3, у міру збільшення біологічного віку хворих на ХП спостерігалося вірогідне зниження вмісту мінералів у сироватці крові хворих і в групі пацієнтів віком понад 60 років досягало рівня гіпоелементозу за показниками заліза, кальцію, магнію, міді та цинку. За рівнем цинку вірогідний гіпомікроелементоз констатували також і в групі хворих середнього віку із ХП. Накопичення токсичних речовин — свинцю і кадмію — вірогідно збільшувалося, не перевищуючи допустимих меж зі збільшенням віку хворих на ХП.
Таким чином, за даними проведеного дослідження було встановлено дисбаланс мікроелементів у всіх вікових групах хворих на ХП, який проявлявся мікроелементозом кальцію, фосфору, магнію, калію, міді, цинку, заліза до нижньої межі норми та вірогідне збільшення змісту токсичних мінералів (свинцю і кадмію) в порівнянні з таким у групі здорових людей.
Дослідження вітамінного балансу показало різного ступеня вірогідності зниження рівня вітамінів у групах хворих на ХП більш старшого віку, причому в групі хворих віком понад 60 років рівні вітамінів були нижчими за норму. Отже, в цій віковій групі констатовано вірогідний гіповітаміноз ретинолу, токоферолу і вітаміну D.
Висновки
1. У хворих на ХП у всіх вікових групах під час обстеження виявлено вірогідне (р < 0,001) зниження рівнів кальцію, фосфору, магнію, калію, міді, цинку, заліза, ретинолу, токоферолу, вітаміну D3 в сироватці крові до рівня нижньої межі норми.
2. У групі хворих віком понад 60 років констатували стан гіпомінералемії за рівнями кальцію, фосфору, магнію, калію, міді, цинку, заліза (р < 0,001), що вимагає їх корекції.
3. Зі збільшенням віку пацієнтів встановлено вірогідне підвищення в крові (р < 0,05) вмісту токсичних мінералів (свинцю і кадмію) в порівнянні з таким у групі здорових.
4. Вік хворих на ХП є предиктором мінеральної та вітамінної недостатності та накопичення токсичних мінералів (свинцю і кадмію), що необхідно враховувати під час формування комплексного лікування.
У перспективі подальших досліджень плануємо розробити програми комплексного лікування хворих на ХП залежно від віку та глибини трофологічної недостатності.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Оцінка клінічної симптоматики та загального стану хворих на хронічний панкреатит в амбулаторній практиці / Л.С. Бабінець, О.І. Криськів, Ю.В. Коваль, Ю.Я. Коцаба, Т.С. Литвинюк // Здобутки клінічної та експериментальної медицини. — Тернопіль — ТДМУ, 2011. — С. 8.
2. Бараков А.Г. Лечение больных хроническим панкреатитом в амбулаторно-поликлинических условиях / А.Г. Бараков // Эксперим. и клин. гастроэнтерол. — 2007. — № 5. — С. 71-72.
3. Machado M.A., Surjan R.C., Nishinari K. et. el. Iliac-hepatic arterial bypass for compromised collateral flow during modified Appleby operation for advanced pancreatic cancer //
Eur. J. Surg. Oncol. — 2009. — 956 p.
4. Гриневич В.Б. Проблема хронического панкреатита с позиции терапевта и хирурга / В.Б. Гриневич, Н.А. Майстренко [и др.] // Медицинский академический журнал. — 2012. — Т. 12, № 2. — С. 35-53.
5. ICD-10: international statistical classification of di–seases and related health problems: tenth revision. Geneva: World Health Organization; 2004 (http://apps.who.int/iris/handle/10665/42980, accessed 6 May 2015).
6. Губергриц Н.Б. Внешнесекреторная недостаточность поджелудочной железы: этиопатогенетические варианты и лечение / Н.Б. Губергриц // Сучасна гастроентерологія. — 2013. — № 3(13). — С. 24-32.
7. Кітура О.Є. Вплив лікування на якість життя хворих на хронічний панкреатит [Електронний ресурс] / О.Є. Кітура // Вісник проблем біології і медицини. — 2013. — Вип. 3(1). — С. 100-103. Режим доступу: http://nbuv.gov.ua/j–pdf/Vpbm_2013_3(1)__23.pdf].
8. Ettle O., Post S., Neuhaus P. et al. Adjuvant chemotherapy with gemcitabine vs observation in patients undergoing curative-intent resection of pancreatic cancer, a randomized controlled trial // Jama. — 2007. — 297. — 267-277.
9. Дронов А.И., Крючина Е.А., Добуш Р.Д. Комплексное лечение рака поджелудочной железы // Український журнал хірургії. — 2011. — № 4(13). — С. 20-24.
10. Nair R.J., Lawler L., Miller M.R. Chronic Pancreatitis // Am. Fam. Physician. — 2007. — Vol. 76, № 11. — P. 1679-1688.
11. Ishikawa O. Surgical technique, curability and postoperative quality of life in an extended pancreatectomy for adenocarcinoma of pancreas // Hepatogastroenterol. — 1996. — 43. — 320-325.
12. Alrawashdeh W., Kocher H. Pancreatic Cancer // Clin. Evid. — 2010. — 54. — 409 p.; Ramesh H. Management of pancreatic cancer: current status and future directions // Indian J. Surg. — 2010. — 72. — 285-289.
13. Клінічна біохімія: [підручник] / за заг. ред. Г.Г. Луньової. — К.: Атіка, 2013. — 1156 с.
14. Кишкун А.А. Клиническая лабораторная диагностика: [учеб. пособ.] / А.А. Кишкун. — М.: ГЭОТАР-Медиа, 2008. — 720 с.

/29-1.jpg)
/30-1.jpg)