Вступ
За останніми оцінками Всесвітньої організації охорони здоров’я (ВООЗ), більше 500 мільйонів осіб у світі мають надмірну масу тіла. Поширеність ожиріння набуває характеру епідемії [1–4]. Ця проблема торкнулася всіх верств населення незалежно від соціальної і професійної приналежності, віку, місця проживання і статі. У країнах Західної Європи, наприклад, від 10 до 20 % чоловіків і від 20 до 25 % жінок мають надмірну масу тіла або ожиріння [1, 3]. В Україні в середньому 30 % осіб працездатного віку мають ожиріння і 25 % — надлишкову масу тіла [5]. Повсюдно спостерігається зростання частоти ожиріння в дітей і підлітків [1, 6–8].
Ожиріння традиційно визначали як надмірне накопичення жиру в організмі, коли надлишок жирової маси на 15 % перевищує ідеальну масу тіла або на 10 % — максимально допустиму масу тіла. Менший надлишок жиру (< 10 %) розглядають як надлишкову масу тіла. Сьогодні під ожирінням розуміють хронічне захворювання обміну речовин, яке виявляється надлишковим розвитком жирової тканини, прогресує при природному перебігу, має певне коло ускладнень і високу ймовірність рецидиву після закінчення курсу лікування [1].
Численні спостереження і дослідження підтвердили зв’язок надмірного накопичення жирової тканини в абдомінальній ділянці з метаболічними порушеннями і ризиком розвитку артеріальної гіпертензії (АГ), цукрового діабету 2-го типу (ЦД2), атеросклеротичних захворювань. Накопичення жиру у вісцеральних депо навіть при нормальних значеннях індексу маси тіла (ІМТ), як правило, супроводжується метаболічними і гемодинамічними порушеннями, а в 40 % пацієнтів, які страждають від ішемічної хвороби серця (ІХС), знаходять вісцеральне ожиріння при нормальній масі тіла [1, 9]. Саме зв’язок ожиріння з різними метаболічними порушеннями робить його однією з найбільш важливих проблем охорони здоров’я як для розвинених країн, так і країн, що розвиваються [10].
Мета дослідження: проаналізувати динаміку показників ліпідного та вуглеводного обмінів у хворих із морбідним ожирінням (МО) до та після біліопанкреатичного шунтування в модифікації Hess — Marceau і поздовжньої резекції шлунка.
Матеріали та методи
Вибірку дослідження становили 82 пацієнти з морбідним ожирінням та супутнім метаболічним синдромом віком від 21 до 62 років (середній вік — 40,60 ± 1,09 року), які були прооперовані з даного приводу та перебували в післяопераційному періоді під спостереженням у клініці «Гарвіс», що є базою кафедри хірургії 1 ДЗ «Дніпропетровська медична академія МОЗ України», протягом від 2 до 3 та більше років після операції. Над лікувальним результатом працювала мультидисциплінарна команда співробітників медичної академії, що складалася з хірургів, анестезіологів, кардіологів та ендокринологів. Серед тематичних пацієнтів було 50 (61,0 %) жінок і 32 (39,0 %) чоловіки. Тривалість спостережень коливалась у межах 2010–2017 рр. для відібраної проспективної групи.
Ступінь ожиріння встановлювався згідно з класифікацією ВООЗ (1997 р.). ІМТ визначався за формулою: ІМТ (кг/м2) = маса тіла (кг)/зріст (м2); ідеальна маса тіла — за міжнародною таблицею Metropolitan Height and Weight Tables, Converted to Metric System (1983 р.); відсоток втрати надлишкової маси тіла (%EWL) — за формулою: %EWL = (втрачена маса тіла (кг)/надлишкова маса тіла (кг)) × 100 %.
Із загальної кількості хворих, які спостерігалися, сформовано дві клінічні групи спостереження залежно від методу хірургічного лікування, який був у них застосований залежно від показників маси тіла напередодні оперативного лікування. І клінічну групу становили 30 (36,6 %) хворих із БПШ у модифікації Hess — Marceau; ІІ групу — 52 (63,4 %) пацієнти з поздовжньою резекцією шлунка. У І групі було 9 (30,0 %) чоловіків і 21 (70,0 %) жінка, у ІІ групі — 23 (44,2 %) і 29 (55,8 %) відповідно (р = 0,203 між групами за критерієм χ2). Середній вік пацієнтів І групи становив 37,90 ± 1,79 року, у ІІ групі — 42,20 ± 1,34 року (р = 0,056 за t-критерієм). Тобто обидві клінічні групи були статистично порівнянними (р > 0,05) за статтю і віком пацієнтів, що доводило їх однорідність за цими характеристиками.
Обстеження хворих проводилось за умови отримання усного поінформованого погодження пацієнтів на базі мережі лабораторій «ДІЛА» (сертифікована згідно з вимогами міжнародних стандартів ISO 9001:2008 та ISO 15189:2007; ліцензія МОЗ України АВ №447607 від 12.02.2009 р. та АД № 063597 від 02.08.2012 р.; свідоцтво про атестацію № ПТ-0275/06 від 28.07.2006 р. та № ПТ-274/11 від 01.08.2011 р.). У різної кількості хворих в обох групах протягом терміну спостереження проводили визначення характеристик ліпідного та вуглеводного обміну із застосуванням загальних практичних та клінічних методів. Окрім дослідження рівня тригліцеридів (ТГ) та загального холестерину (ЗХС), визначали фракцій холестерину: ліпопротеїди низької щільності (ХС ЛПНЩ), ліпопротеїди дуже низької щільності (ХС ЛПДНЩ) і ліпопротеїди високої щільності (ХС ЛПВЩ), що розрізняються за складом і функціями, а також аполіпопротеїну А і В (АпоЛП А і В). Стан вуглеводного обміну визначали за рівнями: інсуліну та С-пептиду за допомогою імуноферментних методів (ІФА), глікозильованого гемоглобіну; додатково за допомогою ІФА-методів визначали рівень лептину. Обов’язковим було проведення тесту толерантності до глюкози.
Оцінку результатів зниження маси тіла, зміни з боку маркерів ліпідного та вуглеводного обміну проводили в динаміці спостереження — при першому візиті на етапі передопераційної підготовки, через 3, 6, 12, 18, 24 і 36 місяців після оперативного втручання.
Статистичну обробку матеріалів дослідження здійснювали з використанням методів біостатистики [11], реалізованих у ліцензованому пакеті програм Statistica v.6.1® (Statsoft Inc., США). Перевірку відповідності розподілу кількісних даних нормальному закону проводили за критеріями Колмогорова — Смірнова з поправкою Лілієфорса. У випадках нормального закону розподілу статистичні характеристики подані як середня арифметична (М), її стандартна похибка (± m), 95% довірчий інтервал (95% ДІ) і коефіцієнт варіації (С), в інших випадках — у вигляді медіани (Ме) та інтерквартильного розмаху (25-й; 75-й перцентилі). Для порівняння, у різних групах у динаміці спостереження використовували параметричні і непараметричні критерії: Стьюдента для незв’язаних (t) і зв’язаних (Т) вибірок, Манна — Уїтні (U), Вілкоксона (W). Порівняння відносних показників проводилось за критерієм хі-квадрат Пірсона (c2) і двостороннім точним критерієм Фішера. Взаємозв’язок між ознаками оцінювався за коефіцієнтами рангової кореляції Спірмена (rs). Критичне значення рівня значущості (р) приймалося < 0,05, тенденцію визначали при р < 0,1.
Результати та обговорення
На початку дослідження 42 пацієнти (51,2 %) мали ІМТ понад 45 кг/м2: 21 (65,6 %) чоловік та 21 (42,0 %) жінка (р = 0,037 за критерієм χ2). Показник ІМТ у чоловіків коливався від 35,5 до 85,9 кг/м2 і в середньому становив (51,40 ± 1,97) кг/м2, тоді як у жінок ІМТ змінювався від 30,7 до 62,1 кг/м2 і в середньому становив (44,20 ± 0,99) кг/м2 (p = 0,002 за t-критерієм). При цьому сформовані за видом операції клінічні групи здебільшого вірогідно відрізнялись за показниками МО (від p < 0,05 до p < 0,01) (табл. 1).
/46-1.jpg)
Сьогодні прийнято вважати, що в основі розвитку метаболічних проблем у пацієнтів з ожирінням лежать два феномени: інсулінорезистентність (ІР) і ліпотоксичність (ЛТ) [10, 12, 13]. Однак існують на сьогодні певні проблеми в трактуванні вищеописаних феноменів. Деякі пацієнти з МО не мають метаболічних порушень, у тому числі МС, а у пацієнтів із дефіцитом маси тіла та ліподистрофією може розвиватися тяжка ІР. На підставі гіпотези про обмежену здатність жирової тканини до експансії можна пояснити феномен масивного ожиріння, що не супроводжується тривалий час метаболічними ускладненнями. Коли жирова тканина втрачає здатність утримувати ліпіди для запобігання їх ектопії в інші органи, тип ліпідів стає більш важливим, ніж їх надмірна кількість [10, 12, 13]. Ідентифікація ліпідних спектрів, специфічних для кожного органа, — це ключова інформація для розробки специфічних терапевтичних втручань. Специфічні ліпотоксичні зразки можуть бути ранніми і дуже точними метаболічними біомаркерами [14, 15]. Звертаючи увагу на той факт, що існує концепція, яка враховує значення специфічних типів ліпідів у розвитку метаболічних порушень у печінці, зокрема резистентності до інсуліну, напередодні оперативного лікування вивчали ліпідний статус (табл. 2).
Морбідне ожиріння призводило до дисліпідемічних проявів у 100 % випадків, що не асоціювалися зі статтю пацієнта, та доводило той факт, що в разі досягнення ІМТ значення ≥ 35 кг/м2 статеві розбіжності за віком між показниками дисліпідемії зникають.
У половини пацієнтів обох груп (55,7 %) рівень у крові ЗХС перевищував показники норми (< 5 ммоль/л), досягаючи в окремих випадках 8,3 ммоль/л. Аналогічні тенденції визначались при аналізі рівнів ХС ЛПНЩ і ХС ЛПДНЩ — 56,5 і 40,3 % пацієнтів відповідно мали високі показники з максимальними значеннями 5,57 і 2,22 ммоль/л. Рівень ТГ у пацієнтів тематичних груп також у третині випадків (39,1 %) перевищував норму (< 1,7 ммоль/л), характеризувався значною варіабельністю (від 0,61 до 4,91 ммоль/л, коефіцієнт варіації С = 56,1 %) і в середньому дорівнював 1,78 ± 0,12 ммоль/л. Вірогідних розбіжностей між клінічними групами за середніми показниками ЗХС, ХС ЛПНЩ, ХС ЛПДНЩ, ТГ та АпоЛП А і В напередодні проведення оперативного лікування не відзначено (p > 0,05 при усіх порівняннях між групами). Дисліпідемічні порушення у хворих із МО вірогідно корелювали з показниками надлишкової маси тіла: для ЗХС коефіцієнт кореляції rs = 0,274 (p < 0,05), для ТГ — rs = 0,291 (p < 0,05), для ХС ЛПНЩ — rs = 0,283 (p < 0,05), для ХС ЛПДНЩ — rs = 0,339 (p < 0,05), для ХС ЛПВЩ — rs = –0,390 (p < 0,01).
При ожирінні відбувається зниження утилізації глюкози периферичними тканинами, підвищується продукція глюкози печінкою, що сприяє розвитку гіперглікемії. Ожиріння є головною причиною розвитку ЦД2 [1, 16, 17] у 85–90 % хворих на діабет. Зростання захворюваності на ЦД2 зазначається практично повсюдно [1, 18–20]: менше ніж за 20 років число хворих на ЦД2 у світі збільшилося в 6 разів. Сьогодні гіперглікемію взагалі і натщесерце зокрема розглядають як найважливішу ланку патогенезу ЦД2, фактор ризику розвитку атеросклерозу і як самостійне явище, що перешкоджає досягненню компенсації даного захворювання [1, 21, 22].
Ураховуючи приналежність усіх пацієнтів до групи ризику щодо виникнення порушень вуглеводного обміну, було проведено тест толерантності до глюкози (табл. 3), результати якого свідчать про коливання вихідних середніх показників на верхній межі норми.
Рівень лептину, що є індикатором запасу енергії та медіатором балансу енергії, напередодні оперативного лікування в пацієнтів І клінічної групи коливався від 24,5 до 101,0 нг/мл та в середньому становив (57,90 ± 4,75) (95% ДІ 48,2–67,6) нг/мл, а в ІІ клінічній групі він варіював від 8,42 до 101 нг/мл, у середньому — (39,70 ± 3,33) (95% ДІ 32,9–46,5) нг/мл з р = 0,002 між групами за t-критерієм. При цьому встановлені прямі взаємозв’язки рівня лептину з початковими рівнями ІМТ (rs = 0,295; р < 0,05) і надлишковою масою тіла (rs = 0,279; р < 0,05).
Результати поглибленого дослідження показників вуглеводного обміну напередодні оперативного лікування свідчили про наявність істотної взаємозалежності рівнів С-пептиду, інсуліну і глюкози в крові від ІМТ пацієнтів: для середнього рівня глюкози коефіцієнт кореляції становив rs = 0,260 (p < 0,05), для концентрації інсуліну — rs = 0,464 (p < 0,001), для С-пептиду — rs = 0,340 (p < 0,01).
На початку дослідження 42 (62,7 %) пацієнти обох груп, які були поглиблено досліджені, мали високі рівні С-пептиду (> 3,85 нг/мл), у тому числі 24 (80,0 %) пацієнти І клінічної групи і 18 (48,6 %) — ІІ групи (р = 0,008 за критерієм χ2), із максимальними значеннями 15,9 і 11,4 нг/мл.
Для баріатричних пацієнтів був розроблений раціон харчування в післяопераційному періоді, який містив від 1,0 до 1,5 г білка на 1 кг ідеальної маси тіла на добу. Рекомендували сироватковий протеїн, казеїн, яєчний білок, ізольовані соєві білки, а також пшеничний протеїн, які є джерелом лейцину, із розрахунку приблизно 10 г/добу. Розподіл білкової їжі протягом дня був рівномірним, при цьому вміст жиру в білкових продуктах був мінімальним. У пацієнтів із БПШ призначали замісну терапію, що включала обов’язкове щоденне вживання в їжу достатньої кількості страв, які містять білки, жиророзчинні вітаміни, препарати кальцію в дозі 2 г на добу та препарати сульфату заліза в дозі 256 мг. Потрапляння жиру не тільки обмежували, а й слідкували за якістю жиру, що потрапляє до організму. Пріоритетним було вживання ненасичених жирних кислот, а саме олії: льняної, ріпакової, оливкової, соєвої та масла виноградних кісточок, замість традиційних соняшникової та кукурудзяної. Було знижено в раціоні частку швидких вуглеводів, що сприяло більш значущій втраті ваги. Хворі отримували близько 14 г клітковини на кожну 1000 споживаних кілокалорій, а загальне потрапляння енергії від вуглеводів не перебільшувало 40–45 % добового калоражу.
Аналіз динаміки показників МО протягом 3 років після оперативного лікування показав загальні тенденції до вірогідного (від p < 0,01 до p < 0,001) зменшення показників маси тіла та ІМТ у пацієнтів усіх клінічних груп вже через 3 місяці від початку лікування.
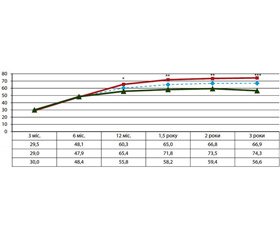
Загалом втрати надлишкової маси тіла в пацієнтів із МО зросли з 29,5 % через 3 міс. після операції до 66,9 % упродовж 3 років спостереження з найбільшими показниками в пацієнтів із комбінованою методикою БПШ (до 74,3 %) (рис. 1).
Незалежно від вихідної маси тіла покращання показників ліпідного обміну в тематичних хворих наставало вже через 3 місяці після оперативного лікування (табл. 5), що доводило обґрунтованість вибору виду оперативного втручання залежно від показника вихідного ІМТ пацієнта із МО.
За результатами дослідження виявлено зниження рівнів загального холестерину з (5,47 ± 0,19) ммоль/л (95% ДІ 5,09–5,85) напередодні оперативного лікування до (3,53 ± 0,08) ммоль/л (95% ДІ 3,36–3,70) через 2 роки після баріатричного втручання в І групі та з (5,38 ± 0,14) ммоль/л (95% ДІ 5,10–5,67) до (3,73 ± 0,11) ммоль/л (95% ДІ 3,51–3,96) — в II; ліпо–протеїдів низької щільності — з (3,14 ± 0,10) ммоль/л (95% ДІ 2,95–3,34) до (1,99 ± 0,07) ммоль/л (95% ДІ 1,84–2,14) та з (3,35 ± 0,13) ммоль/л (95% ДІ 3,08–3,62) до (1,91 ± 0,06) ммоль/л (95% ДІ 1,78–2,03) по групах відповідно з р < 0,001.
Через 2 роки після оперативного лікування ожиріння середній рівень лептину в пацієнтів І групи знизився в середньому на 84 % з коливаннями від 1,83 до 21,34 нг/мл та в середньому становив (9,27 ± 0,59) (95% ДІ 8,06–10,48) нг/мл. В ІІ клінічній групі відповідні зміни становили 76,2 % із середнім рівнем (9,43 ± 0,46) (95% ДІ 8,49–10,38) нг/мл (р < 0,001 за t-критерієм) без вірогідних розбіжностей між групами дослідження (р = 0,831 за t-критерієм).
Наприкінці 2 років показники рівня С-пептиду в крові не перевищували межі норми, а медіана в пацієнтів І клінічної групи зменшилась на 65,7 % (p < 0,001), у ІІ групі — на 61,9 % (p < 0,001). Показники рівня інсуліну також через 2 роки досягли норми (табл. 6).
Слід відзначити наявність вірогідних взаємозв’язків між вмістом лептину в крові і показниками МО, вуглеводного та ліпідного обміну в пацієнтів із МО через 1,5–2 роки після оперативного лікування, а саме з ІМТ (rs = 0,270, p < 0,05), ТГ (rs = 0,424, p < 0,001), ХС ЛПНЩ (rs = 0,275, p < 0,05), ХС ЛПВЩ (rs = –0,295, p < 0,05), АпоЛП В (rs = 0,384, p < 0,01), інсуліном (rs = 0,265, p < 0,05), глюкозою (rs = 0,365, p < 0,01). Отримані результати пояснюються функціями лептину, дія якого при ожирінні становиться агресивнішою.
Таким чином, слід розуміти, що терапія ожиріння, як і будь-якого хронічного захворювання, — процес довічний, і тільки спільними зусиллями лікаря і пацієнта можна досягти позитивного результату, причому основна відповідальність за лікування покладається на самого хворого. У пацієнтів з МО через 1,5–2 роки після проведення баріатричних операцій різними способами відзначено нормалізацію показників ліпідного та вуглеводного обміну, що дозолило значно знизити, а потім іноді навіть відмовитися від застосування препаратів, спрямованих на нормалізацію тригерів МС.
Висновки
1. Результати дослідження ліпідограми свідчили про наявність суттєвих порушень процесів ліпідного обміну у хворих із МО до проведення оперативного лікування. Дисліпідемічні порушення у хворих із МО вірогідно корелювали з показниками надлишкової маси тіла: для ЗХС коефіцієнт кореляції дорівнював rs = 0,274 (p < 0,05), для ТГ — rs = 0,291 (p < 0,05), для ХС ЛПНЩ — rs = 0,283 (p < 0,05), для ХС ЛПДНЩ — rs = 0,339 (p < 0,05), для ХС ЛПВЩ — rs = –0,390 (p < 0,01).
2. Результати дослідження показників вуглеводного обміну напередодні оперативного лікування свідчили про наявність істотної взаємозалежності рівнів С-пептиду, інсуліну і глюкози в крові від ІМТ пацієнтів: для середнього рівня глюкози коефіцієнт кореляції становив rs = 0,260 (p < 0,05), для концентрації інсуліну — rs = 0,464 (p < 0,001), для С-пептиду — rs = 0,340 (p < 0,01). Установлені прямі взаємозв’язки рівня лептину з початковими рівнями ІМТ (rs = 0,295; р < 0,05) і надлишкової маси тіла (rs = 0,279; р < 0,05).
3. У динаміці дослідження встановлено тенденції до нормалізації показників ліпідного та вуглеводного обмінів у пацієнтів обох груп упродовж 2 років після баріатричного втручання з найбільшими змінами в групі після БПШ вже після 3 та 6 місяців. Через 1 рік спостереження подібні тенденції в нормалізації показників зберігалися в значеннях загального холестерину, ХС ЛПВЩ, ЛПНЩ. У змінах показників вуглеводного обміну вірогідні тенденції в ці терміни не спостерігалися. У наступні терміни спостереження (через 1, 1,5 і 2 роки) подібні розбіжності з початковим рівнем у пацієнтів обох груп зникали (p > 0,05 при усіх порівняннях).
Конфлікт інтересів. Дослідження проведено в рамках науково-дослідної роботи кафедри хірургії 1 Державного закладу «Дніпропетровська медична академія МОЗ України» «Обґрунтування системного підходу до хірургічного лікування хворих на морбідне ожиріння і супутній метаболічний синдром» (№ державної реєстрації 0113U006621), термін виконання — 01.01.13–31.12.17, та не має комерційної або іншої зацікавленості фізичних та юридичних осіб. Автори заявляють про відсутність конфлікту інтересів при підготовці статті.
Список литературы
1. Федорова Е.Ю. Механизмы прогрессирования поражения почек при ожирении / Е.Ю. Федорова, И.М. Кутырина // Нефрология и диализ. — 2006. — № 2. — С. 102-111.
2. Бутрова С.А. Висцеральное ожирение — ключевое звено метаболического синдрома / С.А. Бутрова, Ф.Х. Дзгоева // Ожирение и метаболизм. — 2010. — № 1. — С. 10-16.
3. Buckland Y. The obesity epidemic / Y. Buckland // J. Fam. Heaith Care. — 2002. — Vol. 12(4). — P. 111.
4. Labib M. The investigation and management of obesity /
M. Labib // Journal of Clinical Pathology. — 2003. — Vol. 56. —
P. 17-25.
5. Возможности хирургической коррекции метаболического синдрома у больных ожирением / А.С. Лаврик, А.С. Тывончук, Н.В. Манойло и др. // Сучасні медичні технології. — 2013. — № 3. — С. 98-101.
6. The global childhood obesity epidemic and the association between socio-economic status and childhood obesity / Wang Y.,
Lim H. // Int. Rev. Psychiatry. — 2012. — Vol. 24(3). —
P. 176-188. doi: 10.3109/09540261.2012.688195.
7. Петеркова В.А. Ожирение в детском возрасте /
В.А. Петеркова, О.В. Ремизов // Ожирение и метаболизм. — 2004. — № 1. — С. 17-23.
8. Livingstoun B. Epidemiology of childhood obesity in Europe /
B. Livingstoun // Eur. J. Pediatr. — 2000. — Vol. 159 (Suppl. 1). —
P. 14-34.
9. Десперс Ж.-П. Оптимальное предупреждение коронарного риска у больных с висцеральным ожирением и дислипидемией / 10th European Congress on Obesity, May 2000 // Ожирение. Актуальные вопросы. — 2001. — № 5. — С. 6-8.
10. Ивашкин В.Т. Липотоксичность и метаболические нарушения при ожирении / В.Т. Ивашкин, М.В. Маевская // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2010. — № 1. — С. 4-13.
11. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ Statistica / О.Ю. Реброва — М.: Медиа Сфера, 2002. — 312 с. — ISBN: 5-89084-013-4.
12. Dynamics of fat cell turnover in humans / K.L. Spalding, E. Arner, P.O. Westermark et al. // Nature. — 2008. —
Vol. 453(7196). — P. 783-787. doi: 10.1038/nature06902.
13. Meritxell R. Role of nuclear receptor corepressor RIP140 in metabolic syndrome / Meritxell R., Marius C.J., Malcolm G.P. // Biochim. Biophys. Acta. — 2011. — Vol. 1812, № 8. — P. 919-928. doi: 10.1016/j.bbadis.2010.12.016.
14. Modes-of-Action Related to Repeated Dose Toxicity: Tissue-Specific Biological Roles of PPARγ Ligand-Dependent Dysregulation in Nonalcoholic Fatty Liver Disease / Merilin Al Sharif, Petko Alov, Vessela Vitcheva et al. // PPAR Res. — 2014. — P. 432647. doi: 10.1155/2014/432647.
15. Current state of the art in repeated dose systemic toxicity testing / Prieto P., Testai E., Cronin M. et al. // Towards the Replacement of In Vivo Repeated Dose Systemic Toxicity Testing. — 2011. — Vol. 1. — P. 38-46. doi: 10.1007/s00204-011-0798-7.
16. Аметов А.С. Управление гипергликемией при остром коронарном синдроме. Проблемы и решения / А.С. Аметов, Я.В. Пуговкина, Н.А. Черникова // Медицинский совет. — 2010. — № 3. — С. 98-104. doi: 10.21518/2079-701X-2016-3-98-105.
17. Аметов А.С. Факторы риска сахарного диабета. Роль ожирения / А.С. Аметов // Русский медицинский журнал. — 2003. — Т. 11, № 27. — С. 1477-1480.
18. Дедов И.И Эпидемиология сахарного диабета /
И.И. Дедов, Ю.И. Сунцов, С.В. Кудрякова // Сахарный диабет: Руководство для врачей. — М.: Универсум паблишинг, 2003. — С. 75-93.
19. Metabolic syndrome with and without C-peptid protein as a predictor of coronary heart disease and diabetes in the West of Scotland Coronary Prevention Study / Sattar N., Gaw A., Scherbakova O.
et al. // Circulation. — 2003. — Vol. 108. — P. 414-419.
20. Дедов И.И. Патогенетические аспекты ожирения / И.И. Дедов, Г.А. Мельниченко, Т.И. Романцова // Ожирение и метаболизм. — 2004. — № 1. — С. 3-9.
21. Дедов И.И. Морбидное ожирение / под ред. И.И. Дедова — М.: МИА, 2014. — 608 с. — ISBN: 978-5-9986-0171-2.
22. Маколкин В.И. Метаболический синдром / Маколкин В.И. — М.: Мед. информ. агентство, 2010. — 142 с. — ISBN: 978-5-8948-1803-0.

/46-1.jpg)
/47-1.jpg)
/51-1.jpg)
/48-1.jpg)
/49-1.jpg)
/50-1.jpg)