Портальна гіпертензія є наслідком підвищеного опору кровотоку у воротній вені, обумовленого надпечінковими, внутрішньопечінковими і підпечінковими факторами. Внутрішньопечінкові фактори, зі свого боку, ділять на пресинусоїдні, синусоїдні і постсинусоїдні. Найбільш поширеними у світі серед причин розвитку портальної гіпертензії є цироз та шистосомоз. Якщо за відсутності цирозу конкретна причина портальної гіпертензії не визначена, захворювання визначають як ідіопатичну нециротичну портальну гіпертензію (ІНЦПГ) [1].
Хоча ІНЦПГ відома вже понад сто років, медична спільнота часто трактує захворювання помилково. Наукові дані про ІНЦПГ обмежені у зв’язку з недостатньою клінічною та гістопатологічною діагностикою, а також внаслідок відсутності стандартизованої термінології і критеріїв діагностики. Сучасні морфологічні дослідження дозволили отримати більш глибоке розуміння ІНЦПГ, продемонструвавши її широкий гістологічний спектр та часті кореляції з іншими системними захворюваннями. Більше того, під час цих досліджень виявилося, що різноманітні морфологічні форми різних діагнозів, наприклад печінково-портальний склероз, часткова вузлова трансформація, неповний септальний цироз і вузлова регенеративна гіперплазія, в дійсності означають тимчасову, стадійну і просторову гетерогенність одного стану, головною ланкою в патогенезі якого є облітеруюча портальна венопатія [2–7].
Шаутен і співавтори запропонували використовувати ІНЦПГ як уніфікований діагностичний термін, щоб позначити різні гістопатологічні форми, які проявляються у вигляді портальної гіпертензії без цирозу, в клінічній термінології [6].
Стандартизація термінології не тільки буде сприяти підвищенню рівня медичного обслуговування, але також забезпечить обмін знаннями та проведення спільних досліджень, на підставі яких у подальшому будуть розроблені терапевтичні і діагностичні алгоритми та керівництва.
Азіатсько-Тихоокеанська асоціація досліджень печінки (APASL) визначає ІНЦПГ (іменована як «нециротичний портальний фіброз»/ідіопатична портальна гіпертензія) як «захворювання неясної етіології, що характеризується перипортальним фіброзом із залученням малих і середніх гілок ворітної вени, що призводить до розвитку портальної гіпертензії» [7].
У роботах вчених відсутнє належне описання даного захворювання, що також не має загальноприйнятого визначення, що обумовлено, можливо, його рідкістю. Як правило, це захворювання вважають клінічною формою внутрішньопечінкової портальної гіпертензії без виражених ознак цирозу або інших захворювань печінки, які можуть стати причиною портальної гіпертензії і вісцерального венозного тромбозу [1, 4, 8, 9].
Діагноз ІНЦПГ установлюють пацієнтам із портальною гіпертензією після виключення тромбозу ворітної вени, синдрому Бадда — Кіарі, тромбозу селезінкових вен і інших захворювань печінки, що можуть проявлятися у вигляді портальної гіпертензії, з наступним підтвердженням за допомогою біопсії печінки [1]. У клініці частіше аналізуються декілька захворювань чи їх комбінація, що можуть бути пов’язані з ІНЦПГ: хронічні інфекції, імунологічні та тромботичні розлади, генетична схильність, дія ліків та токсинів. Оскільки ІНЦПГ — це діагноз виключення, клініцисти і патоморфологи стикаються з низкою проблем, а багато пацієнтів отримують діагноз «передбачуваний цироз» чи «ісход у цироз» [1, 10].
Отже, резюмуючи літературні джерела, з початком ІНЦПГ пов’язують [11]:
1) збільшений портальний венозний кровотік:
— артеріовенозна фістула (хвороба Рандю — Ослера, травма, біопсія печінки, гепатоцелюлярна карцинома);
— спленомегалія, не пов’язана із захворюваннями печінки (поліцитемія, мієлофіброз, хвороба Гоше, лейкоз, мієлоїдна метаплазія);
2) захворювання печінки:
— гострі: алкогольний гепатит; алкогольна жирова дистрофія печінки; фульмінантний вірусний гепатит;
— хронічні: алкогольні захворювання печінки; хронічний активний гепатит; хвороба Вільсона — Коновалова; вірусний цироз печінки; гемохроматоз; недостатність α1-АТ; кістозний фіброз; захворювання печінки, викликані миш’яком, вінілхлоридом, солями міді, лікарськими препаратами; вроджений фіброз печінки; гранулематози (шистосомоз, саркоїдоз, туберкульоз); метапластична карцинома;
3) захворювання печінкових венул та вен й нижньої порожнистої вени:
— венооклюзійна хвороба;
— тромбоз нижньої порожнистої вени;
4) захворювання серця:
— кардіоміопатія;
— захворювання серця з ураженням клапанів;
— констриктивний перикардит;
5) імунологічні розлади;
6) генетичну схильність.
У більшої частини пацієнтів із ІНЦПГ етіологія захворювання так і не була встановлена.
Проте ІНЦПГ, за даними зарубіжних публікацій, виявляють досить часто при різних імунологічних захворюваннях, включаючи системний червоний вовчак, тяжку міастенію, системний склероз, глютенову хворобу, тиреоїдит, ревматоїдний артрит, хворобу Крона, синдром Фелті, синдром Шегрена, автоімунний гепатит, первинний біліарний цироз печінки, варіабельний некласифікований імунодефіцит і гіпергаммаглобулінемію, що дозволяє припустити з високою часткою ймовірності імунологічний характер етіології [9–19]. Однак імунологічна природа вимагає більш детального морфологічного спостереження та аналізу.
В дослідженні японських учених показано, що близько 70 % жінок, які страждають від ІНЦПГ, мають антитіла проти ДНК, а 24 і 21,5 % — мають відповідно антиядерні й антимікросомні антитіла [7, 15]. Аналогічно підвищена захворюваність на гломерулонефрит й утворення імунних комплексів зазначалися в пацієнтів з ІНЦПГ після спленоренального шунтування порівняно з тими, у кого печінка була в нормі [17–20]. Одним з імовірних механізмів є дисбаланс кількох імуноглобулінів або цитокінів, що також може призводити до мікротромбозу, активувати фіброгенез.
Більш висока зустрічальність ІНЦПГ відзначається в більш низьких соціально-економічних групах, і результати експериментальних досліджень на тваринах свідчать на користь інфекційної етіології [1, 9, 17, 20]. Так, у західних країнах ІНЦПГ особливо часто діагностується в пацієнтів із вірусом імунодефіциту людини (ВІЛ) [10–15]. У більш ранніх дослідженнях стверджувалося, що використання диданозину, антивірусного препарату класу інгібіторів оберненої транскриптази з потенціалом мітохондріальної токсичності, може провокувати розвиток ІНЦПГ [18–20]. Однак нещодавнє багатоцентрове дослідження методом «випадок — контроль» продемонструвало, що деякі з цих пацієнтів мали генетичну схильність до розвитку даного стану [21]. У цьому дослідженні встановлено, що в субпопуляції пацієнтів із ВІЛ, які приймали диданозин і у яких потім виявили ІНЦПГ, часто зустрічаються чотири специфічні поліморфізми з одним нуклеотидом (ПОН) у двох генах, що кодують ферменти метаболізму пуринів. Більше того, кумулятивний ризик розвитку ІНЦПГ прийнятий на рівні 100 % за наявності всіх чотирьох ПОН. Навпаки, пряме пошкодження синусоїдальних ендотеліальних клітин, що зумовлене вірусами, може призвести до розвитку ІНЦПГ у пацієнтів із ВІЛ [4]. З цього визначити точну причину розвитку ІНЦПГ у пацієнтів із ВІЛ досить складно. Так само привертає увагу те, що більшість хворих були чоловіки із середнім інтервалом між установленням діагнозу ВІЛ та ІНЦПГ 15 років і більше. Крім прийому диданозину пацієнтами з ВІЛ, розвиток ІНЦПГ може бути пов’язаний із впливом різних медикаментів, хімікатів і токсинів [9–17]. Адже, як правило, пацієнти цієї групи прий–мають від 3 до 15 медичних препаратів.
Розвиток ІНЦПГ у пацієнтів із вродженими захворюваннями, що включає синдром Адамса — Олівера, синдром Тернера, дефіцит фосфоманнозоізомерази, а також спадкова захворюваність на ІНЦПГ говорять про певний фактор у генетичній будові цих пацієнтів, що обумовлює їх схильність до ІНЦПГ. У дослідженні, предметом якого стали чотири сім’ї, в яких зафіксована ІНЦПГ, шість із семи членів (85,5 %) із ІНЦПГ демонстрували позитивну реакцію на антигени HLA-DR3 [18].
І нарешті, точно встановлено зв’язок гіперкоагуляції і ІНЦПГ. Повідомлялося, що до 54 % пацієнтів з ІНЦПГ страждають від тромбофлебіту, при цьому тромбоз ворітної вени виявлявся досить часто [4, 20]. Крім того, деякі з характерних гістологічних характеристик ІНЦПГ, такі як облітерація і м’язова гіпертрофія гілок ворітної вени, можна пояснити попереднім/стійким епізодом тромбоемболії. Тромбозні зміни у ворітних венах та їх великих гілках також відзначалися при розтині в пацієнтів з ІНЦПГ [2].
У пацієнтів із ВІЛ відзначався придбаний дефіцит протеїну S, що призводило до виникнення тромбофілії і ІНЦПГ [4], при цьому передбачалося, що свою роль відіграла саме гіперкоагуляція. Аналогічно результати біопсії печінки в пацієнтів із первинним тромбозом ворітної вени без цирозу часто показують наявність флебосклерозу і УРГ [15, 18]. З огляду на зв’язок між ІНЦПГ та гіперкоагуляцією для лікування ІНЦПГ можна використовувати терапію антикоагулянтами [4].
Досить частою причиною портальної гіпертензії в країнах Африки, Азії та Латинської Америки є шистосомоз (фіброз Симмерса). Сьогодні шистосомоз набуває досить актуальне значення і для жителів України. Слід урахувати те, що активно розвиваються туристичні поїздки, активна міграція населення і що шистосоми живуть в організмі людини кілька десятків років. За даними Всесвітньої організації охорони здоров’я, 85 % із 207 мільйонів людей, інфікованих шистосомозом, проживають в Африці. Треба відзначити, що найбільш яскравий і тяжкий перебіг шистосомозу відзначається не в місцевого населення, а в туристів.
Шистосоми або кров’янисті сисуни — різностатеві трематоди розміром 4–20 мм. Проникаючи через стінки кровоносних судин, яйця скупчуються в просвіті сечового міхура і кишечника й виділяються назовні. При попаданні личинок у водойму відбувається їх розвиток у молюсках. Потім личинки залишають проміжного господаря й активно проникають через шкіру в тіло людини, наприклад, під час купання або при питті зараженої води. Потім личинки мігрують по лімфатичних і кровоносних судинах, досягають легенів, звідси потрапляють у велике коло кровообігу, а потім осідають в органах. Тут вони досягають статевої зрілості і починають виділяти яйця. Доросла самка відкладає в добу від 300 до 3000 яєць, які розносяться з током крові й осідають у багатьох органах і тканинах, провокуючи формування гранулематозного запалення. Частина яєць, виділених із калом і сечею, потрапляючи у воду, вивільняє мірацидії, які інфікують равликів. Мірацидії в равликах перетворюються в цекарій, які повторно інфікують людину.
Пошкодження печінки спостерігаються при гострому і хронічному шистосомозі. Хронічний перебіг захворювання супроводжується розвитком портальної гіпертензії на тлі перипортального фіброзу, пресинусоїдальної гіпертензії, обумовлених локальною запальною реакцією на яйця паразита.
Діагностика заснована на даних епідеміологічного анамнезу, виявленні в калі і сечі яєць паразитів, даних позитивного специфічного імуноферментного аналізу крові, біопсії печінки.
Вроджений фіброз печінки — спадкове захворювання, що виявляється у віці 10–30 років, у 75 % хворих клінічні симптоми з’являються у віці 2–14 років, в 30 % випадків поєднується з вродженими дефектами розвитку нирок. При вродженому фіброзі печінки причиною портальної гіпертензії, ймовірно, є недостатня кількість термінальних гілок ворітної вени, що обумовлена фіброзом портальних зон.
Середня тривалість життя хворих — близько 19 місяців. Пацієнти з ІНЦПГ зазвичай демонструють ознаки і симптоми, викликані ускладненнями портальної гіпертензії, включаючи варикозну кровотечу у верхніх відділах шлунково-кишкового тракту, спленомегалію і гіперспленізм (анемія, тромбоцитопенія і лейкопенія). Градієнт венозного тиску в печінковій вені, різниця між тиском заклинювання в печінковій вені і вільним тиском у печінковій вені значно нижчі при ІНЦПГ, ніж при цирозі, і можуть бути нормальними або злегка підвищеними. Але тиск у ворітних венах істотно підвищений. Ці ознаки характерні для пресинусоїдальної портальної гіпертензії [4, 5]. Варикозне розширення аноректальних вен також часто зустрічається при ІНЦПГ, але при цьому кровотеча з таких вен спостерігається не часто [5]. Рідше можуть відмічатися асцит, енцефалопатія, гепаторенальний синдром і жовтяниця, у деяких пацієнтів розвивається тромбоз позапечінкових ворітних вен [14–20]. Рівні ферментів печінки в нормі або можуть бути злегка змінені; зміна рівнів окремих ферментів печінки фіксується у 20 % пацієнтів з ІНЦПГ [16–18]. Синтетична функція печінки, як правило, зберігається; в окремих випадках спостерігається її порушення, що вимагає трансплантації печінки [1, 7, 22].
При ультразвуковому дослідженні можуть візуалізуватися вузлові ущільнення на поверхні печінки і потовщення стінки ворітної вени [2]. Під час комп’ютерної та магнітно-резонансної томографії можна побачити ознаки портальної гіпертензії, тромбозу позапечінкових вен, аномалії внутрішньопечінкових ворітних вен, вузлові утворення по контуру печінки і гіпертрофію хвостової частини з атрофією сегмента IV. Дві останні ознаки найбільш часто зустрічаються при цирозі [9].
При вимірах за допомогою еластографії середній показник еластичності печінки при ІНЦПГ нижчий, ніж при цирозі.
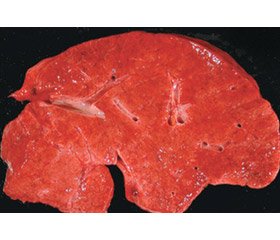
Макроскопічна картина печінки гетерогенна, може бути нормальною, збільшеною, атрофічною, поверхня гладка, з вузловими ущільненнями (рис. 1). Можливі субкапсулярна септація, випуклість портальних трактів біля поверхні, цироз ворітної вени з формуванням тромбів або без нього. У деяких хворих спостерігалась відносна гіпертрофія правої й атрофія лівої долі. Вузли можуть бути по всій поверхні зрізу або на деяких ділянках навколо воріт печінки.
Гістопатологічні ознаки ІНЦПГ залежать від стадії захворювання і ділянки проб. Спостерігаються різні комбінації гістологічних компонентів, портальні фібрози, судинні аномалії, вузлові регенеративні гіперплазії. Відзнаками є облітеруюча портальна венопатія з щільним фіброзом/склерозом ворітної вени, портальний/перипортальний фіброз, склероз гілок ворітної вени, зменшення просвіту (рис. 2), збільшення кількості портальних васкулярних каналів та артеалізація гілок ворітної вени. Крім того, портальні судини з’єднують перипортальні ділянки і дольки печінки напряму, можуть спостерігатися легке лімфоцитарне портальне запалення та проліферація жовчних проток [10].
Зміни в дольках печінки включають дифузне або фокальне вузликове переродження, мегасинусоїди, збільшену кількість венозних профілів у дольці, деформацію архітектури, тонкі фіброзні септи з портального тракту із сліпим закінченням у дольці, пресинусоїдальний і перивенулярні фібрози. Можуть відмічатися рудименти портального тракту або малі портальні тракти, у яких просвіт жовчної протоки або артерії менші за прилягаючий гепатоцит, із непомітними або відсутніми гілками ворітної вени (рис. 3) [10].
Перераховані вище гістологічні ознаки виявляються при ІНЦПГ, однак відмічається специфічність індивідуальних показників, і саме вона потребує подальшого дослідження.
Резюмуючи вищесказане, можна в алгоритм обстеження пацієнтів з ІНЦПГ включити: вивчення наявності супутніх захворювань та сімейного анамнезу, аналіз ліків та їх побічних дій (та можливих отрут), які хворий приймає, дослідження функціональних проб печінки, коагулограми і рівня тромбоцитів, лейкоцитів, наявність анемії, IgG до шистоматозу, виключення вірусних та автоімунних, холестатичних захворювань печінки. Слід оцінити органи черевної порожнини, виконати ультразвукове дослідження з допплерографією судин черевної порожнини, магнітно-резонансну томографію, еластографію, біопсію печінки.
Терапія головним чином концентрується на конт–ролі і запобіганні симптомам портальної гіпертензії, особливо варикозній кровотечі.
Стратегія, що використовується для лікування портальної гіпертензії у хворих на цироз печінки, сьогодні застосовується і для лікування ІНЦПГ, при цьому довгостроковий прогноз є сприятливим. Наприклад, при гострій варикозній кровотечі з розширених вен стравоходу застосовують комбіновану терапію з використанням вазоактивних препаратів й ендоскопічного лігування варикозу/склерозуючої терапії. Транс’югулярне інтрапечінкове портосистемне шунтування (ТІПШ) пропонують пацієнтам, у яких була відсутня відповідь на ендоскопічну терапію або спостерігаються рецидивні кровотечі. Профілактика варикозних кровотеч включає використання неселективних бета-блокаторів, ендоскопічне лігування варикозу або ТІПШ. Крім того, припиняють прийом будь-яких лікарських препаратів, вплив яких пов’язують із розвитком ІНЦПГ, і здійснюють терапію всіх медичних станів, обумовлених ІНЦПГ.
Попередні дані дозволяють припустити позитивний ефект терапії антикоагулянтами при тромбофілічній ІНЦПГ. У дослідженні серії випадків 15 пацієнтів з ІНЦПГ і повним або частковим тромбозом ворітної вени дали позитивну відповідь на терапію антикоагулянтами, продемонструвавши реканалізацію тою чи іншою мірою. Також рання терапія антикоагулянтами при ІНЦПГ у пацієнтів із гіперкоагуляцією забезпечувала сприятливий клінічний результат, а також покращувала функцію печінки в пацієнтів із ВІЛ і ІНЦПГ.
Хоча варикозна кровотеча зустрічається досить часто, загальний довгостроковий прогноз щодо ІНЦПГ є більш оптимістичним, ніж при цирозі, можливо, у зв’язку зі збереженою печінковою функцією в більшості пацієнтів.
Висновки
1. ІНЦПГ є рідкісним захворюванням, мало вивченим як у клінічному, так і в гістологічному плані. Для опису даної форми використовується безліч термінів, що викликає додаткову плутанину. Хоча лікування ІНЦПГ направлено найголовніше на контроль і профілактику ускладнень портальної гіпертензії, етіопатогенез та природна динаміка ІНЦПГ, імовірно, відрізняються від етіопатогенезу і природної динаміки цирозу.
2. Вивчення клінічних проявів, гістопатологічних аспектів і супутніх факторів ризику ІНЦПГ дозволить правильно діагностувати пацієнтів з ІНЦПГ.
3. До алгоритму дослідження хворих із підозрою на ІНЦПГ слід включити: аналіз сімейного анамнезу, терапії супутніх захворювань, виключення інших захворювань печінки, оцінку ознак гіперспленізму, дослідження органів черевної порожнини, біопсію печінки.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Хухліна О.С. Портальна гіпертензія / О.С. Хухліна // Острые и неотложные состояния в практике врача. — 2008. — № 2/1. — С. 27-31.
2. The effectiveness of current acute variceal bleed treatments in unselected cirrhotic patients: refining short / L. Amitrano, M.A. Guardascione, F. Manguso et al. // Hepatology. — 2017. — Vol. 65(1). — Р. 331-333.
3. Сompensated and decompensated liver disease / S.K. Asrani, J.A. Talwalkar, P.S. Kamath et al. // J. Hepatol. — 2014. — Vol. 60. — Р. 934-939.
4. Bosch J. Evolution in the understanding of the pathophysiological basis of portal hypertension: how changes in paradigm are leading to successful new treatments / J. Bosch, R.J. Groszmann, V.H. Shah // J. Hepatol. — 2015. — Vol. 62(1 Suppl.). — Р. 121-130.
5. Competing risks and prognostic stages of cirrhosis: a 25-year inception cohort study of 494 patients / G. D’Amico, L. Pasta, A. Morabito et al. // Aliment. Pharmacol. Ther. — 2014. — Vol. 39. — Р. 1180-1193.
6. Liver stiffness plus platelet count can be used to exclude high risk oesophageal varices / N.S. Ding, T. Nguyen, D.M. Iser et al. // Liver. Int. — 2016. — Vol. 36. — Р. 240-245.
7. Prospective comparison of spleen and liver stiffness by using shear-wave and transient elastography for detection of portal hypertension in cirrhosis / L. Elkrief, P.E. Rautou, M. Ronot et al. // Radiology. — 2015. — Vol. 275. — Р. 589-598.
8. Vapreotide Study Group. Child-Turcotte-Pugh Class is best at stratifying risk in variceal hemorrhage: analysis of a U.S. multicenter prospective study / B. Fortune, G. Garcia-Tsao, M. Ciarleglio et al. // J. Clin. Gastroenterol. — 2016. — Oct 24. — Р. 1010-1097.
9. Franchis R. Expanding consensus in portal hypertension. Report of the Baveno VI Consensus Workshop: stratifying risk and individualizing care for portal hypertension / Franchis R., Baveno V. Faculty // J. Hepatol. — 2015. — Vol. 63. — Р. 743-752.
10. Garcia-Tsao G. Natural history of cirrhosis / Cardenas A., Keaveny A., eds. Complications of Cirrhosis. — Cham, Switzerland: Springer International, 2015.
11. Передерий В.Г. Практическая гастроэнтерология / В.Г. Передерий, С.М. Ткач. — Винница, 2011. — 769 с.
12. Goel A., Alagammai P.L., Nair S. ADAMTS13 deficiency, despite well-compensated liver functions in patients with noncirrhotic portal hypertension / A. Goel, P.L. Alagammai // Indian J Gastroenterol. — 2014. — Vol. 33(4). — Р. 355-363.
13. Khanna R. Non-cirrhotic portal hypertension — Diagnosis and management / R. Khanna, S. Sarin // J. of Hepat. — 2014. — Vol. 60(2). — Р. 421-441.
14. Real-time shear-wave elastography: applicability, reliability and accuracy for clinically significant portal hypertension / B. Procopet, A. Berzigotti, J.G. Abraldes et al. // J. of Hepatol. — 2015. — Vol. 62. — Р. 1068-1075.
15. A MELD-based model to determine risk of mortality among patients with acute variceal bleeding / E. Reverter, P. Tandon, S. Augustin et al. // Gastroenterology. — 2014. — Vol. 146. — Р. 412-419.
16. The epidemiology of cirrhosis in the United States: a population-based study / S. Scaglione, S. Kliethermes, G. Cao et al. // J. Clin. Gastroenterol. — 2015. — Vol. 49. — Р. 690-696.
17. Systematic review with metaanalysis: the haemodynamic effects of carvedilol compared with propranolol for portal hypertension in cirrhosis / E. Sinagra, G. Perricone, M. D’Amico et al. // Aliment. Pharmacol. Ther. — 2014. — Vol. 39. — Р. 557-568.
18. Magnetic resonance elastography for staging liver fibrosis in non-alcoholic fatty liver disease: a diagnostic accuracy systematic review and individual participant data pooled analysis / S. Singh, S.K. Venkatesh, R. Loomba et al. // Eur. Radiol. — 2016. — Vol. 26. — Р. 1431-1440.
19. Risk of bacterial infection in patients with cirrhosis and acute variceal hemorrhage, based on Child-Pugh class, and effects of antibiotics / P. Tandon, J.G. Abraldes, A. Keough et al. // Clin. Gastroenterol. Hepatol. — 2015. — Vol. 13. — Р. 1189-1196.
20. Villanueva C., Albillos A., Genesca J., Abraldes J.G., Calleja J.L., Aracil C. et al. Development of hyperdynamic circulation and response to beta-blockers in compensated cirrhosis with portal hypertension // Hepatology. — 2016. — Vol. 63. — Р. 197-206.
21. Genetic determinants of idiopathic noncirrhotic portal hypertension in HIV-infected patients / E. Vispo, M. Cevik, J.K. Rockstroh et al. // Clin. Infect. Dis. — 2013. — Vol. 56. — Р. 1117-22.
22. Шерлок Ш. Заболевание печени и желчных путей / Ш. Шерлок, Дж. Дули. — М.: Медицина, 1999. — 864 с.

/66-1.jpg)