Вступ
Вітряна віспа є однією з найпоширеніших інфекційних хвороб дитячого віку. Захворювання реєструється повсюдно, максимум захворюваності припадає на дітей віком 3–4 роки. В Україні щороку на вітряну віспу хворіє близько 150 тис. дітей [1].
Вітряна віспа є гострим захворюванням із переважно сприятливим перебігом. Тяжкі форми й несприятливі наслідки переважно пов’язані з розвитком ускладнень. Ускладнення при вітряній віспі можуть виникати в результаті первинної дії вірусу (пневмоніт, енцефаліт) або вторинного бактеріального інфікування (абсцес, флегмона, бешиха, пневмонія, сепсис), а також унаслідок імуноопосередкованого ураження органів (імунна тромбоцитопенічна пурпура, мозочкова атаксія, синдром Гієна — Барре). До груп ризику щодо розвитку ускладнень належать імуноскомпрометовані пацієнти, діти, народжені від матерів, які захворіли на вітряну віспу в такому інтервалі: 5 днів до пологів і 2 дні після пологів [2].
Сучасне лікування вітряної віспи включає противірусні препарати, підтримуючу й симптоматичну терапію. Для противірусної терапії зазвичай застосовуються препарати ацикловіру й валацикловіру. Згідно із сучасними рекомендаціями в імунокомпетентних дітей специфічна терапія здебільшого не показана. Зокрема, за рекомендацією Американської академії педіатрії, ацикловір показаний дітям, старшим від 12 років, пацієнтам із хронічними захворюваннями шкіри й легень, тим, хто отримує тривалу терапію саліцилатами або приймає системні й інгаляційні стероїди [2]. Деякі рекомендації також радять застосовувати ацикловір при вторинних випадках унаслідок побутового контакту [3]. Максимальна ефективність ацикловіру досягається при його застосуванні протягом перших 24 годин після появи перших елементів висипки. При застосуванні в пацієнтів із груп ризику за відсутності ускладнень рекомендується пероральний прийом препарату, у той же час при тяжких і ускладнених формах показане парентеральне введення ацикловіру. Препарат валацикловіру схвалений Управлінням продовольства й медикаментів США (FDA) для лікування вітряної віспи в дітей віком від 2 років [4]. Зареєстровані на даний час в Україні препарати валацикловіру дозволені для застосування в дітей віком від 12 років.
Симптоматичне й підтримуюче лікування показане при всіх формах вітряної віспи. До основних напрямків належать профілактика дегідратації, полегшення симптомів інтоксикації, свербежу, профілактика бактеріальних ускладнень з боку шкіри та слизових оболонок. Для контролю лихоманки й полегшення загальних симптомів рекомендується застосування парацетамолу. Аспірин не рекомендується у зв’язку з ризиком розвитку синдрому Рея (варіант гострої печінкової енцефалопатії). Існують також застереження щодо застосування нестероїдних протизапальних засобів (у тому числі ібупрофену) при вітряній віспі з огляду на можливий ризик бактеріальних суперіфекцій шкіри й м’яких тканин [5].
Для полегшення відчуття свербежу шкіри традиційно застосовуються антигістамінні препарати першого покоління. Перевага надається пероральному прийому цих лікарських засобів, оскільки при місцевому застосуванні можливе передозування внаслідок високої абсорбції препарату зі шкіри. Слід брати до уваги, що прийом Н1-блокаторів, як відомо, пов’язаний із ризиком потенційно небезпечних побічних реакцій, таких як порушення серцевого ритму, запаморочення, активація судомної активності, порушення координації рухів, підвищення внутрішньоочного тиску, артеріальна гіпотензія, агранулоцитоз, тромбоцитопенія, гемолітична анемія, спазм дихальної мускулатури тощо [6].
З огляду на зазначене вище в рамках протокольного лікування вибір безпечних противірусних і симптоматичних засобів для лікування дітей із вітряною віспою досить обмежений. Саме цим обумовлений інтерес клініцистів до препаратів рослинного походження, що можуть мати лікувальний ефект при вітряній віспі й відзначаються високим профілем безпеки.
В Україні на фармацевтичному ринку присутній препарат Еребра, що містить екстракт із листя обліпихи крушиноподібної, Hippophae rhamnoides L. Даний лікарський засіб, згідно з чинною інструкцією, рекомендований до застосування як лікувально-профілактичний засіб при грипі (А і В) й інших гострих респіраторних вірусних інфекціях, при герпетичній інфекції, вітряній віспі й цитомегаловірусній інфекції. Біологічно активними компонентами препарату є галоелаготаніни (не менше від 60 %), хлорогенова, еохлорогенова, кумарова, аскорбінова кислоти, катехін, епікатехін, рутин, кверцетин, ізорамнетин, елеагнозид, каротиноїди, ефірні масла тощо [7].
З огляду на зазначене вище в клініці дитячих інфекцій Національного медичного університету імені О.О. Богомольця проведені клінічні спостереження щодо оцінки ефективності й переносимості препарату екстракту з листя Hippophae rhamnoides (Еребра) у комплексній терапії вітряної віспи в дітей.
Мета дослідження: оцінка ефективності й переносимості препарату Еребра в комплексній терапії вітряної віспи в дітей.
Матеріали та методи
Дизайн дослідження: проспективне відкрите конт–рольоване. До дослідження залучались діти, які перебували на стаціонарному лікуванні в Київській міській дитячій клінічній інфекційній лікарні з діагнозом «вітряна віспа» впродовж 2017–2018 рр. Розрахунок необхідної кількості учасників дослідження не проводився. Усі діти з діагнозом «вітряна віспа» перевірялись на відповідність критеріям включення/виключення і при отриманні інформованої згоди батьків залучались до дослідження.
Критерії включення дитини до дослідження:
— встановлений діагноз вітряної віспи;
— вік від 3 до 18 років;
— тривалість захворювання < 3 діб.
Критерії виключення дитини з дослідження:
— тяжкий і/або ускладнений перебіг вітряної віспи;
— застосування специфічної терапії (ацикловір);
— дострокова виписка до зникнення гострих симптомів;
— відома непереносимість будь-якого компонента досліджуваного препарату;
— участь у будь-якому іншому клінічному дослідженні.
Усі діти, які відповідали критеріям включення, рандомізувались у дві групи методом випадкових чисел. Пацієнти першої групи (основна) отримували в комплексній терапії вітряної віспи препарат Еребра, пацієнтам другої групи (контрольна) призначалась стандартна симптоматична терапія, що включала жарознижуючі, антигістамінні засоби, місцеву обробку висипань антисептичними засобами [3]. Препарат екстракту з листя Hippophae rhamnoides, таблетки сублінгвальні, призначався згідно з інструкцією до препарату. Тривалість лікування препаратом екстракту з листя Hippophae rhamnoides — 7–10 днів.
Оцінку ефективності лікування проводили на підставі дослідження динаміки основних клінічних симптомів захворювання — інтоксикаційні прояви (млявість і зниження апетиту), лихоманка, свербіж і поява нових висипань. Контроль показників здійснювали під час госпіталізації хворих і через 3, 5 та 7 днів стаціонарного лікування.
Для статистичної визначались середні показники й стандартні відхилення (М ± SD), при порівнянні показників використовували непараметричні тести Kruskal-Wallis, хі-квадрат (χ2), точний критерій Фішера. Статистично вірогідною вважали різницю при р < 0,05.
Результати
Під спостереженням перебували 64 дитини, хворі на вітряну віспу, віком від 3 до 18 років. Серед них хлопчиків було 51,7 % (33 дитини), дівчаток — 48,3 % (31 дитина). Дітей віком 3–6 років було 50 % (32 дитини), 7–12 років — 37,5 % (24 дитини), 13–18 років — 12,5 % (8 дітей). У всіх пацієнтів перебіг захворювання був середньої тяжкості.
Основну групу становили 34 пацієнти, які додатково до стандартної терапії отримували препарат екстракту з листя Hippophae rhamnoides. Контрольну групу становили 30 пацієнтів, які отримували стандартну симптоматичну й підтримуючу терапію. За віковим складом і статтю суттєвих відмінностей між основною й контрольною групами не було (p > 0,05 за критерієм χ2).
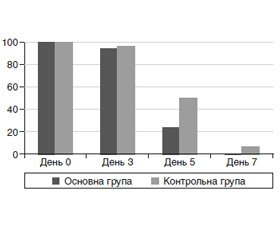
У всіх (100 %) хворих із вітряною віспою при госпіталізації відзначалася лихоманка (рис. 1). На тлі терапії в основній групі лихоманка зберігалася на 3-й день від початку лікування у 94,1 % пацієнтів, у контрольній групі — у 96,7 % дітей (p > 0,05 за критерієм χ2). На 5-й день лихоманка була зафіксована у 8 (23,5 %) дітей основної групи й 15 (50,0 %) дітей контрольної групи (p < 0,05 за критерієм χ2). На 7-й день лихоманка не була зафіксована в жодної дитини основної групи, у контрольній групі її мали 2 дитини (6,7 %).
/33-1.jpg)
Порушення поведінки (млявість, сонливість) під час госпіталізації спостерігались у всіх пацієнтів (рис. 2). На 3-й день спостереження даний симптом відмічався в 19 (55,8 %) дітей основної групи й 26 (86,7 %) хворих групи контролю (p < 0,05, за критерієм χ2). На 5-й день стаціонарного лікування порушення поведінки виявлялись у 9 (26,5 %) і 12 (40,0 %) пацієнтів основної та контрольної груп відповідно (p > 0,05 за критерієм χ2). На 7-й день порушення поведінки були відсутні в усіх пацієнтів основної групи і зберігались у 3 (10,0 %) дітей групи контролю (p > 0,05).
Скарги на зниження апетиту в перший день спостереження також відмічались у всіх хворих (рис. 3). На тлі лікування в обох групах спостерігалась позитивна динаміка цього симптому. На 3-й день спостереження в основній і контрольній групах він зберігався у 22 (64,7 %) і 24 (80,0 %) дітей відповідно; на 5-й день — у 6 (17,7 %) і 10 (33,3 %) хворих; на 7-й день — у всіх пацієнтів скарги на зниження апетиту були відсутні. Статистичної різниці за частотою цього показника не було (p > 0,05).
Нові висипання в день госпіталізації реєструвались у всіх хворих (рис. 4).
На 3-й день спостереження поява нових елементів висипки була відмічена в 32 (94,1 %) дітей основної групи й 29 (96,7 %) пацієнтів контрольної групи (p > 0,05). На 5-й день нові елементи висипки виявлялись лише у 12 (35,3 %) дітей в основній групі і більше ніж у половини хворих (53,3 %) у групі контролю (p > 0,05). На 7-й день у всіх дітей основної групи не було нових висипань, у контрольній групі вони спостерігались у 2 (6,7) % дітей (p > 0,05).
У переважної більшості хворих висипка на шкірі супроводжувалась свербежем. Під час госпіталізації даний симптом відмічався в 32 (94,1 %) пацієнтів основної групи й 29 (96,7 %) дітей контрольної групи. На тлі лікування в усіх пацієнтів спостерігалась позитивна динаміка й зменшення інтенсивності даного симптому. На 3-й день спостереження скарги на свербіж залишались у 30 (88,2 %) і 27 (90,0 %) дітей в основній і конт–рольній групах відповідно. На 5-й день свербіж турбував 13 (38,2 %) дітей в основний групи та 14 (46,7 %) — у контрольній групі. На 7-й день спостереження свербіж спостерігався лише в однієї дитини контрольної групи. Статистичної різниці за частотою даного симптому протягом терміну спостереження не було (p > 0,05).
При застосуванні препарату екстракту з листя Hippophae rhamnoides у рамках даного дослідження побічні ефекти не були зареєстровані.
Обговорення
Препарати на основі Hippophae rhamnoides застосовуються в медичній практиці з давніх часів. На сього–дні відомо, що препарати на основі екстракту з листя Hippophae rhamnoides мають, зокрема, антимікробну й антиоксидантну активність [8–12].
Противірусна активність екстракту з листя Hippophae rhamnoides вивчалась, зокрема, щодо вірусів грипу. Під час дослідження in vitro на культурі клітин А. Torelli et al. вивчали ефективність різних концентрацій препарату. Автори зазначають, що суттєве пригнічення росту й зменшення концентрації вірусу грипу A H1N1 спостерігалось навіть при низьких концентраціях препарату (від 2,5 до 50 мкг/мл), а високі концентрації (75 100 мкг/мл) повністю блокували розмноження вірусу [13]. Схожі результати були отримані і в іншому дослідженні, у якому автори встановили, що інгібуюча концентрація (ІС50) для різних підтипів вірусу грипу А становила 7,2–10,3 мкг/мл, а для вірусів грипу В — 2,9–4,5 мкг/мл [14]. Автори зазначають, що препарат напряму не вступає у взаємодію з вірусними частками, а інгібуюча дія, ймовірно, пов’язана з впливом активних речовин, зокрема флавоноїдів, на ранню стадію реплікації вірусу [14]. Ще в одному дослідженні in vitro вивчалась активність препарату Hippophae rhamnoides при інфекції вірусу лихоманки Денге. Додавання препарату до культури макрофагів, інфікованих вірусом лихоманки Денге, підвищувало живучість цих клітин. При цьому, зазначають автори, даний ефект реалізувався на тлі зменшення експресії TNF-α та зростання концентрації IFN-γ [9]. Противірусний ефект препаратів Hippophae rhamnoides також був продемонстрований при герпесвірусній інфекції [15].
Відсутність специфічної взаємодії з певними патогенами в препарату Hippophae rhamnoides, ймовірно, свідчить, що його протимікробна активність має універсальний характер і більшою мірою пов’язана з імуномодуляторним ефектом. Гарною ілюстрацією даного припущення можуть бути результати експериментальної роботи на тваринах E.-Y. Kwon et al., які вивчали вплив препаратів Hippophae rhamnoides при ожирінні. На тлі лікування автори спостерігали вірогідне зниження концентрації прозапальних маркерів, зокрема TNF-α, IL-1β, IL-6 і PAI-1 [16].
Існують також дані про потенційні можливості препаратів Hippophae rhamnoides при бактеріальних інфекціях, навіть при їх тяжких, інвазивних формах. Під час вивчення ефекту екстракту на запальну реакцію, спричинену ліпополісахаридом, було виявлено, що препарат суттєво пригнічує індуковану NO-синтетазу й зменшує продукцію NO [17]. Інші дослідники також повідомляють, що екстракт листя Hippophae rhamnoides пригнічував спричинену ліпополісахаридом продукцію NO й проінфламаторних цитокінів, таких як TNF-α і IL-6 [18]. На даний час існують підтвердження, що антиінфламаторний ефект екстракту з листя Hippophae rhamnoides реалізується через пригнічення активації нуклеарного фактора каппа В і протеїнкінази р38 (p38 MAPK) [19].
Результати нашого дослідження свідчать про позитивний вплив препарату Еребра (екстракт з листя Hippophae rhamnoides) на динаміку симптомів у дітей з вітряною віспою. Спостерігалось суттєве зменшення частоти лихоманки й порушень поведінки порівняно з контрольною групою. Дані симптоми, як відомо, прямо пов’язані з активністю запальної реакції внаслідок інфекційного процесу, і їх полегшення, ймовірно, пояснюється протизапальною активністю препарату.
Важливою особливістю препаратів на основі Hippophae rhamnoides є їх висока безпека. Багаторічний досвід і сучасні дослідження свідчать про практичну відсутність токсичного впливу екстракту на клітини при застосуванні терапевтичних доз [20]. В експерименті на щурах при застосуванні максимальних ефективних доз препарату (100 мг/кг протягом 30 днів і 1–2 г/кг протягом 14 днів) дослідники не спостерігали суттєвих функціональних чи лабораторних відхилень з боку життєво важливих органів. Гострі токсичні реакції при пероральному прийомі спостерігались лише при введенні дози 10 г/кг [21]. Результати клінічних спостережень у людей також свідчать про безпеку терапевтичних доз препарату, навіть при тривалому застосуванні [22]. У нашому дослідженні ми використовували форму екстракту Hippophae rhamnoides для перорального прийому (сублінгвальні таблетки Еребра) в дозі 2–4 мг/кг (у перерахунку вмісту екстракту) курсами 7–10 днів. Результати нашого дослідження також підтверджують високий профіль безпеки даного лікарського засобу.
Висновки
1. Застосування екстракту з листя Hippophae rhamnoides (Еребра) в комплексній терапії в дітей з вітряною віспою прискорює нормалізацію клінічних симптомів.
2. Препарат екстракту з листя Hippophae rhamnoides (Еребра) має високий профіль безпеки й добре переноситься.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Nezgoda І, Levic'ka L. Vіtrjana vіspa u dіtej. Іnfekcіjnі hvorobi. 2017;1(87):61-70. (In Ukrainian).
2. English R. Varicella. Pediatrics in Review. 2003;24(11):372-379.
3. CDC. About Chickenpox. – Available from: https://www.cdc.gov/chickenpox/about/index.html. Accessed: 1 Jul 2016.
4. Valtrex (Valacyclovir Hydrochloride): Side Effects, Interactions, Warning, Dosage & Uses. RxList Inc. Available: https://www.rxlist.com/valtrex-drug.htm#description. Accessed: 16 04 2018.
5. Mikaeloff Y, Abbas K, Samy S. Nonsteroidal anti-inflammatory drug use and the risk of severe skin and soft tissue complications in patients with varicella or zoster disease. British journal of clinical pharmacology. 2008; 65(2):203-9.
6. Diana D, Church S, Church M. Pharmacology of Antihistamines. World Allergy Organ J. 2011;4(3):22-27.
7. EREBRA® tabletki sublіngval'nі | Іnstrukcіja MOZ, cіna v aptekah, sklad, pokazannja | Dovіdnik Kompendіum. К.: Morion; 2017. Available: https://compendium.com.ua/dec/263453/. Accessed: 16 04 2018.
8. Suomela J, Ahotupa M, Yang B, Vasankari T, Kallio H. Absorption of flavonols derived from sea buckthorn (Hippophaë rhamnoides L.) and their effect on emerging risk factors for cardiovascular disease in humans. J Agric Food Chem. 2006;54:7364-7369.
9. Jain M, Ganju L, Katiyal A, et al. Effect of Hippophae rhamnoides leaf extract against Dengue virus infection in human blood-derived macrophages. Phytomedicine. 2008;15:793-799.
10. Ganju L, Padwad Y, Singh R, et al. Anti-inflammatory activity of Seabuckthorn (Hippophae rhamnoides) leaves. Int. Immunopharmacol. 2005;5:1675-1684.
11. Geetha S, Sai RM, Singh V, Ilavazhagan G, Sawhney R. Anti-oxidant and immunomodulatory properties of seabuckthorn (Hippophae rhamnoides) — An in vitro study. J Ethnopharmacol. 2002;79:373-378.
12. Larmo P, Alin J, Salminen E, Kallio H. Effects of sea buckthorn berries on infections and inflammation: a double-blind, randomized, placebo-controlled trial. European Journal of Clinical Nutrition. 2008;62(9):1123-1130.
13. Torelli A, Gianchecchi E, Piccirella S, et al. Sea buckthorn bud extract displays activity against cell-cultured Influenza virus. Journal of Preventive Medicine and Hygiene. 2015;56(2):E51-E56.
14. Enkhtaivan G, Maria JK, Pandurangan M, Hur J, Leutou A, Kim D. Extreme effects of Seabuckthorn extracts on influenza viruses and human cancer cells and correlation between flavonol glycosides and biological activities of extracts. Saudi Journal of Biological Sciences. 2017;24(7):1646-1656.
15. Shipulina L, Tolkachev O, Krepkova L, Bortnikova V, Shkarenkov A. Anti-viral anti-microbial and toxicological studies on Seabuckthorn, (Hippophae rhamnoides). Singh, V. (Ed.), Seabuckthorn (Hippophae L.): A Multipurpose Wonder Plant. 2014;2;471-483.
16. Kwon E-Y, Lee J, Kim YJ, et al. Seabuckthorn Leaves Extract and Flavonoid Glycosides Extract from Seabuckthorn Leaves Ameliorates Adiposity, Hepatic Steatosis, Insulin Resistance, and Inflammation in Diet-Induced Obesity. Nutrients. 2017;9(6):569.
17. Padwad Y, Ganju L, Jain M, et al. Effect of leaf extract of Seabuckthorn on lipopolysaccharide induced inflammatory response in murine macrophages. Int Immunopharmacol. 2006;6(1):46-52.
18. Tanwar H, Shweta SD, Singh S, Ganju L. Anti-inflammatory activity of the functional groups present in Hippophae rhamnoides (Seabuckthorn) leaf extract. Inflammopharmacology. 2018;26(1):291-301.
19. Jayashankar B, Mishra K, Kumar M, et al. A supercritical CO2 extract from seabuckthorn leaves inhibits pro-inflammatory mediators via inhibition of mitogen activated protein kinase p38 and transcription factor nuclear factor-κB. Int Immunopharmacol. 2012;13(4):461-7.
20. Jayashankar B, Singh D, Tanwar H, et al. Augmentation of humoral and cellular immunity in response to Tetanus and Diphtheria toxoids by supercritical carbon dioxide extracts of Hippophae rhamnoides L. leaves. Int Immunopharmacol. 2017;44:123-136.
21. Wani T, Wani S, Ahmad M, Ahmad M, Gani A, Masoodi F. Bioactive profile, health benefits and safety evaluation of sea buckthorn (Hippophae rhamnoides L.): A review. Cogent Food & Agriculture. 2016;2(1):1128519.
22. Zakynthinos G, Varzakas T. Hippophae rhamnoides: safety and nutrition. Curr Res Nutr Food Sci. 2015;3(2):89-97.
23. Agarwal M, Chanda S, Rao M, Ganju L. Effect of Hippophae Rhamnoides Leaf Extract against Dengue Virus Infection in U937 Cells. Virol-mycol. 2016; 5:157.

/33-1.jpg)