Введение
В модели экспериментального поясничного межпоперечного спондилодеза у кроликов, впервые разработанной S.D. Boden et al. в 1994 году [1], в качестве костно-пластического материала использовались аутотрансплантаты из гребня подвздошной кости. Частота состоявшегося спондилодеза в данной модели и в клинике имела сходные показатели [2].
В настоящее время частота костного сращения в модели заднебокового сподилодеза у кроликов варьирует от 42 до 73 % [3]. Такой широкий диапазон успешных результатов спондилодеза можно объяснить как различными экспериментальными условиями (количество трансплантируемого биоматериала и методы оценки костного сращения [4]), так и биологическими свойствами используемых трансплантатов [5].
Скорость формирования зрелых спондилодезных масс связана с активностью репаративной регенерации костной ткани, которая, в свою очередь, в значительной степени определяется наличием остеогенных, и/или остеоиндуктивных, и/или остеокондуктивных свойств используемого костно-пластического материала [6]. Одним из косвенных методов определения активности репаративного процесса in vivo является биохимический.
Целью данного исследования стало изучение маркеров минерального обмена и обмена соединительной ткани в сыворотке крови кроликов после поясничного экспериментального заднебокового спондилодеза с использованием различных костно-пластических материалов.
Материалы и методы
Экспериментальное моделирование поясничного межпоперечного спондилодеза выполнено 42 половозрелым самцам белых калифорнийских кроликов в возрасте 4–5 мес., которые в зависимости от используемого костно-пластического материала были разделены методом случайной выборки на 6 групп (по 7 особей в каждой). В контрольной группе (группа 1) трансплантаты не применялись; в остальных группах использовали: группа 2 — местные аутотрансплантаты, группа 3 — местные аутотрансплантаты в сочетании с PRF, группа 4 — аллотрансплантаты из крыла подвздошной кости, группа 5 — аллотрансплантаты из крыла подвздошной кости в сочетании с PRF, группа 6 — PRF.
PRF получали непосредственно перед операцией путем забора крови из ушной вены кролика в количестве 7,0 мл, помещения ее в пробирку без коагулянта и немедленного центрифугирования со скоростью 3000 оборотов в 1 минуту (приблизительно 400 g) в течение 10 минут. Полученные 3,0 мл аутологичного фибрина, обогащенного тромбоцитами, делились на 2 порции по 1,5 мл для выполнения двустороннего межпоперечного спондилодеза.
Местные костные аутотрансплантаты представляли собой фрагменты резецированных интраоперационно остистых отростков L4 и L5 позвонков (на уровне спондилодеза).
Лиофилизированные аллотрансплантаты, полученные из гребня подвздошной кости кроликов, выведенных из эксперимента, подготовлены на базе отделения трансплантологии ГУ «Институт патологии позвоночника и суставов имени профессора М.И. Ситенко Национальной академии медицинских наук Украины», зарегистрированного МинздравомУкраины.
Забор крови для биохимических исследований производили из ушной вены экспериментальных животных в количестве 5,0 мл согласно протоколу стандартной операционной процедуры № 1 отделения патологии позвоночника, утвержденной на заседании ученого совета ГУ «Институт патологии позвоночника и суставов имени профессора М.И. Ситенко Национальной академии медицинских наук Украины» (протокол № 9 от 5.07.2017). Биохимические исследования выполняли дважды: для получения нормативных показателей у интактных животных — за 5–7 дней до операции (группа Нинт) и перед выведением кроликов из эксперимента через 8 недель после межпоперечного спондилодеза.
Эксперименты на кроликах были проведены на базе аттестованной лаборатории экспериментального моделирования ГУ «Институт патологии позвоночника и суставов имени профессора М.И. Ситенко Национальной академии медицинских наук Украины» с соблюдением требований Европейской конвенции защиты позвоночных животных, которые используются в экспериментальных и других научных целях (Страсбург, 1986) [7], касающихся гуманного отношения к подопытным животным. Эвтаназия животных осуществлялась через 8 недель после операции путем передозировки тиопената с соблюдением всех правил гуманного отношения к животным.
Биохимические исследования проводились на базе отдела лабораторной диагностики и иммунологии ГУ «Институт патологии позвоночника и суставов имени профессора М.И. Ситенко Национальной академии медицинских наук Украины» (свидетельство об аттестации № 100-287/2015 от 20.11.2015). В сыворотке крови животных определяли: общий белок — биуретовым методом, гликопротеины — по Штейнбергу — Доценко, хондроитинсульфаты — по Németh-Csóka в модификации Л.И. Слуцкого, активность щелочной фосфатазы — кинетическим методом, общий кальций — спектрофотометрически, β-липопротеины — по Бурштейну и Самай, фосфор — восстановлением фосфомолибденовой кислоты [8–10].
При статистическом анализе использовали программные пакеты Microsoft Excel XP и Statsoft Statistica v.10. Сравнение групп лабораторных животных проводили с использованием Т-критерия Вилкоксона с определением медианы (Me) и процентилей (25% и 75%), t-критерия Стьюдента с уровнем достоверности р < 0,05 [11].
Экспериментальное моделирование поясничного моносегментарного межпоперечного спондилодеза с использованием ауто-, аллотрансплантатов и аутологичного фибрина, обогащенного тромбоцитами, у кроликов одобрено Комитетом по биоэтике при ГУ «Институт патологии позвоночника и суставов имени профессора М.И. Ситенко Национальной академии медицинских наук Украины» (протокол № 151 от 18.01.2016).
Результаты
Анализ результатов биохимических исследований выявил повышение уровня большинства изученных маркеров сыворотки крови кроликов через 8 недель после моносегментарного межпоперечного спондилодеза с использованием различных костно-пластических материалов во всех экспериментальных группах. В то же время содержание общего белка, кальция и фосфора в сыворотке крови кроликов в среднем сохранялось в пределах физиологической нормы для животных этого вида (в норме в сыворотке крови кроликов уровень общего белка составляет 54–75 г/л, концентрация кальция достигает 1,46–3,60 ммоль/л, содержание фосфора — 0,6–2,7 ммоль/л [12]).
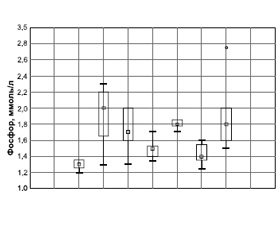
Наиболее выраженное увеличение содержания фосфора в сыворотке крови наблюдалось у животных в контрольной группе 1 (декортикация поперечных отростков LIV–LV), превышая показатели интактной группы на 53,8 % (2,06 ± 0,28 и 1,26 ± 0,14 ммоль/л соответственно). Интересно, что в группе 1 отмечалась и самая низкая концентрация кальция в сыворотке крови (1,67 ± 0,14 ммоль/л), приближавшаяся к нижней границе нормы (табл. 1, рис. 1а).
В группах 2 (применение местных аутотрансплантатов), 4 (использование аллотрансплантатов из гребня подвздошной кости) и 6 (применение PRF) также выявлено повышение уровня фосфора в сыворотке крови кроликов до 1,83 ± 0,16, 1,86 ± 0,04 и 1,86 ± ± 0,04 ммоль/л соответственно. Эти результаты превышали данные интактной группы на 38,5 %. Менее всего отличалась от показателей группы Нинт концентрация фосфора в сыворотке крови экспериментальных животных из групп 3 (2,55 ± 0,09 ммоль/л) и 5 (2,34 ± 0,14 ммоль/л), в которых в качестве костно-пластического материала использовали сочетание костных трансплантатов и аутологичного фибрина, обогащенного тромбоцитами. Уровень фосфора в сыворотке крови кроликов в группах 3 и 5 был увеличен на 15,4 и 13,8 % соответственно по сравнению с показателями интактной группы (табл. 1, рис. 1а).
/19-1.jpg)
Для минерализации костной ткани необходимо поддержание определенных концентраций ионов кальция и фосфора в плазме крови и межклеточной жидкости. Уровень ионов кальция в плазме регулируется с высокой точностью: уже при изменении их концентрации на 1 % включаются механизмы гомеостаза с участием паратгормона, кальцитонина и кальцитриола [13]. Сохранение практически постоянного, с незначительными колебаниями, уровня этих ионов в плазме крови достигается взаимной сбалансированностью процессов депонирования кальция и фосфора в костной ткани и их абсорбции/экскреции в кишечнике и почках [14].
/20-1.jpg)
Процесс минерализации костной ткани иници-ируется в пересыщенном растворе фосфатов кальция в везикулах экстрацеллюлярного матрикса, которые формируются на поверхностной мембране гипертрофированных остеоцитов и хондроцитов [15]. Однако предельная концентрация ионов, ниже которой кальций-фосфорные соли не фиксируются на органическом матриксе, до настоящего времени не установлена, так как состав минеральной фазы кости непостоянен, и на скорость минерализации могут влиять другие неорганические ионы [16]. Так, в присутствии ионов фтора ускоряется образование кристаллов гидрокси–апатита из аморфного фосфата кальция [17].
По мере минерализации костной ткани увеличивается молярное отношение кальций/фосфор, которое в солях фосфата кальция (на начальных этапах минерализации) является относительно низким — около 1,2 [16]. В связи с этим определенный интерес представляет величина аналогичного отношения на нашем экспериментальном материале. Практически идентичными оказались средние показатели отношения кальций/фосфор в сыворотке крови интактной группы животных и в группе 3 (1,71 и 1,69 соответственно); несколько ниже — в группе 5 (1,58), а также в группах 2, 4 и 6 (1,30, 1,25 и 1,31 соответственно). Минимальное среднее отношение кальций/фосфор, не превышавшее 0,97, зарегистрировано в группе 1.
Обсуждение
Полученные данные могут косвенно отражать степень минерализации спондилодезных масс у оперированных животных. Близкие результаты в группах Нинт, 3 и 5 косвенно свидетельствуют о формировании практически зрелой минеральной фазы новообразованной костной ткани в зоне спондилодеза при использовании в качестве костно-пластического материала костных ауто- и аллотрансплантатов в сочетании с PRF. Показатели отношения кальций/фосфор в случаях применения у кроликов костной ауто- и аллопластики при моносегментарном межпоперечном спондилодезе (группы 2 и 4 соответственно) либо только аутологичного фибрина, обогащенного тромбоцитами (группа 6), косвенно указывают на продолжающийся процесс минерализации спондилодезных масс. Низкая средняя величина отношения кальций/фосфор в контрольной группе 1 (декортикация поперечных отростков без использования костно-пластического материала) косвенно отражает начальные стадии минерализации в зоне формирующегося костного сращения.
Начальные стадии процесса минерализации костной ткани связаны с активацией неспецифичного изофермента щелочной фосфатазы, которая расщеп-ляет органические фосфорсодержащие соединения, увеличивая локальную концентрацию ионов фосфора в везикулах экстрацеллюлярного матрикса до точки насыщения [18]. Щелочная фосфатаза, синтезируемая остеобластами, является маркером последних, и ее концентрация в клетках костной ткани коррелирует с их потенциалом минерализации [5], а содержание в плазме крови является информативным показателем костного ремоделирования [15, 18].
На нашем материале максимальная активность щелочной фосфатазы в сыворотке крови, которая в 2,2 раза превышала уровень фермента в интактной группе, была выявлена в контрольной группе 1 (189,41 ± 23,15 ед/л в группе Нинт и 467,38 ± 19,17 ед/л в группе 1; p < 0,05). В группах животных 3 и 5 активность щелочной фосфатазы оказалась существенно ниже, превышая на 35,7 и 54,4 % соответственно показатели интактной группы. В группах кроликов 2, 4 и 6 активность фермента была повышена на 95,9; 76,6 и 75,4 % соответственно по сравнению с аналогичными величинами в интактной группе (табл. 1, рис. 1б).
Значимое повышение уровня щелочной фосфатазы в сыворотке крови животных из группы 1 может свидетельствовать о достаточно выраженной биосинтетической функции данного фермента и, соответственно, высокой активности репаративного остеогенеза в зоне оперированных поясничных сегментов. В остальных экспериментальных группах процессы костного сращения в зоне спондилодезных масс протекали менее интенсивно, особенно в группах с сочетанным использованием костных трансплантатов и PRF.
Во всех экспериментальных группах наблюдалось также повышение концентрации сложных белков в плазме крови. Наиболее существенным изменение уровня гликопротеинов, хондроитинсульфатов и β-липопротеинов по сравнению с показателями интактной группы оказалось в группах 1, 2, 4 и 6. Так, в группе 1 содержание гликопротеинов превышало показатели Нинт в 2,2 раза (p < 0,05), в группах 2, 4 и 6 — в 2 раза (табл. 1, рис. 1в). Концентрация хондроитинсульфатов оказалась увеличенной в группе 1 в 3 раза (p < 0,01), в группе 2 — в 2,2 раза (p < 0,05), в группах 4 и 6 — в 2,4 раза (p < 0,05) по сравнению с показателями интактной группы (табл. 1, рис. 1г). Уровень β-липопротеинов был выше показателей Нинт в 2,5 раза в группе 1 (p < 0,05) и в 2,3 раза — в группах 2 и 6 (p < 0,05). В группах 3 и 5 изменения указанных биохимических маркеров обмена соединительной ткани были существенно ниже. Содержание гликопротеинов в этих группах превышало показатели интактной группы на 53,1 и 62,5 % соответственно; концентрация хондроитинсульфатов — на 59,8 и 47,5 % соответственно, а уровень β-липопротеинов был идентичен показателям Нинт (4,42 ± 0,80 ммоль/л в группе Нинт; 4,65 ± 1,12 ммоль/л в группе 3 и 4,24 ± 0,96 ммоль/л в группе 5) (табл. 1, рис. 1в, г).
Сложные белки в процессе репаративного остеогенеза играют значительную роль, которая окончательно не установлена. Гликаны и фибриллы коллагена, синтезируемые остеобластами, обеспечивают непрерывный рост кристаллов гидроксиапатита и выступают в качестве посредников при связывании минеральных кристаллов с органическим матриксом. В зоне кальцификации при участии лизосомных протеиназ происходит деградация протеогликанов, связанных с коллагеном I типа. Высвобождающиеся фрагменты протеогликанов, заряженные отрицательно, связывают ионы кальция [19]. Некоторое число ионов кальция и фосфатов образуют пары и триплеты, которые связываются с коллагеновыми и неколлагеновыми белками, формирующими матрикс, с образованием кластеров или ядер надмолекулярного матрикса костной ткани [20].
Кристаллизация гидроксиапатита сопровождается снижением уровня протеогликанов и воды в органическом матриксе костной ткани [21] и изменением состава гликозаминогликанов: сульфатированные соединения уступают место несульфатированным [22].
Гликопротеины усиливают структурную организацию экстрацеллюлярного матрикса костной ткани, обеспечивая устойчивость белков и регуляцию их функции [19]. Протеогликаны формируют тканевую структуру, сохраняют пористость и целостность органического матрикса соединительной ткани, повышают растяжимость коллагеновой сети [21].
Хондроитинсульфаты соединительной ткани принимают участие в минерализации костной ткани путем инициирования фиксации серы в процессе синтеза хондроитинсерной кислоты и, таким образом, способствуют депонированию кальция в костной ткани [23]. Они способны поддерживать остеогенную дифференциацию путем повышения эффективности костного анаболического фактора роста [24].
Хондроитинсульфаты участвуют и в формировании коллагеновых волокон. Микрофибриллы коллагена связываются олигосахарами гликопротеинов, создавая укрупненные фибриллы, которые затем с помощью цепей гликозаминогликанов, входящих в состав протеогликанов, объединяются в волокна различной толщины [25]. Необходимо отметить, что существует четкое соответствие между интенсивностью обмена гликозаминогликанов и коллагена: максимальная интенсивность их метаболизма наблюдается в том числе в период формирования тканевых структур [21, 22].
В костном матриксе присутствуют и липиды, которые могут играть существенную роль в образовании ядер кристаллизации при минерализации кости [26]. Бета-липопротеины плазмы крови включают липопротеины низкой плотности и липопротеины очень низкой плотности. Первые транспортируют жирные кислоты, участвующие в синтезе аденозинтрифосфата; вторые переносят жирные кислоты — предшественники построения клеточных мембран и синтеза биологически активных эйкозаноидов [27].
Существенное увеличение концентрации гликопротеинов, хондроитинсульфатов и β-липопротеинов в сыворотке кроликов из групп 1, 2, 4 и 6 косвенно свидетельствует об активном формировании органического матрикса костной ткани в зоне спондилодеза у этих животных. Уровень сложных белков в сыворотке крови экспериментальных животных в группах 3 и 5 косвенно отражал активность процесса создания межклеточного вещества костной ткани, близкую к физиологический норме.
Таким образом, исследованные маркеры минерального обмена и обмена соединительной ткани косвенно характеризуют новообразованные спондилодезные массы как наиболее зрелые при использовании костных алло- или местных аутотрансплантатов в сочетании с аутологичным фибрином, обогащенным тромбоцитами. В случаях изолированного использования костных алло- или местных аутотрансплантатов, а также аутологичного фибрина, обогащенного тромбоцитами, можно говорить об активном процессе репаративного остеогенеза с формированием органического матрикса и минеральной фазы костной ткани. У животных, которым была выполнена декортикация поперечных отростков без применения костно-пластического материала, концентрация исследованных показателей косвенно отражала активное создание межклеточного вещества с начальными стадиями процесса минерализации в зоне костного сращения.
Выводы
1. Концентрация ионов кальция и фосфора и их соотношение выявились наиболее сходными в сыворотке крови кроликов из интактной группы, а также групп с использованием костных алло- и местных аутотрансплантатов в сочетании с PRF. Наибольшие отличия исследованных маркеров минерального обмена от показателей интактной группы наблюдались у экспериментальных животных контрольной группы, где была выполнена декортикация поперечных отростков без использования костно-пластического материала.
2. Активность щелочной фосфатазы в сыворотке крови всех групп экспериментальных животных превышала результаты интактной группы, причем в контрольной группе кроликов различия между показателями оказались значимыми (p < 0,05).
3. Содержание в сыворотке крови сложных белков было повышено во всех группах экспериментальных животных по сравнению с показателями интактной группы; значимыми выявились различия в контрольной группе (для уровня гликопротеинов p < 0,05, хондроитинсульфатов — p < 0,001, β-липопротеинов — p < 0,001), в группе с использованием при спондилодезе в качестве костно-пластического материала PRF (для уровня хондроитинсульфатов p < 0,05, β-липопротеинов — p < 0,05), в группе с применением местных костных аутотрансплантатов (для уровня β-липопротеинов p < 0,05) и в группе с использованием костных аллотрансплантатов (для уровня хондро–итинсульфатов p < 0,05).
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Schimandle J.H. Spine update. The use of animal models to study spinal fusion / J.H. Schimandle, S.D. Boden // Spine (Phila Pa 1976). — 1994. — Vol. 19. — P. 1998-2006.
2. Ghodasra J.H. Factors influencing arthrodesis rates in a rabbit posterolateral spine model with iliac crest autograft / J.H. Ghodasra, E.L. Daley, E.L. Hsu, W.K. Hsu // Eur. Spine J. — 2014. — Vol. 23. — P. 426-434. — doi: 10.1007/s00586-013-3074-0.
3. Reliability of the rabbit postero-lateral spinal fusion mo-del: A meta-analysis / A.M. Riordan, R. Rangarajan, J.W. Balts [et al.] // J. Orthop. Res. — 2013. — Vol. 8. — P. 1261-1269. — doi: 10.1002/jor.22359.
4. Zunariah B. Posterolateral intertransverse lumbar arthrodesis in the New Zealand white rabbit model: The illustration of an alternative surgical approach / B. Zunariah,
Z. Zamzuri, C.S. Che Nor Zarida, A.J. Rosnani // IMJM. — 2012. — Vol. 11. — P. 19-22.
5. А systematic review of comparative studies on bone graft alternatives for common spine fusion procedure / C.R. Fischer,
R. Cassilly, W. Cantor [et al.] // Eur. Spine J. — 2013. — Vol. 22. — P. 1423-1435. — doi: 10.1007/s00586-013-2718-4.
6. Evaluation of autologous platelet concentrate for intertransverse lumbar fusion / G. Acebal-Cortina, M.A. Suarez-Suarez, C. Garcia-Menendez // Eur. Spine J. — 2011. — Vol. 20 (Suppl. 3). — Р. S361-S366. — doi: 10.1007/s00586-011-1904-5.
7. Європейська конвенція про захист хребетних тварин, що використовуються для дослідних та інших наукових цілей. — Страсбург, 18 березня 1986 року: офіційний переклад [Електронний ресурс] / Верховна Рада України. — Офіційний веб-сайт. (Міжнародний документ Ради Європи). — Режим доступу до документу: електрон-ний ресурс: [http:// zakon.rada.gov.ua/cgi-bin/laws/main.cginreg=994_137].
8. Камышников В.С. Клинико-биохимическая лабораторная диагностика. Справочник: В 2 т. Т. 1. — 2-е изд. / В.С. Камышников. — Минск: Интерпрессервис, 2003. — 495 с.
9. Камышников В.С. Клинико-биохимическая лабораторная диагностика. Справочник: В 2 т. Т. 2. — 2-е изд. / В.С. Камышников. — Минск: Интерпрессервис, 2003. — 463 с.
10. Морозенко Д.В. Методи дослідження маркерів метаболізму сполучної тканини у сучасній клінічній та експериментальній медицині / Д.В. Морозенко, Ф.С. Леонтьєва // Молодий вчений: науковий журнал. — 2016. — № 2(29). — С. 168-172.
11. Гланц С. Медико-биологическая статистика: Пер. с англ. / С. Гланц. — М.: Практика, 1998. — 459 с.
12. Ewringmann А. Leitsymptome beim Kaninchen: Diagnostischer Leitfaden und Therapie. — 3 Auflage. — Enke: Stuttgart, 2016. — 279 р.
13. Calcium intake, bone mineral density, and fragi–lity fractures: evidence from an Italian outpatient population / L.Vannucci, L. Masi, G. Gronchi [et al.] // Arch. Osteoporos. — 2017. — Vol. 12. — P. 40. — doi: 10.1007/s11657-017-0333-4.
14. Burckhardt P. Calcium revisited: part I / P. Burckhardt // Bone Key Rep. — 2013. — Vol. 2. — P. 433. — doi: 10.1038/bonekey.2013.167.
15. Millán J.L. The role of phosphatases in the initiation of skeletal mineralization / J.L.Millán // Calcif. Tissue Int. — 2013. — Vol. 93(4). — P. 299-306. — doi: 10.1007/s00223-012-9672-8.
16. Harrison’s Principles of Internal Medicine / J.L. Jameson, A.S. Fauci, D.L. Kasper [et al.]. — 20th еdition. — Vol. 2. — S & P Global Inc.: New York, 2016. — P. 1512-2607.
17. Bone formation controlled by biologically relevant inorganic ions: role and controlled delivery from phosphate-based glasses / N.J. Lakhkar, I.H. Lee, H.W. Kim [et al.] // Adv. Drug. Deliv. Rev. — 2013. — Vol. 65(4). — Р. 405-420. — doi: 10.1589/jpts.27.2261.
18. Sharma U. Alkaline phosphatase: An overview / U. Sharma, D. Pal, R. Prasad // Ind. J. Clin. Biochem. — 2014. — Vol. 29(3). — P. 269-278. — doi: 10.1007/s12291-013-0408-y.
19. Wittmann V. Glycoproteins: Properties. In: Glycoscience: Chemistry and Chemical Biology, 2th ed. / Еd. by Fraser-Reid B.O., Tatsuta K., Thiem J., Wittmann V. — Berlin: Springer, 2008. — P. 1771-1793. — doi: 10-1007/978-3-540-30429-6.
20. Bone biomaterials and interactions with stem cells / C. Gao, S. Peng, P. Feng, C. Shuai // Bone Res. — 2017. — Vol. 5. — P. 150-159. — doi: 10.1038/ boneres. 2017.59.
21. Bio-orthopaedics. A New Approach / A. Gobbi, J. Espreguerira-Mendes, J.G. Lane, M. Karahan. — Berlin: Springer, 2017. — 687 p. — doi: 10.1007/978-3-662-54181-4.
22. Kitagawa H. Biosynthetic mechanism of the bioactive sulfated glycosaminoglycans / H. Kitagawa // Yakugaku Zasshi. — 2002. — Vol. 122(7). — P. 435-450. — doi: 10.1248/yakushi.122.435.
23. Klüppel M. The roles of chondroitin-4-sulfotransferase-1 in development and disease / M. Klüppel // Prog. Mol. Biol. Transl. Sci. — 2010. — Vol. 93. — P. 113-132. — doi: 10.1016/S1877-1173(10)93006-8.
24. Kwon H.J. Chondroitin sulfate-based biomaterials for tissue engineering. Review article / H.J. Kwon, Y. Han // Turk. J. Biol. — 2016. — Vol. 40. — P. 290-299. — doi:10.3906/biy-1507-16.
25. Mikami T. Biosynthesis and function of chondroitin sulfate / T. Mikami, H. Kitagawa // Biochim. Biophys. Acta. — 2013. — Vol. 1830(10). — P. 4719-4733. — doi: 10.1016/j.bbagen.2013.06.006.
26. Hoover-Plow J. Lipoprotein(a) metabolism: potential sites for therapeutic targets / J. Hoover-Plow, M. Huang // Metabolism. — 2013. — Vol. 62. — P. 479-91. — doi: 10.1016/j.metabol.2012.07.024.
27. Kamstrup P.R. Elevated lipoprotein(a) levels, LPA risk genotypes, and increased risk of heart failure in the general population / P.R. Kamstrup, B.G. Nordestgaard // JACC Heart Fail. — 2016. — Vol. 4. — P. 78-87. — doi: 10.1016/j.jchf.2015.08.006.

/19-1.jpg)
/20-1.jpg)