Введение
В настоящее время острые респираторные инфекции (ОРИ) остаются важнейшим патогенным фактором, неблагоприятно влияющим на состояние здоровья детей. Несмотря на определенные достижения медицины, и в частности педиатрии, в разработке новых методов профилактики ОРИ у детей, заболевания респираторного тракта устойчиво занимают первое место в структуре острой инфекционной патологии у детей [10, 30].
В настоящее время особенностью течения заболеваний детского возраста является наличие двух взаимосвязанных и взаимообусловленных процессов: с одной стороны, увеличение количества случаев хронической инфекционной и неинфекционной патологии, с другой — тяжелых форм острых инфекционных заболеваний. В связи с этим для достижения оптимального терапевтического эффекта при лечении ОРИ у детей необходимо использование препаратов, воздействующих на состояние иммунной системы. Данную группу препаратов представляют иммуномодуляторы — лекарственные средства природного или синтетического происхождения, в терапевтических дозах восстанавливающие функции иммунной системы [18, 23], которые широко используют при проведении неспецифической профилактики ОРИ. Однако необходимо отметить, что большинство препаратов иммуномодулирующей группы имеют синтетическое происхождение. В связи с этим в настоящее время особое значение в педиатрической практике получили фитопрепараты как наиболее безопасные иммуномодуляторы [2–4, 6, 15, 26]. Иммуномодулирующие фитопрепараты обладают широким терапевтическим диапазоном, и их клиническое применение практически не сопровождается неблагоприятными реакциями. Фитопрепараты с иммуномодулирующим действием активируют неспецифические звенья иммунитета, способствуя рекогниции и элиминации патогенассоциированных молекулярных структур (PAMP) и самих патогенов. Неспецифическое действие иммунотропных фитопрепаратов обусловливает их способность предупреждать развитие ОРИ вне зависимости от этиологии заболевания [1, 6, 20].
В группу препаратов растительного происхождения, имеющих иммуномодулирующие свойства, входит известный фитониринговый препарат Имупрет («Бионорика СЕ», Германия). Основной действующей субстанцией препарата Имупрет является специальный экстракт BNO 1030, стандартизованный по содержанию биологически активных веществ таких лекарственных растений, как корень алтея, цветки ромашки, трава хвоща полевого, лист ореха, трава тысячелистника, кора дуба и трава одуванчика [6, 7, 24].
Иммуномодулирующее действие растительных составляющих экстракта BNO 1030 продемонстрировано результатами опытов in vivo на мышах [8, 17]. Расшифровывая механизм действия дериватов различных растений, установили, что полисахариды ромашки и алтея повышают более чем в два раза активность фагоцитов; эллагиевая кислота коры дуба способствует выживаемости мышиных тимоцитов; полисахариды эфирного масла травы тысячелистника (алкамиды, апигенин, азулен) обеспечивают противомикробную и противовоспалительную активность; тритерпеновые сапонины травы одуванчика (апигенин и лютеолин) повышают пролиферацию лимфоцитов [6]. Однако остается неизученным влияние экстракта BNO 1030 непосредственно на процессы рекогниции PAMP рецепторами TLR и модуляцию TLR-ассоциированной активности фактора транскрипции NF-kB.
Цель исследования: изучить клиническую эффективность и механизм действия экстракта BNO 1030 при профилактике острых респираторных инфекций у детей
Материалы и методы
Мы провели изучение профилактической эффективности экстракта BNO 1030. В рамках ограниченного клинического исследования было обследовано 68 детей в возрасте от 4 до 11 лет. Экстракт BNO 1030 назначался в форме капель для перорального применения или в форме таблеток, покрытых оболочкой. Препарат применялся у детей в возрасте от 4 до 6 лет по 10 капель 5–6 раз в сутки; у детей от 6 до 11 лет — по 1 таблетке или по 15 капель 5–6 раз в сутки на протяжении четырех недель перед сезоном повышенной заболеваемости острыми респираторными инфекциями (сентябрь — октябрь). Катамнестическое наблюдение проведено на протяжении 12 месяцев после окончания терапии экстрактом BNO 1030. Ни у одного ребенка не было зафиксировано непереносимости препарата или побочных эффектов его применения. Уровень экспрессии гена TLR4 определяли при помощи метода полимеразной цепной реакции в режиме реального времени (Real-time), используя окраску SYBR Green I. Определение экспрессии NF-kB в лимфоцитах и экспрессии гена TLR4 проводилось в НИИ генетических и иммунных основ развития патологии и фармакогенетики ВГУУУ «Украинская медицинская стоматологическая академия» (г. Полтава). Для оценки концентрации в сыворотке крови sCD14 применяли метод твердофазного иммуноферментного анализа (ELISA) (лаборатория «Диагностический центр медицинской академии», г. Днепр).
Статистическую обработку полученных результатов проводили с помощью пакетов компьютерных статистических программ Matstat, Statistica 6.0. При изучении значимости различий статистических выборок использовались пара- и непараметрические критерии. Достоверность различий при распределении, отличном от нормального, оценивалась с помощью U-критерия Манна — Уитни, для данных с нормальным распределением — t-критерия Стьюдента. Статистически значимыми считали различия при P < 0,05.
Результаты
Установлено, что у лиц, получивших на протяжении 4 недель экстракт BNO 1030, наблюдалось достоверное снижение кратности ОРИ (в 1,7 раза; P < 0,05) на протяжении года катамнестического наблюдения (рис. 1).
У детей, получивших экстракт BNO 1030, также отмечалось достоверное укорочение продолжительности последующих ОРИ (в среднем на 1,4 суток, P < 0,05). До проводимой профилактической терапии продолжительность ОРИ в среднем составляла 7,7 ± 04 суток, после — 6,3 ± 05 суток. Подобные результаты были получены ранее во время исследований профилактической эффективности препарата Имупрет, проведенных М. Риммеле [16] и О.А. Цодиковой [19].
Согласно результатам исследования М. Риммеле [16], профилактический прием препарата Имупрет школьниками по 1 таблетке 2 раза в сутки в течение 25 дней значительно снижает (в 3,6 раза) риск развития ОРИ и сопоставим с эффектом противогриппозной сезонной вакцинации. Также показано, что применение препарата Имупрет способствует существенному сокращению продолжительности ОРИ (до 4,6 дня) по сравнению с вакцинированными (5,3 дня).
О.А. Цодикова [19] установила, что в результате применения фитопрепарата Имупрет у детей (до 80 %) восстанавливается физиологический тип неспецифических механизмов адаптации. Автор подчеркивает, что, согласно данным катамнестического наблюдения на протяжении 9 месяцев, применение данного препарата приводит к снижению частоты возникновения последующих ОРИ, уменьшению продолжительности острого респираторного эпизода и увеличению частоты неосложненного течения ОРИ.
Мы отметили, что ОРИ у детей, получивших профилактический курс экстракта BNO 1030, преимущественно протекали легко (частота легкого течения последующих ОРИ увеличилась с 55,9 до 75,0 %) и без развития бактериальных осложнений (рис. 2).
В целом общая сумма дней всех инфекционных эпизодов уменьшилась с 47 ± 3,4 до 26 ± 2,8 суток. Также достоверно уменьшилось количество назначений антибиотиков: с 3,4 ± 0,4 до 1,6 ± 0,2 раза в году (P < 0,05) (рис. 3).
/29-1.jpg)
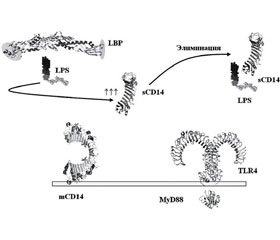
Учитывая, что в функционировании TLR4 принимают участие несколько вспомогательных молекул — липополисахаридсвязывающий протеин (lipopolysaccharide binding protein — LBP), молекулы sCD14, mCD14, мембраноассоциированный аксессуарный фактор 2 миелоидной дифференцировки (accessory protein myeloid differentiation factor 2 — MD-2) [21], мы провели исследование содержания sCD14 как ключевой молекулы, которая определяет транспортировку PAMP патогенов на «стоковые» структуры. Так, первоначально в экстрацеллюлярном пространстве липополисахарид (lipopolysaccharide — LPS) связывается с солютабным LBP, который функционирует как опсонин для гликозилфосфатидилинозитол (GPI)-связанного белка CD14. Протеин CD14 существует в двух формах — солютабной (sCD14) и мембраносвязанной (mCD14) молекулы. Взаимодействие с sCD14 комплекса LPS/LBP предопределяет передачу LPS сывороточным липопротеинам высокой плотности, которые служат своеобразным «стоком», обеспечивающим элиминацию LPS из организма. Таким образом, молекула sCD14 предупреждает возможность достижения LPS рецептора TLR4 и возбуждения TLR4-ассоциированных провоспалительных сигнальных путей, то есть действует как противовоспалительный агент. Липополисахариды, не элиминированные sCD14-механизмом, в комплексе LPS/LBP взаимодействуют с mCD14, что приводит к последующему связыванию LPS с мембраноассоциированным протеином MD-2 [22]. U. Ohto и соавт. [27], исследуя молекулярную структуру гликопротеина MD-2, показали, что на поверхности данного белка существует глубокий гидрофобный карман, который физически взаимодействует с четырьмя ацильными цепями липида IVА. В последующем каскаде молекулярных реакций комплекс LPS/MD-2 взаимодействует с TLR4, вызывая его димеризацию и возбуждение внутриклеточного домена (рис. 4) [25, 28].
/30-1.jpg)
Образование LPS/TLR4/MD-2 приводит к активации внутриклеточных сигнальных путей, которые обусловливают активацию фактора транскрипции NF-κB. В последующем взаимодействие двух LPS/TLR4/MD-2 комплексов приводит к формированию мультимерного рецепторного комплекса, который интернализируется и сохраняется в эндосомах клетки. Мультимер LPS/TLR4/MD-2, находясь на мембране ранней эндосомы, рекрутирует адаптерные молекулы TRAM, TRIF и активирует фактор транскрипции IRF3, что ведет к продукции IFN-β [29].
Таким образом, активация TLR4 соответствующими лигандами, из которых ключевым является LPS грамотрицательных бактерий, представляет собой процесс передачи лиганда на эктодомен TLR4 следующими последовательностями: 1) LPS (LBP → sCD14) элиминация из организма; 2) LPS (LBP → mCD14 → MD-2) TLR4 и возбуждение механизмов воспаления. Активация продукции sCD14 или ингибирование каждого компонента внеклеточного сигнального пути, ведущего к развитию воспаления, могут быть использованы при проведении противовоспалительной терапии.
Полученные нами данные свидетельствуют, что после профилактического приема экстракта BNO 1030 происходило достоверное повышение концентрации молекулы sCD14 в сыворотке крови на фоне практически неизменного уровня экспрессии TLR4 (табл. 1).
После профилактического курса приема экстракта BNO 1030 у детей происходило достоверное снижение активности основного провоспалительного фактора транскрипции NF-kB (табл. 2). Особый интерес представляют собой данные, свидетельствующие о том, что степень снижения активности NF-kB была ассоциирована с легким течением последующих ОРИ.
Обсуждение
Полученные нами результаты влияния экстракта BNO 1030 на состояние иммунной системы несколько противоречат результатам других исследований. В частности, продемонстрировано, что экстракт BNO 1030 способствует дозозависимому увеличению количества клеток с оксидативным взрывом, тем самым усиливая внутриклеточный киллинг патогенов. Показано, что при низких концентрациях экстракт BNO 1030 индуцирует секрецию IL-6, играющего ключевую роль в формировании долговременной иммунной защиты организма от чужеродных агентов, и активность макрофагов, в то время как при высоких концентрациях — активность нейтрофилов [9]. Данный дозозависимый эффект нашел свое отражение в рекомендациях по применению препарата: высокие дозы рекомендуются в острый период (6 раз в сутки), а низкие (3 раза в день) — в более поздние сроки развития инфекционных заболеваний [12]. Также было установлено, что экстракт BNO 1030 способствует увеличению представительства CD56+-клеток, CD8+ Т-лимфоцитов как в ткани миндалин, так и в периферической крови, индукции синтеза IFN-α, -γ в культуре клеток и активности антителогенеза in vivo у экспериментальных животных [11, 13, 14].
В то же время экспериментальное исследование на альвеолярных эпителиальных клетках человека позволило установить, что растительный экстракт BNO 1030 способен уменьшать секрецию ключевого воспалительного хемокина CXCL8/IL-8 и антимикробного пептида β2-дефензина (hBD-2), вызывая противовоспалительный эффект [24].
По нашему мнению, действие экстракта BNO 1030 зависит от состояния макроорганизма. Во время инфекционного процесса экстракт BNO 1030 активирует механизмы элиминации патогенов, а в период относительного клинического здоровья — индуцирует противовоспалительные эффекты за счет усиления продукции sCD14 и подавления активности фактора транскрипции NF-kB.
По всей вероятности, применение экстракта BNO 1030 обусловливает восстановление состояния резистентности или толерантности макроорганизма к инфекционным респираторнотропным патогенам. Учитывая клинические данные, можно считать, что иммуномодулирующее действие экстракта BNO 1030 заключается в усилении продукции молекулы sCD14, которая предупреждает взаимодействие PAMP с mCD14 и активацию TLR4 макроорганизма (рис. 5).
Выводы
Детям в предэпидемический период с профилактической целью рекомендуется назначение экстракта BNO 1030 на протяжении одного месяца.
Применение экстракта BNO 1030 у детей снижает частоту развития острых респираторных инфекций, способствует более легкому и неосложненному течению последующих респираторных эпизодов, уменьшая вероятность применения антибактериальных средств.
Экстракт BNO 1030 обладает противовоспалительным действием за счет усиления продукции солютабной молекулы CD14, которая препятствует взаимодействию некоторых патогенассоциированных молекулярных структур с TLR4, и подавления активности фактора транскрипции NF-kB.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Абатуров А.Е. Современные возможности фитоиммуномодуляции при лечении заболеваний у детей / А.Е. Абатуров, Е.А. Агафонова // Здоров’я України, тематичний номер «Педіатрія». — 2015 (вересень). — № 3(34). — С. 24-26.
2. Абатуров А.Е., Борисова Т.П. Применение иммуномодулятора растительного происхождения в комплексном лечении заболеваний детского возраста // Современная педиатрия. — 2016. — № 2(74). — С. 66-72.
3. Булгакова В.А. Современные возможности диагностики, лечения и профилактики респираторных инфекций у детей // Фарматека. — 2013. — № 4(257). — С. 32-40.
4. Гончарова О.В., Куранов Г.В. Новые подходы к лечению острых респираторных инфекций и профилактике бактериальных осложнений у часто болеющих детей // РМЖ. — 2016. — Т. 24, № 18. — С. 1183-1186.
5. Зайцева О.В. Профилактика рекуррентных респираторных инфекций у детей при помощи бактериальных лизатов // Российский аллергологический журнал. — 2015. — № 4. — С. 52-59.
6. Зупанец И.А. Растительные иммунокорректоры в профилактике и лечении ОРВИ / И.А. Зупанец, Т.С. Сахарова, Н.П. Безуглая // Ліки України. — 2014. — № 9(185). — С. 36-40.
7. Інструкція із застосування препарату Імупрет UA/6909/02/01 // Наказ МОЗ України № 568 від 26.07.2012.
8. Коваленко Л.П. Иммунокорригирующие свойства фитопрепарата Тонзилгон Н / Л.П. Коваленко, Е.В. Шилаева, И.И. Кольченко // Российский медицинский журнал. — 2008. — Т. 16, № 25. — С. 1677-1679.
9. Комбинированный растительный препарат укрепляет иммунитет // Medical Nature. — 2011. — № 8. — С. 30-32.
10. Крамарьов С.О., Євтушенко В.В. Підходи до антибактеріальної терапії гострих респіраторних інфекцій у дітей // Актуальная инфектология. — 2015. — № 1(6). — С. 7-12.
11. Мельников О.Ф. Влияние фитоиммуномодулятора «Имупрет» на факторы противовирусного иммунитета in vitro / О.Ф. Мельников, Л.Д. Кривохатская, М.Д. Тимченко и др. // Ринологія. — 2012. — № 2. — С. 9-13.
12. Мельников О.Ф. Иммуномодуляция фитопрепаратами в терапии воспалительных заболеваний верхних дыхательных путей (экспериментальные и клинико-иммунологические исследования) / О.Ф. Мельников, Н.А. Пелешенко, Д.Д. Заболотная, О.Г. Рыльская. — К., 2013. — 108 с.
13. Мельников О.Ф. Имупрет как фитоиммуномодулятор и адаптоген / О.Ф. Мельников, О.Г. Рыльская, А.В. Цимар, Н.А. Пелешенко // Medical Nature. — 2013. — № 2(14). — С. 70-74.
14. Мельников О.Ф. Экспериментальное исследование иммуномодулирующих свойств Тонзилгона Н in vitro / О.Ф. Мельников, О.Г. Рыльская // Журнал вушних, носових і горлових хвороб. — 2005. — № 3. — С. 74-76.
15. Петров В.А., Горелов А.В., Медведева Т.О. Клинико-экономическая оценка применения лекарственных препаратов для профилактики и лечения ори у детей // Детские инфекции. — 2012. — Т. 11, № 3. — С. 46-51.
16. Риммеле М. Здоровье в сезон простуд благодаря комбинированному растительному препарату // Medical nature. — 2011. — № 5. — С. 29-31.
17. Федорова О.А. Фитоиммунокоррекция в формате современных медицинских технологий и стандартов. Имупрет — опыт и перспективы клинического применения // Український медичний часопис. — 2014. — № 2 (100). — С. 87-94.
18. Хаитов Р.М. Современные иммуномодуляторы: основные принципы их применения / Р.М. Хаитов, Б.В. Пинегин // Иммунология. — 2000. — № 5. — С. 4-7.
19. Цодікова О.А. Вплив фітопрепарату «Імупрет» на індексні показники периферичної крові дітей з рецидивними респіраторними інфекціями // Современная педиатрия. — 2012. — № 4. — С. 122-127.
20. Anheyer D. Herbal medicine in children with respiratory tract infection: systematic review and meta-analysis / D. Anheyer, H. Cramer, R. Lauche et al. // Acad. Pediatr. — 2017, Jun 10. — pii: S1876-2859(17)30358-3. doi: 10.1016/j.acap.2017.06.006. PMID: 28610802.
21. Balistreri C.R. Toll-like receptor-4 signaling pathway in aorta aging and diseases: “its double nature“ / C.R. Balistreri, G. Ruvolo, D. Lio, R. Madonna // J. Mol. Cell. Cardiol. — 2017, Jun 28. — pii: S0022-2828(17)30122-0. doi: 10.1016/j.yjmcc.2017.06.011.
22. Billod J.M. Computational Approaches to Toll-Like Receptor 4 Modulation / J.M. Billod, А. Lacetera, J. Guzmán-Caldentey, S. Martín-Santamaría // Molecules. — 2016, Jul 30. — 21(8). — pii: E994. doi: 10.3390/molecules21080994.
23. Chen L., Yu J. Modulation of Toll-like receptor signa–ling in innate immunity by natural products // Int. Immunopharmacol. — 2016 Aug. — 37. — Р. 65-70. doi: 10.1016/j.intimp.2016.02.005.
24. Hostanska K. Suppression of interleukin (IL)-8 and human beta defensin-2 secretion in LPS-and/or IL-1β-stimulated airway epithelial A549 cells by a herbal formulation against respiratory infections (BNO 1030) / K. Hostanska, J. Melzer, A. Amon, R. Saller // J. Ethnopharmacol. — 2011, Mar 24. — 134(2). — Р. 228-33. doi: 10.1016/j.jep.2010.12.006.
25. Jerala R. Structural biology of the LPS recognition // Int. J. Med. Microbiol. — 2007 Sep. — 297(5). — Р. 353-63. doi: 10.1016/j.ijmm.2007.04.001.
26. Li J., Li J., Zhang F. The immunoregulatory effects of Chinese herbal medicine on the maturation and function of dendritic cells // J. Ethnopharmacol. — 2015, Aug 2. — 171. — Р. 184-95. doi: 10.1016/j.jep.2015.05.050.
27. Ohto U., Fukase K., Miyake K., Satow Y. Crystal structures of human MD-2 and its complex with antiendotoxic lipid Iva // Science. — 2007, Jun 15. — 316(5831). — Р. 1632-4. doi: 10.1126/science.1139111.
28. Park B.S., Lee J.O. Recognition of lipopolysaccharide pattern by TLR4 complexes // Exp. Mol. Med. — 2013, Dec 6. — 45. — e66. doi: 10.1038/emm.2013.97.
29. Płóciennikowska A. Co-operation of TLR4 and raft proteins in LPS-induced pro-inflammatory signaling / A. Płóciennikowska, A. Hromada-Judycka, K. Borzęcka, K. Kwiatkowska // Cell. Mol. Life Sci. — 2015 Feb. — 72(3). — Р. 557-81. doi: 10.1007/s00018-014-1762-5.
30. Shi T. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in young children in 2015: a systematic review and modelling study / T. Shi, D.A. McAllister, K.L. O’Brien et al. // Lancet. — 2017, Jul 6. — pii: S0140-6736(17)30938-8. doi: 10.1016/S0140-6736(17)30938-8.

/28-1.jpg)
/29-1.jpg)
/30-1.jpg)
/31-1.jpg)