Резюме
Актуальність. У структурі дерматологічної захворюваності питома вага атопічного дерматиту (АД) становить до 20,0 %. Тяжкість АД корелює з ураженням шлунково-кишкового тракту, що пояснює необхідність комплексної терапії даної патології. На думку практично всіх фахівців з імунології та алергології, єдиним методом, здатним впливати на всі ланки патологічного процесу, є алергенспецифічна імунотерапія (АСІТ). Мета: визначити ефективність застосування методу АСІТ в дітей із атопічним дерматитом у поєднанні з патологією верхніх відділів шлунково-кишкового тракту. Матеріали та методи. У роботі подані матеріали клінічного спостереження, клініко-лабораторного й інструментального обстеження 168 дітей віком від 7 до 18 років із АД у поєднанні з хронічним гастродуоденітом (ХГД). Порівняльну оцінку різних варіантів лікування проводили в 50 дітей: основна група — 25 дітей із АД і ХГД, яким поряд із традиційною терапією на етапі амбулаторного лікування проводили АСІТ за стандартною схемою протягом року, групу порівняння становили 25 дітей із поєднаною патологією, які отримували базову терапію. Результати. Клінічна симптоматика в дітей із ХГД у поєднанні з АД характеризувалася наявністю провідних синдромів: больового (98,8 ± 8,9 % хворих), диспептичного (91,6 ± 11,2 % хворих), інтоксикаційного (79,1 ± 7,2 % хворих) і шкірного (100 %). У групі дітей, які отримували АСІТ, середні рівні індексу SСORAD через три місяці після лікування знижувались на 61,8 %, через один рік після проведеного лікування — на 42,6 %. Відповідні показники в групі порівняння знижувались на 41,3 та 24,9 % (р < 0,05) відповідно. Застосування комплексного лікування дітей із АД і ХГД дозволило скоротити на 27,8 % термін купірування больового, на 14,0 % — диспептичного й на 25,0 % — астеновегетативного синдромів. Визначено, що відносний ризик розвитку рецидивів захворювання знизиться в 0,48 раза (χ2 = 3,96, р < 0,05) при включенні даної терапії в схему лікування. Висновки. Проведене клінічне дослідження продемонструвало позитивний вплив комплексного лікування із включенням АСІТ на показники клінічного перебігу АД у поєднанні з ХГД. Запропонована комплексна терапія була більш ефективною порівняно з традиційним лікуванням навіть у віддалені терміни спостереження.
Актуальность. В структуре дерматологической заболеваемости удельный вес атопического дерматита (АД) составляет до 20,0 %. Тяжесть АД коррелирует с поражением желудочно-кишечного тракта. По мнению практически всех специалистов по иммунологии и аллергологии, единственным методом, который способен влиять на все звенья патологического процесса, является аллергенспецифическая иммунотерапия (АСИТ). Цель: определить эффективность применения метода АСИТ у детей с атопическим дерматитом в сочетании с патологией верхних отделов желудочно-кишечного тракта. Материалы и методы. В работе представлены материалы клинического наблюдения, клинико-лабораторного и инструментального обследования 168 детей в возрасте от 7 до 18 лет с АД в сочетании с хроническим гастродуоденитом (ХГД). Сравнительную оценку различных вариантов лечения проводили у 50 детей: основная группа — 25 детей с АД и ХГД, которым наряду с традиционной терапией на этапе амбулаторного лечения проводили АСИТ по стандартной схеме в течение года, группу сравнения составили 25 детей с сочетанной патологией, получавших базовую терапию. Результаты. Клиническая симптоматика у детей с ХГД в сочетании с АД характеризовалась наличием ведущих синдромов: болевого (98,8 ± 8,9 % больных), диспептического (91,6 ± 11,2 % больных), интоксикационного (79,1 ± 7,2 % больных) и кожного (100 %). В группе детей, получавших АСИТ, средние уровни индекса SСORAD через три месяца после лечения снижались на 61,8 %, через год после проведенного лечения — на 42,6 %. Соответствующие показатели в группе сравнения снижались на 41,3 и 24,9 % (р < 0,05) соответственно. Применение комплексного лечения детей с АД и ХГД позволило сократить на 27,8 % срок купирования болевого, на 14,0 % — диспептического и на 25,0 % — астеновегетативного синдромов. Установлено, что относительный риск развития рецидивов заболевания снизится в 0,48 раза (χ2 = 3,96, р < 0,05) при включении данной терапии в схему лечения. Выводы. Проведенное клиническое исследование продемонстрировало положительное влияние комплексного лечения с включением АСИТ на показатели клинического течения АД в сочетании с ХГД. Предложенная комплексная терапия была более эффективной по сравнению с традиционным лечением даже в отдаленные сроки наблюдения.
Background. In the structure of dermatological morbidity, the specific weight of atopic dermatitis (AD) is up to 20.0 %. The severity of AD correlates with the lesion of the gastrointestinal tract. In the opinion of almost all immunology and allergology specialists, allergen specific immunotherapy (ASIT) is the only method that is able to influence all links of the pathological process. The purpose was to determine the effectiveness of the ASIT in children with atopic dermatitis combined with the pathology of the upper gastrointestinal tract. Materials and methods. The paper presents data of clinical observation, clinical laboratory and instrumental examination of 168 children aged 7 to 18 years with AD combined with chronic gastroduodenitis (CGD). A comparative evaluation of the different treatment options was carried out in 50 children: the main group of 25 children with AD and CGD who, along with the traditional therapy as a part of outpatient treatment, underwent ASIT according to the standard schedule during the year, the comparison group consisted of 25 children with combined pathology who received standard therapy. Results. Clinical symptoms in children with CGD combined with AD were characterized by the presence of leading syndromes: pain (98.8 ± 8.9 % of patients), dyspepsia (91.6 ± 11.2 % of persons), intoxication (79.1 ± 7.2 % of patients) and cutaneous (100 %). In the group of children receiving ASIT, the mean levels of the Scoring Atopic Dermatitis index decreased by 61.8 % three months after treatment, and one year after the treatment — by 42.6 %. The corresponding indices in the comparison group decreased by 41.3 and 24.9 %, respectively (р < 0.05). The use of comprehensive treatment in children with AD and CGD reduced by 27.8 % the period of pain relief, by 14.0 % — of dyspepsia and by 25.0 % — of asthenovegetative syndromes. It was found that the relative risk of disease recurrence will decrease by 0.48 times (χ2 = 3.96, p < 0.05) when this therapy is included in the treatment regimen. Conclusions. The clinical study demonstrated the positive effect of comprehensive treatment with the inclusion of ASIT on the clinical course of AD combined with CGD. The proposed comprehensive therapy was more effective than traditional treatment even in long-term follow-up.
Вступ
Поширеність алергічних захворювань (АЗ) останніми роками набула розмірів епідемії й зростає в усьому світі [1]. До цих захворювань належать бронхіальна астма, алергічний риніт, алергічний кон’юнктивіт, атопічний дерматит (АД), кропив’янка, медикаментозна й харчова алергія, алергія на укуси комах, анафілаксія, ангіоневротичний набряк. За прогнозами ВООЗ, до 2050 року від різноманітних алергозів буде страждати більша частина населення планети, при цьому алергеном може виступати будь-яка речовина, а ХХІ століття стане епохою алергії [2].
У структурі АЗ особливе місце посідає АД [3], оскільки він є одним із перших і найчастіших проявів алергії; нерідко трансформується надалі в інші форми алергії; суттєво знижує якість життя дітей незалежно від віку; потребує тривалого й етапного лікування й реабілітації [4].
АД — важлива медико-соціальна проблема, оскільки істотно змінився патоморфоз атопічного дерматиту, який проявляється дуже ранньою маніфестацією, збільшенням частоти тяжкого перебігу, розширенням площі тяжкого перебігу, підвищенням частки ускладнених форм хвороби й істотним впливом хвороби на економічний статус сім’ї [5].
Відповідно до сучасних даних, поширеність АД серед дітей у світі становить від 12,0 до 37,0 %, що значно перевищує відповідний показник у дорослих (близько 0,2–2,0 %). У структурі дерматологічної захворюваності частка цієї нозології становить до 20,0 %, а у структурі АЗ — від 50,0 до 75,0 % [6]. Високий рівень захворюваності, дебют у ранньому дитячому віці, часто безперервно рецидивуючий перебіг патологічного процесу, тенденція до збільшення стійких до традиційної терапії форм захворювання й зниження прихильності пацієнтів до лікування надають питанням причинних факторів розвитку захворювання і його ускладнених форм особливої актуальності.
Особливий інтерес викликає поєднання патології шлунково-кишкового тракту з алергічними хворобами. Діти, хворі на АД, скаржаться на шлунково-кишкові розлади. Як і раніше, на сьогодні відсутні наукові дослідження шлунково-кишкових уражень у цих дітей. У структурі захворювань верхніх відділів шлунково-кишкового тракту 45–55 % припадає на частку хронічного гастродуоденіту (ХГД), у 30–35 % випадків реєструються функціональні порушення, у 1–4 % — виразка шлунка й дванадцятипалої кишки, у 6–24 % — інша патологія. Більшість дослідників підкреслюють єдиний механізм виникнення поєднаної патології — імуноалергічний [1, 3]. Морфологічно в таких пацієнтів визначається алергічний процес у слизових оболонках і шкірі. Тяжкість АД корелює з ураженням шлунково-кишкового тракту, що пояснює необхідність комплексної терапії даної патології.
Сучасна стратегія лікування АД у дітей заснована на принципах доказової медицини, узагальнена у висновках ІІ Міжнародної об’єднаної конференції з АД (International Consensus Conference on Atopic Dermatitis, ICCAD) [7]. З метою уніфікації різних підходів до діагностики й лікування АД Європейська академія алергології й клінічної імунології (European Academy of Allergy and Clinical Immunology, EAACI) разом з Американською академією алергії, астми й імунології (American Academy of Allergy, Asthma & Immunology, AAAAI) створила робочу групу PRAСTALL (Practical Allergology Consensus Report) [8]. Більшість дослідників прогнозують подальше зростання алергії, що диктує пошук нових способів вирішення проблеми, зокрема впровадження сучасних методів діагностики, лікування й профілактики. На думку практично всіх фахівців із імунології й алергології, єдиним методом, що здатний впливати на всі ланки патологічного процесу при АЗ, сформувати толерантність до впливу антигенів, що викликали цей патологічний процес, є алергенспецифічна імунотерапія (АСІТ) [9–15].
Мета дослідження: визначити ефективність застосування методу АСІТ у дітей з атопічним дерматитом у поєднанні з патологією верхніх відділів шлунково-кишкового тракту.
Матеріали та методи
У роботі подані матеріали клінічного спостереження, клініко-лабораторного й інструментального обстеження 168 дітей віком від 7 до 18 років із АД у поєднанні з ХГД, які перебували на амбулаторному й стаціонарному лікуванні. Дослідження проводились протягом 2012–2017 років. Середній вік дітей становив 11,1 ± 0,7 року, серед них було 108 хлопчиків і 60 дівчаток. Критеріями включення були: вік пацієнтів від 7 до 18 років; проживання в Чернівецькій області; підтверджений діагноз АД у поєднанні з ХГД. Критеріями виключення були: вік дітей до 1 року; шкірні захворювання інфекційно-запального, паразитарного й автоімунного генезу, генодерматози, контактні дерматити, наявність вродженого імунодефіциту, шкірні прояви системних захворювань, метаболічних порушень і неопластичних процесів. Контрольну групу становили 30 практично здорових дітей. Критеріями включення дітей у конт–рольну групу були: відсутність алергічного захворювання, необтяжений спадковий анамнез з атопії; відсутність хронічних захворювань, у тому числі шлунково-кишкового тракту, інфекційних захворювань упродовж 3 місяців до моменту обстеження; відповідність показників загального аналізу крові й сечі віковій нормі.
Для встановлення діагнозу АД використовували клінічні дані, результати загальних і спеціальних лабораторно-інструментальних обстежень згідно із загальновизнаними діагностичними критеріями J.M. Hanifin та G. Rajka (1980), клінічною класифікацією АД відповідно до затвердженого Наказом МОЗ України № 670 від 04.07.2016 року уніфікованого клінічного протоколу первинної, вторинної (спеціалізованої), третинної (високоспеціалізованої) допомоги «Атопічний дерматит», Наказу МОЗ України № 767 від 27.12.2005 року «Про затвердження Протоколів діагностики та лікування алергологічних хвороб у дітей», адаптованої клінічної настанови, заснованої на доказах, «Атопічний дерматит» Державного експертного центру МОЗ України від 2016 року. Діагноз захворювань верхніх відділів шлунково-кишкового тракту в дітей виставляли згідно з уніфікованим протоколом «Дитяча гастроентерологія» (Наказ МОЗ України від 29.01.2013 № 53). Діти розподілені на групи за періодом клінічного перебігу АД (гострий, підгострий, ремісія). Оцінка тяжкості перебігу АД проводилась напівкількісним методом за індексом SСORAD (Scoring of Atopik Dermatitis), розробленим Європейською робочою групою експертів. У кожній групі обстежувані були розподілені на підгрупи за віком і тяжкістю клінічного перебігу захворювання (легкий, середньотяжкий, тяжкий). Порівняльну оцінку різних варіантів лікування проводили в 50 дітей, які методом рандомізації були розділені на дві групи. В основну групу увійшли 25 дітей з АД та ХГД, яким поряд із традиційною терапією на етапі амбулаторного лікування проводили АСІТ за стандартною схемою протягом року, групу порівняння становили 25 дітей із поєднаною патологією, які отримували базову терапію. Усі групи обстежених дітей були стандартизовані за базовою терапією згідно з наказами МОЗ України № 670 від 04.07.2016 та № 53 від 29.01.2013. АСІТ проводили за стандартною схемою згідно з методичними рекомендаціями, розробленими Асоціацією алергологів України від 02.12.2014, «Алерген-специфічна імунотерапія алергічних захворювань».
Усі дослідження проводились після підписання інформованої згоди дітьми й батьками. У роботі дотримані етичні принципи щодо людей, які виступають суб’єктами дослідження, з урахуванням основних положень GCР ІCH та Гельсінської декларації Всесвітньої медичної асоціації з біомедичних досліджень, у яких людина виступає їх об’єктом (World Medical Association Declaration of Helsinki 1964, 2000, 2008), Конвенції Ради Європи про права людини й біомедицину (2007 р.)
Статистична обробка результатів досліджень здійснювалась за допомогою стандартних алгоритмів варіаційної статистики, для розрахунків використовувалась комп’ютерна програма Excel (Microsoft Office, USA), Statistica 6.0 та on-line калькулятор SISA (Simple Interactive Statistical Analysis) із застосуванням кореляційного й параметричного аналізу. Середні величини подані у вигляді M ± m, де М — середнє значення показника, m — стандартна похибка середнього; n — обсяг аналізованої –групи.
Результати та обговорення
Розподіл дітей за віком і тривалістю АД у поєднанні з ХГД поданий у табл. 1.
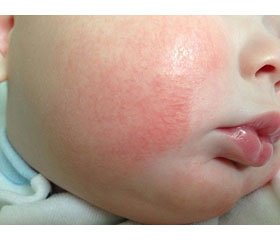
Клінічна симптоматика в дітей із ХГД у поєднанні з АД характеризувалася наявністю провідних синдромів: больового (98,8 ± 8,9 % хворих), диспептичного (91,6 ± 11,2 % хворих), інтоксикаційного (79,1 ± 7,2 % хворих) та шкірного (100 %). Аналіз поширення запального процесу слизової оболонки шлунка й дванадцятипалої кишки показав наявність у хворих дітей антрального гастриту: I ступеня активності — у 40 осіб (23,8 %), II ступеня — у 100 осіб (59,5 %), III ступеня — у 28 осіб (16,7 %); дуоденіту: I ступеня активності — у 42 осіб (25,0 %), II ступеня — у 98 осіб (58,3 %), III ступеня — у 28 осіб (16,7 %).
Тяжкість шкірних проявів АД у дітей оцінювали за шкалою SСORAD (табл. 2, 3).
У дітей віком 7–10 років значно рідше уражалась ділянка обличчя, водночас висипання були чітко локалізовані, обмежені періорбітально, періорально, помітно вища частота локалізації висипань на верхніх і нижніх кінцівках, особливо на згинальних поверхнях. У дітей віком 11–15 років рідше, ніж у молодших дітей, спостерігалось ураження обличчя, найчастіше вражалися згинальні поверхні верхніх і нижніх кінцівок. У всіх дітей реєструвався шкірний свербіж, інтенсивність якого є одним із критеріїв тяжкості захворювання. Свербіж був легким, епізодичним, не порушував сон, працездатність і загальний стан у 24,2 % дітей; сильний постійний свербіж, що викликав появу на шкірі глибоких розчосів, порушував нічний сон, знижував працездатність і –зумовлював неспокій, відмічався в 75,8 % дітей.
Запропонована комплексна терапія з поєднаним використанням АСІТ виявилася ефективною, що підтверджувалось регресом клінічних проявів запального процесу на шкірі. Відмічалось зменшення площі й інтенсивності висипань на шкірі, свербежу, нормалізація самопочуття та сну. Разом з тим регрес шкірних проявів залежав від морфологічного варіанта АД. При ексудативній формі спостерігалось зменшення ексудації, набряку, підсихання ерозивних поверхонь, утворення кірочок, лусочок з наступною епітелізацією. При еритематозно-сквамозній формі відмічалось поступове зменшення еритеми й інфільтративних змін, епітелізація екскоріацій і тріщин, регрес папул, утворення лусочок, посилення дрібнопластинчастого лущення на уражених ділянках. При ліхеноїдній формі спостерігалось поступове зменшення еритеми, екскоріацій, згладжування шкірного рисунка, проте чітко обмежені вогнища ліхеніфікації в типових місцях зберігались, утримувались потовщення й дисхромія шкіри. Загалом при виписці із стаціонару в більшості дітей утримувались залишкові явища у вигляді підвищеної сухості шкіри, велико- й дрібнопластинчастого лущення (табл. 4).
/52-1.jpg)
Аналіз показників поширеності патологічного процесу на шкірі залежно від застосованого лікування показав швидше зменшення площі ураження на фоні комплексної терапії з АСІТ у дітей із АД і ХГД порівняно з традиційним лікуванням. Спостерігалось зменшення площі поширення проявів патологічного процесу на шкірі в дітей основної групи на фоні АСІТ, і більш вираженим воно було при легкому й середньотяжкому перебігу, меншим — у випадку тяжкого перебігу захворювання (р < 0,05).
Інтенсивність запальних змін на шкірі загалом також піддавалась швидкому регресу під впливом обох схем лікування. При цьому кращий результат через один місяць відмічався в дітей основної групи порівняно із пацієнтами групи порівняння. Водночас на фоні традиційного лікування через один рік інтенсивність запальних змін на шкірі знову зростала, на той час як у групі дітей, які отримували запропоновану комплексну терапію з АСІТ, на фоні лікування через один рік інтенсивність запальних змін на шкірі й далі зменшувалась. Оцінка й аналіз суб’єктивних проявів показали, що під впливом лікування відмічалося покращення самопочуття хворих, зменшувався свербіж шкіри, нормалізувався сон, причому до початку лікування суб’єктивні симптоми в дітей із АД були вірогідно більш вираженими (р < 0,05). Під впливом обох схем лікування середні значення інтенсивності свербежу й показники порушення сну зменшувалися.
З метою оцінки ефективності проведеної терапії в дітей з АД у поєднанні з ХГД визначали середні рівні індексу SСORAD, динаміка якого залежала від термінів і способу лікування (табл. 5).
У групі дітей, які отримували АСІТ, середні рівні індексу SСORAD через три місяці після лікування знижувались на 61,8 %, через один рік після проведеного лікування — на 42,6 %. Відповідні показники в групі порівняння знижувались на 41,3 і 24,9 % (р < 0,05).
У групі дітей з АД та ХГД, які отримували комплексну терапію з включенням АСІТ, тенденція до зниження середніх рівнів об’єктивних, суб’єктивних проявів та індексу SCORAD спостерігалась через один місяць, і в подальшому тривало цих показників через три місяці й один рік після початку лікування. У групі дітей з АД та ХГД, які отримували традиційну терапію, максимальний терапевтичний ефект і тенденція до зниження середніх рівнів об’єктивних, суб’єктивних проявів та індексу SCORAD спостерігалась також через один місяць після лікування, проте в подальшому відновлювалась клінічна симптоматика захворювання з поступовим повторним зростанням середніх рівнів об’єктивних, суб’єктивних проявів та індексу SCORAD (р < 0,05).
Середня тривалість купірування больового синдрому в дітей становила в групі порівняння 3,6 ± 0,2 дня, в основній групі — 2,6 ± 0,9 дня, p < 0,001. Прояви диспептичного синдрому нівелювались упродовж 5,3 ± 0,3 дня в дітей групи порівняння й 4,3 ± 0,2 дня — в основній групі (p < 0,01). Ознаки астеновегетативного синдрому в дітей групи порівняння зникали на 8-му — 10-ту добу, на той час як у дітей основної групи — на 6-ту — 7-му добу. Отже, застосування комплексного лікування дітей із АД і ХГД дозволило скоротити на 27,8 % термін купірування больового, на 14,0 % — диспептичного й на 25,0 % — астеновегетативного синдромів. Середня тривалість перебування в стаціонарі хворих, які отримували терапію з додаванням АСІТ, також скоротилась (на 18,8 %) порівняно з особами групи порівняння.
Визначення основних показників оцінки ефективності лікування дітей з АД та ХГД із застосуванням АСІТ показало, що відносний ризик розвитку рецидивів захворювання знизиться в 0,48 раза (95% ДІ: 0,12–2,17) (χ2 = 3,96, р < 0,05) при включенні даної терапії в схему лікування, а число хворих, яких необхідно пролікувати для отримання одного позитивного результату, становить 2,1 (95% ДІ: 1,52–3,61).
Отже, в дітей, які отримували комбіноване лікування з включенням АСІТ, створювалися передумо–ви для швидшої ліквідації симптомів ураження верхніх відділів шлунково-кишкового тракту й меншої частоти рецидивування надалі.
Аналіз особливостей перебігу АД у дітей залежно від застосованого лікування через рік показав, що в основній групі дітей середня частота загострень на рік була рідшою, середня тривалість загострень у днях була меншою, а середня тривалість ремісії в місяцях була довшою порівняно з групою порівняння (р < 0,05).
Висновки
Проведене клінічне дослідження продемонструвало позитивний вплив комплексного лікування із включенням АСІТ на показники клінічного перебігу АД у поєднанні з ХГД. Запропонована комплексна терапія була більш ефективною порівняно із традиційним лікуванням навіть у віддалені терміни спостереження.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Weidinger S., Novak N. Atopic dermatitis // Lancet. — 2016. — 387. — 1109. doi: https://doi.org/10.1016/S0140-6736(15)00149-X.
2. Wolter S., Price H.N. Atopic dermatitis // Pediatr. Clin. North Am. — 2014 Apr. — 61(2). — 241-60. doi: 10.1016/j.pcl.2013.11.002.
3. Дудникова Э.В., Кобзева Н.Н., Приходская Е.С. и др. Особенности клинического течения атопического дерматита у детей раннего возраста // Медицинский вестник Юга России. — 2013. — № 1. — С. 44-46.
4. Ревякина В.А., Агафонов А.С. Атопический дерматит у детей и инфекции, осложняющие течение болезни // Лечащий врач. — 2011. — № 1. — С. 25-31.
5. Репецкая М.Н., Маслов Ю.Н., Шайдуллина Е.В. Клинико-лабораторная характеристика осложненных и неосложненных форм атопического дерматита у детей // Уральский медицинский журнал. — 2011. — № 3(81). — С. 30-35.
6. Гостищева Е.В. Исследование психоэмоционального статуса у детей с атопическим дерматитом // Актуальні питання фармацевтичної і медичної науки та практики. — 2013. — № 3. — С. 21-23.
7. Мельников В.Л., Рыбалкин С.Б., Митрофанова Н.Н., Агейкин А.В. Некоторые клинико-эпидемиологические аспекты течения атопического дерматита на территории Пензенской области // Фундаментальные исследования. — 2014. — № 10, ч. 5. — С. 936-940.
8. Ballow M., Akdis C.A., Casale T.B. et al. Immune response modifiers in the treatment of asthma: A PRACTALL document of the American Academy of Allergy, Asthma & Immunology and the European Academy of Allergy and Clinical Immunology // Journal of Allergy and Clinical Immunology. — 2012. — Vol. 130. — № 2. — P. 311-324. doi:10.1016/j.jaci.2012.04.046.
9. Bae J.M., Choi Y.Y., Park C.O. et al. Efficacy of allergen-specific immunotherapy for atopic dermatitis: a systematic review and meta-analysis of randomized controlled trials // J. Allergy Clin. Immunol. — 2013. — 132. — 110. doi: 10.1016/j.jaci.2013.02.044.
10. Darsow U. Allergen-specific immunotherapy for atopic eczema: updated // Curr. Opin Allergy Clin. Immunol. — 2012. — 12. — 665. doi: 10.1097/ACI.0b013e3283588cf4.
11. Tam H.H., Calderon M.A., Manikam L. et al. Specific allergen immunotherapy for the treatment of atopic eczema: a Cochrane systematic review // R.J. Allergy. — 2016 Sep. — 71(9). — 1345-56. doi: 10.1111/all.12932.
12. Berings M., Karaaslan C., Altunbulakli C. [et al.]. Advances and highlights in allergen immunotherapy: On the way to sustained clinical and immunologic tolerance // Journal of Allergy and Clinical Immunology. — 2017. — 140, 5. — 1250. doi: 10.1016/j.jaci.2017.08.025.
13. Simpson E.L., Chalmers J.R., Hanifin J.M. et al. Emollient enhancement of the skin barrier from birth offers effective atopic dermatitis prevention // J. Allergy Clin. Immunol. — 2014. — 134. — 818.doi: 10.1016/j.jaci.2014.08.005.
14. Silverberg N.B., Durán-McKinster C. Special Considerations for Therapy of Pediatric Atopic Dermatitis // Dermatol. Clin. — 2017 Jul. — 35(3). — 351-363. doi: 10.1016/j.det.2017.02.008.
15. Halling-Overgaard A.S., Zachariae C., Thyssen J.P. Management of Atopic Hand Dermatitis // Dermatol. Clin. — 2017 Jul. — 35(3). — 365-372. doi: 10.1016/j.det.2017.02.010.

/51-1.jpg)
/52-1.jpg)
/53-1.jpg)