Журнал «» №4 (60), 2018
Вернуться к номеру
Резолюція Консультативної експертної ради щодо вдосконалення підходів до ведення пацієнтів із легеневою гіпертензією в Україні
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Робоча група: Андреєва Л.М. (Полтава), Богдан Н.І. (Суми), Васильєва Л.І. (Дніпро), Водославська Л.Я. (Івано-Франківськ), Гаркуша С.Л. (Житомир), Гросман А.Б. (Дніпро), Живило І.О. (Київ), Залізна Ю.І. (Київ), Коник М.В. (Львів), Кузьмич Є.О. (Херсон), Кушнір Л.В. (Київ), Плохотнюк В.Л. (Одеса), Радченко А.Д. (Київ), Распутіна Л.В. (Вінниця), Рожанська О.М. (Рівне), Савченко І.П. (Тернопіль), Серік С.А. (Харків), Сіренко Ю.М. (Київ), Шабільянов А.В. (Миколаїв), Шандра Т.Л. (Черкаси)
Легенева гіпертензія (ЛГ) — група захворювань, що характеризуються патологічним хронічним підвищенням тиску в легеневих артеріях [1–4]. Згідно з класифікацією розрізняють 5 груп ЛГ:
1. Легенева артеріальна гіпертензія (ЛАГ).
2. ЛГ, асоційована з ураженням лівої половини серця.
3. ЛГ, асоційована із захворюваннями легенів та/або гіпоксією.
4. Хронічна тромбоемболічна легенева гіпертензія (ХТЕЛГ) та інші види обструкції легеневої артерії.
5. ЛГ із невідомими та/або багатофакторними механізмами.
До групи ЛАГ включена ідіопатична (або первинна ЛАГ) та інші вторинні ЛАГ [3–5].
ЛГ зазвичай швидко прогресує, і без призначення специфічної терапії середня тривалість життя при ідіопатичній ЛАГ становить усього 2,8 року та 6,8 року — при ХТЕЛГ [6–9].
Клінічні симптоми ЛГ неспецифічні: задишка інспіраторного характеру при фізичному навантаженні, швидка втомлюваність, слабкість, кашель, біль у грудній клітці, синкопальні стани, кровохаркання, набряки нижніх кінцівок та інші прояви правошлуночкової серцевої недостатності [5]. При деяких формах захворювання, наприклад при ХТЕЛГ на ранніх стадіях, симптоми можуть бути відсутніми. Через це діагноз більшості форм ЛГ встановити складно, і в середньому пацієнт втрачає на діагностичний пошук від двох до трьох років при ЛАГ [10–14] і близько року при ХТЕЛГ [15], хоча саме рання діагностика та призначення специфічної терапії дозволяють уповільнити прогресування хвороби і продовжити життя пацієнта на десятки років.
З діагностичної точки зору підвищення тиску в легеневій артерії (власне синдром ЛГ) є проявом і спостерігається при всіх зазначених вище клінічних формах захворювання. Діагноз ЛГ підтверджується, якщо середній тиск у легеневій артерії при прямому вимірюванні шляхом катетеризації порожнин серця (КПС) становить або перевищує 25 мм рт.ст. у стані спокою, а легеневий судинний опір дорівнює або більше 3 одиниць Вуда [5]. Згідно із затвердженим Наказом МОЗ України № 614 від 21.06.2016 Уніфікованим клінічним протоколом екстреної, первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Легенева гіпертензія у дорослих» [16] верифікація діагнозу, а також призначення специфічного лікування мають відбуватися в спеціалізованих центрах, які можуть здійснювати високотехнологічні обстеження, такі як тест 6-хвилинної ходьби, ЕХОКС, КПС, вазореактивний тест, КТ або пряма ангіопульмонографія, оцінку функції зовнішнього дихання і споживання кисню. Організація спеціалізованих центрів ЛГ є загальноприйнятою світовою практикою надання медичної допомоги таким пацієнтам.
Основним завданням лікарів, що надають первинну або вторинну медичну допомогу, є підозра, раннє виявлення ЛГ і направлення пацієнтів до спеціалізованого центру.
Ознаками, що можуть викликати підозру щодо ЛГ насамперед є дані фізикального обстеження пацієнта. Докладно із діагностичним алгоритмом можна ознайомитись в Адаптованій клінічній настанові на сайті Реєстру медико-технологічних документів Державного експертного центру МОЗ України [5].
Розмір проблеми надання спеціалізованої допомоги є завеликим для кожного окремого пацієнта з ЛГ і лікаря, який веде цього пацієнта. В об’єднанні зусиль пацієнтів та лікарів допомагають громадські організації. Із 2012 року в Україні активно діє Громадська організація «Асоціація хворих на легеневу гіпертензію» [17]. Зусиллями активістів цього об’єднання у 2017 році було забезпечено значну частину пацієнтів із ЛАГ портативними інгаляторами (небулайзерами). На сайті асоціації [17] розміщено покрокову інструкцію з використання інгалятора для проведення інгаляції препаратом, що містить ілопрост.
Завдяки зусиллям експертів, зокрема співробітників відділу симптоматичних гіпертензій державної установи «Національний науковий центр «Інститут кардіології імені академіка М.Д. Стражеска» Національної академії медичних наук України», на державному рівні було впроваджено програму за напрямком «Централізована закупівля медикаментів для лікування громадян, які страждають на легеневу артеріальну гіпертензію» [18].
Від того часу держава здійснює підтримку пацієнтів, які страждають від ЛАГ (група 1) та ХТЕЛГ (група 4), оскільки ці дві групи віднесено до переліку орфанних (рідкісних) нозологій, що мають несприятливий прогноз та для яких існують визнані методи лікування. Пацієнти з цими формами ЛГ підлягають забезпеченню ліками за Державною програмою централізованої закупівлі медикаментів.
До 2018 року із усього спектра специфічних лікарських засобів, що застосовуються в дорослих пацієнтів із ЛГ в Україні, були доступні лише два препарати: інгаляційний ілопрост (зареєстрований для лікування первинної ЛАГ), що належить до групи простагландинів (синтетичний аналог простацикліну), і силденафіл — єдиний представник групи інгібіторів фосфодіестерази 5-го типу (ФДЕ-5), зареєстрований для лікування первинної ЛАГ і ЛГ, асоційованої із захворюванням сполучної тканини [19, 20].
Як і будь-які інші лікарські засоби та предмети медичного призначення, препарати для лікування ЛАГ потрібно використовувати відповідно до інструкцій для медичного застосування, а розпочинати прийом слід тільки під контролем лікаря, який має досвід лікування ЛГ.
Ілопрост для інгаляцій в Україні зареєстровано в лікарській формі розчину, готового до застосування, в ампулах об’ємом 2 мл, по 30 ампул в упаковці. Кожна ампула містить ілопросту трометамол у кількості, еквівалентній 20 мкг ілопросту [19].
Слід зауважити, що доза, що доставляється через трубку інгалятора (небулайзера), не є тотожною кількості препарату, що міститься в ампулі. При застосуванні 2 мл препарату (тобто вмісту однієї ампули) шляхом інгаляції тривалістю 4–10 хв доза ілопросту, що доставляється через трубку інгалятора, становить близько 5 мкг. Таким чином, для однієї інгаляції, що відповідає стандартним потребам пацієнта із ЛАГ, потрібна 1 ампула ілопросту.
В інструкції для медичного застосування ілопросту для інгаляцій наведено очікувану тривалість інгаляції, що залежить від конкретної моделі небулайзера, та відповідну дозу препарату, що доставляється через трубку інгалятора [19].
Пацієнтам, стан яких стабілізовано при використанні певного інгалятора, не слід переходити на використання іншого пристрою без нагляду лікаря, оскільки різні інгалятори продукують аерозоль із дещо різними фізичними характеристиками та швидкістю доставки розчину. Це обумовлено звичайною особливістю інгаляційного шляху введення ліків: існує залежність кількості лікарського засобу, що доставляється в організм пацієнта, від розміру аерозольних крапель (так званого масмедіанного аеродинамічного діаметра), що створює небулайзер [21–46]. Завислі краплі за розміром більше ніж 5 мкм є менш летючими, а краплі розміром менше за 1 мкм можуть втрачатися під час видиху, тому лише певна частка лікарського засобу надходить у легені [26–28, 43, 44].
Хоча сучасні інгалятори забезпечують утворення аерозолю розчину лікарського засобу з переважним розміром крапель 1–5 мкм [21–24, 45, 46], обов’язково необхідно враховувати, що лише близько чверті ілопросту, що міститься в ампулі, доставляється через трубку інгалятора [19].
Початкова доза ілопросту для інгаляцій має становити 2,5 мкг ілопросту, що доставляється через трубку інгалятора. Якщо ця доза добре переноситься, тоді дозу слід збільшити до 5 мкг ілопросту та підтримувати на цьому рівні. Якщо доза 5 мкг погано переноситься, тоді дозування слід зменшити до 2,5 мкг ілопросту [19].
Вибір дозування здійснюється автоматично при використанні рекомендованих небулайзерів, або за допомогою певної небулайзерної камери та конт–рольного диску, або шляхом зміни часу інгаляції.
Для кожної інгаляції щоразу слід вводити в небулайзерну камеру вміст однієї відкритої безпосередньо перед застосуванням ампули ілопросту для інгаляцій. Після кожної інгаляції слід видалити залишки розчину з небулайзера та очистити небулайзер згідно з інструкцією щодо гігієни, наданою виробником небулайзера.
Залежно від індивідуальної потреби та переносимості на добу потрібно використовувати від 6 до 9 ампул ілопросту для інгаляцій [19].
Розпочинаючи терапію ілопростом, лікарі мають роз’яснювати пацієнтам зазначені особливості використання небулайзерів.
Також доцільно обговорити з пацієнтом можливі побічні реакції внаслідок місцевої дії ілопросту при інгаляційному введенні (такі як кашель) та системної дії, що є передбачуваними з огляду на фармакологічні властивості простацикліну. Найчастіше в пацієнтів під час клінічних досліджень реєструвалися реакції, обумовлені вазодилатацією, зокрема гіпотензія, головний біль, приплив крові до обличчя. Вазодилататорний ефект інгаляційного ілопросту є нетривалим (1–2 години) [19].
На початку лікування ілопростом слід конт–ролювати артеріальний тиск (АТ). Для хворих зі зниженим системним тиском, постуральною гіпотензією або для тих, які отримують терапію препаратами, що можуть знижувати АТ, необхідно вжити заходів проти подальшого зниження АТ. Лікування препаратом ілопросту не слід розпочинати, якщо в пацієнта систолічний АТ нижче 85 мм рт.ст. Також слід звертати особливу увагу на наявність у пацієнта супутніх хвороб або одночасне застосування лікарських засобів, що можуть підвищувати ризик розвитку гіпотензії або синкопального стану. Синкопальний стан є поширеним симптомом самого захворювання, але він також може виникати під час лікування. Пацієнти з ЛГ, у яких розвивається синкопальний стан, повин–ні уникати надмірного напруження, наприклад під час фізичного навантаження. Перед фізичним навантаженням рекомендується здійснити інгаляцію. Збільшення частоти синкопальних станів може свідчити про загострення захворювання або про недостатню ефективність препарату [19].
Найсерйознішими побічними реакціями були артеріальна гіпотензія, бронхоспазм та кровотеча (в основному носова і кровохаркання). Остання часто спостерігалася в популяції пацієнтів, багато з яких застосовували антикоагулянти як супутню терапію. Через пригнічення ілопростом агрегації тромбоцитів його застосування в комбінації з антикоагулянтами або антитромбоцитарними препаратами чи нестероїдними протизапальними засобами може підвищити ризик виникнення кровотечі. Тому необхідно здійснювати ретельний моніторинг стану пацієнтів, які приймають антикоагулянти або інші інгібітори агрегації тромбоцитів одночасно з ілопростом [19].
У разі припинення терапії ілопростом для інгаляцій існує ризик виникнення ефекту рикошету. Слід забезпечити ретельний моніторинг стану пацієнта при припиненні інгаляцій ілопросту. Для хворих у критичному стані слід розглянути альтернативне лікування [19].
Станом на 2018 рік в Україні зареєстрований таблетований стимулятор гуанілатциклази — ріоцигуат у дозуваннях 0,5, 1, 1,5, 2,0 та 2,5 мг.
До закупівлі за Державною програмою у даний час доступні дозування ріоцигуату 1, 2,0 та 2,5 мг, але в майбутньому до цього переліку планується включення всіх форм випуску ріоцигуату.
Ріоцигуат рекомендовано застосовувати при спадкових формах ЛАГ або ЛАГ, пов’язаній із захворюваннями сполучної тканини, крім того, це у даний час єдина опція, схвалена МОЗ України для консервативної терапії для пацієнтів із ХТЕЛГ, згідно з інструкцією з медичного застосування [2, 5, 47].
Пацієнти з ХТЕЛГ є особливою категорією хворих щодо як патогенезу захворювання, так і терапевтичних можливостей. У близько 75 % пацієнтів ХТЕЛГ може бути наслідком тромбоемболії легеневої артерії (ТЕЛА) [15]. Водночас у 25–30 % пацієнтів із ХТЕЛГ анамнестичний зв’язок із ТЕЛА не виявлений. Тому ХТЕЛГ не може бути виключена в пацієнтів без венозного тромбоемболізму [15, 48].
Для пацієнтів із ХТЕЛГ тромбендартеректомія є методом лікування першого вибору [2, 5, 47]. Але близько третини пацієнтів є неоперабельними із різних причин [15]. Завдання відбору пацієнтів, для яких доцільним є проведення тромбендартеректомії, вирішує мультидисциплінарна команда досвідчених спеціалістів [5]. Наслідки хірургічного лікування є зазвичай сприятливими, у більшої частини пацієнтів якість життя значно покращується. Але з огляду на технічну складність проведення тромбендартеректомії при ХТЕЛГ, в Україні такі операції проводяться окремим пацієнтам і лише в одному закладі [13]. У приблизно кожного третього пацієнта після оперативного втручання покращання не настає або з часом виникає рецидив ХТЕЛГ [49]. Для пацієнтів із ХТЕЛГ ІІ–ІІІ функціонального класу (ФК) за класифікацією Всесвітньої організації охорони здоров’я (ВООЗ), яких визнано неоперабельними або зі стійкою чи рецидивуючою ХТЕЛГ, єдиною визнаною альтернативою є медикаментозна терапія з використанням ріоцигуату.
Слід зауважити, що в клінічних дослідженнях такий важливий показник, як виживання пацієнтів протягом року лікування ріоцигуатом, становив 97 %, що оцінюється як дуже добрий результат для цієї категорії пацієнтів [50].
Лікування ріоцигуатом може розпочинати та контролювати лікар, який має досвід терапії ЛГ. Індивідуальний підбір (титрування) дози на початку лікування дає змогу відкоригувати дозу відповідно до потреб пацієнта. Таблетки слід приймати 3 рази на день незалежно від їжі, дотримуючись інтервалу між прийомом, що становить приблизно 6–8 годин. Для пацієнтів, які не здатні проковтнути таблетку ріоцигуату, її можна подрібнити та змішати з водою або м’якою їжею, такою як яблучне пюре, безпосередньо перед застосуванням [47].
Дозу ріоцигуату поступово, кожні 2 тижні, збільшують (із кроком по 0,5 мг на прийом), починаючи з дози 1 мг 3 рази на день, до досягнення максимальної дози 2,5 мг 3 рази на день або максимально переносимої дози (максимальна загальна добова доза становить 7,5 мг).
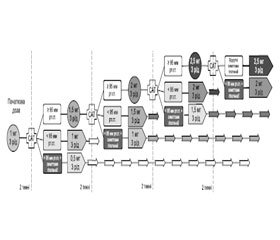
Графічне зображення алгоритму титрування подане на рис. 1.
Рекомендовану початкову дозу 1 мг 3 рази на день пацієнт повинен приймати протягом 2 тижнів.
— У разі зниження показників систолічного АТ до рівня менше 95 мм рт.ст. дозу залишають на попередньому рівні за умови, що в пацієнта відсутні будь-які симптоми гіпотензії (тобто пацієнт продовжує отримувати 1 мг 3 рази на день).
— Якщо в будь-який час систолічний АТ знижується до рівня менше 95 мм рт.ст. і спостерігаються симптоми гіпотензії, дозу слід знизити на 0,5 мг 3 рази на день (тобто пацієнт, який спочатку отримував 1 мг 3 рази на день, має перейти на дозування 0,5 мг 3 рази на день).
— Якщо систолічний АТ ≥ 95 мм рт.ст. і відсутні будь-які симптоми гіпотензії, через 2 тижні прийому дозу необхідно підвищити на 0,5 мг (тобто пацієнт повинен перейти на дозування 1,5 мг 3 рази на день).
Наступні 2 тижні пацієнт отримує дозу 1,5 мг 3 рази на день (у деяких пацієнтів із ЛАГ може бути отримане покращання стану вже при застосуванні дози 1,5 мг 3 рази на день).
— У разі зниження показників систолічного АТ до рівня менше 95 мм рт.ст. дозу залишають на попередньому рівні за умови, що в пацієнта відсутні будь-які симптоми гіпотензії (тобто пацієнт продовжує отримувати 1,5 мг 3 рази на день).
— Якщо в будь-який час систолічний АТ знижується до рівня менше 95 мм рт.ст. і спостерігаються симптоми гіпотензії, дозу слід знизити на 0,5 мг 3 рази на день (тобто пацієнт, який отримував 1,5 мг 3 рази на день, має повернутися до дозування 1 мг 3 рази на день).
— Якщо систолічний АТ ≥ 95 мм рт.ст. і у пацієнта відсутні будь-які симптоми гіпотензії, через 2 тижні прийому дозу необхідно підвищити на 0,5 мг (тобто пацієнт повинен перейти на дозування 2 мг 3 рази на день).
Наступні 2 тижні пацієнт отримує дозу 2 мг 3 рази на день.
— У разі зниження показників систолічного АТ до рівня менше 95 мм рт.ст. дозу залишають на попередньому рівні за умови, що в пацієнта відсутні будь-які симптоми гіпотензії (тобто пацієнт продовжує отримувати 2 мг 3 рази на день).
— Якщо в будь-який час систолічний АТ знижується до рівня менше 95 мм рт.ст. і спостерігаються симптоми гіпотензії, дозу слід знизити на 0,5 мг 3 рази на день (тобто пацієнт, який отримував 2 мг 3 рази на день, має повернутися на дозування 1,5 мг 3 рази на день).
— Якщо систолічний АТ ≥ 95 мм рт.ст. і відсутні будь-які симптоми гіпотензії, через 2 тижні прийому дозу необхідно підвищити на 0,5 мг (тобто пацієнт повинен перейти на дозування 2,5 мг 3 рази на день).
Пацієнт отримує дозу 2,5 мг 3 рази на день, що є цільовою і максимально добовою.
Через 2 тижні прийому дози 2,5 мг 3 рази на день вирішується питання продовження лікування цією дозою препарату або в разі зниження систолічного АТ менше 95 мм рт.ст. та розвитку симптомів гіпотензії повертаються до дозування 2 мг 3 рази на день.
У разі виявлення непереносимості питання про зниження дози можна розглянути в будь-який час.
У клінічних дослідженнях при використанні препарату протягом 1 року максимальна добова доза 7,5 мг досягалась у 90 % пацієнтів [50].
Хоча ріоцигуат добре переноситься, пацієнтів доцільно попереджати про можливі побічні реакції на фоні його застосування. Переважна більшість побічних реакцій спричинена міорелаксацією непосмугованих м’язових клітин судинної системи або шлунково-кишкового тракту. Найчастіше повідомляється про такі побічні реакції, як головний біль, запаморочення, диспепсія, периферичні набряки, нудота, діарея та блювання [47].
Хоча ріоцигуат не впливає на агрегацію тромбоцитів, рекомендується ретельне спостереження за хворими, які отримують антикоагулянти.
Одночасне застосування ріоцигуату з нітратами або донаторами оксиду азоту (наприклад, з амілнітритом) у будь-якій формі, включаючи рекреаційні препарати, так звані «попперси», так само як і з інгібіторами ФДЕ-5 (силденафіл, тадалафіл, варденафіл), протипоказане.
Загальні рекомендації щодо організації способу життя пацієнтів включають:
— пацієнтам із ЛГ не рекомендується надмірне фізичне навантаження;
— жінкам слід обов’язково дотримуватись рекомендацій гінеколога щодо планування вагітності;
— рекомендується імунізація проти грипу та пневмококової інфекції;
— необхідна психосоціальна підтримка, яку надають досвідчені спеціалісти;
— у пацієнтів із ФК III–IV ВООЗ та в осіб із сатурацією кисню менше 60 % при авіаперельотах потрібно передбачити можливість застосування кисневої терапії;
— якщо можливо, то при плановій операції замість загальної анестезії повинна бути використана епідуральна анестезія.
Для контролю за станом хворих на ЛГ і оцінки результатів проведеної терапії хворі повинні постійно надглядатися сімейним лікарем разом із кардіологом, який пройшов стажування в спеціалізованому центрі легеневої гіпертензії [5].
У середньому близько 15 % пацієнтів, які отримують терапію, на жаль, помирають протягом року [5]. Водночас час, що витрачається на встановлення правильного діагнозу та призначення специфічної терапії, можна скоротити, якщо підвищити настороженість лікарів різних спеціальностей щодо цього захворювання і покращити доступ пацієнта до експертної допомоги.
Таким чином, успіх лікування пацієнтів із ЛГ на сьогодні цілком залежить від створення в регіонах центрів спеціалізованої медичної допомоги. На діагностичні можливості спеціалізованих центрів, в яких проводять верифікацію діагнозу ЛГ, впливає технічне забезпечення, тому одним із першочергових напрямків державної підтримки могло б бути забезпечення їх необхідними витратними матеріалами (зокрема, для катетеризації правих відділів серця).
З огляду на недостатнє забезпечення пацієнтів інгаляторами доцільним вбачається подання клопотання про розширення Державної програми централізованої закупівлі медикаментів та включення до переліку окрім ліків, також і небулайзерів. Також необхідна державна підтримка навчання лікарів і пацієнтів відповідальному використанню інгаляторів та засобів для інгаляції, наприклад, шляхом розповсюдження методичних рекомендацій, затверджених МОЗ України.
На жаль, у деяких випадках пацієнти з ЛГ не мають доступу до життєво необхідних препаратів не через відсутність цих препаратів на державному рівні, а через складність схем постачання в межах певних регіонів. Інколи виникають прикрі ситуації, коли дорогий препарат перестає бути потрібним одному пацієнту, але не може бути повернутий до лікувального закладу та переданий іншим пацієнтам; а надлишок препарату, що утворився в одному обласному центрі, не може бути переданий в інше місто. Крім того, в ЛПУ існує необхідність зберігання певного запасу препаратів для нових пацієнтів, які вперше звернулись за медичною допомогою або у яких виникла потреба в додатковій специфічній терапії при тривалому перебігу захворювання. При застосуванні деяких препаратів (у тому числі ріоцигуату) необхідні тривалий період титрування дози і подальша корекція дози залежно від переносимості лікування. Все це не дозволяє точно прогнозувати потребу в специфічних препаратах на 1 рік у кожному окремому регіоні, а при існуючому механізмі забезпечення хворих на ЛАГ та ХТЕЛГ лікарськими засобами може призводити до відстрочення початку життєво необхідного лікування на 1 рік із відповідними наслідками прогресування захворювання, погіршення стану і смерті пацієнтів. Тому потрібно продовжувати вдосконалювати механізми забезпечення пацієнтів та розробити простіші шляхи перерозподілу ліків між окремими регіонами та лікувальними установами.
Список литературы
1. McLaughlin V.V., Archer S.L., Badesch D.B. et al. ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association // J. Am. Coll. Car-diol. — 2009, Apr 28. — 53(17). — Р. 1573-619. doi: 10.1016/j.jacc.2009.01.004.
2. Galiè N., Humbert M., Vachiery J.L. et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT) // Eur. Heart J. — 2016, Jan 1. — 37(1). — Р. 67-119. doi: 10.1093/eurheartj/ehv317.
3. Simonneau G., Gatzoulis M.A., Adatia I. et al. Updated clinical classification of pulmonary hypertension // J. Am. Coll. Cardiol. — 2013. — 62, Suppl. 25. — Р. 34-41. doi: 10.1016/j.jacc.2013.10.029.
4. Budev M.M., Arroliga A.C., Jennings C.A. Diagnosis and evaluation of pulmonary hypertension // Cleve Clin. J. Med. — 2003 Apr. — 70, Suppl. 1. — Р. 9-17.
5. Адаптована клінічна настанова, заснована на доказах «Легенева гіпертензія» // https//mtd.dec.gov.ua/images/dodatki/2016_614.../2016_614_AKN_LegGipert.pdf (доступ: 11.05.2018).
6. D’Alonzo G.E., Barst R.J., Ayres S.M. et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry // Ann. Intern. Med. — 1991, Sep 1. — 115(5). — Р. 343-9. doi: 10.7326/0003-4819-115-5-343.
7. Kunieda T., Nakanishi N., Satoh T. et al. Prognoses of primary pulmonary hypertension and chronic majorvessel thromboembolic pulmonary hypertension determined from cumulative survival curves // Intern. Med. — 1999 Jul. — 38(7). — Р. 543-6.
8. Escribano-Subias P., Blanco I., Lopez-Maseguer M. et al. Survival in pulmonary hypertension in Spain: insights from the Spanish registry // Eur. Resp. J. — 2012. — 40(3). — Р. 596-603. doi: 10.1183/09031936.00101211.
9. Rådegran G., Kjellström B., Ekmehag B. et al. Characteristics and survival of adult Swedish PAH and CTEPH patients 2000–2014 // Scand. Cardiovasc. J. — 2016 Aug. — 50(4). — Р. 243-50. doi: 10.1080/14017431.2016.1185532.
10. Badesch D.B., Raskob G.E., Elliott C.G. et al. Pulmonary arterial hypertension: baseline characteristics from the REVEAL Registry // Chest. — 2010 Feb. — 137(2). — Р. 376-87. doi: 10.1378/chest.09-1140.
11. Benza R.L., Miller D.P., Gomberg-Maitland M., Frantz R.P., Foreman A.J., Coffey C.S., Frost A., Barst R.J., Badesch D.B., Elliott C.G., Liou T.G., McGoon M.D. Predicting survival in pulmonary arterial hypertension: insights from the Registry to Evaluate Early znd Long-Term Pulmonary Arterial Hypertension Disease Management (REVEAL) // Circ. — 2010. — 122(2). — Р. 164-72. doi: 10.1161/CIRCULATIONAHA.109.898122.
12. Strange G., Gabbay E., Kermeen F. et al. Time from symptoms to definitive diagnosis of idiopathic pulmonary arterial hypertension: The delay study // Pulm. Circ. — 2013 Jan. — 3(1). — Р. 89-94. doi: 10.4103/2045-8932.109919.
13. Живило І.О., Радченко Г.Д., Сіренко Ю.М. Створення загальнодержавного реєстру хворих із легеневою гіпертензією — вимога сучасності? // Укр. кардіол. журн. — 2016. — 1. — С. 41-6.
14. Семен Х.О., Любицький І.М., Максим Г.Я. та співавт. Досвід роботи регіональної програми допомоги хворим з легеневою гіпертензією: ще один крок назустріч створенню реєстру пацієнтів // Укр. кардіол. журн. — 2017. — 3. — С. 31-9.
15. Pepke-Zaba J., Delcroix M., Lang I. et al. Chronic thromboembolic pulmonary hypertension (CTEPH): results from an international prospective registry // Circ. — 2011, Nov 1. — 124(18). — С. 1973-81. doi: 10.1161/CIRCULATIONAHA.110.015008.
16. Уніфікований клінічний протокол екстреної, первинної, вторинної (спеціалізованої) та третинної (високоспеціалізованої) медичної допомоги «Легенева гіпертензія у дорослих» (затв. Наказом Міністерства охорони здоров’я України № 614 від 21.06.2016) // https://mtd.dec.gov.ua/images/dodatki/2016_614.../2016_614_YKPMD_LegGipert_dor.pdf (доступ: 11.05.2018).
17. https://pha.org.ua/ (доступ: 11.05.2018).
18. https://moz.gov.ua/article/ministry-mandates/nakaz-moz-ukraini-vid-27042018--807-pro-rozpodil-medikamentiv-dlja-likuvannja-gromadjan-jaki-strazhdajut-na-legenevu-arterialnu-gipertenziju-zakuplenih-za-koshti-derzhavnogo-bjudzhetu-ukraini-na-2017-rik (доступ: 11.05.2018).
19. Інструкція для медичного застосування лікарського засобу Вентавіс, зі змінами, затвердженими Наказом МОЗ України № 83 від 17.01.2017.
20. Інструкція для медичного застосування лікарського засобу Ревацио, зі змінами, затвердженими Наказом МОЗ України №760 від 04.07.2017.
21. Finlay W.H., Stapleton K.W., Zuberbuhler P. Variations in predicted regional lung deposition of salbutamol sulphate between 19 nebulizer types // J. Aerosol. Med. — 1998. — 11. —Р. 65-80.
22. Anthony J., Hickey A.J. Pharmaceutical Inhalation Aerosol Technology. — 2 ed. — CRC Press, 2003. — 288 p.
23. CEN. Respiratory therapy equipment. Part 1: nebulizing systems and their components.
24. ISO 27427:2013 Anaesthetic and respiratory equipment. — Nebulizing systems and components.
25. Pedersen S. Inhalers and nebulizers: which to choose and why // Respir. Med. — 1996. — 90. — Р. 69-77.
26. Stapleton K.W., Finlay W.H., Zuberbuhler P. An in vitro method for determining regional dosages delivered by jet nebuli–zers // J. Aerosol. Med. — 1994, Winter. — 7(4). — Р. 325-44.
27. Pirozynski M., Sosnowski T.R. Inhalation devices: from basic science to practical use, innovative vs generic products // Expert Opin. Drug. Deliv. — 2016 Nov. — 13(11). — Р. 1559-71. doi: 10.1080/17425247.2016.1198774.
28. Elphick M., von Hollen D., Pritchard J.N. et al. Factors to consider when selecting a nebulizer for a new inhaled drug product development program // Expert Opin. Drug. Deliv. — 2015 Aug. — 12(8). — Р. 1375-87. doi: 10.1517/17425247.2015.1014339.
29. Martin A.R., Finlay W.H. Nebulizers for drug delivery to the lungs // Expert Opin. Drug. Deliv. — 2015. — 12(6). — Р. 889-900. doi: 10.1517/17425247.2015.995087.
30. Elphick M., von Hollen D., Pritchard J.N. et al. Factors to consider when selecting a nebulizer for a new inhaled drug product development program // Expert Opin. Drug. Deliv. — 2015 Aug. — 12(8). — Р. 1375-87. doi: 10.1517/17425247.2015.1014339.
31. Najlah M., Parveen I., Alhnan M.A. et al. The effects of suspension particle size on the performance of air-jet, ultrasonic and vibrating-mesh nebulisers // Int. J. Pharm. — 2014, Jan 30. — 461(1–2). — Р. 234-41. doi: 10.1016/j.ijpharm.2013.11.022.
32. Finlay W.H., Stapleton K.W., Zuberbuhler P. Predicting regional lung dosages of a nebulized suspension: Pulmicort® (Budesonide) // Particulate Sci. Technol. — 1997. — 15(3–4). — Р. 243-251. doi: 10.1080/02726359708906770.
33. Yeo L.Y., Friend J.R., McIntosh M.P. et al. Ultrasonic nebulization platforms for pulmonary drug delivery // Expert Opin. Drug. Deliv. — 2010. — 7. — Р. 663-79. doi: 10.1517/17425247.2010.485608.
34. Mccallion O.N., Taylor K.M., Thomas M., Taylor A.J. Nebulization of fluids of different physicochemical properties with air-jet and ultrasonic nebulizers // Pharm. Res. — 1995. — 12. — Р. 1682-8. doi: 10.1023/A:1016205520044.
35. Phipps P.R., Gonda I. Droplets produced by medical nebulizers — some factors affecting their size and solute concentration // Chest. — 1990. — 97. — Р. 1327-32. doi: 10.1378/chest.97.6.1327.
36. Georgitis J.W., McWilliams B., Cruz-Rivera M. et al. Effective once-daily administration of budesonide inhalation suspension by nebulizer with facemasks or mouthpieces for persistent asthma in infants and young children // Pediatr. Asthma Allergy Immunol. — 2001. — 15. — Р. 3-13. doi: 10.1089/088318701750314527.
37. Finlay W.H. Pharmaceutical Aerosol Sprays for Drug Delivery to the Lungs // Ashgriz N. (eds) Handbook of Atomization and Sprays. Boston, MA: Springer, 2011. — 935 p. doi: 10.1007/978-1-4419-7264-4_41.
38. Kishida M., Suzuki I., Kabayama H. et al. Mouthpiece versus facemask for delivery of nebulized salbutamol in exacerbated childhood asthma // J. Asthma. — 2002. — 39. — Р. 337-9.
39. Dolovich M.B., Ahrens R.C., Hess D.R. et al. Device selection and outcomes of aerosol therapy: Evidence-based guidelines: American College of Chest Physicians/American College of Asthma, Allergy, and Immunology // Chest. — 2005 Jan. — 127(1). — Р. 335-71. doi: 10.1378/chest.127.1.335.
40. Finaly W.H. The Mechanics of Inhaled Pharmaceutical Aerosols: An Introduction. — Elsevier, 2001. — 320 p.
41. Nokhodchi A., Martin G.P. Pulmonary Drug Deli-very: Advances and Challenges. — John Wiley & Sons, 2015. — 384 p.
42. Kwok P.C.L., Chan H.-K. Advances in Pulmonary Drug Delivery. CRC Press, 2016. — 246 p.
43. Gaz C., Cremona G., Panunzi S. et al. A geometrical approach to the PKPD modelling of inhaled bronchodilators // J. Pharmacokinet Pharmacodyn. — 2012 Oct. — 39(5). — Р. 415-28. doi: 10.1007/s10928-012-9259-z.
44. Chalupa D.C., Morrow P.E., Oberdörster G. et al. Ultrafine particle deposition in subjects with asthma // Environ Health Perspect. — 2004. — 112. — Р. 879-82.
45. Boe J., Dennis J.H., O’Driscoll B.R. European respiratory society guidelines on the use of nebulisers // Eur. Respir. J. — 2001 Jul. — 18(1). — Р. 228-42.
46. Hickey A.J. Inhalation Aerosols: Physical and Biological Basis for Therapy. — 2 ed. — CRC Press, 2006. — 473 p.
47. Інструкція для медичного застосування лікарського засобу Адемпас®, зі змінами, затвердженими Наказом МОЗ України №760 від 04.07.2017.
48. Jamieson S.W., Kapelanski D.P., Sakakibara N. et al. Pulmonary endarterectomy: experience and lessons learned in 1,500 cases // Ann. Thorac. Surg. — 2003 Nov. — 76(5). — Р. 1457-62; discussion 1462-4.
49. Condliffe R., Kiely D.G., Gibbs J.S. et al. Improved outcomes in medically and surgically treated chronic thromboembolic pulmonary hypertension // Am. J. Respir. Crit. Care Med. — 2008, May 15. — 177(10). — Р. 1122-7. doi: 10.1164/rccm.200712-1841OC.
50. Simonneau G., D’Armini A.M., Ghofrani H.A. et al. Riociguat for the treatment of chronic thromboembolic pulmonary hypertension: a long-term extension study (CHEST-2) // Eur. Respir. J. — 2015 May. — 45(5). — Р. 1293-302. doi: 10.1183/09031936.00087114.

/28-1.jpg)