Вступ
Патологія печінки займає провідне місце серед хвороб органів травлення. Щороку в країнах СНД реєструється від 500 тис. до 1 млн людей, які страждають від захворювань даного органа. В Україні за останні 10 років поширеність цих захворювань збільшилась на 20,1 % [1, 2]. Серед них хронічні дифузні захворювання печінки (ХДЗП) різної етіології, що перебігають із достатньо неспецифічними клінічними проявами [2–4]. Спектр структурних порушень при ХДЗП також значно варіює залежно від нозології: від доброякісного накопичення печінкових тригліцеридів (ізольований стеатоз) до запалення та некрозу гепатоцитів — стеатогепатиту, а з часом — до цирозу печінки та гепатоцелюлярної карциноми (ГЦК) [5–7]. Вважається, що ХДЗП найближчим часом стане найчастішим показником до трансплантації печінки в світі [8, 9].
Уже доведено, що порушення синтезу та утилізації вільних жирних кислот виступає однією з причин формування ХДЗП та інших захворювань печінки, пов’язаних із порушенням обміну ліпідів.
Дослідження на тваринах та клінічні спостереження підтверджують концепцію, згідно з якою пошкодження гепатоцитів, характерне для ХДЗП, обумовлюється надлишком первинних метаболічних субстратів (глюкози, фруктози та жирних кислот) у печінці, внаслідок чого жирні кислоти впливають на біохімічні шляхи, що призводить до пошкодження клітин [6, 7]. Різні аспекти цих шляхів, що ведуть до стеатогепатиту, потенційно варіюватимуть у пацієнтів залежно від етіології захворювання, наявності ожиріння або діабету, але в результаті однаково призведуть до ускладнень [8].
До 25 % усіх випадків хронічних захворювань печінки пов’язані з уживанням алкоголю. ХДЗП як алкогольного, так і неалкогольного генезу характеризується підвищенням відкладення тригліцеридів у гепатоцитах унаслідок надлишкового накопичення вільних жирних кислот (ВЖК) у печінці і/або їх підсиленого синтезу органом з ацетилкоензиму А (ацетил-КоА), особливо при недостатності останнього. Продукція тригліцеридів у гепатоциті прямо залежить від умісту в ньому жирних кислот, ацетил-КоА та глюкози, що в процесі гліколізу перетворюється у фосфатидну кислоту, яка запускає синтез тригліцеридів. У міру накопичення жиру гепатоцити стають більш чутливими до токсичного впливу та втрачають свої функ–ціональні властивості [10]. Головну роль у накопиченні жиру в гепатоциті на тлі споживання алкоголю відіграє ацетальдегід — основний токсичний продукт метаболізму етанолу. У процесі окиснення етанолу відмічається підвищене використання коферменту НАД+, який, приєднуючи протон, відновлюється до НАДH+. Підвищення відновленої форми НАДН+ при систематичному вживанні алкоголю знижує активність основних ферментів ліпоксигеназного шляху, які забезпечують транспорт жирних кислот у мітохондрії, зменшує їх внутрішньомітохондріальне окиснення, що призводить до вираженого порушення метаболізму жирів, накопичення в клітинах печінки тригліцеридів та розвитку стеатозу [9, 10].
Сучасні функціональні методи діагностики (якісні показники стеатозу) не завжди відображають реальну картину. Серед них магнітно-резонансна спектроскопія — найбільш точний метод кількісного визначення стеатозу, проте найбільш затратний, тому біопсія печінки є єдиним тестом, що дозволяє вірогідно встановити діагноз і залишається золотим стандартом оцінки тяжкості стеатозу, але є випадки, у яких виконання біопсії не рекомендується [2].
Газова хроматографія на сьогодні є єдиним методом, що дозволяє визначити жирнокислотний склад у біологічних субстратах. Перевага цього методу полягає у швидкості виконання й високій чутливості методу, завдяки чому можливо виявити найменші концентрації сполук у дослідному зразку (до 10–12 моль). Впровадження цього методу в клінічну практику лікарів дозволяє діагностувати захворювання печінки на ранньому етапі розвитку та коригувати виявлені порушення [11].
Жирнокислотний склад сироватки крові пацієнтів зі стеатозом характеризується зниженням загального вмісту ВЖК за рахунок дефіциту ненасичених жирних кислот. У сукупності з морфологічними методами досліджень використання довголанцюгових ВЖК для діагностування захворювань, пов’язаних із порушенням структури, функцій та в’язкості гепатоцитів, відкриває можливість для розкриття патогенезу ХДЗП із метою підвищення диференціальної діагностики та ефективності лікування виявлених порушень [12].
Мета роботи — оцінка вільних жирних кислот у сироватці крові пацієнтів із ХДЗП залежно від його етіології та морфологічних особливостей, визначення ролі цих змін у прогресуванні патології печінки.
Матеріали та методи
Обстежені 66 пацієнтів із ХДЗП, середній вік (59,2 ± 2,4) року. Усі обстежені хворі були розподілені на групи залежно від етіологічних факторів при формуванні та прогресуванні стеатозу та фіброзу печінки: І — неалкогольна жирова хвороба печінки (НАЖХП, n = 38); ІІ — хронічний гепатит, асоційований з вірусом С (ХГС) (n = 13); III — алкогольна хвороба печінки (АХП, n = 15). Серед обстежених пацієнтів жінок було 46 %, а чоловіків — 54 %.
За допомогою методики черезшкірної пункційної трепан-біопсії печінки в кожного пацієнта взято 3 стовпчики тканини з VII сегмента правої частки органа. Цю методику виконували під безперервним ультразвуковим контролем під місцевою анестезією напівавтоматичною голкою Colt Shot 16 G. Для гістологічних досліджень біоптати фіксували в 10,0% розчині нейтрального формаліну, зневоднювали в спиртах висхідної концентрації і заливали в парафін (за загальноприйнятим у морфологічній практиці методом). Гістологічні зрізи товщиною 3–5 мкм забарвлювали гематоксиліном і еозином та за Маллорі в модифікації Слінченка [13].
Для проведення комп’ютерної морфометрії біоптати фотографували і здійснювали вимірювання за допомогою програми ImageJ 1.45S (розроблена в National Institutes of Health, США). Комп’ютерний індекс фіброзу — це отримане на цифровому зображенні співвідношення площі колагену до загальної площі біоптату. Напівтонкі зрізи отримували за допомогою ультратому УМТП-7 із використанням скляних ножів. Гістологічні зрізи товщиною 1 мкм забарвлювали толуїдиновим синім. Дослідження напівтонких зрізів проводили методом світлової мікроскопії високої роздільної здатності (імерсійне масло, об’єктив х100). Отримані дані доповнювали інформаційну картину при вивченні парафінових зрізів.
Хроматографічне дослідження ВЖК у сироватці крові було проведено з використанням апаратно-програмного комплексу для медичних досліджень на базі газового хроматографа «ХРОМАТЕК-КРИСТАЛЛ 5000».
Обладнання. Газовий хроматограф із полум’яно-іонізаційний детектором. Кварцева капілярна колонка (RESTEK) довжиною 60 м, внутрішній діаметр 0,25 мм, нерухома фаза типу FFAP і товщиною плівки 0,25 мкм.
Режим приладу при проведенні досліджень. Ізотермічна температура термостату становила 140 °С, температура випаровувача і детектора — 230 °С. Газ-носій — азот, із тиском на вході до колонки 1,8 атм. Витрати газу-носія — 2 мл/хв, водню — 25 мл/хв, повітря — 300 мл/хв. Співвідношення потоків газу-носія на викид і до колонки — 50 : 1. Ідентифікацію фракцій вільних жирних кислот проводили згідно із стандартами метильованих жирних кислот фірми «Restek».
KOH-метилювання ліпідів у біологічних субстратах, які містять воду (сироватка крові, гомогенат тощо). До 0,14 мл проби додавали 2 мл гексану (30 °С ) і 0,28 мл КОН (1 М в 70% метанолі, 30 °С), пробірки перемішували впродовж 2,5 хв і витримували на водяній бані при 30 °С впродовж 20 хв, періодично помішуючи. Реакцію зупиняли 0,03 мл оцтової кислоти. Метильовані жирні кислоти, які знаходилися в гексановому шарі, аналізувалися на газовому хроматографі. При малій кількості проби до 28 мкл додавали 0,5 мл гексану і 56 мкл КОН (1 М в 70% метанолі, 30 °С) і проводили всі процедури, описані вище [14]. Групу контролю становили відносно здорові особи (n = 7).
Для статистичного аналізу даних використовували дескриптивну статистику; порівняння середніх значень перемінних здійснювали за допомогою параметричних методів (t-критерію Стьюдента) за нормального розподілу даних ознак, виражених в інтервальній шкалі. Відповідність виду розподілу ознак закону нормального розподілення перевіряли за допомогою методу Шапіро — Уїлка. В інших випадках використовували непараметричний метод (U-критерій Манна — Уїтні). Усі розрахунки виконували у програмі SPSS 9.0 for Windows [15]. Усі засоби вимірювальної техніки, які використовувались при виконанні роботи, мали метрологічну повірку в установленому порядку.
Результати та обговорення
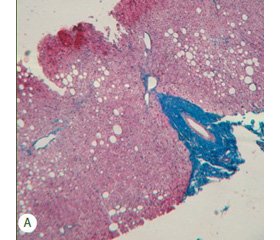
Морфологічна картина в І групі пацієнтів являла собою осередки великокрапельної жирової дистрофії на тлі відсутності фіброзу або тонких фіброзних септ та незначного накопичення клітин запалення. Для ІІ групи пацієнтів були характерні найбільш виражені показники запалення та активності гепатиту: інфільтрація портальних трактів від помірної до вираженої, інтрачасточкова інфільтрація, вогнища некрозу гепатоцитів, збільшення кількості лімфоїдних фолікулів та жирова дистрофія, яка найчастіше супроводжувала помірне фіброзування та в більшості випадків являла собою осередки дрібнокрапельного або змішаного стеатозу, що розташовані в середині часточок і не зачіпають прикордонну пластинку. Морфологічна картина в ІІІ групі пацієнтів характеризувалась в першу чергу значною дезорганізацією ліпідних включень та помітними змінами гістологічної структури як за рахунок запалення, так гідропічної дистрофії гепатоцитів (рис. 1).
/25-1.jpg)
При біохімічному дослідженні спектра ВЖК у сироватці крові пацієнтів із ХДЗП нами було ідентифіковано більше 20 фракцій, серед яких такі основні насичені жирні кислоти: міристинова С14:0, пентодеканова С15:0, пальмітинова С16:0, стеаринова С18:0, такі основні ненасичені жирні кислоти: олеїнова С18:1, лінолева С18:3, арахідонова С20:4 (табл. 1).
Незалежно від етіологічного фактора розвиток ХДЗП супроводжувався статистично значущим підвищенням умісту пальмітинової та олеїнової жирних кислот у сироватці крові порівняно з контролем. В усіх групах хворих сумарний уміст ВЖК у сироватці крові був підвищений: у І групі — у 21,2 раза, до (5,528 ± 0,967) мкг/мкл, р < 0,001; у ІІ групі — у 23 раза, до (5,987 ± 3,109) мкг/мкл, р < 0,001, у ІІІ групі — у 45,5 раза, до (11,83 ± 6,19) мкг/мкл, р < 0,01, порівняно з групою контролю ((0,26 ± 0,09) мкг/мкл) (табл. 1).
Для пацієнтів з І та ІІ групи було характерним вірогідне підвищення вмісту найбільш токсичної фракції — пальмітинової (С16:0) відповідно на 22,2 % (р < 0,05) та на 20,8 % (р < 0,05) щодо контролю (табл. 1). При цьому більшість морфологічних показників, пов’язаних із запаленням, були найменш вираженими в І групі пацієнтів (рис. 2А).
Так, дифузна інфільтрація портальних трактів у І групі пацієнтів зустрічалася вірогідно рідше — у 9,1 % випадків порівняно з 43,75 % випадків у ІІ групі та 37,5 % випадків у ІІІ групі; осередки некрозу та лімфоїдні фолікули також зустрічались вірогідно рідше, ніж у пацієнтів із ХГС.
Із чим же в такому випадку пов’язане збільшення токсичної фракції? На нашу думку, таке збільшення може пояснюватися в тому числі й поширеною гідропічною дистрофією гепатоцитів, що зустрічалася в цій групі пацієнтів частіше за інші — у 54,5 % випадків порівняно з 18,75 % випадків в ІІ групі та 25,0 % випадків в ІІІ групі.
Крім цього, у пацієнтів І групи відбувалося підсилення синтезу пентадеканової кислоти (С15:1) із більш низькомолекулярних попередників. Це можна пояснити тим, що при формуванні НАЖХП відбувається перебудова метаболічних шляхів з активним використанням пропіонату, який є субстратом не тільки для синтезу жирних кислот із непарним числом атомів вуглецю, а й для утворення амінокислот (глутамату, аспартату, глутаміну), азотистих основ фосфоліпідів. На мікроструктурному рівні дисліпідемія характеризується наявністю великих гомогенних (простих за складом) жирових крапель у цитоплазмі гепатоцитів. За допомогою методики напівтонких зрізів були локалізовані ці ліпідні включення темно-янтарного кольору, які рівномірно заповнювали всю цитоплазму гепатоцитів (рис. 2Б).
/26-1.jpg)
На відміну від цього для ІІ групи пацієнтів були характерні найбільш виражені показники запалення та активності гепатиту: інфільтрація портальних трактів від помірної до вираженої, інтрачасточкова інфільтрація, вогнища некрозу гепатоцитів (рис. 3А).
Необхідно зазначити, що збільшення кількості лімфоїдних фолікулів, що є ознакою персистенції ХГС, вірогідно частіше зустрічалося в цій групі порівняно з 12,5 % випадків в ІІІ групі пацієнтів, зовсім не зустрічалося в І групі. Вірогідна різниця між досліджуваними групами проявлялась і в частоті виявлення адгезії лімфоцитів та нейтрофільних лейкоцитів у синусоїдах. У досліджуваних препаратах напівтонких зрізів паренхіми печінки пацієнтів ІІ групи адгезія нейтрофільних лейкоцитів в синусоїдах була виявлена в 31,25 % випадків, а адгезія лімфоцитів — у 75,0 %, у той час як у І групі пацієнтів адгезія нейтрофільних лейкоцитів була виявлена в 9,1 % випадків, а адгезія лімфоцитів — у 27,3 %.
Зміни в спектрі ненасичених жирних кислот при ХДЗП характеризувалися накопиченням моноєнових жирних кислот за рахунок зростання частки пальмітолеїнової кислоти (С16:1) в І групі пацієнтів в 1,8 раза, у ІІ групі — в 1,7 та в ІІІ групі — 8,8 раза, а також зниженням вмісту полієнових кислот, що виникало лише завдяки відсутності фракції жирної кислоти С20:4. Отже, треба зазначити, що ІІ група пацієнтів характеризувалася менш вираженими, але більш різноманітними змінами ліпогенезу. Це підтверджується також і тим, що дослідження біоптатів методикою напівтонких зрізів дозволило продемонструвати гетерогенність складу ліпідних крапель у гепатоцитах, а також гетерогенність їх розміру. Так, за допомогою методики напівтонких зрізів у ІІ групі пацієнтів були виявлені ліпідні краплі янтарного кольору, дрібні та середні ліпідні краплі бурого кольору, дуже дрібні прозорі краплі, які рівномірно заповнювали цитоплазму гепатоцитів. У ліпідних краплях великого розміру спостерігалась інкрустація ліпідами більш високої щільності, що характеризувалась більш темним кольором (рис. 3Б).
У ІІІ групі пацієнтів спостерігалися найбільш помітні зміни морфологічної будови здебільшого за рахунок дезорганізації будови, запалення, апоптозу та некрозу гепатоцитів, осередкової жирової дистрофії гепатоцитів (рис. 4). Також у пацієнтів цієї групи виявлено й вірогідне підвищення пальмітинової (С16:0) та олеїнової (С18:1) кислот.
З метою об’єктивізації результатів було проведено послідовне морфометричне дослідження біоптатів із підрахунком індексу фіброзу (відношення площі фіброзної тканини до загальної площі біоптату), індексу стеатозу (кількість гепатоцитів у стані жирової дистрофії на 100 клітин) та кількості апоптотично змінених клітин у 5 послідовних великих полях зору.
Морфометричне дослідження показало, що індекс стеатозу був найвищим у І групі пацієнтів — (0,36 ± 0,11), що підтверджує дані морфологічного дослідження щодо поширеності жирової дистрофії, при цьому індекс фіброзу був найменшим та становив (0,0443 ± 0,0110). У ІІ групі пацієнтів було зафіксовано найбільш значні коливання індексу стеатозу із середнім значенням (0,23 ± 0,09), у той час як індекс фіброзу становив (0,0812 ± 0,0600). ІІІ група пацієнтів вірогідно відрізнялась від І групи за індексом фіброзу (0,1266 ± 0,0130) та стеатозу (0,2289 ± 0,1500), при цьому ці показники в даній групі були найвищими.
При розрахунку коефіцієнтів співвідношення окремих фракцій жирних кислот було виявлено зниження k1 в групах пацієнтів: у І — в 1,4 раза; ІІ — у 8,5 раза; у ІІІ — у 38,0 раза, що свідчить про зниження активності основного ферменту ліпоксигеназного шляху Δ9-десатурази та, як наслідок, зниження клітинного росту та диференціації за рахунок її впливу на текучість мембран та сигнальної трансдукції (рис. 5). Було виявлено зниження k2 в І групі пацієнтів в 1,3 раза, у ІІ групі — у 8,3 раза та в ІІІ групі — у 5,3 раза порівняно з контролем, що може свідчити про зниження активності Δ6-десатурази.
Про недостатню активність ферменту елонгази свідчило зниження k3 в І групі 3 раза, у ІІ групі — у 6,0 раза та ІІІ групі — 7,0 раза порівняно з контролем, що відображає зниження активності синтезу ненасичених жирних кислот у пацієнтів всіх груп (рис. 5).
Таким чином, для пацієнтів із НЖХП є характерними численні морфологічні та біохімічні патомеханізми: підвищення синтезу ВЖК у сироватці крові та їх накопичення у печінці (токсичний вплив), запальні процеси (ушкодження гепатоцитів), присутність окисного стресу (табл. 2).
Для пацієнтів із НАЖХП та ХГС терапія перш за все повинна бути направлена на детоксикацію організму, зниження вмісту ВЖК; для пацієнтів із токсичним гепатитом алкогольного генезу — на зниження окисного стресу та захист органел клітин, усі ці факти слід враховувати при призначенні лікування пацієнтам із хронічними дифузними захворюваннями печінки.
Висновки
1. У пацієнтів із ХДЗП у ліпідному екстракті сироватки крові було виявлено підвищення вмісту ВЖК, що підтверджує гіпотезу про пролонговану ліпотоксичну дію цих кислот на печінку, різнонаправлені зміни окремих фракцій ВЖК, зниження/відсутність вмісту арахідонової жирної кислоти (С20:4) в мембранних структурах гепатоцитів як наслідок інтенсивного використання цієї фракції у вільнорадикальних реакціях та синтезі простагландинів.
2. Типова морфологічна картина при НАЖХП являла собою осередки великокрапельної жирової дистрофії на тлі незначного фіброзування та запалення. Для ХГС були характерні найбільш виражені показники запалення та активності гепатиту на тлі помірного фіброзування та дрібнокрапельного або змішаного стеатозу. У групі ХГС були зафіксовані найбільш значні коливання індексу стеатозу зі середнім значенням (0,23 ± 0,09), у той час як індекс фіброзу становив (0,0812 ± 0,0600). У групі АХП індекси фіброзу (0,1266 ± 0,0130) та стеатозу (0,2289 ± 0,1500) були найвищими, а типова морфологічна картина характеризувалася в першу чергу значною дезорганізацією ліпідних включень та помітними змінами гістологічної будови за рахунок як запалення, так і гідропічної дистрофії гепатоцитів.
3. При розрахунку коефіцієнтів співвідношення окремих жирних кислот було виявлено зниження k1 у групах пацієнтів: у І — в 1,4 раза; у ІІ — у 8,5; у ІІІ — 38,0 раза; k2 в групах пацієнтів: у І — в 1,3 раза, у ІІ — 8,3, ІІІ — у 5,3 раза, що свідчить про зниження активності ферментів ліпоксигеназного шляху, які беруть участь у подовженні вуглеводного ланцюга та утворенні подвійного зв’язку в молекулі жирної кислоти; k3 в групах пацієнтів: у І — у 3 рази, у ІІ — 6, у ІІІ — у 7 разів порівняно з контролем, відображає зниження синтезу ненасичених жирних кислот у пацієнтів всіх груп.
4. Морфологічні та біохімічні показники при АХП вірогідно відрізнялись від НАЖХП: за індексом фіброзу ((0,1266 ± 0,0130) порівняно з (0,0443 ± 0,0110)) та стеатозу ((0,2289 ± 0,1500) порівняно з (0,36 ± 0,11)).
Науково-практичне впровадження. Ця робота відноситься до числа фундаментальних досліджень у галузі біохімії та морфології. Отримані результати значно доповнюють сучасні уявлення щодо біохімічних механізмів розвитку хронічних дифузних захворювань печінки. Визначення вмісту вільних жирних кислот у сироватці крові пацієнтів із хронічними дифузними захворюваннями печінки впроваджено в клінічну практику нашого інституту, що дозволяє значно покращити диференціальну діагностику та ефективність лікування виявлених порушень. Метод кількісної гістологічної оцінки стадії фіброзу та стеатозу при хронічних дифузних захворюваннях печінки за допомогою комп’ютерної морфометрії дозволяє отримати числові дані та проаналізувати їх зв’язок із іншими гістологічними, лабораторними та клінічними даними. На відміну від звичайної гістологічної оцінки біоптатів додаткова морфометрична характеристика дає можливість отримання більш точних, об’єктивних, відтворюваних результатів. Розробка пройшла апробацію в лабораторії патоморфології ДУ «Інститут гастроентерології НАМН України», КЗ УОЗ МКЛ №2 (м. Харків), КЗ «ЦПМСД №2» (м. Вінниця) з позитивними результатами (значне підвищення точності морфологічного дослідження).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці статті.
Список литературы
1. Степанов Ю.М. Применение эссенциальных фосфолипидов для лечения жировой болезни печени / Ю.М. Степанов // Гастроентерологія. — 2016. — №4(62). — С. 58-63.
2. Диденко В.И. Современные достижения в оценке стеатоза печени / В.И. Диденко // Гастроентерологія. — 2015. — № 3(57). — С. 94-100.
3. Chen R. Serum fatty acid profiles and potential biomarkers of ankylosing spondylitis determined by gas chromatography-mass spectrometry and multivariate statistical analysis / R. Chen, S. Han, D. Dong [et al.] // Biomed. Chromatogr. — 2014. — Vol. 29(4). — P. 604-11. — doi: 10.1002/bmc.3321.
4. Wang D.C. Serum fatty acid profiles using GC-MS and multivariate statistical analysis: potential biomarkers of Alzheimer’s di–sease / D.C. Wang, C.H. Sun, L.Y. Liu [et al.] // Neurobiol. Aging. — 2012. — Vol. 33(6). — P. 1057-66. — doi: 10.1016/j.neurobiolaging.
5. Pat. US 9239334 B2, IPC/US2009/056176. Fatty acid C16: 1N7-palmitoleate a lipokine and biomarker for metabolic status / Haiming Cao, Gokhan S. Hotamisligil; Owner. — President And Fellows Of Harvard College. — No. US 13/062,527; Date of Pat. Jan. 19, 2016.
6. Jiang M. Serum metabolic signatures of four types of human arthritis / M. Jiang, T. Chen, H. Feng [et al.] // J. Proteom. Res. — 2013. — Vol. 12(8). — P. 3769-79. — doi: 10.1021/pr400415a.
7. Perez-Cornago A. Metabolomics identifies changes in fatty acid and amino acid profiles in serum of overweight older adults following a weight loss intervention / A. Perez-Cornago, L. Brennan, I. Ibero-Baraibar [et al.] // J. Physiol. Biochem. — 2014. — Vol. 70(2). — P. 593-602. — doi: 10.1007/s13105-013-0311-2.
8. Copaci I. Noninvasive markers of improvement of liver steatosis achieved by weight reduction in patients with nonalcoholic fatty liver disease / I. Copaci, I. Lupescu, E. Caceaune [at al.] // Rom. J. Intern. Med. — 2015. — № 53(1). — P. 54-62.
9. Буторова Л.И. Гепатопротективная терапия жировой болезни печени неалкогольного и алкогольного генеза / Л.И. Буторова, М.А. Калашникова, Н.Г. Крайникова [и др.] // Эффективная фармакотерапия. — 2016. — № 34. — C. 12-21.
10. Барышникова H.В. Алкогольная болезнь печени: особенности диагностики и лечения / H.В. Барышникова, Л.Н. Белоусова // Гастроэнтерология. Приложение к журналу Consilium Medicum. — 2014. — № 2. — С. 16-18.
11. Діденко В.І. Актуальність визначення спектра жирних кислот у біологічних субстратах у діагностиці гастроентерологічних захворювань / В.І. Діденко, І.А. Кленіна, С.О. Бабій, В.А. Карачинова // Гастроентерологія. — 2017. — Т. 51(2). — С. 137-141.
12. Роль кишкової мікробіоти у розвитку порушень ліпідного обміну у хворих на неалкогольну жирову хворобу печінки / Зигало Е.В., Ягмур В.Б., Кленіна І.А., Меланіч С.В., Попок Д.В. // ММФ. — 2017. — С. 57-60.
13. Сапожников А.Г. Гистологическая и микроскопическая техника / А.Г. Сапожников, А.Е. Доросевич. — Смоленск: САУ, 2000. — 476 с.
14. Ichihara К. Preparation of fatty acid methyl esters
by selective methanolysis of polar glycerolipids / K. Ichihara, Ch. Yamaguchi, Y. Araya [et al.] // Lipids. — 2010. — 45. — P. 367-374.
15. Енюков И.С. Методи, алгоритми, програми багатомірного статистичного аналізу / И.С. Енюков. — М.: Фінанси і статистика, 1986. — 86 с.

/25-1.jpg)
/26-1.jpg)
/27-1.jpg)
/28-1.jpg)
/29-1.jpg)