Мікробіота і її роль в організмі
Дослідження мікробіому і його впливу на стан здоров’я й розвиток захворювань визнано одним із 10 найбільших досягнень ХХI століття [1]. Мікробіом людини — це сукупність усіх мікроорганізмів у всіх її біотопах, а термін «мікробіота» стосується популяцій мікроорганізмів у різних екосистемах тіла (наприклад, кишкова мікробіота, мікробіота шкіри тощо) [2]. На сьогодні людина та її мікробіом –фактично являють собою два організми в одній оболонці [1].
Використання методів швидкого секвестрування у поєднанні з новими біоінформативними технологіями дозволило вченим описати мікробіом із небувалою точністю. Організм здорової дорослої людини містить 100 трильйонів бактерій, вірусів, археїв і грибів, що в 10 разів перевищує кількість соматичних і зародкових клітин [3], а мікробіота кишечника — понад 1000 видів і понад 7000 підвидів [2]. Щільність мікробіому людини найвища в товстій кишці, де переважають Firmicutes, Bacteroidetes, Proteobacteria та Actinobacteria, що становлять близько 64, 23, 8 і 3 % від загальної кількості мікроорганізмів відповідно [3].
У здорових людей мікробіота кишечника дуже різноманітна, оскільки її мінливість у гастроінтестинальному тракті залежить від багатьох факторів включно з генетичними, фізіологічними, психологічними й екологічними детермінантами [3] і зумовлена віковими особливостями. Доведено, що особи молодого віку мають інакший мікробний склад товстої кишки, ніж люди похилого віку, зокрема, встановлено зменшення Bifidobacteria з віком [4].
Мікробіота кишечника виконує багато функцій, спрямованих на підтримання стабільності й рівноваги в організмі. Функціонально кишкова мікробіота відіграє важливу роль у перетравлюванні поживних речовин, забезпеченні біодоступності лікарських засобів, виробленні коротколанцюгових жирних кислот (КЛЖК), імунних медіаторів, продукції метаболітів і модуляції експресії генів [4]. Бактерії кишечника здатні виробляти активні метаболіти, необхідні для різних систем організму людини. Наприклад, Lactobacillus і Bifidobacterium синтезують гамма-аміномасляну кислоту (ГАМК) з глутамату мононатрію; Escherichia coli, Candida, Streptococcus, Escherichia і Enterococcus вироб–ляють серотонін, а Bacillus і Serratia — допамін. Експериментальні дослідження на щурах вказують на збільшення рівня триптофану в плазмі після перорального введення їм Bifidobacterium infantis [2]. Корисні бактерії не тільки виробляють енергію, вітаміни й інші метаболіти, а й допомагають обмежити доступ патогенних мікроорганізмів до тканин кишечника за рахунок створення захисної біоплівки — міцної унікальної системи, що зберігає стабільність у мінливих умовах внутрішнього й зовнішнього середовища [3]. Отже, бактерії, що живуть у кишці, взаємодіють з людськими клітинами [2].
Роль мікробіоти кишечника не обмежується дією на шлунково-кишковий тракт (ШКТ), вона може мати значний вплив на функцію різних систем та органів і бути причетною до формування багатьох захворювань. Дослідження E.A. Mayer та співавт. (2015) і М. Carabotti та співавт. (2015), проведені на мишах, показали, що зміна нормального складу мікробіоти кишечника може спричинити порушення поведінки й пригнічувати функції мозку, зумовити відхилення від норми в нейрохімічних показниках. У роботі С. Yang і співавт. (2017) доведено, що Bifidobacteria кишечника може забезпечити стійкість до хронічного стресу, а пероральний прийом Bifidobacteria сприяє полегшенню симптомів депресії. Отримані дані підтверджують зв’язок між кишечником і мозком, у якому мікробіота кишки є важливим дистанційним посередником функції мозку, що впливає на розвиток і терапевтичні наслідки захворювань внутрішніх органів [5].
Склад мікробіоти кишечника змінюється залежно від різних факторів, таких як дієта, антимікробна терапія, імунологічна терапія (наприклад, вакцини) та патологічний стан, у тому числі вплив інфекційних агентів. Дисбаланс у мікробіоті кишечника може бути також обумовлений порушенням гігієнічних звичок, зміною якості їжі й питної води, вживанням синтетичних консервантів і дією стресу [6].
Мікробний дисбактеріоз («мікробний дисбаланс», або «дезадаптація популяцій мікроорганізмів») сильно асоціюється з порушеннями обміну речовин (цукровий діабет, ожиріння) [7], синдромом подразненого кишечника (СПК), целіакією, неспецифічними запальними захворюваннями кишечника, нейропсихіатричними захворюваннями, такими як шизофренія, аутизм [8], тривожними розладами, депресією [4] і хворобою Альцгеймера [5].
Протягом останніх кількох років усе більше усвідомлюється важливість осі «кишечник — мозок» завдяки доказам, що базуються на розумінні нових зв’язків між імунною, ендокринною й нервовою системами [8].
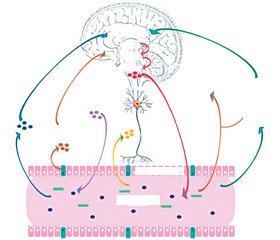
Встановлено, що кишечник і мозок тісно пов’язані між собою і становлять вісь «кишечник — мозок» із кількома двонаправленими сигнальними шляхами. Нейромедіатори мозку людини та їх попередники, такі як ГАМК, триптофан, серотонін (5-гідрокситроптофан, 5-НТ) та інші моноаміни, можуть вироблятися бактеріями кишкової мікробіоти [9]. Отже, вісь «кишечник — мозок» — бінаправлена комунікативна система, за допомогою якої мозок модулює функції шлунково-кишкового тракту і навпаки завдяки нейронним, ендокринним та імунним механізмам, що пов’язані між собою на організмовому, органному, клітинному й молекулярному рівнях [10].
Встановлено, що мікроструктура й когнітивні функції мозку суттєво асоціюються з конкретним профілем мікробіоти кишечника. Нормальне функціонування мікробіоти кишечника є необхідним для підтримання динамічної регуляції й контролю таких функцій головного мозку, як рівень тривожності й соціальна поведінка, а також для нейрогенезу й нормальної серотонінергічної нейротрансмісії центральної нервової системи (ЦНС) при стресі й відповіді на антидепресанти [9]. Отже, мікробіота кишечника може опосередковано впливати на функціонування мозку через вісь, що включає центральну нервову систему, нейроендокринні й нейроімунні системи, гіпоталамо-гіпофізарно-надниркову (ГГН) систему, вегетативну нервову систему й ентеральну нервову систему (ЕНС) [11, 12] (рис. 1).
Вісь «кишечник — мозок»
Роль імунної системи
Імунна система відіграє важливу посередницьку роль у підтриманні динамічної рівноваги між мозком і кишечником. ГГН вісь, автономна нервова система (АНС) та ЕНС безпосередньо взаємодіють з імунною системою. Лімфоїдна тканина кишечника є найбільшим імунним органом людського тіла й становить понад 70 % від загальної імунної системи. Отже, кишечник є важливим імунним органом і виконує захисну функцію – є бар’єром між зовнішніми патогенами й внутрішнім біологічним середовищем.
Дослідження з використанням моделей тварин чітко продемонстрували, що патогенні мікроорганізми впливають на поведінку через активацію шляхів імунної сигналізації від периферії до головного мозку. Наприклад, введення мишам у субклінічних дозах патогенних бактерій (Campylobacter jejuni) викликає тривожну поведінку, а введення прозапальних цито–кінів гризунам призводить до різних депресивних ефектів, а також до порушення сну, зниження апетиту [13].
Мікроби кишечника сприяють формуванню імунної відповіді через вироблення імунних медіаторів (цитокінів, таких як інтерлейкін (IL) 1α, IL-1β, фактор некрозу пухлини альфа (TNF-α) та IL-6), що є сигнальними медіаторами [2]. На периферії цитокіни діють на аферентні нервові рецептори шляхом модифікації сигналів, що надходять із периферії до ЦНС [14]. Це є передумовою динамічної взаємодії між імунною системою й ЦНС через здатність медіаторів проходити гематоенцефалічний бар’єр (ГЕБ), діючи на специфічні рецептори, що експресуються нейронами й гліальними клітинами, особливо в мікроглії, змінюючи їх фізіологічну активність [4].
Дисбактеріоз кишечника може активувати клітини Th17, викликаючи запалення шлунково-кишкового тракту, а також відіграє важливу роль у формуванні нервово-психічних захворювань [4].
Імуномодулюючі ефекти пробіотиків пов’язують з їх регулюючою дією на Т-клітинну популяцію й синтез і секрецію протизапального цитокіну IL-10 [13]. У дослідженні S.D. Bilbo та J.M. Schwarz (2012) доведено, що пероральне введення Bifidobacterium infantis 35624 у людини асоціюється з посиленням експресії IL-10 у периферичній крові [15].
Мікробіота кишечника також підтримує нормальне функціонування кишкового бар’єра, що важливо для стабільності гомеостазу [4]. Баланс кишкових мікробів може регулювати запальні реакції в організмі. Порушення цього мікробного балансу, особливо в ранньому дитячому віці, може сприяти розвитку хронічного запального процесу, що призводить до неадаптивних змін настрою й поведінки, у тому числі підвищеної чутливості до стресу, а також збільшити ймовірність формування хронічних захворювань унаслідок стресу [13].
Кишковий бар’єр
Кишковий бар’єр — це багаторівнева система, що складається з поверхневого фізичного бар’єра (слизова оболонка кишечника — перший шар) і глибокого функціонального бар’єра (другий шар), який ідентифікує мікроорганізми (патогенні чи непатогенні) й індукує імунну реакцію проти патогенів. Цілісність кишкового бар’єра залежить від складу мікробіоти, імунних клітин, епітеліальних клітин кишечника і їх комбінації, а також антимікробних пептидів. Порушення цілісності кишкового бар’єра змінює його проникність і сприяє проходженню патогенів і шкідливих речовин у кровотік. Дисфункція кишкового бар’єра може викликати неврологічні й поведінкові зміни [4, 16].
Нейротрансмітери
Бактерії кишкової мікробіоти можуть виробляти нейромедіатори, такі як ГАМК, норадреналін, допамін, серотонін, адреналін, ацетилхолін, гістамін, і потенціювати дію біологічно активних нейропептидів. ГАМК є інгібіторним нейромедіатором, і зменшення (або порушення) її продукції часто пов’язано з такими симптомами, як депресія та тривога. Продукування ГАМК кишковою мікробіотою (Lactobacillus і Bifidobacterium) доводить, що ці бактерії ефективні для вироблення нейротрансмітерів, таким чином вони впливають на ГАМКергічну нейротрансляцію через здатність перетинати ГЕБ і проникати в ЦНС. Крім того, залучення блукаючого нерва дозволяє регулювати траєкторію нейропередачі ГАМК. Модуляція кишкової мікробіоти, наприклад, з пробіотиками модифікує експресію ГАМК у ЦНС, зменшуючи рівень ГАМК у гіпокампі й збільшуючи його в кіркових ділянках [17].
Іншою групою нейротрансмітерів є катехоламіни: норадреналін і допамін. Ці нейромедіатори беруть участь у таких фізіологічних процесах, як регуляція ендокринних осей, керування рухом і пізнавальною діяльністю. Норадреналін і допамін можуть також утворюватися мікробіотою кишечника, таким чином збільшуючи їх рівні в мозку. Кишкова мікробіота також виробляє серотонін і гістамін, що пов’язані з циркадним ритмом, когнітивними функціями, прийомом їжі та сприйняттям болю. Отже, кишкова мікробіота працює як ендокринний орган і може також контролювати ГГН вісь [4, 18, 19].
Гормональний зв’язок через гіпоталамо-гіпофізарно-надниркову вісь
ГГН вісь є головною віссю стресу й пов’язана з реакцією на стрес і гіперсекрецію кортизолу. Активація паравентрикулярного ядра через вплив психологічних чи фізичних стресових факторів викликає секрецію кортикотропін-рилізинг-гормону. Ланцюг кортикотропін-рилізинг-гормону починається в гіпоталамусі й закінчується в передній частці гіпофіза, де секретується адренокортикотропний гормон. Адренокортикотропний гормон викликає вивільнення кортизолу (глюкокортикоїд) корою надниркових залоз. Стрес-відповідь може порушити цю схему через надмірне вироблення глюкокортикоїдів, що регулюють багато фізіологічних процесів, таких як імунітет, метаболізм і нейророзвиток [4, 18].
Зв’язок через блукаючий нерв
АНС поділяється на симпатичну, парасимпатичну й ентеральну нервову систему. Блукаючий нерв — це десятий черепно-мозковий нерв, він складається з моторних і сенсорних волокон. Зв’язок між мікробіотою кишечника (ентеральною нервовою системою) і головним/спинним мозком (ЦНС) є двоспрямованим і також може здійснюватися через блукаючий нерв. Активація блукаючого нерва відіграє важливу роль у поведінковій, когнітивній, емоційній і мозковій діяльності, пов’язаній з такими механізмами, як активація імунітету (запальна реакція), кишкова проникність, ендокринна сигналізація й кишковий рефлекс. Еферентний шлях модулює функцію кишечника (секрецію бікарбонатів, рухливість), підтримуючи нормальну мікробіоту кишечника [4].
Триптофановий обмін і синтез серотоніну
Триптофан — незамінна амінокислота, яку людина отримує з їжею. Деякі бактеріальні штами мікробіоти кишечника (наприклад, Firmicutes і Proteobacteria) можуть виробляти триптофан безпосередньо з триптофанази [4].
Важливий метаболіт триптофану — серотонін, який є нейромедіатором і бере участь у багатьох фізіологічних процесах, таких як поведінка, регуляція апетиту, емоцій, моторної, пізнавальної функції [20, 21].
Близько 95 % 5-НТ (5-гідрокситриптофан) в організмі утворюється ентерохромафінними клітинами слизової оболонки кишечника й нейронами ЕНС. 5-HT бере участь у регуляції секреції й моторної функції (скорочення гладкої мускулатури й релаксація) гастроінтестинального тракту, а також у сприйнятті болю, тоді як у мозку 5-HT сигнальні шляхи беруть участь у регулюванні настрою й пізнання. Отже, дисфункціональна 5-HT сигналізація може лежати в основі патологічних симптомів, пов’язаних як із гастроінтестинальним трактом, так і з порушенням настрою, а також може сприяти поєднанню цих розладів [13, 18]. Отже, препарати, що модулюють серотонінергічну нейро–трансмісію (трициклічні антидепресанти, специфічні інгібітори зворотного захвату серотоніну), мають бути ефективні для лікування не тільки нейропсихіатричних розладів, а й функціональних захворювань гастроінтестинального тракту, в тому числі й при СПК.
Результати експериментальних досліджень вказують, що мікробіота може регулювати синтез 5-HT у кишечнику. При цьому синтез серотоніну суттєво залежить від наявності триптофану. Вчені з Іспанії (Clark A., Mach N., 2016) встановили, що відсутність мікробіоти в мишей раннього віку призводить до збільшення концентрації триптофану в плазмі й збільшення 5-HT у гіпокампі в дорослому віці [21]. В іншому дослідженні на тваринних моделях продемонстровано, що мікроб–ні метаболіти, такі як КЛЖК, сприяють транскрипції триптофангідроксилази, що має вирішальне значення для біосинтезу 5-HT [22, 23].
Отже, мікробіота кишечника може відігравати важливу роль в забезпеченні (або підвищенні) біодоступності й метаболізмі триптофану і таким чином впливати на концентрацію 5-НТ у ЦНС. Хоча специфічні механізми, що лежать в основі цієї взаємодії, невідомі, скоріше за все, вони потенційно опосередковані імунною системою, пов’язаною з мікробною колонізацією [13].
Ентероендокринні сигнальні шляхи
Слизову оболонку шлунково-кишкового тракту становлять епітеліальні клітини й ентероендокринні (приблизно 1 % від усіх клітин у просвіті кишечника), які можуть виробляти сигнальні молекули (нейропептиди), а саме субстанцію Р, серотонін, нейропептид Y, соматостатин, глюкагоноподібний пептид тощо, що є важливими трансмітерами ЦНС і забезпечують зв’язок між нейронами й іншими клітинами. Вони є важливими сигнальними агентами в аферентних, центральних і еферентних трактах двонаправленої системи комунікації кишечника й мозку. Доведено, що бактеріальні популяції кишкової мікробіоти можуть регулювати ці ентероендокринні клітини. Функції осі кишкового мозку пов’язані з емоційними й когнітивними центрами, такими як центральна, вегетативна й кишкова нервова системи, а також ентероендокринна система [4, 19].
Коротколанцюгові жирні кислоти
Мікробіота кишечника метаболізує певні КЛЖК. Оцтова, пропіонова й масляна кислота є основними КЛЖК (основні продукти анаеробного метаболізму), що продукуються кишковими бактеріями. Ці метаболіти впливають на фізіологічні функції, такі як регуляція експресії генів, джерела енергії, модуляція нейротрансмісії, зміна сигнальних молекул, регуляція імунних клітин і пригнічення запалення, а також можуть впливати на фізіологічні функції мозку й поведінку. КЛЖК, що утворюються в кишечнику, можуть проникати через ГЕБ [23]. Зокрема, ацетат може викликати фізіологічні зміни в гіпоталамусі (зміна рівня нейротрансмітерів — глутамату, глутаміну й ГАМК) і підвищення рівня експресії аноректичного нейропептиду, такого як α-меланоцитстимулюючий гормон. Продукція ацетату через ферментацію вуглеводів кишковою мікробіотою також може модулювати відчуття ситості [4, 24].
Отже, мікробіота кишечника може опосередковано впливати на функціонування мозку через вісь, що включає центральну нервову систему, блукаючий нерв, обмін триптофану, нейроендокринні й нейроімунні системи, ГГН систему, вегетативну нервову систему та ЕНС (рис. 1) [11, 26, 27].
Стає очевидним факт, що в основі патогенезу не тільки нейропсихіатричних, а й багатьох захворювань внутрішньої медицини, у тому числі й функціональних розладів шлунково-кишкового тракту, таких як СПК, лежать мультифакторні комплексні взаємопов’язані зміни мікробіоти, імунної, нейроендокринної систем і різних відділів нервової системи, що об’єднуються в єдину вісь «кишечник — мозок» (рис. 2).
Синдром подразненої товстої кишки через призму осі «кишечник — мозок»
Синдром подразненої товстої кишки — один із найбільш частих функціональних розладів шлунково-кишкового тракту. Його поширеність у західних країнах сягає 15 %. Значну роль в його виникненні відіграє взаємодія факторів зовнішнього середовища й індивідуальних особливостей пацієнта [28]. Серед останніх виділяють, зокрема, розлади адаптації, супутні психічні захворювання, когнітивні порушення, а також порушення моторики кишечника, вісцеральну гіперчутливість (ВГЧ), знижену активність імунної системи, порушення бар’єрної функції кишечника, мікро–запалення (low-grade) і зміни кишкової –мікробіоти внаслідок порушення функціонування сигнальної системи, що пов’язує кишечник і голов–ний мозок [29].
Роль мікробіоти у формуванні СПК
У хворих з СПК встановлено нестабільність складу мікробіоти, що може бути тимчасовою або постійною.
Результати досліджень складу кишкової мікробіоти у пацієнтів із СПК вказують на зниження кількості біфідобактерій, що корелює з вираженістю симптоматики СПК. Зафіксована обернено пропорційна кореляція між вираженістю болю, частотою дефекації та вмістом пристінкових Bifidobacteria [29].
Найбільш виражені дисбіотичні зміни виявлено у хворих на СПК після перенесеного гострого ентероколіту. Відзначені такі патогени, як Staphylococcus aureus, Shigella, Clostridium perfringens, а також у великих кількостях виявлено Bacillus cereus і Campylobacter, що збільшує ризик формування СПК у 6 разів [30, 31].
Доказом того, що мікрофлора шлунково-кишкового тракту — один із факторів патогенетичного механізму СПК, є результати дослідження з транс–плантації калу, у якому було показано, що симптом СПК, зокрема біль у животі внаслідок вісцеральної гіперчутливості, може бути індукований у стерильних (позбавлених бактеріальної флори) щурів за допомогою трансплантації тваринам кишкової мікробіо–ти пацієнтів із СПК [32]. У клінічному дослідженні J. Jalanka-Tuovinen (2011), що включало пацієнтів із больовою й безбольовою формами СПК, встановлено зниження кількості біфідобактерій (більше ніж у 5 разів) у хворих із больовою формою СПК [29]. За даними гістологічного дослідження біоптатів слизової ободової кишки й досліджень зразків калу у пацієнтів з СПК також виявлено зменшення вмісту бактерій роду Bifidobacterium [32].
Відомо, що в стерильних мишей, колонізованих кишковою мікробіотою пацієнтів із СПК з переважанням діареї, відзначаються збільшення швидкості транзиту по ШКТ і порушення проникності кишкової стінки, на той час як у мишей, колонізованих кишковою мікробіотою здорових осіб, перераховані зміни не зареєстровані [24]. У дослідженні J. Sundin та співавт. (2015) виявлено відмінності в рівнях цитокінів у пацієнтів із постінфекційною формою СПК і здорових осіб контрольної групи. Після стимуляції ex vivo біопсії кишечника з відповідними видами анаеробних коменсальних бактерій (Bacteroides ovatus, Ruminococcus gnavus, Akkermansia muciniphila, Subdoligranulum variabile, Eubacterium limosum) у групі хворих із СПК виявлено вірогідні відмінності у вивільненні імунорегуляторних цитокінів (IL-13, IL-10 і IL-1β) порівняно з показниками контрольної групи, що вказує на змінену імунну відповідь у хворих із СПК [33].
Роль запалення й імунної відповіді у формуванні СПК
Ультраструктурні зміни слизової оболонки товстої кишки у хворих на СПК вказують на потовщення базальної мембрани, надлишкове відкладення колагенових волокон у субепітеліальній зоні, дистрофічні зміни окремих клітин епітелію. Майже в половини хворих із СПК підвищена активність і кількість запальних клітин у слизовій оболонці кишки, підвищена експресія прозапальних і знижена експресія проти–запальних цитокінів, виявляють також такі особ–ливості запального інфільтрату слизової оболонки кишки, як переважання ентерохромафінних клітин, які секретують серотонін, що, у свою чергу, викликає посилення моторики, а також скупчення тучних клітин і їх де–грануляцію в зоні нервових закінчень, змінює сприйняття болю.
Проведені морфологічні дослідження у хворих із СПК вказують на запалення низького ступеня (low-grade) у слизовій оболонці кишечника. Доведено, що такого характеру запальні зміни можуть викликати вісцеральну гіперчутливість, епітеліальну й нервово-м’язову дисфункцію й порушення перистальтики [29, 32].
Останніми роками при вивченні патогенетичних ланок формування СПК все більше уваги приділяється змінам експресії тол-подібних рецепторів (toll-like receptors, TLR) слизової оболонки кишечника, які виявлені на імунних та ентероендокринних клітинах і нейронах ентеральної нервової системи, що підкреслює принципову роль дисбіозу кишечника, запалення низького ступеня й імунної відповіді в розвитку СПК. TLR у фізіологічних умовах взаємодіють з лігандами нормальної мікрофлори кишечника. Таке розпізнавання коменсальної мікрофлори необхідне для підтримки нормального гомеостазу й забезпечення балансу функцій кишкового епітелію й інших клітин, синтезу про- і протизапальних цитокінів і різних протективних факторів. TLR необхідні для стимуляції й збільшення проліферації й репарації епітеліальних клітин. Сигнали TLR посилюють бар’єрну функцію кишечника.
У хворих із СПК виявлена підвищена експресія TLR-4 і TLR-5, відповідальних за розпізнавання ліпополісахариду й флагеліну. При цьому в крові визначається підвищений рівень антифлагелінових антитіл, що корелює з підвищеною проникністю слизової оболонки кишки при СПК [35]. Дослідження S.C. Bischoff та співавт. (2014) показують, що підвищена імунна відповідь при СПК характеризується збільшенням експресії й посиленням активації TLR. При цьому проникність кишечника збільшується на 15–50 % у хворих із СПК, що дозволяє мікробіоті кишечника запустити запальний процес, що, у свою чергу, може впливати на центральну нервову систему через збільшення рівнів циркулюючих цитокінів [36].
У пацієнтів із СПК при біопсії кишечника встановлена інфільтрація переважно тучними клітинами навколо нейронів, що асоціюється із здуттям, болем і вираженістю симптомів захворювання, а також активація моноцитів, що індукує імунне запалення. Отже, імунна активація може відігравати вирішальну роль у патогенезі СПК [29]. Крім того, психологічний стрес є одним із факторів, що індукують імунну активацію й активують вироблення нейромедіаторів. В експериментальному дослідженні встановлено, що в стерильних мишей (відсутність бактеріальної колонізації в кишечнику) спостерігається підвищена реакція на стрес, а також підвищені рівні гормонів стресу, що має тенденцію до нормалізації при лікуванні Bifidobacterium infantis [35].
Серотонін, що виробляється ентерохромафінними клітинами в кишечнику [37], і гістамін, що продукується тучними клітинами слизової оболонки, діють як прозапальні медіатори в кишечнику й модулюють кишкову проникність. У хворих на СПК після перенесеного гострого ентероколіту виявлена підвищена регуляція серотонінергічного сигналу, що викликано кріогенним запаленням і може пов’язуватись із вираженістю симптоматики. У пацієнтів із СПК після перенесеного гострого ентероколіту виявлено значне збільшення кількості ентерохромафінних клітин, що розглядається як фактор ризику розвитку СПК. Крім того, вироблення серотоніну й регуляція 5-HT рецепторів роблять внесок у розвиток вісцеральної гіперсенсибілізації [22, 28].
Бактерії, вісцеральна гіперчутливість і порушення моторики
Важливим фактором патогенезу СПК є порушення інтрамуральної нервової регуляції кишки, що призводить до розвитку вісцеральної гіперчутливості, яка проявляється виникненням больових відчуттів і моторних порушень у відповідь на допороговий стимул. Вісцеральна гіперчутливість відіграє важливу роль у розвитку хронічного болю й дискомфорту у хворих із СПК.
Її регулювання відбувається на багатьох рівнях — на рівні слизової й підслизової оболонки кишечника, на рівні спинного мозку, таламуса й кори головного мозку. Взаємодія між серотонінергічними шляхами й лімбічною системою дуже важлива для формування вісцерального болю. Дослідження вказують на зв’язок між вісцеральною гіперчутливістю при СПК і емоційними розладами, такими як депресія й біполярні порушення. Негативні емоційні стани (страх, печаль) асоціюються з аномальною вісцеральною гіперчутливістю і болями в животі. Відомо, що вегетативна нер–вова система регулює вісцеральну гіперчутливість, а також модулює й координує моторику шлунково-кишкового тракту [38].
Дослідження Р. Luczynski та співавт. (2017) на тваринах показали, що відсутність бактеріальної колонізації в кишечнику (стерильні тварини) призводить до вісцеральної гіперчутливості й може бути нормалізована шляхом введення мікроорганізмів у кишечник, що свідчить про необхідність бактеріальної колонізації для нормального розвитку ноцицептивного функціонування [39]. Інше дослідження також показало, що підвищена чутливість кишечника може бути перенесена на щурів через трансплантацію фекалій від хворих на СПК [35].
Отже, вісцеральна гіперчутливість — виражена патофізіологічна особливість хворих на СПК, яка може включати порушення будь-якого або всіх (нервових, імунних, ендокринних та метаболічних) процесів. Імунні шляхи можуть призводити до підвищеної проникності кишечника. При цьому на проникність кишечника, на яку можуть впливати пробіотики через їх позитивну дію на білки, що створюють тісний зв’язок у кишкових епітеліальних клітинах. У дослідженні, що включало пацієнтів з СПК, виявлено порушення співвідношення цитокинів (IL-10/IL-12), яке нормалізувалося разом із зменшенням клінічних симптомів після 8-тижневого прийому Bifidobacterium infantis 35624 [35].
Зв’язок між бактеріями й кишковою моторикою здійснюють TLR-рецептори, що контролюють кишковий епітеліальний гомеостаз. На експериментальних моделях встановлена значна затримка моторики шлунково-кишкового тракту в TLR4-мутантних мишей [40], а E.K. Brint і співавт. (2011) у своїх дослідженнях вказують на підвищену експресію TLR4 з біопсії кишечника у хворих із СПК із переважанням діареї [41].
Продукти життєдіяльності мікробіоти кишечника, такі як ліпополісахариди й флагелін, регулюють TLR4 і TLR5 рецептори, отже, підвищена експресія цих рецепторів може бути реакцією на підвищений рівень цих бактеріальних компонентів унаслідок дисбіозу, що, у свою чергу, викликає запалення слизової оболонки, підвищує проникність і сприяє вісцеральній гіперчутливості [35].
Отже, розвиток вісцеральної гіперчутливості товстої кишки внаслідок порушення в системі «головний мозок — кишечник» розглядається як одна з причин зміни моторики при СПК. Шлунково-кишкова дисмоторика — одна з провідних особливостей СПК, що проявляється в затримці транзиту в пацієнтів, схильних до запорів, а також у прискоренні транзиту в пацієнтів, схильних до діареї.
Як кінцевий результат при СПК виникають дискінезія (гіперсегментарний гіперкінез, антиперистальтичний гіперкінез або дискоординація тонічного й пропульсивного компонентів моторики кишки, рідше — дистоничний гіпо- або акінез чи порушення змішаного характеру) товстої кишки, що проявляється болем і дискомфортом у животі [38].
Доцільність використання Альфлорексу (Bifidobacterium infantis 35624) у хворих із синдромом подразненого кишечника
З огляду на вищенаведені дані вибір тактики лікування хворих на СПК має бути спрямований на ліквідацію основних патогенетичних механізмів на рівні осі «кишечник — мозок». Із цією метою застосовують різні групи препаратів.
З точки зору комплексного впливу на патогенетичні ланки цікавим є власне Альфлорекс (Bifidobacterium infantis 35624), який сприяє усуненню дефіциту біфідо–бактерій, а також зменшенню мікрозапалення, що може бути корисним для нормалізації взаємодії –кишечника й мозку у пацієнтів із СПК.
Докази того, що застосування Bifidobacterium infantis 35624 може нормалізувати взаємодію кишечника й мозку, були продемонстровані неодноразово в експериментальних дослідженнях. Так, у дослідженні J. McCarthy та співавт. у 2003 році було доведено зменшення запалення кишечника під впливом B.іnfantis 35624 порівняно з групою плацебо, що характеризувалося зменшенням прозапальних цитокінів і базальної продукції TNF-α й інтерферону-γ в моноцитах кишечника в експериментальних моделях, що підтверджує протизапальні властивості B.іnfantis за допомогою модуляції імунної системи як на системному, так і на органному рівнях [42].
Альфлорекс (B.infantis 35624) може сприяти нормалізації показників стрес-індукованого запалення шляхом регулювання запальної відповіді, що було показано в дослідженні N. Sudo та співавт. у 2004 р. [21].
Інші дослідження продемонстрували схожі ефекти штаму щодо стрес-індукованого запалення [43]. L. Desbonnet та співавт. (2010) викликали стрес у щурів, відокремлюючи їх у ранньому віці від матерів. У цій моделі вчені встановили, що Bifidobacterium infantis 35624 нормалізував підвищену запальну реакцію, що проявлялося збільшенням рівня норадреналіну в мозку й підвищенням рівня системного ІL-6 і кортикостерону в плазмі в стрес-індукованих щурів [44].
Нормалізуючий вплив B.infantis 35624 на запальні процеси підтверджено в численних дослідженнях як in vitro, так і in vivo, у тому числі A.M. O’Hara та співавт. (2006 р.) [42].
L. O’Mahony та співавт. (2005) проводили подвійне сліпе паралельне плацебо-контрольоване дослідження у 77 хворих із СПК з порівнянням двох різних штамів: B.infantis 35624 і L.salivarius UCC4331. Використання штаму B.infantis 35624 сприяло зменшенню системного запалення, нормалізуючи співвідношення рівнів IL-10 і IL-12 у сироватці крові, що вказує на імуномодулюючу роль цього пробіотика при СПК. Нормалізація цитокінового профілю супроводжувалася зменшенням вираженості симптомів захворювання (здуття, дискомфорт у животі). При використанні L.salivarius встановлено лише незначне зниження прозапальних цитокінів. Отже, штам L.salivarius не продемонстрував терапевтичного ефекту, отримані результати вказують, що ефект є специфічним лише для штаму B.infantis 35624 і він не може бути інтерпольований на інші види й штами бактерій [43, 45, 46].
Вплив B.infantis на серотонін може становити особ–ливий інтерес з огляду на наявність даних, підтверджених морфологічно за результатами біопсії товстої кишки, про дефекти серотонінергічної сигналізації в кишечнику хворих на СПК [47]. Хоча метааналізи свідчать про те, що селективні інгібітори зворотного захвату серотоніну істотно не покращують симптоми СПК [48], при цьому серотонін, що виробляється локально бактеріями кишкової мікробіоти, є більш ефективним [47].
Ефективність B.infantis також була продемонстрована в багатоцентровому дослідженні із залученням 362 пацієнтів із СПК. Вживання B.infantis 35624 сприяло зменшенню/нормалізації клінічної симптоматики (біль і дискомфорт у животі, розпирання, відчуття неповного випорожнення, метеоризм) [49, 50].
Отже, Альфлорекс — штам B.іnfantis 35624, ексклюзивно представлений в Україні, сприяє зменшенню всіх клінічних симптомів СПК за рахунок його здатності сприяти нормалізації імунних реакцій, зменшенню мікрозапалення, модуляції моторної діяльністі і зниженню вісцеральної гіперчутливості.
Висновки
Від стану мікробіому залежить фізичне й психічне здоров’я людини, а також якість і тривалість її життя. Не викликає сумніву, що мікробіота кишечника впливає на функції організму через двонаправлений зв’язок по осі «кишечник — мозок», регулюючи імунні, нейроендокринні й вагальні шляхи [1].
СПК — одна з найбільш частих патологій органів травлення [37], він має багатокомпонентний патогенез, що включає генетичну схильність, психосоматичні аспекти, хронічне запалення низького ступеня в слизовій оболонці кишечника і, як наслідок, формування вісцеральної гіперчутливості, зміни рухової активності кишечника [51]. Порушення в кишковій мікрофлорі також розглядається як один із важливих факторів розвитку СПК через зміни у двонаправленому зв’язку між голов–ним мозком і кишечником, що поєднує зміни ЦНС, ней–роендокринних, нейроімунних систем, ГГН системи, а також вегетативної та ентеральної нервових систем.
Серед засобів, які можуть впливати на симптоми СРК, переконливу доказову базу має Альфлорекс (Bifidobacterium infantis 35624) за рахунок його здатності сприяти нормалізації різних патогенетичних ланок СПК через призму осі «кишечник — мозок». Ці особ–ливості Альфлорексу можуть бути корисні для пацієнтів із СПК — як при СПК з діареєю, так і при СПК із запорами, а також при СПК змішаного типу. Як зазначено в клінічних дослідженнях, зокрема Е. Quigley та співавт., Альфлорекс (Bifidobacterium infantis 35624) сприяє зменшенню всіх симптомів СПК і відрізняється добрим профілем безпеки [52], що досягається шляхом зменшення запальної відповіді і, як наслідок, вісцеральної гіперчутливості, а також нормалізації моторики кишечника. І коли ми вперше встановлюємо діагноз СПК, це означає, що у хворого вже є мікрозапалення слизової кишечника, вісцеральна гіперчутливість, і тому він потребує корекції цих змін. Отже, у низці випадків варто розглядати доцільність тривалої підтримуючої терапії таких пацієнтів за допомогою засобу Альфлорекс (B.infantis 35624) для забезпечення стійкої ремісії клінічних симптомів СПК.
Отже, розуміння складних, багатофакторних механізмів патогенезу СРК дає можливість більш чітко зосередитися на шляхах корекції патогенетичних чинників і розглянути доцільність використання –засобів комплексного впливу на вісь «кишечник — мозок».
Конфлікт інтересів. Не заявлений.
Список литературы
1. Инновационные подходы к коррекции микробиома в педиатрической практике / [Г.В. Бекетова, Ф. Франчески, О.Г. Шадрин, С.А. Крамарев] // Здоров’я України. Тематичний номер. — 2016. — № 2(37). — С. 4-6.
2. Evrense А. The Gut-Brain Axis: The Missing Link in Depression / A. Evrensel, M.E. Ceylan // Clinical Psychopharmacology and Neuroscience. — 2015. — № 13 (3). — Р. 239-244.
3. Relationship between the gut microbiome and brain function / [M.H. Mohajeri, G. La Fata, R.E. Steinert, P. Weber] // Nutrition Reviews. — 2018. — April. — Р. 1-16.
4. The role of the gut microbiota in schizophrenia: Current and future perspectives / [D. Rodrigues-Amorim, T. Rivera-Baltanás, B. Regueiro et al.] // The World Journal of Biological Psychiatry. — 2018. — № 21. — Р. 1-15.
5. Abnormal gut microbiota composition contributes to cognitive dysfunction in SAMP8 mice / [G. Zhan, N. Yang, S. Li et al.] // –Aging. — 2018. — Vol. 10, № 6. — P. 1257-1267.
6. Abhari K. Psychobiotics: Next Generation Treatment for Mental Disorders / K. Abhari, H. Hosseini // Journal of Clinical Nutrition and Dietetics. — 2018. — Vol.4, № 1. — P. 1.
7. Gut Microbiota Interacts with Markers of Adipose Tissue Browning, Insulin Action and Plasma Acetate in Morbid Obesity / [J.M. Moreno-Navarrete, M. Serino, V. Blasco-Baque et al.] // Mol. Nutr. Food Res. — 2018. — № 62(3).
8. The Role of the Microbial Metabolites Including Tryptophan Catabolites and Short Chain Fatty Acids in the Pathophysiology of Immune-Inflammatory and Neuroimmune Disease / [G. Morris, M. Berk, A. Carvalho et al.] // Mol. Neurobiol. 2017. — № 54(6). — Р. 4432-4451.
9. Innovative biomarkers in psychiatric disorders: a major clinical challenge in psychiatry / M. Lozupone, D. Seripa, E. Stella et al.] // Expert Review of Proteomics. — 2017. — Vol. 14, № 9. — Р. 809-824.
10. Связь между микробиотой ЖКТ и психическим здоровьем человека / [А.Е. Козлов, А.В. Казанцев, В.А. Вязовченко и др.] // Bulletin of Medical Internet Conferences. — 2015. — Vol. 5, Is. 12. — Р. 1692.
11. Gut microbiota interacts with brain microstructure and function / [J.M. Fernandez-Real, M. Serino, G. Blasco et al.] // J. Clin. Endocrinol. Metab. — 2015. — № 100(12). — Р. 4505-4513.
12. Bienenstock J. Microbiota and the gut-brain axis / J. Bie–nenstock, W. Kunze, P. Forsythe // Nutrition Review. — 2015. — Vol. 73(S1). — P. 28-31.
13. Foster J.A. Stress and the gut-brain axis: Regulation by the microbiome / J.A. Foster, L. Rinaman, J.F. Cryan // Neurobiology of Stress. — 2017. — № 7. — Р. 124-136.
14. Sampson T.R. Control of brain development, function, and behavior by the microbiome / T.R. Sampson, S.K. Mazmanian // Cell Host Microbe. — 2015. — № 17. — Р. 565-576.
15. Bilbo S.D. The immune system and developmental programming of brain and behavior / S.D. Bilbo, J.M. Schwarz // Front. Neuroendocrinol. — 2012. — № 33(3). — Р. 267-286.
16. Composition and diversity of mucosa-associated microbiota along the entire length of the pig gastrointestinal tract; dietary influences / [J. Kelly, K. Daly, A.W. Moran et al.] // Environ. Microbiol. — 2017. — № 19(4). — Р. 1425-1438.
17. Gut microbiota in autism and mood disorders / [F. Mangiola, G. Ianiro, F. Franceschi et al.] // World J. Gastroenterol. — 2016. — № 22(1). — Р. 361-368.
18. Recognizing Depression from the Microbiota-Gut-Brain Axis / [S. Liang, X. Wu, X. Hu et al.] // Int. J. Mol. Sci. — 2018. — № 19. — Р. 1592.
19. Bienenstock J. Disruptive physiology: olfaction and the microbiome-gut-brain axis / J. Bienenstock, W.A. Kunze, P. Forsythe // Biol. Rev. Camb. Philos. Soc. — 2018. — № 93(1). — Р. 390-403.
20. Lamas B. Caspase recruitment domain 9, microbiota, and tryptophan metabolism: dangerous liaisons in inflammatory bowel di–seases / B. Lamas, M.L. Richard, H. Sokol // Curr. Opin. Clin. Nutr. Metab. Care. — 2017. — № 20(4). — Р. 243-247.
21. Clark A. Exercise-induced stress behavior, gut-microbio–ta-brain axis and diet: a systematic review for athletes / A. Clark, N. Mach // Journal of the International Society of Sports Nutrition. — 2016. — № 13. — Р. 43
22. Malinova T.S. Serotonin: A mediator of the gut-brain axis in multiple sclerosis / Malinova T.S., Dijkstra C.D., de Vries H.E. // Mult. Scler. — 2018. — № 24(9). — Р. 1144-1150.
23. The role of the microbial metabolites including tryptophan catabolites and short chain fatty acids in the pathophysiology of immune-inflammatory and neuroimmune disease / [G. Morris, M. Berk, A. Carvalho et al.] // Mol. Neurobiol. — 2017. — № 54(6). — P. 4432-4451.
24. The role of the microbiome for human health: from basic science to clinical applications / [M.H. Mohajeri, R.J.M. Brummer,· R.A. Rastall] // European Journal of Nutrition. — 2018. — May 10. — https://doi.org/10.1007/s00394-018-1703-4
25. Possibility of polyunsaturated fatty acids for the prevention and treatment of neuropsychiatric illnesses / [М. Hashimoto, М. Maekawa, М. Katakura et al.] // J. Pharmacol. Sci. — 2014. — № 124(3). — Р. 294-300.
26. The gut-brain axis: interactions between enteric microbiota, central and enteric nervous systems / [M. Carabottia, A. Sciroccoa, M.A. Masellib, C. Severia] // Annals of Gastroenterology. — 2015. — № 28. — Р. 1-7.
27. The gut-brain-axis and the heart / [R.B. Singh, J. Fedacko, D. Pella et al.] // MOJ Public Health. — 2018. — № 7(3). — Р. 129-138.
28. New therapeutic perspectives in irritable bowel syndrome: Targeting low-grade inflammation, immuno-neuroendocrine axis, motility, secretion and beyond / [E. Sinagra, G.C. Morreale, G. Mohammadian et al.] // World J. Gastroenterol. — 2017. — № 23(36). — Р. 6593-6627.
29. Irritable bowel syndrome, the microbiota and the gut-brain axis / [H. Raskov, J. Burcharth, H.-C. Pommergaard, J. Rosenberg] // Gut Microbes. — 2016. — Vol. 7, № 5. — Р. 365-383.
30. Postinfectious irritable bowel syndrome: follow-up of a patient cohort of confirmed cases of bacterial infection with Salmonella or Campylobacter / [J. Schwille-Kiuntke, P. Enck, C. Zendler et al.] // Neurogastroenterol. Motil. — 2011. — № 23(11). — e479-88.
31. Cytokine Response after Stimulation with Key Commensal Bacteria Differ in Post-Infectious Irritable Bowel Syndrome (PI-IBS) Patients Compared to Healthy Controls / [J. Sundin, I. Rangel, D. Repsilber, R.J. Brummer] // PLoS One. — 2015. — № 10(9). — Р. e0134836.
32. An irritable bowel syndrome subtype defined by species-specific alterations in faecal microbiota / [ I.B. Jeffery, P.W. O’Toole, L. Ohman et al.] // Gut. — 2012. — № 61. — Р. 997-1006.
33. Aberrant mucosal lymphocyte number and subsets in the colon of post-infectious irritable bowel syndrome patients / [J. Sundin, І. Rangel, A.K. Kumawat et al.] // Scand. J. Gastroenterol. — 2014. — № 49(9). — Р. 1068-1075.
34. Oleskin A.V. Neuromodulatory effects and targets of the SCFAs and gasotransmitters produced by the human symbiotic microbiota / A.V. Oleskin, B.A. Shenderov / Microb. Ecol. Health Dis. — 2016. — № 27. — Р. 30971.
35. Harper А. The Role of Bacteria, Probiotics and Diet in Irritable Bowel Syndrome / A. Harper, M.M. Naghibi, D. Garcha // Foods. — 2018. — № 7(2). — Р. 13. doi: 10.3390/foods7020013.
36. Intestinal permeability-a new target for disease prevention and therapy / [S.C. Bischoff, G. Barbara, W. Buurman et al.] // BMC Gastroenterol. — 2014. — № 14. — Р. 189.
37. Степанов Ю.М. Роль висцеральной гиперчувствительности в развитии синдрома раздраженного кишечника / Ю.М. Степанов, И.Я. Будзяк // Гастроентерологія. — 2018. — № 52(2). — С. 104-108.
38. Бубнова Е.А. Виды нарушений двигательной функции толстой кишки и висцеральной гиперчувствительности при различных клинических вариантах синдрома раздраженного кишечника / [Е.А. Бубнова, О.Ю. Фоменко, И.Л. Халиф, В.В. Павленко] // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2016. — № 6(6). — С. 32-39.
39. Microbiota regulates visceral pain in the mouse / [P. Luczynski, M. Tramullas, M. Viola et al.] // eLife. — 2017. — № 6. — e25887.
40. Gut microbial products regulate murine gastrointestinal moti–lity via Toll-like receptor 4 signaling / [M. Anitha, M. Vijay-Kumar, S.V. Sitaraman] // Gastroenterology. — 2012. — № 143(4). — Р. 1006-1016.
41. Differential expression of toll-like receptors in patients with irritable bowel syndrome / [E.K. Brint, J. MacSharry, A. Fanning et al.] // Am. J. Gastroenterol. — 2011. — № 106(2). — Р. 329-336.
42. Brenne D.M. Bifidobacterium infantis 35624: A Novel Probiotic for the Treatment of Irritable Bowel Syndrome / D.M. Brenne, W.D. Chey // Rev. Gastroentero. Dis. — 2009. — № 9(1). — Р. 7-15.
43. Probiotics for the treatment of depressive symptoms: An anti-inflammatory mechanism? / [Р. Caroline, E. Brietzke, J.D. Rosenblat et al.] // Brain, Behavior, and Immunity. — 2018. Jul 18. pii: S0889-1591(18)30304-0.
44. Effects of the probiotic Bifidobacterium infantis in the maternal separation model of depression / [L. Desbonnet, L. Garrett, G. Clarke et al.] // Neuroscience. — 2010. — № 170(4). — Р. 1179-1188.
45. Lactobacillus and bifidobacterium in irritable bowel syndrome: symptom responses and relationship to cytokine profiles / [L. O’Mahony, J. McCarthy, P. Kelly et al.] // Gastroenterology. — 2005. — № 128(3). — Р. 541-551.
46. Mind-altering with the gut: Modulation of the gut-brain axis with Probiotics / [K. Namhee, Y. Misun, J.O. Young, C. Hak-Jong] / Journal of Microbiology. — 2018. — № 56(3). — Р. 172-182.
47. Bifidobacterium infantis 35624 and other probiotics in the management of irritable bowel syndrome. Strain specificity, symptoms, and mechanisms / [A.P. Allen, G. Clarke, J.F. Cryan et al.] // Current Medical Research and Opinion. — 2017. — № 33(7). — Р. 1349-1351.
48. Indigenous bacteria from the gut microbiota regulate host serotonin biosynthesis / [J.M. Yano, K. Yu, G.P. Donaldson et al.] // Cell. — 2015. — № 161(2). — Р. 264-276.
49. Parkes G.C. Treating irritable bowel syndrome with probio–tics: the evidenceTreating irritable bowel syndrome with probiotics: the evidence / G.C. Parkes, J.D. Sanderson, K. Whelan // Proceedings of the Nutrition Society. — 2010. — № 69. — Р. 187-194.
50. Korpela R. Probiotics and irritable bowel syndrome / R. Korpela, L. Niittynen // Microbial Ecology in Health and Disease. — 2012. — № 23. — Р. 18573. — http://dx.doi.org/10.3402/mehd.v23i0.18573.
51. Степанов Ю.М. Синдром поздразненого кишечника: діагностика, лікування: Навчальний посібник / Ю.М. Степанов, І.Я. Будзяк. – К.: Видавець Заславський О.Ю., 2017. – 114 с.
52. Quigley E., Catanzaro D., Wycherley C., Tillisch K. Tole–rability and safety of the probiotic Bifidobacterium infantis 35624: review of clinical and postmarketing data // Am. J. Gastroenterol. — 2010. — 105 (Suppl. 1). — S480-S481. Abstract 1305.