Резюме
Актуальність. Остеопороз та дефіцит вітаміну D — відомі ускладнення травми хребта та спинного мозку (ТХСМ). Дані щодо ролі вітаміну D та паратгормона (ПТГ) в генезі остеопорозу в цієї категорії хворих залишаються суперечливими. Метою роботи було визначити рівень вітаміну D та паратгормона і його зв’язок із показниками кісткової тканини в осіб із ТХСМ. Матеріали та методи. Були обстежені 69 пацієнтів із ТХСМ та 43 особи відповідного віку та статі, які становили групу порівняння. Визначення рівня вітаміну D, паратгормона, маркера резорбції кісткової тканини (β-CTx) виконувалося за допомогою електрохемілюмінесцентного методу. Кісткову тканину досліджували методом двофотонної рентгенівської абсорбціометрії та ультразвукової (УЗ) денситометрії п’яткової кістки. Результати. У пацієнтів із ТХСМ рівень вітаміну D був вірогідно нижчим, ніж в осіб групи порівняння (12,7 ± 8,9 та 24,6 ± 9,8 нг/мл, t = 6,6, p < 0,0001). Показники паратгормона, кальцію, фосфору не відрізнялись. Зі збільшенням тривалості посттравматичного періоду рівень вітаміну D вірогідно зменшувався, а рівень ПТГ збільшувався. Показник ПТГ також вірогідно збільшувався зі зменшенням рівня вітаміну D. Залежності між рівнем вітаміну D та показниками кісткової тканини не знайдено. Проте отримано позитивний кореляційний зв’язок між рівнем ПТГ та Z-показником п’яткової кістки в пацієнтів із тривалістю посттравматичного періоду більше 5 років, а також вірогідний негативний зв’язок між показником резорбції кісткової тканин (β-CTx) та ПТГ. Висновки. У пацієнтів із ТХСМ знижені, а не підвищені рівні ПТГ свідчать про підвищену резорбцію кісткової тканини і можуть розглядатися як чинник ризику розвитку остеопорозу.
Актуальность. Остеопороз и дефицит витамина D — известные осложнения травмы позвоночника и спинного мозга (ТПСМ). Данные о роли витамина D и паратгормона (ПТГ) в генезисе остеопороза у этой категории больных остаются противоречивыми. Целью работы было определить уровень витамина D и паратгормона и его связь с показателями костной ткани у лиц с ТПСМ. Материалы и методы. Были обследованы 69 пациентов с ТПСМ и 43 человека соответствующего возраста и пола, составивших группу сравнения. Определение уровня витамина D, паратгормона, маркера резорбции костной ткани (β-CTx) выполнялось с помощью электрохемилюминесцентного метода. Костную ткань исследовали методом двухфотонной рентгеновской абсорбциометрии и ультразвуковой (УЗ) денситометрии пяточной кости. Результаты. У пациентов с ТПСМ уровень витамина D был достоверно ниже, чем у лиц группы сравнения (12,7 ± 8,9 и 24,6 ± 9,8 нг/мл, t = 6,6, p < 0,0001). Показатели паратгормона, кальция, фосфора не отличались. С увеличением продолжительности посттравматического периода уровень витамина D достоверно уменьшался, а уровень ПТГ увеличивался. Показатель ПТГ также достоверно увеличивался с уменьшением уровня витамина D. Зависимости между уровнем витамина D и показателями костной ткани не найдено. Однако получена положительная корреляционная связь между уровнем ПТГ и Z-показателем пяточной кости у пациентов с длительностью посттравматического периода более 5 лет, а также достоверная отрицательная связь между показателем резорбции костной тканей (β-CTx) и ПТГ. Выводы. У пациентов с ТПСМ сниженные, а не повышенные уровни ПТГ свидетельствуют о повышенной резорбции костной ткани и могут рассматриваться как фактор риска развития остеопороза.
Background. Osteoporosis and vitamin D deficiency are known complications of spinal cord injury (SCI). The role of vitamin D and parathyroid hormone (PTH) in the SCI-induced osteoporosis remain controversial. The purpose of the study was to determine the vitamin D and PTH levels and its relationship with bone loss in SCI persons. Materials and methods. Sixty-nine SCI persons and 43 people of the corresponding age and gender in the comparison group were examined. The levels of vitamin D, PTH as well as bone resorption marker (β-CTx) were determined using the electrochemiluminescent method. Bone loss was examined by dual-energy X-ray absorptiometry and ultrasound (US) densitometry of the calcaneus. Results. The vitamin D level in SCI persons was significantly lower than in the comparison group (12.7 ± 8.9 versus 24.6 ± 9.8 ng/ml; t = 6.6; p < 0.0001). The PTH, calcium and phosphorus levels did not differ. The vitamin D level decreased significantly and PTH increased significantly with the increase of SCI duration. The PTH also increased significantly with a decrease in the vitamin D level. There was no correlation between the level of vitamin D and the bone parameters. However, a positive correlation was found between the PTH level and the calcaneus Z-index in chronic SCI (over 5 years), as well as a significant negative correlation between the bone resorption markers (β-CTx) and PTH. Conclusions. Low PTH level, rather than elevated level indicates increased bone resorption and can be considered as a risk factor for SCI-induced osteoporosis.
Вступ
Остеопороз — відоме ускладнення травми хребта та спинного мозку (ТХСМ). За даними літератури, частота остеопорозу й остеопенії в пацієнтів із ТХСМ варіює від 32 [1] до 82 % [2]. До сьогодні механізми розвитку остеопорозу в цієї категорії хворих остаточно не досліджені. Доведена роль іммобілізації, фізичної активності, ступеня пошкодження спинного мозку тощо [1, 2]. Дані щодо ролі вітаміну D та паратгормона (ПТГ) залишаються суперечливими.
Перші дослідження вітаміну D у пацієнтів із ТХСМ були проведені в 1990-х рр. [3]. В багатьох дослідженнях показано, що в осіб із ТХСМ вміст вітаміну D вірогідно нижчий, ніж у популяції, і не залежить від віку, статі та сезонності на відміну від популяційних значень [4, 5]. Навіть серед осіб із ТХСМ, які професійно зай-маються спортом, у більшості обстежених зареєстровано дефіцит чи недостатність вітаміну D [6].
Згідно з визначенням Інституту медицини (Institute of Medicine) та Комітету ендокринологів зі створення настанов із клінічної практики (Endocrine Practice Guidelines Committee), дефіцит вітаміну D — це клінічний синдром, зумовлений низьким рівнем 25(OH)D у сироватці крові (нижчий за 20 нг/мл або 50 нмоль/л). Достатній рівень вітаміну D — вищий від 30 нг/мл (75 нмоль/л). Рівень 25(OH)D від 20 до 30 нг/мл (або від 50 до 75 нмоль/л) вважають недостатністю вітаміну D [5].
Основним джерелом вітаміну D є інсоляція. Надходження вітаміну D з їжею обмежене, оскільки в природі він міститься в незначній кількості та в невеликому переліку продуктів. Обмеження мобільності в пацієнтів із пара- та тетраплегією внаслідок ТХСМ призводить до зменшення часу інсоляції і зниження синтезу вітаміну D.
Метою роботи було визначити рівень вітаміну D та паратгормона і його зв’язок із показниками кісткової тканини в осіб із ТХСМ.
Матеріали та методи
У відділі клінічної фізіології та патології опорно-рухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» були обстежені 69 пацієнтів із ТХСМ (53 чоловіки та 16 жінок) із тетра- та параплегією або глибоким нижнім парапарезом, що виключає можливість стояння та ходи (ступінь пошкодження спинного мозку згідно із шкалою пошкодження Американської асоціації травми спинного мозку (AIS) — A, B) із тривалістю посттравматичного періоду від 3 місяців до 45 років, рівнем пошкодження від С4 до L1 (38 пацієнтів із пошкодженням на шийному рівні, 22 — на грудному та 9 пацієнтів із ТХСМ на поперековому рівні). Також були обстежені 43 особи без неврологічної патології та захворювань і станів із доведеним впливом на кісткову тканину відповідного віку та статі, які становили групу порівняння (табл. 1). Обов’язковим критерієм включення в дослідження була наявність добровільної інформованої згоди. Дослідження схвалене Комісією з питань етики клінічного відділу ДУ «Інститут геронтології ім. Д.Ф. Чеботарьова НАМН України», протокол № 5 від 19.12.2011.
З метою вивчення впливу тривалості посттравматичного періоду на кальцієво-фосфорний обмін пацієнти були розподілені на підгрупи: підгрупа 1 — тривалість до ТХСМ становить до 1 року (13 пацієнтів), підгрупа ІІ — тривалість ТХСМ — 1–5 років (21 пацієнт), підгрупа ІІІ — тривалість посттравматичного періоду — 5–10 років (14 пацієнтів), підгрупа IV — більше 10 років (21 пацієнт).
Визначення рівня вітаміну D, паратгормона, маркера резорбції кісткової тканини (С-телопептиду зшивок колагену І типу (β-CTx)) виконувалося за допомогою електрохемілюмінесцентного методу на аналізаторі Eleсsys 2010 (Roche Diagnostics, Німеччина) за допомогою тест-систем cobas. Визначення рівня кальцію та фосфору проводили на біохімічному автоматичному аналізаторі А15 (BioSystems S.A., Іспанія).
Мінеральну щільність кісткової тканини (МЩКТ) у пацієнтів підгруп І та ІІ визначали за допомогою двофотонної рентгенівської абсорбціометрії на приладі Prodigy, GEНС Lunar, Мадисон, США (2005). У пацієнтів підгрупи ІІІ і IV стан кісткової тканини визначали методом ультразвукової (УЗ) денситометрії п’яткової кістки за допомогою кількісного кісткового ультрасонометра Sahara (Hologic Inc., model 04874, 2008). З метою нівелювання впливу віку та статі кісткову тканину оцінювали за Z-показником.
Статистичний аналіз проводили із застосуванням програм Statistica 10 та MEDCALC. Нормальність розподілу визначали за критерієм Шапіро — Уїлка. Різницю показників між групами та підгрупами встановлювали за допомогою однофакторного дисперсійного аналізу ANOVA та критерію Манна — Уїтні. Регресійний аналіз виконаний із використанням лінійної регресії та кореляції Спірмена при непараметричному розподілі. Відмінності розподілу вибірок оцінювали за допомогою критерію χ2-тест. Результати подані як середні величини (± SD). Різницю показників вважали вірогідною при р < 0,05.
Результати
У пацієнтів із ТХСМ дефіцит вітаміну D реєструвався вірогідно частіше, ніж у осіб контрольної групи, — 90,3 і 32,1 % відповідно (ДІ 40,12–70,8, χс2 = 40,1, р < 0,0001). Рівень вітаміну D у пацієнтів із ТХСМ становив 12,7 ± 8,9 нг/мл і був вірогідно нижчим, ніж в осіб групи порівняння, — 24,6 ± 9,8 нг/мл (t = 6,6, p < 0,0001). Показники сироваткових рівнів кальцію загального, фосфору загального та паратгормона у вдвох групах не відрізнялись (табл. 2). Вірогідної різниці між показниками чоловіків і жінок в основній та групі порівняння не отримано. Тому в подальшому результати досліджень будуть наведені без поділу за статтю.
В обох групах показники кальцію, фосфору та паратгормона не залежали від віку й антропометричних даних.
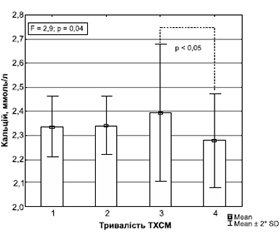
Установлено, що зі збільшенням тривалості посттравматичного періоду більше 10 років вміст кальцію в сироватці крові знижувався, але залишається в межах нормативних значень (рис. 1).
При тривалості ТХСМ у межах 10 років показники кальцію вірогідно не відрізнялись, але в дослідженні окремо не виділяли пацієнтів у гострому та ранньому періоді травми. Подібні відмінності зареєстровані і для показників фосфору (рис. 2).
Показник вітаміну D у пацієнтів із ТХСМ у середньому по групі був у межах дефіциту (< 20 нг/мл), а в осіб підгрупи ІІІ і підгрупи ІV (тривалість посттравматичного періоду більше 5 років) — у межах тяжкого дефіциту (< 10 нг/мл). Вміст вітаміну D знижувався зі збільшенням тривалості посттравматичного періоду (рис. 3), а рівень ПТГ вірогідно збільшувався (рис. 4, 5).
Найнижчим показник ПТГ був у пацієнтів І підгрупи з тривалістю посттравматичного періоду менше 1 року. І хоча в середньому по підгрупі показник був у межах норми в 43 % пацієнтів, рівень ПТГ був нижчим за норму. Це пацієнти з тривалістю посттравматичного періоду 3–6 місяців. У пацієнтів із тривалістю ТХСМ менше 10 років рівень ПТГ вірогідно залежав від тривалості посттравматичного періоду (ПТГ: y = 19,14 + + 2,67*x; r = 0,45; p = 0,002; r2 = 0,21), у пацієнтів із тривалістю більше 10 років рівень ПТГ вірогідно не збільшувався.
Показник ПТГ вірогідно збільшувався зі зменшенням рівня вітаміну D та збільшенням тривалості посттравматичного періоду (рис. 6).
У пацієнтів із тривалістю посттравматичного періоду до 5 років (підгрупи І і ІІ) не отримано зв’язку між показниками кальцію, фосфору, паратгормона, вітаміну D та показниками кісткової тканини (Z-показник на рівні шийки чи проксимального відділу стегнової кістки). А в пацієнтів із тривалістю посттравматичного періоду більше 10 років стан кісткової тканини (за даними Z-показника п’яткової кістки) вірогідно корелював із рівнем ПТГ (y = –3,92 + 0,02*x; r = 0,38; p = 0,04; r2 = 0,15). Стан кісткової тканини був кращим у пацієнтів із вищим рівнем ПТГ. Залежності між рівнем кальцію, фосфору, вітаміну D й показниками кісткової тканини знайдено не було. Проте було отримано вірогідний негативний зв’язок між показником резорбції кісткової тканини (β-CTx) та ПТГ (рис. 7).
Обговорення
Згідно з даними літератури поширеність дефіциту вітаміну D в осіб із ТХСМ становила від 39 до 93 % [3, 7]. У нашому дослідженні цей показник становив 90,3 %. У зв’язку з тим, що рівень вітаміну D зменшується зі збільшенням тривалості ТХСМ, такі суттєві розбіжності літературних даних можуть бути обумовлені різною тривалістю посттравматичного періоду в обстежених пацієнтів. До провідних причин дефіциту вітаміну D в осіб із ТХСМ відносять недостатню інсоляцію, малий вміст вітаміну D у продуктах, а також прогресуючу втрату здатності синтезувати 1,25(OH)2D у зв’язку з хронічною хворобою нирок [8]. Серед пацієнтів із ТХСМ та дефіцитом вітаміну D близько 80 % мали ознаки хронічної хвороби нирок [9]. При ТХСМ ризик розвитку хронічної хвороби нирок підвищується у зв’язку з високою поширеністю хронічних інфекцій сечових шляхів, нейрогенної дисфункції сечового міхура і сечокам’яної хвороби. Частота хронічної ниркової недостатності в цій популяції пацієнтів досягає 35 % [10]. Хронічна ниркова недостатність та дефіцит вітаміну D можуть пояснити й зниження рівня кальцію і фосфору в пацієнтів із тривалістю ТХСМ більше 10 років.
Літературні дані щодо рівня ПТГ у пацієнтів із ТХСМ різняться. В ранньому періоді ТХСМ рівень ПТГ зменшується у відповідь на гіперрезорбцію кісткової тканини. Дані щодо тривалості низького рівня ПТГ суперечливі: за даними різних досліджень, від декількох місяців до декількох років [9, 11]. У нашому дослідженні рівень ПТГ прогресивно збільшувався зі збільшенням тривалості ТХСМ. Показники вище норми були зареєстровані тільки в 3 осіб із тривалістю ТХСМ більше 20 років. У ранньому періоді травми показники ПТГ не вивчалися, але в 43 % пацієнтів із тривалістю до 1 року рівень ПТГ був нижчим за норму (у всіх тривалість ТХСМ менше 6 місяців). Отримані дані підтверджують дані літератури щодо зниження ПТГ після ТХСМ. Надмірна резорбція кісткової тканини в ранньому періоді ТХСМ також викликає вивільнення фосфору з кісткової тканини. Збільшення концентрації фосфору в сироватці негативно впливає на активність 1-α-гідроксилази, що додатково зменшує синтез 1,25(OH)2D [3]. В експерименті показано, що додаткове введення ПТГ при ТХСМ сприяє збільшенню формування кісткової тканини [12], а отже, тривало знижений ПГТ може бути одним із механізмів розвитку остеопорозу.
У пізньому періоді травми рівень ПТГ збільшується і може перевищувати нормативні значення, що в літературі пояснюють тривалим дефіцитом вітаміну D [13]. У пацієнтів із низьким рівнем вітаміну D рівень ПТГ був вищим порівняно з пацієнтами з нормальним статусом вітаміну D [14, 15]. Концентрація ПТГ збільшувалася зі збільшенням тривалості посттравматичного періоду [9] і негативно корелювала з показниками вітаміну D [14]. В нашому дослідженні також отримано залежність рівня ПТГ від рівня вітаміну D та тривалості посттравматичного періоду. Ще одним поясненням підвищення ПТГ може були низький вміст кальцію в дієті [16].
У літературі відмінностей показників кальцію між пацієнтами із ТХСМ та особами груп порівняння не виявлено [15, 17]. У нашому дослідженні відмінностей показників кальцію між групами не отримано, проте зареєстроване зниження кальцію і фосфору (в межах нормативних значень) у пацієнтів із тривалістю посттравматичного періоду більше 10 років.
Результати досліджень щодо зв’язку між рівнем вітаміну D та МЩКТ суперечливі. Одні дослідники не знаходять такого зв’язку [4]. Інші вказують на демінералізацію під впливом дефіциту вітаміну D і втрату кісткової маси [3]. Крім того, в дослідженні італійських вчених показаний тісний корелятивний зв’язок між рівнем вітаміну D та рівнем тестостерону в пацієнтів із ТХСМ, що може бути ще одним поясненням впливу дефіциту вітаміну D на розвиток остеопорозу [17]. Отримані нами результати щодо позитивного кореляційного зв’язку між Z-показником та рівнем ПТГ не можна пояснити тільки впливом вітаміну D. Імовірніше, нижчі рівні ПТГ обумовлені підвищеною резорбцією кісткової тканини, і, відповідно, підвищення ПТГ свідчить про зниження резорбції, а отже, нижча резорбція — краща кісткова тканина. Зв’язок між вітаміном D та ПТГ, найімовірніше, не безпосередній, а обумовлений впливом тривалості посттравматичного періоду, оскільки зі збільшенням ТХСМ рівень ПТГ збільшується, а вітаміну D зменшується.
Висновки
Дефіцит вітаміну D, як і остеопороз, — часте ускладнення травми хребта та спинного мозку, частота якого зростає зі збільшенням тривалості посттравматичного періоду. У пацієнтів із ТХСМ концентрація ПТГ збільшувалася зі збільшенням тривалості посттравматичного періоду і негативно корелювала зі швидкістю резорбції кісткової тканини та рівнем вітаміну D. Проте стан кісткової тканини (за даними УЗ-денситометрії п’яткової кістки) позитивно корелював із рівнем ПТГ. Отже, знижені, а не підвищені рівні ПТГ свідчать про підвищену резорбцію кісткової тканини і можуть розглядатися як чинник ризику розвитку остеопорозу в пацієнтів із ТХСМ.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Hammond E.R. Bone mass in individuals with chronic spinal cord injury: associations with activity-based therapy, neurologic and functional status, a retrospective study / E.R. Hammond, H.M. Metcalf, J.W. McDonald, C.L. Sadowsky // Arch. Phys. Med. Rehabil. — 2014. — Vol. 95(12). — P. 2342-9. doi: 10.1016/j.apmr.2014.07.395.
2. Abderhalden L. Dual-energy X-ray absorptiometry and fracture prediction in patients with spinal cord injuries and disorders / L. Abderhalden, F.M. Weaver, M. Bethel et al. // Osteoporos Int. — 2017. — Vol. — 28(3). — P. 925-934. doi: 10.1007/s00198-016-3841-y.
3. Lamarche J. Vitamin D and spinal cord injury: should we care? / J. Lamarche, G. Mailhot // Spinal Cord. — 2016. — Vol. 54(12). — P. 1060-1075. doi: 10.1038/sc.2016.131.
4. Doubelt I. Influences of nutrition and adiposity on bone mineral density in individuals with chronic spinal cord injury: A cross-sectional, observational study / I. Doubelt, J.T. de Zepetnek, M.J. MacDonald, S.A. Atkinson // Bone Reports. — 2015. — Vol. 2. — P. 26–31. doi: 10.1016/j.bonr.2015.02.002
5. Поворознюк В.В. Дефіцит вітаміну D у населення України та фактори ризику його розвитку / В.В. Поворознюк, Н.І. Балацька // Біль. Суглоби. Хребет. — 2012. — № 4 (08). — 2012. — С. 5-11.
6. Pritchett K. 25(OH)D Status of Elite Athletes with Spinal Cord Injury Relative to Lifestyle Factors / K. Pritchett, R. Pritchett, D. Ogan, P. Bishop, E. Broad, M. LaCroix // Nutrients. — 2016. — № 8(6). — P. 374. http://doi.org/10.3390/nu8060374.
7. Gaspar A.P. Bone mass and hormone analysis in patients with spinal cord injury: evidence for a gonadal axis disruption / A.P. Gaspar, C.M. Brandao, M. Lazaretti-Castro // J. Clin. Endocrinol. Metab. — 2014. — Vol. 99. — P. 4649-4655. doi: 10.1210/jc.2014-2165.
8. Nemunaitis G.A. A descriptive study on vitamin D levels in individuals with spinal cord injury in an acute inpatient rehabilitation setting / G.A. Nemunaitis, M. Mejia, J.A. Nagy, T. Johnson, J. Chae, M.J. Roach // PM R. — 2010. — Vol. 2. — P. 202-208. doi: 10.1016/j.pmrj.2010.01.010.
9. Karapolat I. Longitudinal study of bone loss in chronic spinal cord injury patients / I. Karapolat, H.U. Karapolat, Y. Kirazli, K. Capaci, Y. Akkoc, K. Kumanlioglu // J. Phys. Ther. Sci. — 2015. — Vol. 27. — P. 1429-1433. doi: 10.1589/jpts.27.1429.
10. Ritter C.S. Direct suppression of Pth gene expression by the vitamin D prohormones doxercalciferol and calcidiol requires the vitamin D receptor / C.S. Ritter, A.J. Brown // J. Mol. Endocrinol. — 2011. — Vol. 46. — P. 63-66. doi: 10.1677/JME-10-0128
11. Ceglia L. Vitamin D and its role in skeletal muscle / L. Ceglia, S.S. Harris // Calcif. Tissue Int. — 2013. — Vol. 92. — P. 151–162. doi: 10.1007/s00223-012-9645-y
12. Harlow L. Daily parathyroid hormone administration enhances bone turnover and preserves bone structure after severe immobilization induced bone loss / L. Harlow, K. Sahbani, J.S. Nyman, C.P. Cardozo, W.A. Bauman, H.A. Tawfeek // Physiological Reports. — 2017. — Vol. 5(18). — e13446. http://doi.org/10.14814/phy2.13446.
13. Flueck J.L. Vitamin D deficiency in individuals with a spinal cord injury: a literature review / J.L. Flueck, C. Perret // Spinal. Cord. — 2017. — Vol. 55(5). — P. 428-434. doi: 10.1038/sc.2016.155.
14. Hummel K. Serum 25(OH)D, PTH and correlates of suboptimal 25(OH)D levels in persons with chronic spinal cord injury / K. Hummel, B.C. Craven, L. Giangregorio // Spinal Cord. — 2012. — Vol. 50 — P. 812-816. doi: 10.1038/sc.2012.67.
15. Barbonetti A. Independent association of vitamin D with physical function in people with chronic spinal cord injury / A. Barbonetti, A. Sperandio, A. Micillo, S. D’Andrea, F. Pacca, G. Felzani et al. // Arch. Phys. Med. Rehabil. — 2016. — Vol. 97. — P. 726-732. doi: 10.1016/j.apmr.2016.01.002.
16. Bauman W.A., Korsten M.A., Radulovic M., Schilero G.J., Wecht J.M., Spungen A.M. 31st G. Heiner Sell Lectureship: Secondary Medical Consequences of Spinal Cord Injury / W.A. Bauman, M.A. Korsten, M. Radulovic, G.J. Schilero, J.M. Wecht, A.M. Spungen // Topics in Spinal Cord Injury Rehabilitation. — 2012. — Vol. 18(4). — P. 354-378. doi.org/10.1310/sci1804-354.
17. Barbonetti A., Vassallo M.R., Felzani G., Francavilla S., Francavilla F. Association between 25(OH)-vitamin D and testosterone levels: evidence from men with chronic spinal cord injury / A. Barbonetti, M.R. Vassallo, G. Felzani, S. Francavilla, F. Francavilla // J. Spinal. Cord Med. — 2015. — Vol. 39. — P. 246-252. doi: 10.1179/2045772315Y.0000000050.

/24-1.jpg)
/25-1.jpg)
/25-2.jpg)
/26-1.jpg)
/26-2.jpg)
/27-1.jpg)