Вступ
У нозологічній структурі гострих респіраторних інфекцій дитячого віку провідне місце посідають гострі прості бронхіти (ГПБ). Частота зустрічальності гострого бронхіту становить від 74 до 96 ‰. Останнім часом відзначається патоморфоз гострих респіраторних захворювань у дітей, який характеризується схильністю до розвитку затяжного й ускладненого перебігу [3, 5]. Під час лікування ГПБ з урахуванням того, що одним із ключових проявів ГПБ є кашель, разом із використанням етіотропних лікарських засобів широко застосовуються відхаркувальні препарати, які сприяють відновленню дренажної функції бронхіального дерева і запобігають розвитку затяжного перебігу захворювання [2]. У численних клінічних дослідженнях продемонстровано високий профіль ефективності та безпеки застосування екстракту листя плюща звичайного (Hederae helicis e folium), що належить до сімейства Araliaceae, при лікуванні респіраторних захворюваннях як у дітей, так і в дорослих [1, 13, 17, 19, 24, 30]. Ми припускаємо, що дія екстракту листя плюща звичайного не обмежується індукцією відхаркувального ефекту, а проявляється також впливом на продукцію ефекторних молекул неспецифічного захисту респіраторного тракту, що зумовлено високим вмістом сапонінів [1].
Мета роботи — вивчення клініко-імунологічної ефективності препарату екстракту листя плюща звичайного при лікуванні гострого простого бронхіту в дітей.
Матеріали та методи
Під нашим спостереженням перебували 40 дітей віком від двох до шести років, хворих на ГПБ, які лікувалися стаціонарно в міській клінічній лікарні № 1 м. Дніпра. Група з 14 дітей отримувала препарат Пектолван Плющ по 2,5 мл 3 рази на добу. Решта хворих отримувала стандартну терапію (пероральна регідратація, вітамінотерапія, симптоматична терапія), що відповідала протоколу ведення дітей, хворих на гострий простий бронхіт, затвердженому МОЗ України. При проведенні роботи використовувались клінічні й лабораторні методи дослідження.
Загальноклінічне дослідження включало вивчення скарг хворих, анамнезу життя та захворювання і клінічне обстеження органів і систем організму. При клінічній оцінці стану тяжкості хворого використовувалась запропонована L. Dome, R. Schuster в 1996 році шкала BSS (Bronchitis severity score) [16, 21, 23]. Згідно з даними метааналізу, шкала BSS є адекватним інструментом для клінічної оцінки перебігу ГПБ [29]. Шкала BSS інтегрує вираженість проявів п’яти клінічних ознак ГПБ: кашлю, відходження мокротиння, аускультативне визначення хрипів, наявність болю в грудній клітці під час кашлю та диспное. Вираженість цих ознак оцінюється за п’ятибальною шкалою Likert: 0 — відсутня, 1 — помірна, 2 — середньої тяжкості, 3 — тяжка і 4 — дуже тяжка. Діапазон сумарної кількості балів коливається від 0 до 20 [4].
Лабораторне дослідження включало: загальний аналіз крові, сечі, назоцитологічні, імуноферментні методи. Етіологічний діагноз встановлювався на підставі вірусологічних методів дослідження.
Вміст антимікробних факторів у ротоглотковій рідині досліджувався за допомогою імуноферментного аналізу ELISA в сертифікованій імунологічній лабораторії лікувально-діагностичного центру «Аптеки медичної академії» за адресою: м. Дніпро, пл. Соборна, 4; лізензія АЕ № 459359 від 18.09.2014 р., ldc @ dialab.dp.ua. Для визначення концентрації лактоферину використовувався набір Нuman Lactoferrin NK 329 Edition 06-16 виробництва компанії Hycult Biotech (США), кількість нейтрофільних α-дефензинів (1–3) (Human Neutrophil Peptides 1–3 — HNP 1–3) визначалась за допомогою реактивів Нuman HNP NK317 Edition 08-16 виробництва компанії Hycult Biotech (США).
Статистична обробка даних проводилася за допомогою методів варіаційної статистики з використанням програм Statgraf. Вірогідність відмінностей статистичних сукупностей у разі нормального розподілу оцінювалась за допомогою t-критерію Стьюдента і в разі ненормального розподілу — за допомогою критерію Манна — Уїтні (U).
Результати
Гострий бронхіт, що спостерігався у хворих, був викликаний вірусними агентами. Етіологічна структура гострого бронхіту подана в табл. 1.
У всіх дітей, хворих на ГПБ, захворювання почалося гостро і проявлялося у вигляді катарального та загальнозапального синдромів. У симптоматичній структурі проявів ГПБ переважали кашель (2,4–2,7 бала) і вологі різнокаліберні розсіяні хрипи (2,3–2,9 бала). Застосування в терапії відхаркувального препарату Пектолван Плющ у хворих із ГПБ сприяло більш швидкому зменшенню клінічних проявів захворювання (t-критерій — 7,90; p = 0,000001) (табл. 2).
Установлено, що на час періоду одужання у хворих із ГПБ, які отримували препарат Пектолван Плющ, спостерігалася вірогідно менша вираженість таких проявів хвороби, як: кашель (t-критерій — 2,68; p = 0,01), аускультативне визначення хрипів (t-критерій — 6,96; p = 0,000001), диспное (t-критерій — 5,81; p = 0,000001), ніж у хворих, які не отримували препарат Пектолван Плющ. У жодного хворого з ГПБ, який отримував препарат Пектолван Плющ, не було виявлено навіть тенденції до формування затяжного перебігу захворювання.
Необхідно відзначити, що застосування препарату Пектолван Плющ при лікуванні ГПБ супроводжувалося й вірогідним зниженням кількості лейкоцитів у слизі носової порожнини (табл. 3). Так, в осіб, які не отримували препарат Пектолван Плющ, згідно з даними назоцитограм, кількість лейкоцитів у полі зору зберігалася приблизно на одному рівні упродовж захворювання, тоді як у хворих, які отримували препарат Пектолван Плющ, їх кількість знижувалася з 16,7 ± 3,8 до 8,0 ± 1,7 (t-критерій — 2,09; p = 0,047).
Вплив терапії із застосуванням препарату Пектолван Плющ на кількість антимікробних факторів у ротоглотковій рідині поданий у табл. 4.
Включення препарату Пектолван Плющ у терапію дітей, хворих на ГПБ, вірогідно (t-критерій — 2,07; p = 0,046) сприяло збільшенню вмісту лактоферину в ротоглотковій рідині на час періоду реконвалесценції ГПБ, що не спостерігалося у хворих дітей, які не отримували даний препарат. Цікавим є те, що екстракт листя плюща звичайного, впливаючи на рівень продукції лактоферину, не впливав на концентрацію нейтрофільних α-дефензинів (1–3) у ротоглотковій рідині.
Обговорення
Призначення препарату Пектолван Плющ дітям під час лікування ГПБ сприяє швидшому одужанню і скороченню тривалості катарального синдрому. Так, на тлі терапії даним препаратом більш швидко регресують прояви кашлю, утрудненого дихання, скорочується період аускультативної реєстрації вологих хрипів над поверхнею легень. Більш швидке зникнення катарального синдрому супроводжується підвищенням концентрації лактоферину в ротоглотковій рідині в періоді реконвалесценції. На нашу думку, посилення продукції лактоферину клітинами слизової оболонки на тлі терапії препаратом Пектолван Плющ є ще одним патогенетичним механізмом противірусної та протизапальної дії екстракту листя плюща звичайного.
Згідно з результатами, отриманими Eun-Hye Hong і співавт. [14], екстракт листя плюща звичайного має противірусну дію. Автори показали, що тритерпеноїдний сапонін листя плюща — гедерасапонін F пригнічує синтез віріонів грипу A/PR/8 і підвищує ефективність терапії озельтамівіру. Ймовірно, що посилення продукції лактоферину на тлі лікування препаратом Пектолван Плющ також сприяє зниженню вірусного навантаження. Установлено, що на ранніх етапах інфекційного процесу лактоферин має досить виражену противірусну активність щодо вірусу грипу, респіраторно-синцитіального вірусу та аденовірусу [6]. Вважають, що лактоферин, зв’язуючись із вірусними структурними поліпептидами або з клітинними рецепторами (глікозаміноглікани, гепарансульфат) макроорганізму, просторово роз’єднує інфекційний агент і рецептор, перешкоджаючи закріпленню вірусів на поверхні клітинної мембрани [12]. Ядерна локалізація лактоферину, виявлена в різних типах епітеліальних клітин людини, свідчить про те, що лактоферин має противірусну дію не тільки на ранній стадії взаємодії вірусу з поверхневими рецепторами клітини, але й після проникнення вірусу в клітину. Здатність лактоферину проявляти виражену противірусну активність підкреслює його значення в системі захисту слизової оболонки респіраторного тракту від патогенних інфектів [6].
На думку Janka Schulte Michels і співавт. [25], компоненти екстракту листя плюща звичайного підвищують стабільність комплексу фактора транс–крипції NF-κB із його інгібуючим фактором IκBα, що перешкоджає ядерній транслокації фактора транскрипції NF-κB і, як наслідок, індукції транс–крипції прозапальних генів. Компоненти екстракту листя плюща звичайного перешкоджають або гальмують продукцію TNF-α і IL-6. Сапонін листя плюща — гедерасапонін F пригнічує рекрутинг прозапальних CD11b+Ly6+ і CD11b+Ly6int моноцитарних клітин у респіраторному тракті під час вірусної інфекції [14].
У модуляції активності запальної реакції бере участь і лактоферин. Лактоферин вважають гострофазовим білком, який функціонує як представник родини алармінів, що вивільняються з нейтрофілів після їх інфікування. Лактоферин бере участь в організації зв’язку між нейтрофілами і дендритними клітинами, стимулюючи перехід від вродженої до адаптивної імунної відповіді [18]. Лактоферин, взаємодіючи з В-лімфоцитами, сприяє антитіло–утворенню [27].
Лактоферин впливає на клітини макроорганізму, взаємодіючи: 1) з мультилігандними рецепторами — LRP1, LRP2 (low-density lipoprotein receptor-related proteins-1, -2), які розташовані на макрофагах, тромбоцитах; 2) інтелектином-1, що експресується на моноцитах, лімфоцитах, епітеліоцитах тонкого кишечника; 3) нуклеоліном (табл. 5).
Лактоферин може взаємодіяти з дрейфуючим між мембранною поверхнею і клітинним ядром поверхневим нуклеоліном. Проникаючи в ядро клітини, лактоферин зв’язується зі специфічними ділянками ДНК та таким чином регулює процеси транскрипції генів, продукти яких беруть участь у регуляції різноманітних фізіологічних і патофізіологічних процесів [22].
Лактоферин має імуномодулюючу активність, викликаючи як про-, так і протизапальні ефекти (табл. 6).
Протизапальний ефект лактоферину переважно обумовлений його здатністю зв’язуватися з такими патогенасоційованими молекулярними паттернами (РАМР), як ліпополісахариди (LPS) і неметильований CpG бактеріальної ДНК. Лактоферин перешкоджає їх взаємодії з TLR і, як наслідок, сприяє зниженню рівня продукції прозапальних цитокінів [15].
Крім того, лактоферин нейтралізує вільний LPS, він взаємодіє з CD14 — аксесуарною молекулою механізмів рекогніції PAMP, порушуючи активацію TLR4 [8]. Також лактоферин пригнічує активність рецепторів TLR2, TLR9. Рестрикція збудження TLR обмежує рівень активації фактора транскрипції –NF-κB [31], як наслідок, відбувається зменшення продукції прозапальних цитокінів та хемокінів –(IL-1α і β, IL-6, CXCL8/IL-8, TNF-α, IL-12, IL-15, IFN-α і IFN-β), циклооксигеназ (COX1 і COX2) і генерації монооксиду азоту; експресії протеїнів, що беруть участь в ініціюванні адаптивних імунних реакцій (CD80, CD86 і CD40) [9]. Romy Fischer і –співавт. [10] продемонстрували, що лактоферин є раннім модулятором відповіді на антигенний вплив, що конт–ролює співвідношення продукції IL-12 і IL-10.
З огляду на наявність рецепторів на поверхні моноцитів, макрофагів, лімфоцитів до лактоферину, на думку Orla M. Conneely [7], даний протеїн може безпосередньо пригнічувати продукцію прозапальних цитокінів імуноцитів.
В експерименті продемонстровано, що внутрішньоочеревинне введення лактоферину мишам із гострим ураженням легень сприяє зниженню рівня запальної реакції. Після введення лактоферину мишам із гострим LPS-індукованим ураженням легень спостерігається значне зниження активності легеневої мієлопероксидази, концентрації TNF-α і кількості імуноцитів у рідині бронхоальвеолярного лаважу, а також ступеня інфільтрації запальними клітинами тканини уражених регіонів легень і вираженості набряку тканин [20].
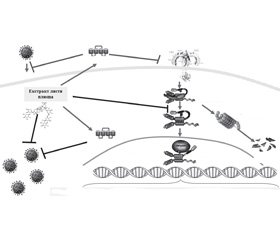
Таким чином, компоненти екстракту листя плюща звичайного прямо або за рахунок індукованого ними лактоферину, пригнічуючи реплікацію вірусів (зокрема, грипу) і гальмуючи активність фактора транскрипції NF-κB, сприяють саногенезу при гострому простому бронхіті та знижують ймовірність розвитку пролонгованого перебігу захворювання (рис. 1).
Екстракт листя плюща звичайного, сприяючи продукції лактоферину, не впливає на рівень вмісту нейтрофільних дефензинів (1–3) у ротоглотковій рідині. Цілком ймовірно, в основі даного феномену лежить протизапальна активність екстракту листя плюща, що перешкоджає рекрутуванню нейтрофілів. Обмеження кількості нейтрофілів, залучених у місце ураження, й обумовлює відсутність приросту концентрації дефензинів. Однак можливо, що компоненти екстракту листя плюща звичайного не впливають на сигнальні шляхи, що асоційовані з продукцією дефензинів.
Висновки
Гострий простий бронхіт, що посідає провідне місце в структурі гострих захворювань органів дихання в дітей, викликається респіраторно-тропними вірусами і клінічно характеризується переважанням катарального синдрому, що обумовлює застосування відхаркувальних лікарських засобів. Одним з ефективних і безпечних відхаркувальних препаратів, рекомендованих для застосування при захворюваннях органів дихання в періоді дитинства, є Пектолван Плющ, що містить екстракт листя плюща звичайного. Застосування препарату Пектолван Плющ у дітей, хворих на ГПБ, супроводжується зменшенням тривалості клінічної симптоматики захворювання, особливо катарального синдрому. На тлі лікування препаратом екстракту листя плюща звичайного відбувається підвищення вмісту лактоферину, що, цілком ймовірно, сприяє елімінації інфекційних агентів і пригніченню надлишкової активності запального процесу. Згідно з отриманими даними вважаємо, що препарат Пектолван Плющ є не тільки симптоматичним відхаркувальним, але й патогенетичним лікарським засобом при лікуванні гострого простого бронхіту в дітей.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Абатуров А.Е. Отхаркивающая терапия при острых респираторных инфекциях у детей / А.Е. Абатуров, В.Л. Бабич, В.И. Ивашина, Н.М. Токарева // Здоровье ребенка. — 2018. — Т. 13, № 5.
2. Бекчанова Ю.Х., Абдалов Ш.У., Курвандурдиева Н.К. Острый бронхит у детей и эффективные комбинированные препараты, применяемые при данной патологии // Актуальные научные исследования в современном мире. — 2017. — № 4–6(24). — С. 87-89.
3. Джумагазиев А.А. Применение иммуномодуляторов и метаболитов для профилактики острого бронхита и острой пневмонии у детей // Новая наука: Теоретический и практический взгляд. — 2016. — № 117-3. — С. 44-45.
4. Крючко Т.О. Пріоритетність застосування фітопрепаратів у лікуванні вірусних респіраторних інфекцій у дітей / Т.О. Крючко, О.Є. Абатуров., О.Я. Ткаченко, Н.М. Токарева // Здоровье ребенка. — 2018. — № 1(13). — С. 59-65. doi: 10.22141/2224-0551.13.1.2018.127062.
5. Сухорукова Д.Н., Кузнецова Т.А. Эпидемиология острого бронхита и бронхиолита у детей // Евразийский союз ученых. — 2016. — № 32. — С. 19-21.
6. Berlutti F. Antiviral properties of lactoferrin — a natural immunity molecule / F. Berlutti, F. Pantanella, T. Natalizi et al. // Mo–lecules. — 2011, Aug 16. — 16(8). — Р. 6992-7018. doi: 10.3390/molecules16086992.
7. Conneely O.M. Antiinflammatory Activities of Lactoferrin // Biochem. Cell. Biol. — 2002. — 80(1). — Р. 95-102. Review. PMID: 11908649.
8. Drago-Serrano M.E. Lactoferrin: Balancing Ups and Downs of Inflammation Due to Microbial Infections / M.E. Drago-Serrano, R. Campos-Rodríguez, J.C. Carrero, M. de la Garza // Int. J. Mol. Sci. — 2017, Mar 1. — 18(3). — pii: E501. doi: 10.3390/ijms18030501.
9. Figueroa-Lozano S. Dietary N-Glycans from Bovine Lactoferrin and TLR Modulation / S. Figueroa-Lozano, R.L. Valk-Weeber, S.S. van Leeuwen et al. // Mol. Nutr. Food. Res. — 2018 Jan. — 62(2). doi: 10.1002/mnfr.201700389.
10. Fischer R. Regulation of physiological and pathological Th1 and Th2 responses by lactoferrin / R. Fischer, H. Debbabi, M. Dubarry, P. Boyaka, D. Tome // Biochem. Cell. Biol. — 2006 Jun. — 84(3). — Р. 303-11. doi: 10.1139/o06-058.
11. Gepdiremen A. Acute anti-inflammatory activity of four saponins isolated from ivy: alpha-hederin, hederasaponin-C, hederacolchiside-E and hederacolchiside-F in carrageenan-induced rat paw edema / A. Gepdiremen, V. Mshvildadze, H. Süleyman, R. Elias // Phytomedicine. — 2005 Jun. — 12(6–7). — Р. 440-4. doi: 10.1016/j.phymed.2004.04.005.
12. Gualdi L. Lack of effect of bovine lactoferrin in respiratory syncytial virus replication and clinical disease severity in the mouse mo–del / L. Gualdi, S. Mertz, A.M. Gomez et al. // Antiviral Res. — 2013 Aug. — 99(2). — Р. 188-95. doi: 10.1016/j.antiviral.2013.05.013.
13. Hocaoglu A.B. Effect of Hedera helix on lung histopathology in chronic asthma / A.B. Hocaoglu, O. Karaman, D.O. Erge et al. // Iran J. Allergy Asthma Immunol. — 2012 Dec. — 11(4). — Р. 316-23. doi: 011.04/ijaai.316323.
14. Hong E.H. Coadministration of Hedera helix L. Extract –Enabled Mice to Overcome Insufficient Protection against Influenza A/PR/8 Virus Infection under Suboptimal Treatment with Oseltamivir / E.H. Hong, J.H. Song, A. Shim et al. // PLoS One. — 2015, Jun 22. — 10(6). — e0131089. doi: 10.1371/journal.pone.0131089.
15. Hwang S.A., Kruzel M.L., Actor J.K. Recombinant human lactoferrin modulates human PBMC derived macrophage responses to BCG and LPS // Tuberculosis (Edinb). — 2016 Dec. — 101S. — Р. 53-62. doi: 10.1016/j.tube.2016.09.011.
16. Kardos P. Assessment of the effect of pharmacotherapy in common cold/acute bronchitis — the Bronchitis Severity Scale / P. Kardos, S. Lehrl, W. Kamin, H. Matthys // Pneumologie. — 2014 Aug. — 68(8). — Р. 542-6. doi: 10.1055/s-0034-1377332.
17. Kim H.P., Lim H., Kwon Y.S. Therapeutic Potential of Medicinal Plants and Their Constituents on Lung Inflammatory Disorders // Biomol. Ther. (Seoul). — 2017, Mar 1. — 25(2). — Р. 91-104. doi: 10.4062/biomolther.2016.187.
18. Kruzel M.L., Zimecki M., Actor J.K. Lactoferrin in a Context of Inflammation-Induced Pathology // Front. Immunol. — 2017, Nov 6. — 8. — 1438. doi: 10.3389/fimmu.2017.01438.
19. Lang C., Röttger-Lüer P., Staiger C. A Valuable Option for the Treatment of Respiratory Diseases: Review on the Clinical Evidence of the Ivy Leaves Dry Extract EA 575® // Planta Med. — 2015 Aug. — 81(12–13). — Р. 968-74. doi: 10.1055/s-0035-1545879.
20. Li X. Lactoferrin protects against lipopolysaccharide-induced acute lung injury in mice/ X. Li, D. Liu et al// Int. Immunopharmacol. 2012;12:460–464. doi: 10.1016/j.intimp.2012.01.001.
21. Matthys H., Kamin W. Positioning of the Bronchitis Severity Score (BSS) for standardised use in clinical studie // Curr. Med. Res. Opin. — 2013 Oct. — 29(10). — Р. 1383-90. doi: 10.1185/03007995.2013.832183.
22. Mayeur S. Lactoferrin, a Pleiotropic Protein in Health and Disease / S. Mayeur, S. Spahis, Y. Pouliot, E. Levy // Antioxid. Redox Signal. — 2016, May 10. — 24(14). — Р. 813-36. doi: 10.1089/ars.2015.6458.
23. Moawad E.M. Cross-sectional evaluation of the Bronchitis Severity Score in Egyptian children: A move to reduce antibiotics / E.M. Moawad, M.A. Haron, R.M. Maher et al. // S. Afr. Med. J. — 2017, Mar 29. — 107(4). — Р. 342-345. doi: 10.7196/SAMJ.2017.v107i4.11428.
24. Schaefer A. A randomized, controlled, double-blind, multi-center trial to evaluate the efficacy and safety of a liquid containing ivy leaves dry extract (EA 575®) vs. placebo in the treatment of adults with acute cough / A. Schaefer, M.S. Kehr, B.M. Giannetti et al. // Pharmazie. — 2016, Sep 1. — 71(9). — Р. 504-509. doi: 10.1691/ph.2016.6712.
25. Schulte-Michels J. Anti-inflammatory effects of ivy leaves dry extract: influence on transcriptional activity of NFκB / J. Schulte-Michels, C. Keksel, H. Häberlein, S. Franken // Inflammopharmaco–logy. — 2018, May 11. doi: 10.1007/s10787-018-0494-9.
26. Schulte-Michels J. Ivy leaves dry extract EA 575® decreases LPS-induced IL-6 release from murine macrophages / J. Schulte-Michels, F. Runkel, S. Gokorsch, H. Häberlein // Pharmazie. — 2016 Mar. — 71(3). — Р. 158-61. PMID: 27183712.
27. Siqueiros-Cendón T. Immunomodulatory effects of lactoferrin / T. Siqueiros-Cendón, S. Arévalo-Gallegos, B.F. Iglesias-Figueroa et al. // Acta Pharmacol. Sin. — 2014 May. — 35(5). — Р. 557-66. doi: 10.1038/aps.2013.200.
28. Süleyman H. Acute and chronic antiinflammatory profile of the ivy plant, Hedera helix, in rats / H. Süleyman, V. Mshvildadze, A. Gepdiremen, R. Elias // Phytomedicine. — 2003. — 10(5). — Р. 370-4. PMID: 12834000.
29. Timmer A. Pelargonium sidoides extract for acute respiratory tract infections / A. Timmer, J. Günther, G. Rücker et al. // Cochrane Database Syst. Rev. — 2013, Oct 22. — 10. — CD006323. doi: 10.1002/14651858.CD006323.pub3.
30. Zeil S., Schwanebeck U., Vogelberg C. Tolerance and effect of an add-on treatment with a cough medicine containing ivy leaves dry extract on lung function in children with bronchial asthma // Phytomedicine. — 2014, Sep 15. — 21(10). — Р. 1216-20. doi: 10.1016/j.phymed.2014.05.006.
31. Zheng Y. Lactoferrin suppresses the Epstein-Barr virus-induced inflammatory response by interfering with pattern recognition of TLR2 and TLR9 / Y. Zheng, Z. Qin, Q. Ye et al. // Lab. Invest. — 2014 Nov. — 94(11). — Р. 1188-99. doi: 10.1038/labinvest.2014.105.

/20-1.jpg)
/21-1.jpg)
/22-1.jpg)
/23-1.jpg)