Международный эндокринологический журнал Том 14, №5, 2018
Содержание грелина в плазме крови детей с синдромом биологически неактивного гормона роста
Авторы: Спринчук Н.А., Большова О.В.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Резюме
Актуальність. У світовій літературі відомості про стан системи «гормон росту/ростові фактори» (ГР/інсуліноподібний фактор росту 1 (ІФР-1)), зокрема щодо відношень ГР/ІФР-1/грелін (Ghr), у пацієнтів із низькорослістю вкрай обмежені. Мета роботи — визначення особливостей секреції греліну в пацієнтів із синдромом біологічно неактивного гормона росту порівняно із секрецією греліну в дітей із соматотропною недостатністю. Матеріали та методи. Ghr визначали в 33 хворих із низькорослістю, серед них 22 пацієнти — із соматотропною недостатністю і 11 хворих — із синдромом біологічно неактивного гормона росту. Паспортний вік всіх обстежених пацієнтів відповідав діапазону статевого дозрівання. Кістковий вік в обох групах відставав від паспортного більше ніж на 2 роки. Відставання в рості всіх дітей становило від мінус 2SD. Контрольну групу становили 6 здорових дітей. У всіх обстежених дітей визначали базальний рівень ГР, ІФР-1 й рівень ГР під час нічного викиду та стимуляційного тесту з клонідином. Одночасно отримували зразки крові для дослідження рівня Ghr. Результати. Найсуттєвіші зміни показників рівня Ghr були виявлені через 120 хвилин після засинання у всіх обстежених. Установлено значне підвищення рівня Ghr у дітей із синдромом біологічно неактивного гормона росту, соматотропною недостатністю, а також у групі контролю порівняно з базальними показниками та максимальним викидом при проведенні клонідинового тесту. Так, нічний рівень Ghr перевищував базальний в 1,4 раза в дітей із соматотропною недостатністю, у 3,4 раза — у дітей із синдромом біологічно неактивного гормона росту та у 2,8 раза — у дітей контрольної групи. Ми не встановили зв’язку між показниками ІФР-1 та Ghr у всіх обстежених дітей. Висновки. У пацієнтів із синдромом біологічно неактивного гормона росту та соматотропною недостатністю встановлено суттєвий викид греліну в перші години після засинання. Не виявлено взаємозв’язку між рівнями греліну та ІФР-1 у пацієнтів із синдромом біологічно неактивного гормона росту, соматотропною недостатністю та в здорових дітей. Введення клонідину не викликає суттєвих змін рівня греліну в низькорослих та здорових дітей.
Актуальность. В мировой литературе сведения о состоянии системы «гормон роста/ростовые факторы (ГР/инсулиноподобный фактор роста 1 (ИФР-1)), в частности относительно взаимоотношений ГР/ИФР-1/грелин (Ghr), у пациентов с низкорослостью крайне ограниченны. Цель работы — определение особенностей секреции грелина у пациентов с синдромом биологически неактивного гормона роста по сравнению с секрецией грелина у детей с соматотропной недостаточностью. Материалы и методы. Определение Ghr было проведено у 33 больных с низкорослостью, среди них 22 пациента — с соматотропной недостаточностью и 11 больных — с синдромом биологически неактивного гормона роста. Паспортный возраст всех обследованных пациентов отвечал диапазону полового созревания. Костный возраст в обеих группах отставал от паспортного более чем на 2 года. Отставание в росте всех детей составляло от минус 2SD. Контрольную группу составили 6 здоровых детей. У всех обследованных детей определяли базальный уровень ГР и ИФР-1, уровень ГР во время ночного выброса и стимуляционного теста с клонидином. Одновременно получали образцы крови для исследования уровня Ghr. Результаты. Существенные изменения показателей уровня Ghr были обнаружены через 120 минут после засыпания у всех обследованных. Установлено значительное повышение уровня Ghr у детей с синдромом биологически неактивного гормона роста, соматотропной недостаточностью, а также в группе контроля по сравнению с базальными показателями и максимальным выбросом при проведении клонидинового теста. Так, ночной уровень Ghr превышал базальный в 1,4 раза у детей с соматотропной недостаточностью, в 3,4 раза — у детей с синдромом биологически неактивного гормона роста и в 2,8 раза — у детей контрольной группы. Мы не установили связь между показателями ИФР-1 и Ghr у всех обследованных детей. Выводы. У пациентов с синдромом биологически неактивного гормона роста и соматотропной недостаточностью установлен существенный выброс грелина в первые часы после засыпания. Не найдено взаимосвязи между уровнями грелина и ИФР-1 у пациентов с синдромом биологически неактивного гормона роста, соматотропной недостаточностью и у здоровых детей. Введение клонидина не вызывает существенных изменений уровня грелина у пациентов с низкорослостью и здоровых детей.
Background. In the world literature, information on the state of the system of growth hormone/growth factors (GH/IGF-1), in particular regarding the relationship of GH/IGF-1/grelin, in patients with short stature is extremely limited. The purpose of the study was determination of the features of ghrelin secretion in patients with syndrome of biologically inactive growth hormone compared to that in children with somatotropic insufficiency. Materials and methods. The ghrelin (Ghr) concentration was determined in 33 patients with short stature, among them 22 patients with somatotropic insufficiency and 11 patients with biologically inactive growth hormone syndrome. The passport age of all the examined patients corresponded to the range of puberty. The bone age retarded from the passport age for more than 2 years in both groups. The growth retardation in all the children was minus 2SD. The control group consisted of 6 healthy children. Basal levels of the growth hormone (GH) and insulin-like growth factor 1 (IGF-1), GH level during night-time excretion and clonidine-stimulating test were determined in all examined children. At the same time blood samples were obtained for studying the Ghr level. Results. The most significant changes in the Ghr level were detected in 90 minutes after falling asleep in all subjects. A significant increase in Ghr levels in children with syndrome of biologically inactive growth hormone, somatotropic insufficiency, and in control group compared to baseline and maximum release during the clonidine test was established. Thus, the nightly level of Ghr exceeded basal level by 1.4 times in children with somatotropic insufficiency, by 3.4 times — in children with syndrome of biologically inactive growth hormone and by 2.8 times — in children of the control group. We did not establish a link between IGF-1 and ghrelin in all of the examined children. Conclusions. In patients with syndrome of biologically inactive growth hormone and somatotropic insufficiency, a significant release of ghrelin was detected in the first hours after falling asleep. No correlation between the levels of ghrelin and IGF-1 was found in patients with syndrome of biologically inactive growth hormone, somatotropic insufficiency and in healthy children. The administration of clonidine does not induce the significant changes in the ghrelin level of patients with short stature and in healthy children.
Ключевые слова
грелін; гормон росту; інсуліноподібний фактор росту 1; синдром біологічно неактивного гормона росту; діти
грелин; гормон роста; инсулиноподобный фактор роста 1; синдром биологически неактивного гормона роста; дети
ghrelin; growth hormone; insulin-like growth factor 1; biologically inactive growth hormone syndrome; children
Вступ
Синдром біологічно неактивного гормона росту (СБНГР), вперше описаний у 1978 році лікарем-педіатром A. Kowarski [1], характеризується наявністю низькорослості на тлі нормального викиду гормона росту (ГР) при проведенні стимуляційних тестів і низькими показниками інсуліноподібного фактора росту 1 (ІФР-1). У 1996 році була підтверджена генетична природа цього захворювання (гетерозиготні мутації гена гормона росту) Y. Takahashі та співавт. [2], а з 1999 року СБНГР розглядається як уроджена генетична патологія, пов’язана з дефіцитом гормона росту (KІGS Aetіology Classіfіcasіon Lіst) [3]. Останнім часом з’явилися публікації відносно фенотипових особливостей у дітей із СБНГР [4].
У світовій літературі відомості про стан системи «ГР/ІФР-1», зокрема щодо відношень ГР/ІФР-1/грелін, у пацієнтів із низькорослістю вкрай обмежені [5]. Грелін (Ghrelin, Ghr) — гастроінтестинальний пептидний гормон, ідентифікований у 1999 р., що секретується головним чином клітинами слизової оболонки фундального відділу шлунка [6]. Цей гормон діє через рецептори ГР GHS-R1а, які експресуються нейронами в дужкоподібному і вентромедіальному ядрах гіпоталамуса, гіпофізі та деяких інших клітинах [7–13]. Крім того, грелін потенціює секрецію ГР через вплив на рилізинг-гормон гормона росту (ГР-РГ) [14, 15].
Грелін — це орексигенний гормон, що впливає на апетит, масу тіла, енергетичний баланс, метаболізм глюкози, сон, серцево-судинну систему, психічний стан та ін. [16–19]. У даний час не встановлені можлива роль Ghr у патогенезі затримки росту в пацієнтів із СБНГР та його взаємозв’язок із ГР та ростовими чинниками в дітей із різними формами низькорослості.
Мета дослідження — визначення особливостей секреції греліну в пацієнтів із синдромом біологічно неактивного гормона росту порівняно з секрецією греліну в дітей із соматотропною недостатністю.
Матеріали та методи
Дослідження виконували на базі відділу дитячої ендокринної патології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України». Ghr визначали в 33 хворих із низькорослістю, серед яких 22 пацієнти — із соматотропною недостатністю (група 1) і 11 хворих — із СБНГР (група 2). Паспортний вік обстежених пацієнтів першої і другої груп відповідав діапазону пубертатного віку, тобто ІІ–ІІІ стадіям за шкалою Танера, кістковий вік (КВ) в обох групах відставав від паспортного більше ніж на 2 роки. Відставання в рості становило мінус 3,4 ± 0,2 та мінус 3,1 ± 0,3 SD відповідно в дітей першої та другої груп. Контрольну групу становили 6 здорових дітей без відставання в рості та відхилень КВ від паспортного. Клінічну характеристику обстежених дітей наведено в табл. 1.
/10-1.jpg)
У всіх обстежених дітей визначали базальний рівень ГР та ІФР-1, рівень ГР під час нічного фізіологічного викиду через 120 хв після засинання, а також проводили стимуляційний тест із клонідином [20]. Одночасно отримували зразки крові для дослідження рівня Ghr. ГР та ІФР-1 у плазмі крові досліджували імунорадіометричним методом IRMA з використанням стандартних наборів (Immunotech®kit, Чехія). Рівень греліну визначали радіоімунологічним методом із використанням наборів фірми «KIPMR90» (Бельгія). Для підтвердження наявності СБНГР хворим обов’язково проводили чотириденну пробу на чутливість до рекомбінантного ГР [21].
Статистичну обробку виконували, використовуючи статистичні програми Microsoft Excel та методи варіаційної статистики. Результати надано як середні значення та їх стандартна похибка (M ± m). Статистичну вірогідність оцінювали за параметричним t-критерієм Стьюдента. Різниця в результатах вважалась вірогідною при р < 0,05; при 0,05 < р < 0,1 відзначали тенденцію до вірогідності. Для вивчення кореляційного зв’язку використовували метод прямої та оберненої кореляції з розрахунком коефіцієнта кореляції (r).
Результати
Установлено, що в пацієнтів із соматотропною недостатністю відзначаються вірогідне зниження базального рівня ГР і вірогідне зниження його максимального викиду на тлі клонідинового тесту. Крім того, у пацієнтів із СБНГР базальний рівень ГР та максимальний його викид на тлі клонідинового тесту перебували в межах нормальних значень (табл. 2). Рівні ІФР-1 у плазмі крові в дітей як із СБНГР, так і із соматотропною недостатністю були вірогідно зниженими порівняно з показниками в групі конт–ролю. Найнижчі показники ІФР-1 встановлені в пацієнтів із соматотропною недостатністю (р < 0,001 порівняно з показниками в пацієнтів другої групи, р < 0,01 — показниками групи контролю).
На відміну від різко знижених показників максимального викиду ГР вночі (через 120 хвилин після засинання) у дітей із соматотропною недостатністю пацієнти із СБНГР мали задовільний викид ГР, що відповідав показникам у контрольній групі (12,7 ± 0,6 нг/мл та 15,5 ± 0,7 нг/мл відповідно).
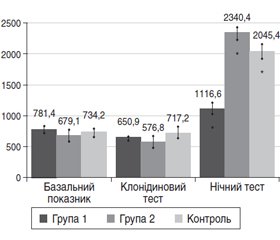
Базальний рівень Ghr у плазмі крові всіх обстежених не мав вірогідних відмінностей та відповідав показникам у контрольній групі. Аналогічні результати були отримані при проведенні клонідинового тесту (рис. 1). Тест із клонідином у пацієнтів із СБНГР призводив до значного викиду ГР, однак не супроводжувався підвищенням рівня Ghr. У дітей із соматотропною недостатністю на тлі клонідинового тесту викид ГР був вірогідно низьким (порівняно з показниками пацієнтів із СБНГР та групою контролю) і не супроводжувався зміною рівня Ghr у плазмі крові. У всіх обстежених під час проведення клонідинового тесту рівні Ghr були дещо нижчими, ніж його базальні рівні, але невірогідно.
/11-2.jpg )
Найсуттєвіші зміни показників рівня Ghr ми виявили через 120 хв після засинання у всіх обстежених. У цій точці встановлено значне підвищення рівня Ghr у дітей із СБНГР, соматотропною недостатністю, а також у групі контролю порівняно з базальними показниками та максимальним викидом при проведенні клонідинового тесту (рис. 1). Так, нічний рівень Ghr перевищував базальний у 1,4 раза в дітей із соматотропною недостатністю, у 3,4 раза — у дітей із СБНГР та у 2,8 раза — у дітей контрольної групи. У пацієнтів із соматотропною недостатністю вночі на тлі найнижчого викиду ГР спостерігався вірогідно нижчий рівень Ghr порівняно з показниками пацієнтів із СБНГР та дітей групи контролю (рис. 2).
Ми не встановили зв’язок між показниками ІФР-1 та греліну у всіх обстежених осіб (табл. 2), графічно наведені дані відсутності зв’язку в дітей із СБНГР (рис. 3–5). Оскільки рівень ІФР-1 не має значних добових коливань, він швидко не змінюється (впродовж кількох годин) під впливом фізіологічних і фармакологічних стимуляторів, тому показники базального рівня ІФР-1 можна враховувати такими, що не мають вірогідної різниці як під час базального та нічного визначення, так і на тлі клонідинового тесту.
Обговорення
Вивчення особливостей секреції та дії Ghr вказують на його плейотропну дію [22] — вплив на вивільнення ГР [23, 24], збільшення маси тіла, численні метаболічні ефекти [18], регуляцію ритму сну [25] тощо. G. Motta та співавт. вважають, що Ghr фактично моделює не тільки секрецію ГР, але й секрецію пролактину та АКТГ і відіграє важливу роль у функціонуванні гіпоталамо-гіпофізарно-гонадної системи [9]. На думку М. Maghnie та співавт., у дітей та дорослих із дефіцитом ГР його підвищення відбувається після збільшення рівня греліну [26].
Роль системи «Ghr/GHS-R1а» в аспекті фізіології росту, харчової поведінки та енергії гомеостазу практично не вивчена [24, 27]. У даний час залишаються відкритими питання фізіологічного взаємозв’язку греліну та ГР, ІФР-1, ІФР-зв’язуючих білків.
Останнім часом були виконані дослідження вмісту Ghr у дітей із низькорослістю на тлі нормального або зниженого вмісту ГР [28, 29]. Робіт щодо досліджень рівня Ghr у плазмі крові у дітей із СБНГР не знайдено.
Особливістю нашого дослідження є те, що кількісні характеристики вмісту ГР у таких пацієнтів знаходяться в межах норми, але сам ГР не є біологічно активним внаслідок суворих генетичних порушень. Отримані нами дані є результатом дослідження вмісту Ghr, що було виконане вперше в пацієнтів із СБНГР. Вивчення вмісту Ghr як базового, так і на тлі функціональних стимулюючих проб є цікавим у плані того, що в пацієнтів із СБНГР низькорослість асоціюється з нормальним вмістом ГР та низьким вмістом ІФР-1.
Установлення негативного оберненого зв’язку між віссю ГР/ІФР-1 та Ghr при низькорослості в дітей із використанням різних стимуляційних тестів залишається дискусійним. Так, B. Tarantini та спів–авт. при проведенні тесту «ГР-РГ + аргінін» у пацієнтів із нормальним та зниженим вмістом ГР показали суттєве зниження рівня Ghr в обох групах, що може свідчити про відсутність негативного оберненого зв’язку ГР та Ghr [30]. H. Matsuoka та співавт. у дітей допубертатного віку з низькорослістю встановили зниження рівнів Ghr на 30 хв проб з інсуліном, глюкагоном, аргініном та L-Dopa [31]. F. Prodam та співавт. не виявили кореляції між ГР, загальним Ghr або відповіді ацикл-греліну на введення аргініну [32]. Автори вважають, що наявність механізму негативного оберненого зв’язку між віссю ГР/ІФР-1 і Ghr у дітей залишається предметом для подальшого вивчення в майбутньому.
В обстежених нами пацієнтів із дефіцитом ГР (соматотропна недостатність) відзначалося як вірогідне зниження базального рівня ГР, так і вірогідно низький викид ГР при проведенні тесту з клонідином. У пацієнтів із СБНГР базальний рівень ГР і максимальний викид ГР відповідали нормальним значенням. Максимальні рівні Ghr у всіх обстежених дітей як із дефіцитом ГР, так і з нормальним рівнем ГР (СБНГР, контрольна група) під час проведення клонідинового тесту не мали вірогідних відмінностей від базальних рівнів гормона та не відрізнялися в дітей різних груп. C. Stylianou та співавт. спостерігали зниження рівня Ghr на тлі підвищення ГР у дітей із нормальним вмістом ГР, тоді як у дітей із дефіцитом ГР відбувалося підвищення і рівня греліну, і ГР. На думку авторів, це є свідченням наявності оберненого зв’язку між Ghr та ГР у дітей із нормальним вмістом ГР. Таких змін не виявлено в дітей із дефіцитом ГР. У дітей із низьким рівнем ГР реєстрували значне зниження греліну на 90-й хв та його підвищення на 120-й хв тесту з клонідином, тоді як у дітей із нормальним вмістом ГР був значно нижчий викид Ghr на 30-й хв, а на 90-й хв рівень Ghr відповідав фоновому рівню. Рівень Ghr був значно вищим у дітей із дефіцитом ГР у всіх точках тесту [33]. Однак наші дані свідчать про те, що зміна рівня ГР не супроводжується зміною рівня Ghr на тлі клонідинового тесту, тобто рівень греліну залишався однаковим при низькому й адекватному викидах ГР. Отримані нами дані відрізняються від результатів C. Stylianou та співавт. й ставлять під сумнів наявність негативного оберненого зв’язку між Ghr та ГР у дітей із різним рівнем секреції ГР. Слід зауважити, що вміст Ghr в основному досліджували в дітей допубертатного віку, щоб уникнути можливого впливу пубертації на його рівень [34]. Обстежені нами пацієнти були віком 10–12 років на початку статевого розвитку. Так чи інакше це питання потребує подальшого вивчення.
У деяких дослідженнях ІФР-1 розглядається як одна з важливих детермінант секреції Ghr протягом дитячого та підліткового віку [35–37]. Однак ми не встановили зв’язку між показниками ІФР-1 та Ghr у всіх обстежених дітей, що збігається з даними, отриманими C. Stylianou та співавт. [34].
Значний викид Ghr ми спостерігали у всіх обстежених через 120 хв після засинання, найбільший — у дітей із СБНГР. Вірогідне підвищення рівня Ghr та ГР відбувалося у всіх обстежених під час фізіологічного викиду ГР вночі через 90 хв після засинання, що може бути пов’язано зі зниженням концентрації кортизолу [38]. Пацієнти із СБНГР мали задовільний нічний викид ГР через 120 хв після засинання. Рівень Ghr після засинання в дітей із СБНГР та в контрольній групі підвищувався одночасно з підвищенням ГР, у той же час у дітей із соматотропною недостатністю підвищення рівня Ghr не супроводжувалось викидом ГР — рівень ГР у плазмі крові залишався низьким. Найнижчий нічний викид ГР у дітей із соматотропною недостатністю супроводжувався вірогідним підвищеним рівнем греліну порівняно з базовим рівнем греліну, але він залишався найнижчим нічним рівнем Ghr порівняно з показниками в пацієнтів із СБНГР та контрольної групи. A. Dzaja та співавт. встановили підвищення рівня Ghr у здорових молодих волонтерів протягом перших чотирьох годин сну з позитивною кореляцією та піком концентрації ГР [39]. Рівень Ghr підвищувався в перші години сну та знижувався вранці. Деякі автори вважають, що це може бути пов’язано найчастіше з процесом сну, ніж із циркадними впливами. Нічне підвищення рівня Ghr не спостерігається при ожирінні та порушенні сну [40].
Таким чином, ми вперше визначили підвищення нічного рівня Ghr у пацієнтів із СБНГР, низькорослістю та в дітей контрольної групи з нормальним ростом, що асоціюється з підвищенням рівня ГР. Вірогідне підвищення Ghr у перші години після засинання відбувається також у дітей із дефіцитом ГР та відсутністю нічного піку ГР. У дітей із нормальним рівнем ГР або дефіцитом ГР рівень Ghr не змінюється на тлі стимуляційної фармакологічної проби з клофеліном. Залежності вмісту Ghr від рівня ІФР-1 не встановлено.
Висновки
1. У пацієнтів із СБНГР та соматотропною недостатністю встановлено суттєвий збережений викид греліну в перші години після засинання.
2. Взаємозв’язку між рівнями греліну та ІФР-1 у пацієнтів із СБНГР, соматотропною недостатністю та в здорових осіб не виявлено.
3. Введення клонідину не викликає суттєвих змін рівня греліну в дітей із низькорослістю внаслідок дефіциту ГР, СБНГР та в здорових дітей без порушення росту.
4. Визначення рівня греліну не може бути запропоновано як діагностичний критерій при СБНГР та соматотропній недостатності в дитячому віці.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Growth failure with normal serum RIA-GH and low somatomedin activity: somatomedin restoration and growth acceleration after exogenous GH [Text] / A. Kowarski, J. Schneider, E. Ben-Galim [et al.] // J. Clin. Endocrinol. Metab. — 1978. — Vol. 47, № 2. — P. 461-464.
2. Short stature caused by a mutant growth hormone [Text] / Y. Takahashi, H. Kaji, Y. Okimura [et al.] // N. Engl. J. Med. — 1996. — Vol. 334. — P. 432-436.
3. Ranke M.B. The KIGS aetiology classification system [Text] / M.B. Ranke, D.A. Price, E.O. Reiter (eds): Growth hormone therapy in pediatrics — 20 Years of KIGS. Basel, Karger, 2007. — P. 29-37.
4. Спринчук Н.А. Роль визначення мутацiї D112G в дiагностицi хворих на синдром бiологiчно неактивного гормону росту серед дiтей, що проживають на територiї України [Текст] / Н.А. Спринчук, В.Є. Досенко // Доповiдi Нацiональної академiї наук України. — 2016. — № 3. — С. 107-112.
5. Вміст греліну у хворих на соматотропну недостатність [Текст] / О.В. Большова, О.Я. Самсон, Н.О. Кульчицька [та ін.] // Клінічна ендокринологія та ендокринна хірургія. — 2011. — № 1(34). — С. 45-50.
6. Ghrelin is a growth-hormone-releasing acylated peptide from stomach [Text] / M. Kojima, H. Hosoda, Y. Date [et al.] // Nature. — 1999. — Vol. 402, № 6762. — P. 656-660.
7. A receptor in pituitary and hypothalamus that functions in growth hormone release [Text] / A.D. Howard, S.D. Feighner, D.F. Cully [et al.] // Science. — 1996. — Vol. 273, № 5277. — P. 974-977.
8. Intracellular signaling mechanisms mediating ghrelin-stimulated growth hormone release in somatotropes [Text] / M.M. Malagón, R.M. Luque, E. Ruiz-Guerrero [et al.] // Endocrinology. — 2003. — Vol. 144, № 12. — P. 5372-5380.
9. Ghrelin actions on somatotropic and gonadotropic function in humans [Text] / G. Motta, S. Allasia, E. Ghigo [et al.] // Prog. Mol. Biol.Transl. Sci. — 2016. — Vol. 138. — P. 3-25. doi: 10.1016/bs.pmbts.2015.11.001.
10. Pereira J.A.D.S. The impact of ghrelin in metabolic di–seases: an immune perspective [Text] / J.A.D.S. Pereira, F.C. da Silva, P.M.M. de Moraes-Vieira // J. Diabetes. Res. — 2017. — 2017. — 4527980. doi: 10.1155/2017/4527980.
11. Ghrelin: discovery of th enatural endogenous ligand for the growth hormone secretagogue receptor [Text] / M. Kojima, H. Hosoda, H. Matsuo, K. Kangawa // Trends Endocrinol. Metab. — 2001. — Vol. 12. — P. 118-122.
12. Preliminary evidence that ghrelin, the natural GH secretagogue (GHS)-receptor ligand, strongly stimulates GH secretion in humans [Text] / E. Arvat, L. DiVito, F. Broglio [et al.] // J. Endocrinol. Invest. — 2000. — Vol. 23. — P. 493-495.
13. Identification of the acyltransferase that octanoylates ghrelin, an appetite-stimulating peptide hormone [Text] / J. Yang, M.S. Brown, G. Liang [et al.] // Cell. — 2008. — Vol. 132. — P. 387-396. doi: 10.1016/j.cell.2008.01.017.
14. A low dose of ghrelin stimulates growth hormone (GH) release synergistically with GH-releasing hormone in humans [Text] / Y. Hataya, T. Akamizu, K. Takaya [et al.] // J. Clin. Endocrinol. Metab. — 2001. — Vol. 86. — P. 4552.
15. Perchard R. Ghrelin and growth [Text] / R. Perchard, P.E. Clayton // Endocr. Dev. — 2017. — Vol. 32. — P. 74-86. doi: 10.1159/000475732.
16. Ghrelin induces adiposity in rodents [Text] / M. Tschop, D.L. Smiley, M.L. Heiman [et al.] // Nature. — 2000. — Vol. 407, № 6806. — P. 908-913.
17. Ghrelin: endocrine, metabolic and cardiovascular actions [Text] / F. Broglio, F. Prodam, E. Me [et al.] // J. Endocrinol. Invest. — 2005. — Vol. 28, № 5 (Suppl.). — P. 23-25.
18. Ghrelin [Text] / T. D. Mьller, R. Nogueiras, M. L. Andermann [et al.] // Molecular Metabolism. — 2015. — Vol. 4. — P. 437–460. doi: 10.1016/j.molmet.2015.03.005. eCollection 2015.
19. Bolshova Ye.V. Serum ghrelin (Ghr) level in adolescents with hypothalamic dysfunction (HD) associated with obesity [Text] / Ye. V. Bolshova, T. N. Malinovskaya // International conference on childhood obesity. — Lisbon, 5–8th July, 2017. — P. 89.
20. Low dose oral clonidine: asimple and reliable growth hormone screening test for children [Text] / R. Lanes, B. Recker, P. Fort, F. Lifshitz // Am. J. Dis. Child. — 1985. — Vol. 139. — P. 87-89.
21. Спринчук Н.А. Роль тесту на чутливість до соматотропіну в діагностиці синдрому біологічно неактивного гормону росту [Текст] / Н.А. Спринчук // Ендокринологія. — 2010. — Т. 15, № 2. — C. 287-290.
22. Poher A.L. Ghrelin regulation of glucose metabolism [Text] / A.L. Poher, M.H. Tschop, T.D. Moller // Peptides. — 2018. — Vol. 100. — P. 236-242.
23. Hassouna R. Hypothalamic regulation of body growth and appetite by ghrelin-derived peptides during balanced nutrition or undernutrition [Text] / R. Hassouna, A. Labarthe, V. Tolle // Mol. Cell. Endocrinol. — 2016. — Vol. 438. — P. 42-51.
24. Labarthe A. Ghrelin: a gastric hormone at the crossroad between growth and appetite regulation [Text] / A. Labarthe, V. Tolle // Biol. Aujourdhui. — 2016. — Vol. 210, № 4. — P. 237-257.
25. Morin V. The effects of ghrelin on sleep, appetite, and memory, and its possible role in depression: A review of the literature [Text] / V. Morin, F. Hozer, J.F. Costemale-Lacoste // Encephale. — 2018. — Vol. 44, № 3. — P. 256-263.
26. GH response to ghrelin in subjects with congenital GH deficiency: evidence that ghrelin action requires hypo-thalamic-pituitary connections [Text] / M. Maghnie, M. C. Pennati, E. Civardi [et al.] // Eur. J. Endocrinol. — 2007. — Vol. 156. — P. 449-454.
27. Ghrelin and obestatin modulate growth hormone-releasing hormone release and synaptic inputs onto growth hormone-relea–sing hormone neurons [Text] / D.D. Feng, S.K. Yang, C. Loudes [et al.] // Eur. J. Neurosci. — 2011. — Vol. 34, № 5. — P. 732-744.
28. Ghrelin and growth hormone serum levels during the clonidine test in children with short stature and variable growth hormone status [Text] / C. Stylianou, A. Galli-Tsinopoulou, M.G. Grammatikopoulou [et al.] // Hormones (Athens). — 2011. — Vol. 10, № 1. — P. 39-45.
29. Acute ghrelin response to intravenous dexamethasone administration in idiopathic short stature or isolated idiopathic growth hormone-deficient children [Text] / G. Radetti, F. Prodam, S. Lauriola [et al.] // J. Endocrinol. Invest. — 2008. — Vol. 31, № 3. — P. 224-228.
30. Serum ghrelin levels in growth hormone-sufficient and growth hormone-deficient patients during growth hormone-relea–sing hormone plus arginine test [Text] / B. Tarantini, C. Ciuoli, S. Checchi et al. // J. Endocrinol. Invest. — 2009. — Vol. 32, № 4. — P. 335-337.
31. Short-term secretory regulation of ghrelin during provocative tests in prepubertal children with various growth hormone secretory capacities [Text] / H. Matsuoka, H. Hosoda, H. Sugawara [et al.] // Horm. Res. — 2005. — Vol. 64. — P. 274-279.
32. Effect of arginine infusion on ghrelin secretion in growth hormone sufficient and GH deficient children [Text] / F. Prodam, G. Genoni, S. Bellone [et al.] // Int. J. Endocrinol. Metab. — 2012. — Vol. 10, № 2. — P. 470-474.
33. Ghrelin and growth hormone serum levels during the clonidine test in children with short stature and variable growth hormone status [Text] / С. Stylianou, A. Galli-Tsinopoulou, M.G. Grammatikopoulou [et al.] // Hormones (Athens). — 2011. — Vol. 10, N 1. — P. 39-45.
34. Ghrelin levels from fetal life through early adulthood: relationship with endocrine and metabolic and anthro-pometric measures [Text] / L. Soriano-Guillen, V. Barrios, J.A. Chowen [et al.] // J. Pediatr. — 2004. — Vol. 144. — P. 30-35.
35. Ghrelin concentrations in healthy children and adolescents [Text] / A.J. Whatmore, C.M. Hall, J. Jones [et al.] // Clin. Endocrinol. — 2003. — Vol. 59. — P. 649-654.
36. Plasma levels of total and active ghrelin in acromegaly and growth hormone deficiency [Text] / Z. Jarkovská, M. Rosická, J. Marek [et al.] // Physiol. Res. — 2006. — Vol. 55. — P. 175-181.
37. Ghrelin plasma levels in patients with idiopathic short stature [Text] / G. Iñiguez, R. Román, R. Youlton [et al.] // Horm. Res. Paediatr. — 2011. — Vol. 75, № 2. — P. 94-100. doi: 10.1159/000317429.
38. Four-hour infusion of hydrocortisone does not suppress the nocturnal increase of circulating acyl- or desacyl-ghrelin concentrations in healthy young adults [Text] / R. Nass, J. Liu, J. Patrie [et al.] // J. Clin. Endocrinol. Metab. — 2014. — Vol. 99, № 9. — P. 1696–1700. doi: 10.1210/jc.2014-1210.
39. Sleep enhances nocturnal plasma ghrelin levels in healthy subjects [Text] / A. Dzaja, M.A. Dalal, H. Himmerich [et al.] // Am. J. Physiol. Endocrinol. Metab. — 2004. — Vol. 286, № 6. — P. 963–967.
40. Alterations in the dynamics of circulating ghrelin, adiponectin, and leptin in human obesity [Text] / B.O. Yildiz, M.A. Suchard, M.L. Wong [et al.] // Proc. Natl. Acad. Sci. USA. — 2004. — Vol. 101, № 28. — P. 10434-10439.

/10-1.jpg)
/11-2.jpg )
/12-1.jpg )
/11-1.jpg )