Резюме
Актуальність. Моторні та немоторні прояви хвороби Паркінсона (ХП) збільшують ризик падінь, що у поєднанні з остеопорозом значно підвищує ризик переломів, зокрема переломів шийки стегнової кістки. Мета. Оцінка ефективності та безпечності комплексної терапії остеопорозу у пацієнтів із ХП. Матеріали та методи. Було обстежено 38 чоловіків і жінок віком 55–75 років із системним остеопорозом та ХП. Серед них 18 пацієнтів отримували комплексну терапію остеопорозу, 20 пацієнтів становили групу порівняння. Мінеральну щільність кісткової тканини (МЩКТ) визначали за методом двофотонної рентгенівської абсорбціометрії. Результати. Під час досліджень встановлено, що у пацієнтів групи порівняння втрата кісткової маси на рівні всього скелета була 1,8 ± 0,8 %, на рівні шийки — 4,5 ± 0,6 %, проксимального відділу стегнової кістки — 3,6 ± 1,1 % та на рівні нижніх кінцівок — 3,1 ± 1,2 %. Внаслідок проведеного лікування із застосуванням комплексної терапії, що включала препарати кальцію, вітаміну D та ризедронової кислоти, у пацієнтів групи І зареєстрована стабілізація МЩКТ на рівні всього скелета та нижніх кінцівок, збільшення МЩКТ на рівні поперекового відділу хребта — на 4,0 ± 2,2, верхніх кінцівок — на 4,8 ± 2,1 %, шийки та проксимального відділу стегнової кістки — на 1,8 ± 0,8 % і 1,3 ± 0,7 % відповідно. Висновки. Застосування комплексної терапії остеопорозу у пацієнтів із ХП сприяє вірогідному збільшенню МЩКТ на рівні стегнової кістки, поперекового відділу хребта та верхніх кінцівок, а також стабілізації кісткової маси на рівні нижніх кінцівок і всього скелета, що зменшує ризик переломів.
Актуальность. Моторные и немоторные проявления болезни Паркинсона (БП) увеличивают риск падений, что в сочетании с остеопорозом значительно повышает риск переломов, в частности переломов шейки бедренной кости. Цель. Оценка эффективности и безопасности комплексной терапии остеопороза у пациентов с БП. Материалы и методы. Обследованы 38 мужчин и женщин в возрасте 55–75 лет с системным остеопорозом и БП. Среди них 18 пациентов получали комплексную терапию остеопороза, 20 пациентов составили группу сравнения. Минеральную плотность костной ткани (МПКТ) определяли методом двухфотонной рентгеновской абсорбциометрии. Результаты. Во время исследований установлено, что у пациентов группы сравнения потеря костной массы на уровне всего скелета составила 1,8 ± 0,8 %, на уровне шейки — 4,5 ± 0,6 %, проксимального отдела бедренной кости — 3,6 ± 1,1 % и на уровне нижних конечностей — 3,1 ± 1,2 %. В результате проведенного лечения с применением комплексной терапии, включающей препараты кальция, витамина D и ризедроновой кислоты, у пациентов группы I зарегистрирована стабилизация МПКТ на уровне всего скелета и нижних конечностей, а также увеличение МПКТ на уровне поясничного отдела позвоночника — на 4,0 ± 2,2 %, верхних конечностей — на 4,8 ± 2,1 %, шейки и проксимального отдела бедренной кости — на 1,8 ± 0,8 % и 1,3 ± 0,7 % соответственно. Выводы. Применение комплексной терапии остеопороза у пациентов с БП приводит к достоверному увеличению МПКТ на уровне бедренной кости, поясничного отдела позвоночника и верхних конечностей, способствует стабилизации костной массы на уровне нижних конечностей и всего скелета, а также уменьшению риска переломов.
Background. Motor and non-motor symptoms in Parkinson’s disease increase the risk of falls, which in combination with osteoporosis significantly increases the risk of fractures, in particular the femoral neck fractures. The purpose of the study was to evaluate the efficacy and safety of combination osteoporosis therapy in patients with Parkinson’s disease. Materials and methods. Thirty eight men and women aged 55–75 years with osteoporosis and Parkinson’s disease were examined. Eighteen of them received combination therapy for osteoporosis, and 20 patients were included in the comparison group. Bone mineral density (BMD) was determined by dual-energy X-ray absorptiometry. Results. The performed studies found that in patients of the comparison group, bone loss was 1.8 ± 0.8 % of the total body, 4.5 ± 0.6 % of the femoral neck, 3.6 ± 1.1 % of the proximal femur and 3.1 ± 1.2 % of the lower extremities. As a result of treatment with the use of combination therapy including calcium, vitamin D and risedronate, the BMD of the total body and lower extremities was stabilized, and the BMD of the lumbar spine increased by 4.0 ± 2.2 %, the upper extremities — by 4.8 ± 2.1 %, the femoral neck and proximal femur — by 1.8 ± 0.8 % and 1.3 ± 0.7 %, respectively, in group I. Conclusions. The use of combination osteoporosis therapy in patients with Parkinson’s disease leads to a significant increase in BMD of the femur, lumbar spine and upper extremities, and also helps stabilize bone mass of the lower extremities and the total body that contributes to reducing the risk of fracture.
Вступ
Хвороба Паркінсона (ХП) і остеопороз — це вік-асоційовані захворювання, що вражають пацієнтів переважно літнього віку. Широкий спектр моторних і немоторних симптомів ХП, зокрема постуральна нестабільність та порушення ходи, збільшують ризик падінь. Велике проспективне дослідження остеопорозу в жінок (Global Longitudinal Study of Osteoporosis in Women) показало, що зв’язок ризику остеопоротичних переломів із ХП був сильнішим, ніж для будь-якої іншої супутньої патології [1]. Наявність ХП збільшує ризик переломів у понад 2 рази [2–4]. Проте збільшений ризик переломів не обумовлюється тільки підвищенням ризику падінь. У багатьох дослідженнях, проведених у різних популяціях пацієнтів із ХП, реєструється низька мінеральна щільність кісткової тканини (МЩКТ) — основний предиктор остеопоротичних переломів [2–4]. У наших попередніх дослідженнях, проведених у співпраці з Асоціацією хвороби Паркінсона, остеопороз як у жінок, так і у чоловіків із ХП реєстрували вірогідно частіше, ніж у групі порівняння (особи без неврологічної патології та захворювань і станів з доведеним впливом на кісткову тканину), зокрема, у жінок — 48 та 6 % відповідно (довірчий інтервал (ДІ) 25,6–56,5; χс2 = 23,2; P < 0,0001), у чоловіків — 24,3 та 2 % відповідно (ДІ 7,4–37,9; χ2 = 8,7; P < 0,05) [5]. У міжнародних рекомендаціях, присвячених діагностиці та лікуванню остеопорозу, ХП виділяють як фактор ризику розвитку остеопорозу та переломів, проте ведення таких пацієнтів рекомендують здійснювати згідно з локальними національними протоколами [6]. На сьогодні не тільки ХП розглядають як фактор ризику остеопорозу та переломів, а досліджують і зворотній вплив. V. Metta та співавт. (2017) називають остеопороз «прихованим немоторним обличчям» ХП і вказують на його роль в посиленні моторних і немоторних симптомів, підкреслюючи необхідність лікування остеопорозу у пацієнтів із ХП [7].
ХП має багатофакторний вплив на кісткову тканину. Серед провідних чинників виділяють рухові порушення, втрату маси тіла, мальабсорбцію та дефіцит вітаміну D [8]. І якщо перші два чинники є безпосередніми симптомами ХП і зменшуються під впливом патогенетичної терапії, то дефіцит вітаміну D потребує окремої корекції.
В наших попередніх дослідженнях у більшості пацієнтів із ХП виявлено дефіцит вітаміну D (< 20 нг/мл), а у частини з них — тяжкий дефіцит вітаміну D (< 10 нг/мл) — 68,5 та 13,7 % відповідно. В групі порівняння ці показники становили 32,1 та 5,6 % відповідно. Крім того, показано, що у пацієнтів із тяжким дефіцитом вітаміну D МЩКТ вірогідно гірша порівняно з пацієнтами з вищим рівнем вітаміну D [9]. Наведені дані акцентують увагу на необхідності застосування препаратів вітаміну D у лікуванні остеопорозу у пацієнтів із ХП.
Недостатнє надходження кальцію з їжею, пов’язане із синдромом мальабсорбції при ХП та його дефіцитом у харчовому раціоні, обумовлює необхідність додаткового прийому препаратів кальцію, особливо у пацієнтів з остеопорозом [10].
Вищенаведене обґрунтувало розробку комплексної терапії остеопорозу у пацієнтів із ХП, яка включала:
1. Комплексні препарати кальцію та вітаміну D3 з умістом: кальцію 1000 мг/добу та вітаміну D3 800 МО/добу.
2. Препарати вітаміну D3 у насичуючій (3000 МО/добу) та підтримуючій (1000 МО/добу) дозах. Тривалість застосування насичуючої дози визначали за формулою, запропонованою співробітниками відділу клінічної фізіології та патології опорно-рухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» [11]:
n = (100 – РВD) • МТ/100,
де n — тривалість курсу терапії насичення, дні; РВD — рівень 25(ОН)D у сироватці крові, нг/мл; МТ — маса тіла, кг.
3. Антирезорбенти — ризедронова кислота в таблетованій формі, в дозі 35 мг, 1 таблетка 1 раз на тиждень.
Вибір остеотропного засобу обумовлений доведеною ефективністю при первинному остеопорозі та доброю переносимістю препарату.
Метою дослідження стала оцінка ефективності та безпечності розробленої комплексної терапії остеопорозу у пацієнтів із ХП.
Матеріали та методи
У відділі клінічної фізіології та патології опорно-рухового апарату ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України» було обстежено 38 пацієнтів із системним остеопорозом і ХП. В дослідження включали чоловіків і жінок віком 55–75 років з діагнозом ХП, встановленим згідно з критеріями Банку мозку Британського товариства хвороби Паркінсона, 2,5–3,0 стадії за Хен-Яр, з тривалістю ХП не менше 5 років на леводопотерапії та системним остеопорозом, визначеним за методом рентгенівської денситометрії. Обов’язковою умовою включення пацієнта в дослідження була наявність добровільної інформованої згоди на його участь. У дослідження не включали пацієнтів із соматичною патологією у декомпенсованому стані, будь-якими захворюваннями з відомим впливом на кісткову тканину та вираженим тремором, який заважає проведенню та оцінці результатів двофотонної рентгенівської абсорбціометрії (ДРА).
Пацієнти були розподілені на дві групи. Групу І (основну) становили 18 пацієнтів, які отримували комбіновану терапію остеопорозу, в групу ІІ (порівняння) увійшли 20 пацієнтів, які не отримували лікування.
МЩКТ визначали за допомогою ДРА на приладі «Prodigy, GEНС Lunar», Мадісон, США, 2005). Вивчали такі ділянки скелета: поперековий відділ хребта (L1-L4), проксимальний відділ стегнової кістки, шийку стегнової кістки, дистальний відділ кісток передпліччя та весь скелет. Визначали МЩКТ (г/см2), Т-показник (відмінність МЩКТ окремої ділянки скелета пацієнта від показника умовно здорових дорослих осіб віком 20 років відображена в середньоквадратичних відхиленнях); Z-показник (відмінність МЩКТ окремої ділянки пацієнта від показника умовно здорових дорослих осіб того ж віку відображена в середньоквадратичних відхиленнях). Інтерпретацію даних ДРА проводили за значеннями Т-показника на рівні поперекового відділу хребта, проксимального відділу стегнової кістки або шийки стегнової кістки (найнижчий показник). Значення Т-показника нижче –2,5 SD відповідає остеопорозу, в межах –2,5 SD та –1 SD — низькій МЩКТ (остеопенії), вище –1 SD дорівнює нормальній МЩКТ. Пацієнтів обстежували двічі: перед початком терапії та через 12 місяців.
Рівень вітаміну D визначали за електрохемілюмінесцентним методом на аналізаторі Eleсsys 2010 (Roche Diagnostics, Німеччина) за допомогою тест-систем cobas. Визначення рівня кальцію проводили на біохімічному автоматичному аналізаторі А15 (BioSystems S.A., Іспанія).
Статистичний аналіз здійснювали із застосуванням програм Statistica 10. Нормальність розподілу визначали за критерієм Шапіро — Уїлка. Різницю показників між групами та підгрупами встановлювали за допомогою критерію Стьюдента для незалежних вибірок і критерію Манна — Уїтні при непараметричному розподілі. Зміни показників МЩКТ у динаміці оцінювали із застосуванням критерію Стьюдента для пов’язаних вибірок.
Результати
Пацієнти обох груп вірогідно не відрізнялися за показниками віку, зросту або маси тіла, тривалістю ХП і добовою дозою леводопи (табл. 1).
Вихідні показники МЩКТ різних ділянок скелета також вірогідно не відрізнялись у пацієнтів обох груп (табл. 2).
Серед обстежених дефіцит і недостатність вітаміну D зареєстровано у 89 % пацієнтів. Показники вірогідно не відрізнялись у пацієнтів обох груп.
У пацієнтів групи ІІ, які не отримували лікування, за 12 місяців зареєстровано вірогідне зниження МЩКТ на рівні шийки стегнової кістки (від 0,835 ± 0,023 г/см2 до 0,797 ± 0,021 г/см2, p < 0,001), проксимального відділу стегнової кістки (від 0,959 ± 0,031 г/см2 до 0,927 ± 0,032 г/см2, p < 0,05), всього скелета (від 1,071 ± 0,027 г/см2 до 1,052 ± 0,032 г/см2, p < 0,05) та нижніх кінцівок (від 1,168 ± 0,034 г/см2 до 1,136 ± 0,043 г/см2, p < 0,05). Вірогідних відмінностей на рівні хребта та верхніх кінцівок не зареєстровано (рис. 1).
/50-1.jpg)
В результаті проведеного лікування у пацієнтів групи І зареєстровано збільшення МЩКТ на рівні поперекового відділу хребта (від 0,935 ± 0,023 г/см2 до 0,968 ± 0,049 г/см2, p < 0,05), шийки стегнової кістки (від 0,789 ± 0,022 г/см2 до 0,805 ± 0,019 г/см2, p < 0,05), проксимального відділу стегнової кістки (від 0,888 ± 0,022 г/см2 до 0,902 ± 0,019 г/см2, p < 0,05) та верхніх кінцівок (від 0,813 ± 0,022 г/см2 до 0,847 ± 0,019 г/см2, p < 0,05), а також досягнуто стабілізації МЩКТ на рівні нижніх кінцівок (1,127 ± 0,022 г/см2 та 1,131 ± ± 0,019 г/см2 відповідно, p > 0,05) та всього скелета (1,026 ± 0,022 г/см2 та 1,037 ± 0,019 г/см2 відповідно, p > 0,05) (рис. 2).
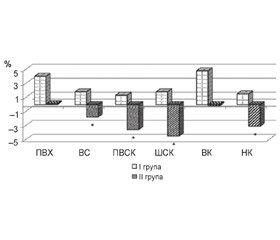
Під час досліджень встановлено, що у пацієнтів групи ІІ втрата кісткової маси становила на рівні всього скелета 1,8 ± 0,8 %, на рівні шийки — 4,5 ± 0,6 %, проксимального відділу стегнової кістки — 3,6 ± 1,1 %, на рівні нижніх кінцівок — 3,1 ± 1,2 %.
Внаслідок проведеного лікування у пацієнтів групи І зареєстрована стабілізація МЩКТ на рівні всього скелета й нижніх кінцівок та збільшення МЩКТ на рівні поперекового відділу хребта — на 4,0 ± 2,2, верхніх кінцівок — на 4,8 ± 2,1 %, шийки та проксимального відділу стегнової кістки — на 1,8 ± 0,8 % та 1,3 ± 0,7 % відповідно (рис. 3). Отже, розроблена комплексна терапія остеопорозу у пацієнтів із ХП сприяє зростанню показників МЩКТ практично на всіх ділянках скелета на відміну від отриманих результатів у групі ІІ та веде до зменшення ризику переломів.
Під час прийому комплексних препаратів кальцію та вітаміну D не було зареєстровано будь-яких побічних ефектів. При контрольному визначенні рівня кальцію та вітаміну D у сироватці крові не зареєстровано відхилень від нормативних значень. Прийом препаратів у наведених дозах не потребує контролю рівнів кальцію та вітаміну D з точки зору безпеки.
Після першого прийому препарату ризедронової кислоти 4 пацієнти (22 %) скаржилися на виникнення короткотривалого больового синдрому помірної сили в кістках і суглобах. Побічний ефект був розцінений як такий, що не потребує відміни препарату та застосування додаткових засобів лікування. Біль зник або повернувся до вихідного рівня через 24–36 годин після виникнення. Жодному пацієнту не була відмінена терапія через розвиток побічного ефекту. При подальших прийомах ризедронової кислоти вираженість побічного ефекту зменшувалась. Інших побічних ефектів зареєстровано не було.
Обговорення
Визначення ролі низької МЩКТ у розвитку переломів шийки стегнової кістки обґрунтовує необхідність застосування остеотропних засобів [12]. У більшості наукових досліджень пацієнтам із ХП рекомендують застосовувати бісфосфонати в дозах, що застосовують для лікування первинного остеопорозу [8, 12]. Досліджень, присвячених вивченню впливу окремих остеотропних засобів при ХП знай-дено всього три [13–16]. Два з них оцінювали вплив на кісткову тканину ризедронової кислоти сумісно з препаратами вітаміну D, в іншому дослідженні оцінювали вплив алендронової кислоти. Всі дослідження мали подібні результати та констатували зменшення відносного ризику переломів і збільшення МЩКТ. Застосування ризедронової кислоти у жінок із ХП протягом двох років зменшувало відносний ризик переломів шийки стегнової кістки (ВР = 0,20) та підвищувало МЩКТ на 3,4 % [14]. У чоловіків дворічний прийом ризедронової кислоти призводив до зменшення ризику переломів (ВР = 0,33) та збільшення МЩКТ на 2,2 % на відміну від групи порівняння, де цей показник зменшувався на 2,9 % [15]. Дворічне застосування алендронової кислоти також знижувало ризик переломів (ВР = 0,29) та підвищувало МЩКТ на 1,3 % [16]. Проте в зазначених дослідженнях МЩКТ вимірювали на рівні другої метакарпальної кістки за допомогою рентгенівської остеоденситометрії, а не методом ДРА, втім автори показали зменшення ризику переломів під впливом лікування, що є основною ознакою ефективної остеотропної терапії.
Результати нашого дослідження показали вірогідне збільшення МЩКТ під впливом лікування на рівні поперекового відділу хребта на 4,0 ± 2,2 %, верхніх кінцівок — на 4,8 ± 2,1 %, шийки та проксимального відділу стегнової кістки — відповідно на 1,8 ± 0,8 % і 1,3 ± 0,7 %, стабілізацію МЩКТ на рівні всього скелета та нижніх кінцівок.
Різні методи оцінки МЩКТ не дозволяють порівняти отримані результати в нашому дослідженні з літературними даними щодо ефективності лікування остеопорозу у пацієнтів із ХП, тому ми порівняли їх із групою пацієнтів з первинним остеопорозом. Так, у дослідженні В.В. Поворознюка та співавт. (2011), яке проводилося на базі Українського науково-медичного центру проблем остеопорозу, встановлено, що застосування ризедронової кислоти протягом 12 місяців у жінок з постменопаузальним остеопорозом призводить до зростання показників МЩКТ на рівні поперекового відділу хребта на 8,3 % [17]. У спостереженні Jie-Mei Gu (2015), в якому також ризедронова кислота призначалася в дозі 35 мг щотижнево протягом 12 місяців у жінок з постменопаузальним остеопорозом, встановлено збільшення МЩКТ на рівні поперекового відділу хребта на 4,87 %, на рівні шийки стегнової кістки — на 1,67 %, на рівні проксимального відділу стегна — на 2,07 % [18]. Застосування ризедронату у чоловіків із первинним остеопорозом призводило до подібних результатів [19].
Висновки
Застосування комплексної терапії остеопорозу, що включає препарати кальцію, вітаміну D та ризедронової кислоти, у хворих на ХП призводить до вірогідного збільшення МЩКТ на рівні шийки та проксимального відділу стегнової кістки, поперекового відділу хребта та верхніх кінцівок, а також сприяє стабілізації кісткової маси на рівні нижніх кінцівок і всього скелета.
Список литературы
1. Dennison E.M. Effect of comorbidities on fracture risk: findings from the glow study / E.M. Dennison, M. Premaor, J. Flahive et al. // Osteoporos Int. — 2011. — N 22. — P. 529-530.
2. Shribman S. A service development study of the assessment and management of fracture risk in Parkinson’s disease / S. Shribman, K. Torsney, A. Noyce et al. // J. Neurol. — 2014. — N 261. — P. 1153-1159. — doi 10.1007/s00415-014-7333-8.
3. Tan L. Parkinson’s disease and risk of fracture: a meta-analysis of prospective cohort studies / L. Tan, Y. Wang, L. Zhou et al. // PLoS ONE. — N 9(4). — doi:10.1371/journal.pone.0094379.
4. Voaklander D.C. Incidence of hip fracture in Parkinson disease: a population-based study in British Columbia, Canada / D.C. Voaklander, W. Martin, P. King-Jesso et al. // Injury Prevention. — 2010. — N 16. (Suppl 1). — A1-A289. — doi: 10.1136/ip.2010.029215.903.
5. Поворознюк В.В. Статеві особливості мінеральної щільності кісткової тканини в пацієнтів із хворобою Паркінсона / В.В. Поворознюк, М.А. Бистрицька, І.М. Карабань, Н.В. Карасевич // Біль. Суглоби. Хребет. — 2018. — № 8(1). — С. 161-166. http://dx.doi.org/10.22141/2224-1507.8.1.2018.130695
6. Cosman F. Clinician’s Guide to Prevention and Treatment of Osteoporosis / F. Cosman, S.J. de Beur, M.S. LeBoff et al. // Osteoporos Int. — 2014. — 25(8). — doi: 10.1007/s00198-014-2794-2.
7. Metta V. Osteoporosis: a hidden nonmotor face of parkinson’s disease / V. Metta, T. Sanchez, C. Padmakumar // Int. Rev. Neurobiol. — 2017. — N 134. — P. 877-890. — doi: 10.1016/bs.irn.2017.05.034.
8. Van den Bos F. Parkinson's disease and osteoporosis / F. Van den Bos, A. Speelman, M. Samson et al. // Age Ageing. — 2013. — 42(2). — P. 156-162. — doi: 10.1093/ageing/afs161.
9. Povoroznyuk V. Bone mineral density and vitamin D status in patients with Parkinson’s disease / V. Povoroznyuk., M. Bystrytska, N. Balatska // Gerontologija (подано до друку).
10. Mischley L. Role of Diet and Nutritional Supplements in Parkinson's Disease Progression / L. Mischley, R. Lau, R. Bennet // Oxid. Med. Cell. Longev. — 2017. — Published online 2017 Sep 10. — doi: 10.1155/2017/6405278
11. Пат. 112357 Україна МПК51А61К31/592 (2006.01). Спосіб індивідуальної цільової терапії дефіциту вітаміну D у пацієнтів із захворюваннями кістково-м’язової системи / Поворознюк В.В., Балацька Н.І., Дзерович Н.І., Муц В.Я., Синенький О.В.; власник ДУ «Інститут геронтології імені Д.Ф. Чеботарьова НАМН України», заявл. 12.12.2014; опублік. 25.08.2016, Бюл. № 16. — 4 с.
12. Monaco M. Type of hip fracture in patients with Parkinson disease is associated with femoral bone mineral density / M. Monaco, F. Vallero, R. Di Monaco et al. // Arch. Phys. Med. Rehabil. — 2008. — Vol. 89. — P. 2297-2301.
13. Van den Bos F. Comorbidities in Parkinson’s disease, cause or consequence? — Ridderprint B.V., Ridderkerk, the Netherlands, 2017. — 181 р.
14. Sato Y. Once-weekly risedronate for prevention of hip fracture in women with Parkinson's disease: a randomised controlled trial / Y. Sato, J. Iwamoto, Y. Honda // J. Neurol. Neurosurg. Psychiatry. — 2011. — 82(12). — P. 1390-1393. — doi: 10.1136/jnnp.2011.244574.
15. Sato Y. Risedronate and ergocalciferol prevent hip fracture in elderly men with Parkinson disease / Y. Sato, J. Iwamoto, Y. Honda // Neurology. — 2007. — 20; 68(12). — P. 911-915.
16. Sato Y. Alendronate and vitamin D2 for prevention of hip fracture in Parkinson's disease: a randomized controlled trial / Y. Sato, J. Iwamoto, Y. Honda et al. // Mov. Disord. — 2006. — 21(7). — P. 924-929.
17. Поворознюк В.В. Ризедроновая кислота в лечении постменопаузального остеопороза / В.В. Поворознюк, Н.И. Дзерович, Н.И. Балацкая, Вас.В. Поворознюк // Боль. Суставы. Позвоночник. — 2011. — № 4. — С. 65-70.
18. Gu J. The efficacy and safety of weekly 35-mg risedronate dosing regimen for Chinese postmenopausal women with osteoporosis or osteopenia: 1-year data / J. Gu, L. Wang, H. Lin et al. // Acta Pharmacolю Sin. — 2015. — 36(7). — P. 841-846.
19. Boonen S. Evidence for safety and efficacy of risedronate in men with osteoporosis over 4 years of treatment: Results from the 2-year, open-label, extension study of a 2-year, randomized, double-blind, placebo-controlled study / S. Boonen, R.S. Lo–renc, D. Wenderoth et al. // Bone. — 2012. — 51(3). — P. 383-388. — doi: 10.1016/j.bone.2012.06.016.

/49-1.jpg)
/50-1.jpg)
/50-2.jpg)