Журнал «Здоровье ребенка» Том 13, №7, 2018
Вернуться к номеру
Оценка вклада герпесвирусной инфекции в развитие и прогрессирование хронических гломерулярных болезней у детей
Авторы: Козыро И.А.(1), Рубаник Л.В.(2), Сукало А.В.(1, 3), Чеботарева Т.К.(4)
(1) — УО «Белорусский государственный медицинский университет», г. Минск, Республика Беларусь
(2) — РНПЦ эпидемиологии и микробиологии, г. Минск, Республика Беларусь
(3) — Национальная академия наук Беларуси, г. Минск, Республика Беларусь
(4) — УЗ «2-я детская клиническая больница», г. Минск, Республика Беларусь
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Актуальність. Етіологія хронічних хвороб клубочкового апарату нирки на сьогодні до кінця невідома. Описано участь ряду факторів, в тому числі вірусних інфекцій. Мета дослідження: визначення антитіл до вірусу Епштейна — Барр (ВЕБ) (IgG до нуклеарного і раннього антигену (АГ), IgG і IgM до вірусного капсидного АГ), цитомегаловірусу (ЦМВ) (IgG, IgM), вірусу простого герпесу (ВПГ) (IgM, IgG), специфічних фрагментів ДНК герпес- і поліомавірусів (BKV, JCV) методом полімеразної цепної реакції в сироватці крові та тканині нирки для уточнення ролі вірусної інфекції в розвитку гломерулопатій (ГП) у дітей. Матеріали та методи. Обстежено 130 дітей з первинними і вторинними гломерулопатіями, в тому числі 42 реципієнти ниркового трансплантата, на наявність антитіл і фрагментів ДНК герпес- і поліомавірусів, як контроль — 36 умовно здорових дітей, проведено ультраструктурний аналіз нефробіоптатов пацієнтів з ГП. Результати. IgM до ВПГ і IgM до ЦМВ частіше виявлялися в сироватках пацієнтів із вторинними і первинними ГП порівняно з контролем (17,1 і 12,8 % проти 0, 20 і 17 % проти 5,5 % відповідно), а також дітьми з нирковим трансплантатом (проти 0 % до ВПГ, 5 % до ЦМВ і 7 % до ВЕБ відповідно). У 5 випадках з групи вторинних ГП одночасно виявлялися АТ класу М до двох і більше герпесвірусів. У 24,4 % дітей із вторинними ГП в крові були виявлені як АТ до ВЕБ (IgG до раннього АГ і IgM до вірусного капсидного АГ), ЦМВ і ВПГ (IgM), так і нуклеокапсиди ВПГ, ЦМВ і ВЕБ. Ультраструктурний аналіз 10 нефробіоптатів показав наявність ДНК ВПГ 1-го, 2-го типу в одному і ДНК ЦМВ у 2 випадках. Наведено особливості перебігу ГП, асоційованих з герпетичною інфекцією. Висновки. Герпесвіруси впливають на розвиток і перебіг патологічного процесу при хронічних ГП. Наведений алгоритм вірусологічного обстеження дітей з ГП може використовуватися в практиці нефролога.
Актуальность. Этиология хронических болезней клубочкового аппарата почки на сегодняшний день до конца не известна. Описано участие ряда факторов, в том числе вирусных инфекций. Цель исследования: определение антител к вирусу Эпштейна — Барр (ВЭБ) (IgG к нуклеарному и раннему антигену (АГ), IgG и IgM к вирусному капсидному АГ), цитомегаловирусу (ЦМВ) (IgG, IgM), вирусу простого герпеса (ВПГ) (IgM, IgG), специфических фрагментов ДНК герпес- и полиомавирусов (BKV, JCV) методом полимеразной цепной реакции в сыворотке крови и ткани почки для уточнения роли вирусной инфекции в развитии гломерулопатий (ГП) у детей. Материалы и методы. Обследовано 130 детей с первичными и вторичными гломерулопатиями, в том числе 42 реципиента почечного трансплантата, на наличие антител и фрагментов ДНК герпес- и полиомавирусов, в качестве контроля — 36 условно здоровых детей, проведен ультраструктурный анализ нефробиоптатов пациентов с ГП. Результаты. IgM к ВПГ и IgM к ЦМВ чаще выявлялись в сыворотках пациентов с вторичными и первичными ГП по сравнению с контролем (17,1 и 12,8 % против 0, 20 и 17 % против 5,5 % соответственно), а также детьми с почечным трансплантатом (против 0 % к ВПГ, 5 % к ЦМВ и 7 % к ВЭБ соответственно). В 5 случаях из группы вторичных ГП одновременно выявлялись антитела (АТ) класса М к двум и более герпесвирусам. У 24,4 % детей с вторичными ГП в крови были обнаружены как АТ к ВЭБ (IgG к раннему АГ и IgM к вирусному капсидному АГ), ЦМВ и ВПГ (IgM), так и нуклеокапсиды ВПГ, ЦМВ и ВЭБ. Ультраструктурный анализ 10 нефробиоптатов показал наличие ДНК ВПГ 1-го, 2-го типа в одном и ДНК ЦМВ в 2 случаях. Приведены особенности течения ГП, ассоциированных с герпетической инфекцией. Выводы. Герпесвирусы оказывают влияние на развитие и течение патологического процесса при хронических ГП. Представленный алгоритм вирусологического обследования детей с ГП может использоваться в практике нефролога.
Background. Etiology of chronic glomerular diseases is not completely known to the present day. A number of factors, including viral infections, are described. Aim of the study: determination of antibodies to Epstein-Barr virus (EBV) (immunoglobulin (Ig) G to the nuclear and early antigen (AG), IgG and IgM to viral capsid AG), cytomegalovirus (CMV) (IgG, IgM), herpes simplex virus (HSV) (IgM, IgG), specific DNA fragments of herpes and polyomaviruses (BK and JC) in the blood serum and kidney tissue to clarify the role of viral infection in the development of glomerulopathies (GP) in children. Materials and methods. One hundred thirty children with primary and secondary GP were examined for the presence of antibodies and DNA fragments of herpes and polyomaviruses, including 42 recipients of the kidney transplant (Tx); 36 apparently healthy individuals were included in the control group. Ultrastructural analysis of kidney tissue for herpes viruses was performed. Results. IgM to HSV and IgM to CMV were detected in the sera of patients with secondary and primary GP more often than in controls (17.1 and 12.8 % vs. 0, 20 and 17 % vs. 5.5 %, respectively), and also children with Tx (vs. 0 % for HSV, 5 % for CMV, and 7 % for EBV, respectively). In 5 cases of secondary GP, IgM to 2 or more herpes viruses simultaneously were detected. In the blood serum of 24.4 % of children with secondary GP, both antibodies to EBV (IgG to early AG and IgM to viral capsid AG) and nucleic acids of HSV, CMV and EBV were detected. The ultrastructural analysis of 10 biopsy specimens showed the presence of type 1 and 2 HSV DNA in one case and CMV DNA in 2 cases. The features of the course of GP associated with herpetic infection are presented. Conclusions. Herpes viruses influence the development and course of the pathological process in chronic GP. The presented algorithm of virological examination of children with GP can be used in the practice of a nephrologist.
хронічні хвороби нирок; діти; герпесвіруси
хронические болезни почек; дети; герпесвирусы
chronic kidney diseases; children; herpes viruses
Введение
Этиология хронических болезней клубочкового аппарата почки на сегодняшний день до конца не известна. Описано участие ряда факторов, в том числе вирусных инфекций [1–5]. Внимание к роли вирусов гепатита В и С в развитии гломерулонефрита знаменовало начало изучения вирусассоци–ированных нефропатий [2]. По данным литературы прослежена связь между инфекцией, вызванной вирусами семейства герпесвирусов (вирус простого герпеса (ВПГ), Эпштейна — Барр (ВЭБ), цитомегаловирус (ЦМВ)) и развитием как самого заболевания, так и провокацией обострений [4–7]. Среди приведенных — нефротический синдром, системные заболевания соединительной ткани (системная красная волчанка (СКВ)), ревматоидный артрит, системные васкулиты (IgA-васкулит Шенлейна — Геноха (ШГ), гранулематоз Вегенера и др.), а также развитие криза отторжения, лимфопролиферативных заболеваний у пациентов с трансплантированной почкой [8–15]. H. Shimohata и соавт. отражают вклад парвовируса В19 в развитие нефропатии [16].
Показано, что ВИЧ непосредственно участвует в патогенезе гломерулопатии, хотя механизм этого до конца не ясен. ВИЧ-нефропатия встречается у 2–10 % ВИЧ-инфицированных, в большинстве случаев проявляется протеинурий или нефротическим синдромом, морфологически фокально-сегментарным гломерулосклерозом [2–5].
Рядом авторов показана связь гломерулярного поражения вирусами и торпидного течения гломерулопатии (ГП), развития резистентности к проводимой гормональной и цитостатической терапии, ухудшения прогноза [2–5].
Целью настоящего исследования явилось определение антител (АТ) к ВЭБ (IgG к нуклеарному и раннему антигену (АГ), IgG и IgM к вирусному капсидному АГ), ЦМВ (IgG, IgM), ВПГ (IgM, IgG), специфических фрагментов ДНК герпес- и полиомавирусов (ПВ) (BKV, JCV) методом полимеразной цепной реакции (ПЦР) в сыворотке крови и ткани почки для уточнения роли вирусной инфекции в развитии ГП у детей.
Материалы и методы
Нами проведено обследование 130 детей с ГП на наличие АТ и фрагментов ДНК герпес- и полиомавирусов, а также электронно-микроскопический (ЭМ) анализ нефробиоптатов пациентов с первичными и вторичными ГП. В качестве контроля обследовано 36 условно здоровых детей без патологии клубочкового аппарата почки, находившихся на обследовании в отделении кардиологии с диагнозом «вегетативная дистония».
Первую исследуемую группу составил 41 пациент с вторичными ГП вследствие СКВ, люпус-нефрита (ЛН) (n = 20), IgA-васкулита Шенлейна — Геноха (n = 17), с АНЦА-ассоциированным нефритом, гранулематозом Вегенера (n = 4). Одиннадцать детей с СКВ, ЛН были обследованы повторно в динамике. Во вторую исследуемую группу вошли пациенты (n = 47) с первичными ГП — IgA-нефропатией (IgAN, n = 18), нефропатией минимальных изменений (n = 15), фокально-сегментарным гломерулосклерозом (n = 14). Третья исследуемая группа — реципиенты почечного трансплантата (Тх, n = 42). Возраст пациентов варьировал от 2 до 18 лет (13,2 ± 4,1 года).
Методом ПЦР ДНК-содержащих вирусов проведено исследование 42 сывороток крови и 21 образца мочи детей с Тх на наличие полиомавирусов BKV, JCV (в качестве группы сравнения для детей с ГП (n = 88)).
Обследование и забор биологического материала (нефробиоптатов, сыворотки крови, мочи) проводились на базе нефрологического отделения УЗ «2-я детская городская клиническая больница» г. Минска и 1-й кафедры детских болезней УО БГМУ. Серологические, молекулярно-биологические и ЭМ-исследования проводились на базе лаборатории вирусных инфекций РНПЦ эпидемиологии и микробиологии. У всех пациентов диагноз ГП верифицирован с проведением световой и иммуногистохимической микроскопии.
Иммуноферментный анализ (ИФА). Для выявления специфических антител к вирусам семейства Herpesviridae использовали тест-системы «ВектоВПГ-IgG», «ВектоВПГ-IgM», «ВектоЦМВ-IgG», «ВектоЦМВ-IgМ», «ВектоВЭБ-VCA-IgM», «ВектоВЭБ-EA-IgG». Постановку реакций проводили в соответствии с инструкциями по применению, прилагаемыми производителем («Вектор-Бест», Россия). Учет результатов проводили на ИФА-анализаторе «АИФ-М/340» («Витязь», Республика Беларусь) при длине волны 450 нм.
Полимеразная цепная реакция. Выделение ДНК проводили с помощью комплекта реагентов «РИБО-преп» (ФГУН ЦНИИЭ Роспотребнадзора, Россия). Наличие ДНК герпесвирусов определяли с использованием ПЦР наборов «АмплиСенс HSVI, II-EPh», «АмплиСенс CMV-EPh» и «АмплиСенс EBV-EPh» (ФГУН ЦНИИЭ Роспотребнадзора, Россия).
Выделение ДНК полиомавирусов, в том числе BKV и JCV, проводилось в лаборатории инфекций с природным резервуаром. Проведение реакций и оценка результатов — согласно прилагаемым к наборам инструкциям.
Статистическая обработка результатов проводилась с использованием программы Statistica 10.0. Вычисляли среднеарифметические величины, их доверительные интервалы, оценку достоверности различий числовых результатов по критерию Стьюдента. Разницу считали статистически достоверной при р < 0,05.
Результаты
Серологическая диагностика (ИФА). В контрольной группе IgM к ВПГ не были выявлены ни в одном образце. В то же время у 2 из 36 (5,5 %) обследуемых обнаружены IgM к ЦМВ, у 3 из 36 (8,3 %) — IgM к ВЭБ. IgG к капсидному АГ ВЭБ не были выявлены ни у одного пациента контрольной группы. Клинически ни у одного пациента не отмечалось признаков герпесвирусной инфекции.
В 1-й исследуемой группе у 7 из 41 (17,1 %) и во 2-й исследуемой группе у 6 из 47 (12,8 %) детей выявлены IgM к ВПГ, у 8 (20 %) из 1-й и у 8 (17 %) из 2-й группы — IgM к ЦМВ. IgM к вирусу Эпштейна — Барр в 1-й и 2-й группах выявлены у 6 (15 %) и 5 (10,1 %) обследуемых соответственно.
Среди детей с Тх почкой IgM к ВПГ не были обнаружены ни у одного пациента, к ЦМВ определялись у 2 (5 %), к ВЭБ — у 3 (7 %) детей.
В 4 случаях (9,8 %) из 1-й группы (дети с СКВ, ЛН) были выявлены одновременно IgM к ЦМВ и ВЭБ. IgM к ЦМВ, ВПГ и ВЭБ одновременно определялись у одного пациента из 1-й исследуемой группы (мальчик с нефритом ШГ без активной патогенетической терапии в момент исследования).
IgG ЕА к ВЭБ были выявлены у 11 (26,8 %) пациентов из 1-й группы, во 2-й группе — у 8 детей (17 %), у 15 (35,7 %) пациентов с Тх почкой, в контроле — у 3 (8,3 %).
Серопозитивными по IgG к ВПГ в 1-й группе были 73,2 % обследуемых (30 из 41), во 2-й группе — 57,4 % (27 из 47), в 3-й группе — 50 % (21 из 42), в контрольной — 22,2 % (8 из 36). Серопозитивными по IgG к ЦМВ в 1-й группе — 53,7 % (22 из 41), во 2-й — 34,04 % (16 из 47), в 3-й — 67 % (28 из 42), в контроле — 44,4 % (16 из 36).
Выявляемость АТ классов IgМ и IgG к герпесвирусам у здоровых, детей с ГП, реципиентов почечного Тх представлена в табл. 1.
У 2 девочек с СКВ, ЛН в сыворотке крови не было выявлено АТ ни класса М, ни G. У обеих отмечалась высокая активность волчанки, IV класс нефрита, протеинурия нефротического уровня, обе получали высокодозную патогенетическую терапию индукции нефрита (пульс-терапию циклофосфамидом 500 мг/м2 1 раз в месяц и преднизолоном в дозе 2 мг/кг/сут). Исследование крови было проведено в динамике, после завершения 6 курсов циклофосфамида и перехода на азатиоприн. У обеих появилась положительная ПЦР к ВЭБ, АТ не определялись. В течение заболевания отмечалась тенденция к лейкопении, в связи с чем в процессе лечения приходилось отменять азатиоприн и увеличивать дозу преднизолона.
У пациентки М. с СКВ, ЛН, получавшей терапию преднизолоном и азатиоприном, при первичном обследовании определялись IgМ и G к ВПГ, ВЭБ IgG EA, положительная ПЦР к ВПГ. СКВ характеризовалась резистентностью к проводимой терапии. Сразу после взятия крови пациентка развернула клинику ветряной оспы, причем в анамнезе у девочки уже отмечена перенесенная ранее ветряная оспа, что потребовало отмены иммуносупрессивной (ИС) терапии. Ассоциация иммуноопосредованной ГП с герпесвирусной инфекцией на фоне проводимой ИС привела к вторичному транзиторному иммунодефициту, что повлекло повторное развитие инфекционного процесса.
У девочки У. в сыворотке крови выявлены IgG к ВПГ, IgG EA ВЭБ, положительная ПЦР к ВЭБ крови и мочи, а также вирусные частицы в нефробиоптате. При повторном исследовании крови все антитела и ПЦР были отрицательными, что можно связать с длительной ИС-терапией.
Нами установлено, что IgM к ВПГ и IgM к ЦМВ чаще выявлялись в сыворотках пациентов исследуемых групп с вторичными и первичными ГП по сравнению с контрольной (17,1 и 12,8 % против 0, 20 и 17 % против 5,5 % соответственно), а также детьми с Тх (против 0 % к ВПГ, 5 % к ЦМВ и 7 % к ВЭБ соответственно). По выявляемости АТ класса М к герпесвирусам дети с Тх почкой могут быть сопоставимы со здоровыми. В 5 случаях из группы вторичных ГП одновременно выявлялись АТ класса М к двум и более герпесвирусам. Клинически у 4 пациентов с СКВ, ЛН отмечался медленный ответ на проводимое лечение.
Молекулярно-биологическое исследование (ПЦР). Кроме проведенного серологического исследования сыворотки крови пациенты всех групп были протестированы методом ПЦР на наличие ДНК ВПГ, ЦМВ, ВЭБ (табл. 2).
При ПЦР-исследовании сыворотки крови на наличие ДНК ВПГ 1-го и 2-го типа у 1 пациента (IgAN) из 2-й группы и 5 (ГВ-1, СКВ-4) из 1-й группы получены положительные результаты. У детей с Тх ДНК ВПГ выявлена не была. В контрольной группе 1 проба также оказалась положительной в отношении данного типа ДНК.
ДНК ЦМВ была обнаружена только в образце пациентки с IgAN из 2-й группы, у одного ребенка контрольной и не обнаружена ни в одной пробе детей 1-й группы. Среди Тх пациентов ДНК ЦМВ выявлена у 7 детей.
ДНК ВЭБ была найдена в 43 образцах сывороток исследуемых групп (в 18 из 1-й, в 15 из 2-й), у 5 детей с Тх почкой и в 5 образцах контрольной группы.
При сопоставлении проведенных серологических и молекулярно-биологических исследований были получены следующие данные. В исследуемых группах ДНК ВПГ 1-го и 2-го типа была обнаружена в 4 образцах детей с СКВ и 1 с ГВ. Ig класса M к ВПГ в этих сыворотках не обнаружено, однако 4 образца были серопозитивными по IgG.
НК ВЭБ обнаружили в 33 пробах детей с ГП. Ig класса M к капсидному антигену VCA ВЭБ были обнаружены двух образцах, однако еще 4 сыворотки были положительными на наличие IgG к раннему антигену ЕА ВЭБ. Все пациенты были из 1-й исследуемой группы.
Следует отметить, что в контрольной группе у одного пациента в сыворотке крови была обнаружена ДНК ЦМВ, уровень антител M к этому возбудителю находился в серой зоне (сомнительный результат), он был серопозитивным по IgG. Пациент не имел почечной патологии и клинических признаков инфекционного процесса, наблюдался по поводу вегетососудистой дистонии.
Таким образом, у 10 из 41 (24,4 %) ребенка с вторичными ГП в сыворотке крови были обнаружены как антитела к ВЭБ (IgG к раннему АГ и IgM к вирусному капсидному АГ), ЦМВ и ВПГ (IgM), так и НК ВПГ, ЦМВ и ВЭБ, что может указывать на роль герпетической инфекции в патогенезе вторичных хронических ГП.
У 8 пациентов, у которых по данным серологического тестирования выявлялись противогерпетические АТ класса М или при молекулярно-биологическом исследовании сыворотки крови детектировался специфический фрагмент ДНК ВПГ или ЦМВ, или ВЭБ дополнительно была исследована моча. Проведенный анализ показал, что у пациентки с СКВ, ЛН наряду с обнаружением IgM в сыворотке крови выявлялся фрагмент ДНК к ЦМВ в моче, что может предполагать локальное размножение герпесвирусов в органах мочеполовой системы.
Проведенный молекулярно-биологический анализ 10 нефробиоптатов показал наличие ДНК ВПГ 1-го и 2-типа в одном и ДНК ЦМВ в 2 случаях. Полученные результаты могут свидетельствовать об участии ткани почки в качестве резервирующего органа для диссеминации и возможного размножения герпесвирусов.
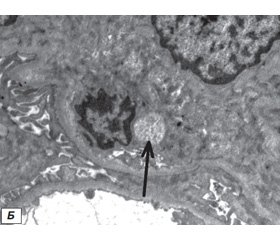
Электронно-микроскопическое исследование нефробиоптата. С целью изучения роли герпесвирусов в развитии ГП методом ультраструктурного анализа исследованы нефробиоптаты пациентов с ГП, у которых методом ПЦР в крови или ткани почек была обнаружена ДНК вирусов семейства Herpesviridae. Наличие этиологического агента с выявлением вирусных частиц, находящихся на ранних и конечных стадиях морфогенеза, было подтверждено только в одном из исследованных биоптатов. Чаще отмечались косвенные признаки инфекции. В клубочках визуализировались как специфические, так и неспецифические дистрофические изменения подоцитов. Кариоплазма в центральной части ядра была светлой, хроматин располагался вдоль внутреннего слоя ядерной мембраны. В дистрофически измененных клетках отмечалось исчезновение ядрышек, пери- и межхроматиновых гранул и накопление беспорядочно расположенных глыбок хроматина. Другой тип изменений наблюдался в цитоплазме инфицированных клеток. Специфические дистрофические процессы проявлялись в виде резких расширений канальцев и цистерн эндоплазматического ретикулума c накоплением электронно-плотных включений внутри. Обнаруживались светлые «пустые» вирусные частицы размером 80–90 нм и отдельные ДНК-содержащие нуклеокапсиды. Большинство вирусных капсидов содержали электронно-плотную сердцевину, что свидетельствовало о репродуктивном типе инфекционного процесса с формированием зрелых вирусных частиц (рис. 1).
Анализируя результаты ультраструктурного анализа, можно сделать вывод, что герпесвирусы оказывают влияние на развитие и течение патологического процесса в почечной ткани и могут являться этиологическими факторами в патогенезе и прогрессировании ГП. Данные ультраструктурного состояния подоцитов важны для дифференциальной диагностики и последующего выбора тактики патогенетической терапии ГП.
На основании проведенной работы разработан алгоритм вирусологического обследования детей с гломерулопатиями. Обследование осуществляется в отношении вирусов простого герпеса 1-го и 2-го типов, цитомегаловируса и вируса Эпштейна — Барр по схеме, состоящей из 3 этапов и представленной на рис. 2.
Первый этап — серологическое обследование в отношении наличия специфических противогерпетических АТ классов М и G в сыворотке крови пациентов. Положительный результат в отношении IgM говорит о текущей/недавно перенесенной инфекции и требует повторного серологического обследования через 4–5 недель. Положительный результат при повторном обследовании свидетельствует об активной герпесвирусной инфекции в организме и является показанием для 2-го этапа обследования.
Второй этап исследования включает молекулярно-биологическое исследование образцов сыворотки крови и мочи с целью обнаружения ДНК герпесвирусов. Положительный результат при исследовании крови свидетельствует о виремии, в моче — о вирурии и является показанием для комплексного исследования нефробиоптата.
Третий этап исследования заключается в комплексном исследовании нефробиоптата с помощью гистологического, иммуногистохимического, электронно-микроскопического и молекулярно-генетического методов с целью постановки дифференциального диагноза и обнаружения ДНК и/или частиц вируса in situ в подоцитах. По результатам третьего этапа осуществляется коррекция проводимой терапии с назначением этиотропных противогерпетических препаратов.
При установлении у пациента с гломерулопатией герпесвирусной инфекции, локализованной в подоцитах, необходимо привлечение врача-инфекциониста для определения тактики этиопатогенетической терапии, направленной на коррекцию герпесиндуцированных поражений почек.
Молекулярная индикация и дифференциация полиомавирусов BKV, JCV. Методом ПЦР ДНК-содержащих вирусов в режиме реального времени проведено исследование 42 сывороток крови и 21 образца мочи детей, реципиентов почечного трансплантата, на наличие полиомавирусов (в качестве группы сравнения для групп детей с первичными и вторичными ГП (n = 88)). Все дети с первичными и вторичными ГП оказались негативными по наличию частиц ПВ, в то время как после трансплантации почки у 1 пациента в сыворотке крови, у 1 в моче выявлена ДНК двух вирусов BK и JCV, у 1 в моче — ДНК ВК вируса, у 4 пациентов обнаружена ДНК JCV вируса.
Учитывая тот факт, что научные исследования по проблеме полиомавирусной инфекции (ПВИ) у детей в нашей стране до настоящего времени не проводились, целесообразным представляется дальнейшее исследование роли ПВИ в развитии нефрологической патологии у иммунокомпетентных пациентов.
Обсуждение
Исследованиями зарубежных и отечественных авторов показано, что вирусные АГ принимают участие в образовании иммунных комплексов, которые обнаруживают у пациентов с ГП. В почечных депозитах находят АГ вируса гепатита В и С, паротита, ВЭБ, ЦМВ, ВПГ, кори, аденовируса, парвовируса В19, ВИЧ и др. [2, 17–19]. Этиопатогенетическую роль вирусов доказывают с помощью иммуносерологических, иммуногисто- и цитохимических, молекулярно-биологических методов исследования с использованием различных биологических материалов, в том числе почечного биоптата [4, 20, 21].
Ассоциация гломерулярного поражения вирусами приводит к торпидному течению ГП, развитию резистентности к проводимой гормональной и цитостатической терапии, ухудшению прогноза [2–4]. В.В. Длин в своих работах доказал роль вирусов группы герпеса в этиопатогенезе ГН у детей, а также обосновал применение у таких детей противовирусной и иммунокорригирующей терапии [2, 3].
Особое место в развитии патологии почек принадлежит ВЭБ, относящемуся к группе Herpesviridae 5-го вида. Описываются наблюдения острой почечной недостаточности в связи с развитием тубулоинтерстициального нефрита [22]. Заболевание проявляется как у детей, перенесших мононуклеоз, так и у тех, у кого первичное поражение вирусной инфекцией протекало асимптомно. Имеются сведения и о возможном поражении клубочковой системы почек ВЭБ с развитием нефротического синдрома [19]. Исследуя биоптаты почечной ткани при фокально-сегментарном гломерулосклерозе, мембранозной нефропатии и IgA-нефропатии, Н. Imata et al. [5] обнаружили присутствие ВЭБ в мезангии, что, по их мнению, свидетельствует о его способности поражать гломерулярные структуры. Однако остается неясным, является ли указанная инфекция этиологическим фактором или сопутствует иммунному процессу в связи с иммуносупрессивной терапией.
Ряд авторов указывает на связь клинических и серологических параметров у пациентов с СКВ и профилем антител к ВЭБ [23–26].
В литературе обсуждают вопросы неспецифического повреждения почек в ходе противовирусного иммунного ответа, гиперактивной поликлональной гипергаммаглобулинемии при некоторых вирусных инфекциях, наличие аутоиммунного компонента в патогенезе, чрезмерной макрофагальной активации при гемофагоцитарном синдроме. Главной особенностью иммунного статуса при герпетической инфекции является формирование вторичного иммунодефицита. В иммунокомпетентном организме герпетическая инфекция приобретает бессимптомное латентное течение, однако у пациентов в состоянии иммуносупрессии при длительной ИС-терапии происходит реактивация герпетической инфекции [27–29].
Полиомавирусная инфекция человека относится к малоизвестным и недостаточно изученным вирусным заболеваниям. Данные литературы о встречаемости ПВИ среди детей с патологией почек весьма ограниченны. Известно, что тропизм ПВ направлен преимущественно на эпителий мочевой системы (МС), именно патология МС является наиболее частым клиническим проявлением ПВИ. Особенно тяжелые проблемы ВК вирусы вызывают у пациентов на фоне лекарственного подавления иммунитета, когда происходит реактивация вирусной инфекции с виремией и вирурией и развитием иногда фатальных осложнений. Особую актуальность представляет своевременная лабораторная диагностика ПВИ, направленная на оперативное выявление возбудителя и определение индивидуальной количественной оценки вирусной нагрузки с целью выработки адекватных подходов к лечению [12–14].
Несмотря на значительные успехи, достигнутые на сегодняшний день как в ранней диагностике, так и в лечении и прогнозе при СКВ с поражением почек, основной причиной смерти в детском возрасте остается развитие цитопенического синдрома и присоединение инфекции, возникающие вследствие либо недостаточности иммунной системы, которая вызвана самим заболеванием, либо агрессивной иммуносупрессивной терапии.
Выводы
Анализируя полученные результаты молекулярно-биологического исследования сывороток крови, мочи и ультраструктурного анализа нефробиоптата, можно сделать вывод, что герпесвирусы оказывают влияние на развитие и течение патологического процесса в почечной ткани и могут являться этиологическими факторами в развитии и прогрессировании ГП.
В случаях, когда причиной развития болезни или ее рецидива является вирусная инфекция, решение об отмене цитостатика должно приниматься немедленно из-за опасности быстрой генерализации инфекции и возможного неблагоприятного исхода. Необходима четкая верификация возбудителя с последующим назначением специфической антивирусной терапии.
Показано, что обнаруженные в биологическом материале специфические фрагменты НК герпесвирусов указывают на роль в поражении гемотканевого барьера, повреждении эндотелиоцитов, перицитов, подоцитов в зонах клубочкового аппарата. В результате ультраструктурного анализа пункционных биоптатов почки детей с гломерулопатиями, у которых методом ПЦР в крови или ткани почек была обнаружена ДНК вирусов семейства Herpesviridae, в цитоплазме подоцитов верифицировано наличие капсидов вируса герпеса. Полученные данные свидетельствуют, что герпесвирусы оказывают влияние на развитие и течение патологического процесса в почечной ткани и могут являться триггерами в патогенезе и прогрессировании гломерулопатий.
Разработанный алгоритм вирусологического обследования детей с гломерулопатиями с целью верификации герпесвирусной инфекции (ВПГ, ЦМВ, ВЭБ) будет полезен для практического врача-нефролога как на этапах диагностики, так и мониторинга пациента с ГП. Данные вирусологических исследований (серологических, молекулярно-биологических, электронно-микроскопических) важны для дифференциальной диагностики и последующего выбора тактики патогенетической терапии гломерулопатий. Наличие у пациента активной/реактивированной герпетической инфекции является показанием для уменьшения объема иммуносупрессивной терапии — отмены цитостатического препарата, коррекции дозы преднизолона.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Информация о вкладе авторов в подготовку статьи: Козыро И.А. — сбор, обработка и анализ полученных материалов; Рубаник Л.В. — выполнение лабораторной части исследования; Сукало А.В. — концепция и дизайн исследования; Чеботарева Т.К. — сбор материала.
1. Детская нефрология: практ. рук-во / Под ред. Э. Лоймана, А.Н. Цыгина, А.А. Саркисяна. — М.: Литера, 2010. — 400 с.
2. Детская нефрология: рук-во для врачей / Под ред. М.С. Игнатовой. — 3-е издание. — 2011. — 692 с.
3. Клиническая нефрология детского возраста / А.В. Папаян, Н.Д. Савенкова. — СПб., 2008. — 600 с.
4. Нечепоренко Н.В., Калинина Н.М., Савенкова Н.Д. Гломерулонефриты, ассоциированные с вирусной инфекцией у детей и подростков // Нефрология. — 2010. — Т. 14, № 2. — С. 35-45.
5. Avner E.D. Pediatric Nephrology / E.D. Avner, W.E. Harmon, P. Niaudet. — 5th ed. — Philadelphia: Lippincott Williams & Wilkins, 2004. — 1564 p.
6. Rees L. Paediatric nephrology / L. Rees, N. Webb, P. Brogan. — London: Oxford University Press, 2007. — 618 p.
7. Wenderfer S.E. Viral-associated glomerulopathies in children // Pediatr. Nephrol. — 2015. — DOI: 10.1007/s00467-015-3057-y.
8. Vachvanichsanong P., McNeil E. Pediatric lupus nephritis: more options, more chances? // Lupus. — 2013. — 22(6). — Р. 545-53. — doi: 10.1177/0961203313485490. Epub 2013 Apr 29.
9. Kawasaki Y., Ono A., Ohara S., Suzuki Y., Suyama K., Suzuki J., Hosoya M. Henoch-Schönlein purpura nephritis in childhood: pathogenesis, prognostic factors and treatment // Fukushima J. Med. Sci. — 2013. — 59(1). — Р. 15-26.
10. KDIGO Clinical Practice Guideline for Glomerulonephritis. — Vol. 2, I. 2, June 2012.
11. BK virus infection in pediatric renal transplantation / Z. Santoveña, G. Meseguer, Martínez Mejía, A. Melgar, F. Camblor, M. Hijosa, Peña Carrión, Espinosa Román L. // Transplant. Proc. — 2015 Jan-Feb. — 47(1). — Р. 62-6. — doi: 10.1016/j.transproceed.2014.11.020.
12. Comerlato J., Campos F.S., Oliveira M.T., Cibulski S.P., Corrêa L., Kulmann M.I., Arantes T.S., Hentges L.P., Spilki F.R., Roehe P.M., Franco A.C. Molecular detection and characterization of BK and JC polyomaviruses in urine samples of renal transplant patients in Southern Brazil // J. Med. Virol. — 2015 Mar. — 87(3). — Р. 522-8. — doi: 10.1002/jmv.24086.
13. Ducharme-Smith A., Katz B.Z., Bobrowski A.E., Backer C.L., Rychlik K., Pahl E. Prevalence of BK polyomavirus infection and association with renal dysfunction in pediatric heart transplant recipients // J. Heart Lung. Transplant. — 2015 Feb. — 34(2). — Р. 222-6. — doi: 10.1016/j.healun.2014.09.043. Epub 2014 Oct 24.
14. Aksenova M., Tsetlina V., Gutovskaya E., Mitrofanova A., Balashov D., Maschan A. BK virus nephropathy in a pediatric patient after hematopoietic stem cell transplantation // Pediatr. Transplant. — 2015 Feb. — 19(1). — E29-32. — doi: 10.1111/petr.12411. Epub 2014 Dec 7.
15. Henoch-Schönlein purpura nephritis in children / Davin J., Coppo R. // Nat. Rev. Nephrol. — 2014 Oct. — 10(10). — Р. 563-73. — doi: 10.1038/nrneph.2014.126. Epub 2014 Jul 29.
16. Shimohata H., Higuchi T., Ogawa Y., Fujita S., Nagai M., Imaizumi M., Maruyama H., Hirayama K., Kobayashi M. Human parvovirus B19-induced acute glomerulonephritis: a case report // Ren. Fail. — 2013. — 35(1). — Р. 159-62. — doi: 10.3109/0886022X.2012.736068. Epub 2012 Nov 1.
17. Ahmad Piroozmand, Hamed Haddad Kashani, Batool. Correlation between Epstein-Barr Virus Infection and Disease Activity of Systemic Lupus Erythematosus: a Cross-Sectional Study // Asian Pac. J. Cancer. Prev. — 2017. — 18(2). — Р. 523-527. — doi: 10.22034/APJCP.2017.18.2.523.
18. Electron-microscopic and immunohistochemical study in Henoch-Schoenlein nephritis / Wozniak A., Pluta-Hadas K., Zurawski J., Janicka-Jedynska M., Kaczmarek E., Zachwieja J., Idasiak-Piechocka I. // Ultrastruct Pathol. — 2013 Feb. — 37(1). — Р. 83-92. — doi: 10.3109/01913123.2012.670035.
19. Dossier C., Jamin A., Deschênes G. Idiopathic nephrotic syndrome: the EBV hypothesis // Pediatr. Res. — 2017 Jan. — 81(1–2). — Р. 233-239. — doi: 10.1038/pr.2016.200. Epub 2016 Sep 28.
20. Gross A.J., Hochberg D., Rand W.M., Thorley-Lawson D.A. EBV and systemic lupus erythematosus: a new perspective // Journal of immunology (Baltimore, Md: 1950). — 2005. — 174(11). — Р. 6599-607. — Epub 2005/05/21. [PubMed]
21. Ascherio A., Munger K.L. EBV and Autoimmunity // Curr. Top. Microbiol. Immunol. — 2015. — 390. — Р. 365-85. — Epub 2015/10/02. — doi: 10.1007/978-3-319-22822-81. [PubMed]
22. Okada H., Ikeda N., Kobayashi T., Inoue T., Kanno Y., Suga–hara S., Nakamoto H., Yamamoto T., Suzuki H. An atypical pattern of Epstein-Barr virus infection in a case with idiopathic tubulointerstitial nephritis // Nephron. — 2002 Oct. — 92(2). — Р. 440-4.
23. Piroozmand A., Kashani H., Zamani B. Correlation between Epstein-Barr Virus Infection and Disease Activity of Systemic Lupus Erythematosus: a Cross-Sectional Study // Asian Pac. J. Cancer. Prev. — 2017. — 18(2). — Р. 523-527. — doi: 10.22034/APJCP.2017.18.2.523.PMCID: PMC5454753.
24. Amaral B., Murphy G., Ioannou Y. et al. A comparison of the outcome of adolescent and adult-onset systemic lupus erythematosus // Rheumatology. — 2014. — 53. — Р. 1130-35. [PubMed]
25. Chen C.-J., Lin K.-H., Lin S.-C. et al. High prevalence of immunoglobulin and antibody against Epstein-Barr virus capsid antigen in adult patients with lupus with disease flare: case control studies // J. Rheumatol. — 2005. — 32. — Р. 44-7. [PubMed]
26. Mohamed A.E., Hasen A.M., Mohammed G.F. et al. Real-Time PCR of cytomegalovirus and Epstein-Barr virus in adult Egyptian patients with systemic lupus erythematosus // Int. J. Rheum. Dis. — 2015. — 18. — Р. 452-8. [PubMed]
27. Shoenfeld Y., Berkun Y., Zandman-Goddard G. et al. Infectious antibodies in systemic lupus erythematosus patients // Lupus. — 2009. — 18. — Р. 1129-35. [PubMed]
28. Marshall V. Williams, Brandon C., Ariza M. Herpesviruses dUTPases: A New Family of Pathogen-Associated Molecular Pattern (PAMP) Proteins with Implications for Human Disease.
29. Rigante D., Esposito S. Infections and Systemic Lupus Erythematosus: Binding or Sparring Partners? // Int. J. Mol. Sci. — 2015 Aug. — 16(8). — Р. 17331-17343. — Published online 2015 Jul 29. — doi: 10.3390/ijms160817331. PMCID: PMC4581196.

/11-1.jpg)
/12-1.jpg )
/13-1.jpg )