Международный эндокринологический журнал Том 14, №7, 2018
Вернуться к номеру
Перебіг гастродуоденальних кровотеч при пептичних виразках у хворих із коморбідним цукровим діабетом
Авторы: Синяченко О.В., Гмошинський М.В., Єрмолаєва М.В., Пилипенко В.В.
Донецький національний медичний університет, м. Лиман, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
Актуальність. Поширеність гастродуоденальних виразкових кровотеч сягає 170 випадків на 100 тис. дорослого населення, а щорічна від них смертність — 15 %. Коморбідний цукровий діабет (ЦД) є незалежним чинником ризику розвитку виразкових кровотеч і погіршує ефективність лікувальних заходів. Серопозитивність хворих на ЦД за носійством гелікобактерної інфекції становить 50–60 %, яка реєструється на 90 % частіше, ніж у загальній популяції. Мета: проаналізувати характер гастродуоденальних кровотеч на тлі коморбідного ЦД, виділити прогностичні критерії. Матеріали та методи. Під наглядом перебував 1261 пацієнт із гастродуоденальними кровотечами. Середній вік обстежених хворих становив 50 років, тривалість маніфестації захворювання — 6 років, тривалість кровотечі — 47 годин, індекс тяжкості хвороби — 6 в.о., тяжкість кровотечі — 2 бали, показник глюкози в крові — 10 ммоль/л, вміст глікованого гемоглобіну (HbA1c) — 8 %, інсуліну — 25 мкМО/мл, коефіцієнт інсулінорезистентності (HOMA) — 12 в.о. Результати. ЦД у співвідношенні легкого, середнього й тяжкого ступенів 1 : 2 : 1 був у 17 % від числа хворих із гастродуоденальними виразками та став чинником ризику тяжкого варіанта кровотеч. Коморбідний ЦД визначав більш виражену тяжкість виразкових гастродуоденальних кровотеч, більшу частоту їх струминного характеру, постінкового підтікання крові з виразок і розвиток геморагічного шоку перед початком лікування, був чинником ризику рецидивів кровотеч і значно погіршував виживаність хворих, впливав на кардіоваскулярні показники гемодинаміки (рівні середнього артеріального тиску, периферичного судинного опору, об’єму циркулюючої крові), а до негативних стосовно прогнозу критеріїв належать початкові рівні глікемії, HbA1c і НОМА. Висновки. Коморбідний ЦД значно погіршує перебіг гастродуоденальних кровотеч і є чинником ризику їх рецидивів.
Актуальность. Распространенность гастродуоденальных язвенных кровотечений достигает 170 случаев на 100 тыс. взрослого населения, а ежегодная от них смертность — 15 %. Коморбидный сахарный диабет (СД) является независимым фактором риска развития язвенных кровотечений и ухудшает эффективность лечебных мероприятий. Серопозитивность больных СД по носительству хеликобактерной инфекции составляет 50–60 %, которая регистрируется на 90 % чаще, чем в общей популяции. Цель исследования: проанализировать характер гастродуоденальных кровотечений на фоне коморбидного СД, выделить прогностические критерии. Материалы и методы. Под наблюдением находился 1261 пациент с гастродуоденальными кровотечениями. Средний возраст обследованных больных составил 50 лет, длительность манифестации заболевания — 6 лет, продолжительность кровотечения — 47 часов, индекс тяжести болезни — 6 о.е., тяжести кровотечения — 2 балла, показатель глюкозы в крови — 10 ммоль/л, гликированного гемоглобина (HbA1c) — 8 %, инсулина — 25 мкМЕ/мл, коэффициента инсулинорезистентности (HOMA) — 12 о.е. Результаты. СД в соотношении легкой, средней и тяжелой степени 1 : 2 : 1 имел место у 17 % от числа больных с гастродуоденальными язвами и являлся фактором риска тяжелого течения кровотечений. Коморбидный СД определял более выраженную тяжесть язвенных гастродуоденальных кровотечений, большую частоту их струйного характера, постеночного подтекания крови из язв и развитие геморрагического шока перед началом лечения, являлся фактором риска рецидивов кровотечений и значительно ухудшал выживаемость больных, влиял на кардиоваскулярные показатели гемодинамики (уровни среднего артериального давления, периферического сосудистого сопротивления, объема циркулирующей крови), а к прогнозонегативным критериям относятся исходные уровни гликемии, HbA1c и НОМА. Выводы. Коморбидный СД значительно ухудшает течение гастродуоденальных кровотечений и является фактором риска их рецидивов.
Background. The prevalence of gastroduodenal ulcerative bleeding reaches 170 cases per 100,000 of the adult population, and the annual mortality due to them is 15 %. Comorbid diabetes mellitus (DM) is an independent risk factor for ulcerative bleeding, and it impairs the effectiveness of therapeutic measures. Seropositivity of patients with DM as carriers of Helicobacter infection is 50–60 % which is registered 90 % more often than in the general population. The purpose was to analyze the nature of gastroduodenal bleeding on the background of comorbid DM, to identify the prognostic criteria. Materials and methods. The study included 1261 patients with gastroduodenal bleedings. The average age of the examined patients was 50 years, the duration of the disease manifestations — 6 years, the duration of bleeding — 47 hours, the severity index — 6 r.u, the severity of bleeding — 2 points, the blood glucose index — 10 mmol/l, glycated hemoglobin (HbA1c) — 8 %, insulin — 25 µIU/ml, the insulin resistance index (HOMA) was 12 r.u. Results. DM in the ratio of mild, moderate and severe 1 : 2 : 1 was present in 17 % of patients with gastroduodenal ulcers, and it was a risk factor for severe bleeding. Comorbid DM determined a more severe ulcerative gastroduodenal bleeding, a greater frequency of its spurting nature, wall blood leakage from ulcers and the development of hemorrhagic shock before treatment, it was a risk factor for bleeding recurrences and significantly worsened the survival of patients, influenced the cardiovascular hemodynamic parameters (the levels of average blood pressure, peripheral vascular resistance, circulating blood volume), and predictive criteria include baseline levels of glycemia, HbA1c and HOMA. Conclusions. Comorbid DM significantly worsens the course of gastroduodenal bleedings, and it is a risk factor for their recurrence.
пептичні виразки; гастродуоденальні кровотечі; цукровий діабет
пептические язвы; гастродуоденальные кровотечения; сахарный диабет
peptic ulcers; gastroduodenal bleedings; diabetes mellitus
Вступ
За високим рівнем поширеності й економічними витратами на обстеження та лікування пептичні виразки шлунка (ВШ) і дванадцятипалої кишки (ВДК) належать до числа найбільш актуальних проблем сучасної медицини [1, 2]. При цьому ЦД 2–го типу є незалежним чинником ризику розвитку ВШ і ВДК [3–5], підвищує частоту ускладнень цих захворювань [6], зокрема гастродуоденальних кровотеч [7–9].
Коморбідний ЦД на 40–50 % збільшує смертність таких хворих упродовж першого місяця [10]. Летальні наслідки від гастродуоденальних виразкових кровотеч при коморбідному ЦД спостерігаються в 2–3 рази частіше, ніж у інших пацієнтів, але їх перебіг на тлі ЦД потребує подальшого вивчення [11, 12].
Мета дослідження: проаналізувати характер перебігу гастродуоденальних виразкових кровотеч на тлі коморбідного ЦД, виділити прогностичні критерії.
Матеріали та методи
Проведено ретроспективний аналіз спостереження за 1261 хворим із виразковими гастродуоденальними кровотечами, які й у минулому перенесли 18,1 % від числа обстежених осіб (оперативні втручання на попередніх етапах із приводу шлунково–кишкових кровотеч перенесли 1,6 % хворих). Співвідношення пацієнтів з ВШ, ВДК і ВШ + ВДК становило 1 : 2 : 1. Індекс тяжкості захворювання (WI) — 5,90 ± 0,06 в.о., при цьому показник був найвищим при ВДК (8,20 ± 0,27 в.о.), меншим — при ВШ + ВДК (6,20 ± 0,06 в.о.) і ще меншим — при ВШ (4,10 ± 0,10 в.о.), а відмінності у хворих на ВШ і ВДК були вірогідні (t = 17,82; p < 0,001).
У 9,4 % від числа спостережень пептичних гастродуоденальних кровотеч у віці від 16 до 70 років (в середньому 37,40 ± 1,82 року) діагностований ЦД 2–го типу, зокрема у 68,7 % чоловіків і 31,3 % жінок, які виявилися на 10 років старші (t = 2,68; p = 0,009). Тривалість захворювання становила 8,60 ± 0,47 року. Інфікування Helicobacter pylori встановлено в 55,0 % випадків, причому в основній групі з ЦД — в 92,9 %, а в групі порівняння без ЦД — у 2,1 раза рідше (χ2 = 10,52; р = 0,001). На гелікобактерне носійство чинили вірогідний вплив показники в крові глюкози — Gl (D = 8,71; p = 0,004), інсуліну — Ins (D = 11,57; p = 0,005), критерію інсулінорезистентності — HOMA (t = 4,88, p = 0,047). При цьому у хворих із ЦД середні параметри Gl становили 10,10 ± 0,43 ммоль/л, HbA1c — 10,30 ± 0,12 %, Ins — 31,40 ± 2,64 мкМО/мл, HOMA — 14,10 ± 1,36 в.о.
Використовуючи біохімічний аналізатор Olympus–AU–640 (Японія), в сироватці крові вивчено показники Gl. Визначення концентрації Ins у крові проводили імуноферментним методом (ридер PR2100–Sanofi Diagnostic Pasteur, Франція), показник HbA1c визначали методом високої рідинної хроматографії на аналізаторі BIO–RAD–D10 (США), показник HOMA (Homeostatic Model Assessment) вираховували за формулою: НОМА = (Ins × Gl) : 22,5.
Усім пацієнтам виконано фіброезофагогастродуоденоскопію з використанням ендоскопів Olympus–GIF–Q20 (Японія), EXERA–II–Olympus (Японія), Fujinon–FG–1Z (Японія). Ідентифікацію гелікобактерної інфекції проводили швидким уреазним тестом і за дослідженням рівня антигелікобактерних антитіл класів імуноглобулінів G і A імуноферментним методом (ридер PR2100–Sanofi Diagnostic Pasteur, Франція), а також за допомогою діагностичної тест–системи «Хелико–БЕСТ–антитела» (Росія).
WI оцінювали за формулою: WI = ln{[(∑1 : n) + (∑2 : n) + (2 × ∑3 : n)] × g × h}, де ln — натуральний логарифм; ∑1, ∑2, ∑3 — відповідно сума клінічних, ендоскопічних і гістологічних ознак хвороби; n — число показників; g — ступінь BI (індекс Алговера — Буррі); h — коефіцієнт, що дорівнює 2 за наявності ускладнень у минулому (кровотеча, стеноз, перфорація та пенетрація виразки).
Виконували біопсію слизової оболонки тіла шлунка, його пілоричного відділу та головки дванадцятипалої кишки збоку від виразки, зрізи біоптатів забарвлювали гематоксиліном і еозином, толуїдиновим синім, за Шуєніновим, ставили PAS–реакцію.
Проведене дослідження схвалено комісією з біоетики Донецького національного медичного університету, хворі подали письмову інформовану згоду на участь у дослідженні.
Статистичну обробку отриманих результатів досліджень здійснено за допомогою комп’ютерного варіаційного, непараметричного, кореляційного, регресійного, одно– (ANOVA) і багатофакторного (ANOVA/MANOVA) дисперсійного аналізу (програми Microsoft Excel та Statistica, StatSoft, США). Оцінювали середні значення (M), їх стандартні похибки (SE) і відхилення (SD), коефіцієнти параметричної кореляції Пірсона (r) й непараметричної Кендалла (t), критерії дисперсії (D) та Уїлкоксона — Рао (WR), відмінностей Стьюдента (t) і Макнемара — Фішера (χ2), а також вірогідність статистичних показників (р). Підраховували ступінь прогностично позитивного результату моделі (PPV), а також виживаність хворих (St) за методом Каплана — Мейєра.
Результати
Основна група та група порівняння не відрізнялися між собою за тривалістю захворювання та кровотечі, а також показником WI. В той самий час у хворих на ЦД виявився вірогідно більшим (на 10 %) ВІ (t = 2,60; p = 0,010). Багатофакторний дисперсійний аналіз Уїлкоксона — Рао продемонстрував дію ступеня тяжкості ЦД на інтегральні прояви гастродуоденальної кровотечі (WR = 8,21; p < 0,001). За результатами однофакторного дисперсійного аналізу встановлено вплив коморбідного ЦД на показник BI (D = 3,49; p = 0,008) і частоту розвитку геморагічного шоку (D = 8,18; p = 0,004).
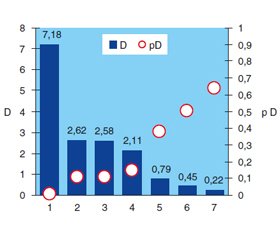
Згідно з рис. 1, встановлено зв’язок із коморбідним ЦД струминного характеру гастродуоденальної кровотечі, що спостерігався у 2,2 раза частіше (χ2 = 5,20; p = 0,027), ніж у решти хворих (рис. 2), а підтікання крові по стінках виразки — в 1,9 раза (χ2 = 9,39; p = 0,002).
Аналіз Уїлкоксона — Рао показав вплив параметрів вуглеводного обміну на інтегральний характер кровотечі (WR = 9,16; p < 0,001), а аналіз множинної регресії продемонстрував пряму залежність показника BI (R = +6,85; p < 0,001). Необхідно відзначити, що коморбідний ЦД підвищував частоту шлунково–кишкових кровотеч у минулому (D = 3,66; p = 0,047). На рівень ВІ впливають значення в крові HbA1c (D = 2,64; p = 0,048), з якими, а також із показником інсулінемії, існують прямі кореляційні зв’язки Кендалла (відповідно t = +0,091; p = 0,027, і t = +0,104; p = 0,011) та Пірсона (рис. 3).
З урахуванням даних дисперсійного та кореляційного аналізу можна зробити висновок, що має певну практичну спрямованість: показник HbA1c > 11 % (>M + SD хворих на ЦД) є чинником ризику тяжкого перебігу кровотеч (PPV = 61,4 %).
Обговорення
Середні показники вуглеводного обміну у хворих із геморагічним шоком і без такого мало відрізнялися між собою й не впливали на частоту рецидивів гастродуоденальних кровотеч, проте рівень Gl чинить дію на летальність хворих (D = 5,56; p = 0,019).
Від ступеня тяжкості ЦД залежить і частота рецидивів кровотеч (D = 23,06; p < 0,001), і число летальних наслідків (D = 7,21; p = 0,008). Рівень НОМА у хворих із рецидивами кровотеч, порівняно з іншими пацієнтами, був вищий на 38 % (t = 2,40; p = 0,017), а у хворих, які померли, щодо живих виявився вірогідно (на 24 %) більшим початковий рівень глікемії (t = 2,38; p = 0,018).
Тривимірні гістограми інтегральних показників вуглеводного обміну (Gl + HbA1c + Ins) у живих і померлих хворих подані на рис. 4, а 60–годинна виживаність представників основної групи і групи порівняння — на рис. 5.
З урахуванням виконаної статистичної обробки даних дослідження встановлено, що прогностичним критерієм рецидивів гастродуоденальних виразкових кровотеч є показник НОМА > 30 в.о. (>M + SD таких хворих; PPV = 65,1 %), а негативним стосовно прогнозу життя хворих — рівень Gl > 17 ммоль/л (PPV = 61,0 %).
Висновки
1. Гастродуоденальні кровотечі мають перебіг на тлі коморбідного ЦД у 9,4 % спостережень пептичних ВШ і ВДК, удвічі частіше у чоловіків та в осіб із носійством гелікобактерної інфекції.
2. Коморбідний ЦД є чинником ризику тяжкого перебігу гастродуоденальних кровотеч при пептичних ВШ і ВДК (зокрема, струминного ульцерозного витікання крові).
3. ЦД підвищує число рецидивів кровотеч і погіршує виживаність хворих, а до негативних стосовно прогнозу критеріїв належать рівні Gl >17 ммоль/л, HbA1c > 11 % і НОМА > 30 в.о.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.

/651-1.jpg)
/651-2.jpg)
/652-1.jpg)
/652-2.jpg)
/652-3.jpg)