Вступ
Злоякісні пухлини тазової кістки залишаються складним питанням сучасної онкологічної ортопедії [6, 12]. До початку XX сторіччя у більшості лікувальних закладах світу таким пацієнтам пропонували видалення пухлини з ампутацією нижньої кінцівки, оскільки видалення анатомічно важливих структур пояса нижньої кінцівки, реконструкція дефекту для забезпечення функціонування кінцівки здебільшого супроводжуються високими показниками ускладнень [4]. Однією з ключових проблем є необхідність проведення повторних хірургічних втручань у зв’язку з ускладненнями (інфекція перипротезного ложа, нестабільність конструкції, вивих ендопротеза кульшового суглоба), у тому числі й ампутації [11].
Біомеханічні дослідження пояса нижніх кінцівок після резекції кісток таза та покращання результатів лікування в даній групі хворих є актуальним питанням сучасної онкологічної ортопедії [2, 5, 7, 13]. Дослідження стабільності фіксації та розподілу навантажень при реконструкції таза автотрансплантатом малогомілкової кістки в поєднанні з фіксацією стрижнево-гвинтовою конструкцією після резекції типу I за Enneking доводять зростання значень напружень та ризик перелому автотрансплантата після збільшення навантаження, якщо металоконструкція відсутня. Після імплантації показники напружень знижувалися. Відповідно до стабільності фіксації та концентрації напружень комбінація методів фіксації тазового кільця подвійною балкою, гвинтами та трансплантацією малогомілкової кістки є кращою, ніж інші методи фіксації в реконструкції таза після резекції типу I [13].
Стрімкий розвиток комп’ютерних технологій у медицині відкриває нові можливості покращання результатів хірургічного лікування шляхом математичного моделювання запланованої операції [2, 3, 5, 7–10, 13]. Даний метод дозволяє дослідити поведінку як імплантованих елементів (металевих конструкцій зовнішньої фіксації, пластин, інтрамедулярних стрижнів, ендопротезів, пластмасових систем та ін.), так і власних тканин (кісток, хрящів, зв’язково-капсульного апарату), що дає можливість проаналізувати та покращити очікуваний результат за рахунок відповідного доопераційного планування [2, 5, 8, 9].
Комп’ютерне моделювання відкриває новий погляд на резекції пухлини тазової кістки. На сучасному етапі згідно з результатами комп’ютерної томографії до операції виготовлюються 3D-друковані індивідуально виготовлені навігаційні інструменти, що забезпечують можливість проведення оптимальної резекції в межах здорових тканин, причому похибка лінії резекції — від 1 до 4 мм. Більше того, дана конструкція біомеханічно оцінена на доопераційному етапі [10].
Обмежена кількість біомеханічних досліджень із визначенням поведінки системи «кістка — фіксатор — ендопротез» для обгрунтованого підходу до реконструкції тазового кільця металопластмасовим спейсером при онкопатології стала мотивом для проведення цього дослідження.
Мета дослідження: вивчити поведінку біомеханічної системи «кістка — фіксатор — ендопротез» під навантаженням при різних типах геміпельвектомії за Enneking з реконструкцією дефекту тазового кільця металопластмасовим спейсером.
Матеріали та методи
Для проведення порівняльного аналізу надійності фіксації кісток таза обрано чотири основних варіанти резекції та реконструкції тазового кільця.
1. Внутрішня геміпельвектомія за Enneking (ІІ тип): реконструкція дефекту тазової кістки металопластмасовим спейсером: 5 металевих гвинтів, що встановлені в клубову кістку (3 шт.), лобкову (1 шт.), сідничну (1 шт.) та з’єднані металевою балкою для транспедикулярної фіксації, ацетабулярний компонент тотального ендопротеза кульшового суглоба розташований по контуру балки, анатомічний контур тазової кістки в зоні реконструкції заповнений кістковим цементом.
2. Внутрішня геміпельвектомія за Enneking (I–ІІ тип): реконструкція дефекту тазової кістки металопластмасовим спейсером: 4 металевих гвинти, що встановлені в крижову кістку (2 шт.), лобкову (1 шт.), сідничну (1 шт.) та з’єднані металевою балкою для транспедикулярної фіксації, ацетабулярний компонент тотального ендопротеза кульшового суглоба розташований по контуру балки, анатомічний контур тазової кістки в зоні реконструкції заповнений кістковим цементом.
3. Внутрішня геміпельвектомія за Enneking (ІІ–III тип): реконструкція дефекту тазової кістки металопластмасовим спейсером: 5 металевих гвинтів, що встановлені в клубову (3 шт.) та контралатеральну лобкову кістку (2 шт.), з’єднані металевою балкою для транспедикулярної фіксації, ацетабулярний компонент тотального ендопротеза кульшового суглоба розташований по контуру балки, анатомічний контур тазової кістки в зоні реконструкції заповнений кістковим цементом.
4. Внутрішня геміпельвектомія за Enneking (I–ІІІ тип): реконструкція дефекту тазової кістки металопластмасовим спейсером: 4 металевих гвинти, що встановлені в крижову кістку (2 шт.), контралатеральну лобкову кістку (2 шт.) та з’єднані металевою балкою для транспедикулярної фіксації, ацетабулярний компонент тотального ендопротеза кульшового суглоба розташований по контуру балки, анатомічний контур тазової кістки в зоні реконструкції заповнений кістковим цементом.
Хірургічне втручання передбачало широке висічення пухлини тазової кістки, встановлення металевих гвинтів та моделювання балки в контралатеральні контури резекції, встановлення ацетабулярного компонента тотального ендопротеза кульшового суглоба по контуру балки, заповнення анатомічного контура тазової кістки поліметилметакрилатом.
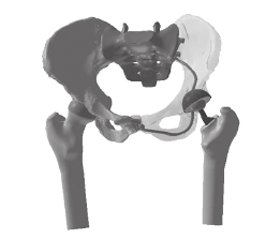
На основі аксіальних сканів спіральної комп’ютерної томографії таза з проксимальним відділом стегнової кістки та ендопротезом кульшового суглоба на стороні ураження, отриманих на комп’ютерному томографі Toshiba Activion 16, за допомогою програмного пакета Mimics в автоматичному та напівавтоматичному режимах відтворено просторову геометрію таза з проксимальними відділами стегнових кісток (рис. 1). Засобами програмного пакета SolidWorks створено імітаційну 3D-модель таза з проксимальним відділом стегнових кісток та ендопротезом на стороні ураження (рис. 2, 3).
Наступним кроком створено імітаційні моделі з чотирма основними варіантами резекції кісток таза у хворих із пухлинами тазової кістки та реконструкції дефекту металопластмасовим спейсером із металевих гвинтів, балки для транспедикулярної фіксації та поліметилметакрилату (рис. 4, 5).
Подальші розрахунки здійснювали методом скінченних елементів (СЕ), що дозволяє дослідити еволюцію процесу деформування елементів імітаційної моделі таза, а саме кісткової тканини, поліметилметакрилату та фіксуючих металоконструкцій із великими геометричними і фізично нелінійними властивостями матеріалів і змінними в часі зовнішніми впливами. Для проведення розрахунків НДС методом СЕ імітаційні моделі було імпортовано в програму ANSYS. У розрахунках застосовували фізичні властивості кісткової тканини, які отримані з літературних джерел [1], фізичні властивості матеріалів фіксаторів отримували з їх технічної документації (табл. 1).
/31-1.jpg)
Як навантаження моделі прийнято дію перерахованої маси тіла для середньостатистичної маси тіла людини 75 кг у положенні стоячи з урахуванням мас-інерційних характеристик — верхня половина тіла (голова, верхні кінцівки, тулуб до пояса) становить 59,3 % від загальної маси тіла людини [1]. Отже, до моделі прикладали зусилля 750 Н × 0,593 = 445 Н, яке було розподілено по усій площині тазового кільця (рис. 6).
У напівавтоматичному режимі згенеровано СЕ модель для всіх моделей, яка налічувала в середньому
1 700 000 вузлів та 1 200 000 елементів (рис. 7). Для збільшення точності розрахунків сітка ущільнена в ділянках контакту та для елементів фіксації й ендопротеза. СЕ сітка представлена переважно тетраедричними елементами (Tetrahedrons), розмір яких на основній моделі не перевищує 2 мм, у місцях згущення — 0,5–1 мм.
Ключовими показниками для порівняльного аналізу обрані дані, отримані шляхом розрахунків значення інтенсивності напружень (за Мізисом) та переміщення (Total Deformations). Значення напружень визначали на усіх елементах моделі, переміщення розглядались для всієї моделі загалом, а також по площині лобкового та крижово-клубового зчленувань.
Результати та обговорення
Розподіл напружень на всіх елементах моделі подано в табл. 2. Максимальні значення напружень на поліметилметакрилаті спостерігались при геміпельвектомії I–III типу (4-й варіант) із показниками 24,67 МРа та значно нижчі — при II–III (3-й варіант) — 7,32 МРа, II (1-й варіант) — 6,59 МРа та I–II (2-й варіант) — 6,46 МРа. Максимальні значення напружень на балці з гвинтами спостерігались при I–II типі (2-й варіант) — 169,27 МРа, нижчі — при ІІ (1-й варіант) — 141,27 МРа та І–ІІІ (4-й варіант) — 132,34 МРа і мінімальні — при II–III (3-й варіант) — 107,11 МРа (табл. 3, рис. 8). Максимальні значення напруження на гвинтах в усіх моделях зосереджені під головкою і не перевищують межі міцності, а мінімальні – в їх дистальних частинах, тому довжина гвинтів не буде суттєво впливати на стабільність конструкції. Максимальні значення напружень на металевій балці в основному концентруються в місцях контакту з кріпленням на гвинтах та мінімальні – в середній частині спейсера, тому доцільність встановлення балки для об’єднання контралатеральних головок гвинтів піддана сумніву, що потребує додаткового дослідження.
За результатами розрахунків розподілу напружень по всіх елементах моделі можна побачити, що найбільш стабільним є II тип (1-й варіант) та I–II типи (2-й варіант хірургічного втручання). При цьому чим більший відсоток становить спейсер з поліметилметакрилату, тим більше навантажується контралатеральна сторона моделі, де можуть виникати залишкові напруження з появою мікротріщин та деградації кісткової тканини. Також зі збільшенням об’єму поліметилметакрилату зростають напруження в ньому самому. В умовах неякісної фіксації гвинтів та армування під дією циклічних навантажень це може призводити до відокремлення металу від поліметилметакрилату (табл. 2, рис. 8).
Максимальні значення напружень на металевій балці переважно концентровані в місцях контакту з кріпленням на гвинтах та мінімальні — у середній частині спейсера, тому доцільність встановлення балки для об’єднання контралатеральних головок гвинтів піддана сумніву та потребує додаткового дослідження.
За результатами розрахунків розподілу напружень по всіх елементах моделі можна побачити, що найбільш стабільним є 1-й та 2-й варіанти хірургічного втручання. При цьому чим більший відсоток становить спейсер із поліметилметакрилату, тим більше навантажується контралатеральна сторона моделі, де можуть виникати залишкові напруження з появою мікротріщин та деградації кісткової тканини. Також зі збільшенням обсягу поліметилметакрилату зростають напруження в ньому самому. В умовах неякісної фіксації гвинтів та армування під дією циклічних навантажень це може призводити до відокремлення металу від метилметакрилату;
Показники загальних та локальних переміщень у моделі подано в табл. 3. Максимальні значення загальних переміщень зафіксовано при I–II типі геміпельвектомії (2-й варіант) — 3,78 мм, дещо нижчі — при II (1-й варіант) — 3,51 мм та II–III (3-й варіант) — 3,51 мм, мінімальні — при I–III (3-й варіант) — 2,84 мм (табл. 3, рис. 9, 10).
Найбільші показники переміщень в усіх моделях виявлено на крижово-клубовому зчленуванні на стороні ураження при I–II типі геміпельвектомії (2-й варіант) — 2,54 мм, дещо нижчі — у II (1-й варіант) — 2,43 мм та II–III (3-й варіант) — 2,47 мм, мінімальні — I–III (4-й варіант) — 2,01 мм.
Дещо нижчі та рівнозначні показники переміщень для усіх досліджуваних моделей на крижово-клубовому зчленуванні контралатеральної сторони при I–II типі геміпельвектомії (2-й варіант) — 1,65 мм, II–III (3-й варіант) — 1,64 мм, II (1-й варіант) — 1,6 мм та I–III (4-й варіант) — 1,55 мм.
Ще нижчі показники переміщень виявлено на лобковому зчленуванні на стороні ураження при I–II типі геміпельвектомії (2-й варіант) — 1,45 мм, дещо нижчі — при II (1-й варіант) — 1,39 мм, II–III (3-й варіант) — 1,18 мм та мінімальні — при I–III (4-й варіант) — 0,99 мм.
Найнижчі показники переміщень виявлено на лобковому зчленуванні контралатеральної сторони при I–II (2-й варіант) та II–III (3-й варіант) типі геміпельвектомії — 1,18 мм, дещо нижчі — при II (1-й варіант) — 1,14 мм та мінімальні — при III (4-й варіант) — 0,99 мм.
Максимальні значення загальних переміщень зафіксовано при I–II типі геміпельвектомії (2-й варіант) — 3,78 мм, дещо нижчі — при II (1-й варіант) — 3,51 мм та II–III (3-й варіант) — 3,51 мм, мінімальні — при I–III (4-й варіант) — 2,84 мм (табл. 3, рис. 9, 10).
Отримані значення показників локальних переміщень за осями X, Y, Z при різних варіантах хірургічного втручання відрізняються несуттєво та не перевищують порогових значень.
Як видно з табл. 3 та рис. 9–10, збільшення обсягу поліметилметакрилату збільшує жорсткість моделі загалом. Це, з одного боку, підвищує загальні напруження в моделі, а з іншого — зменшує ризики виникнення тріщин від «втоми» матеріалу.
Найбільш жорсткою конструкцією можна вважати модель I–III типу геміпельвектомії (4-й варіант хірургічного втручання), але в ній виникають достатньо великі напруження, що не дає оцінити даний вид хірургічного втручання як найнадійніший. Зі свого боку, II тип (1-й варіант) хірургічного втручання має дещо більші переміщення на фоні достатньо низьких показників напружень, що виникають у даній моделі, тому саме такий варіант можна вважати більш оптимальним. Тобто зменшення значень напружень у моделі виникають за рахунок збільшення показників переміщень елементів моделі, які відбуваються переважно по площині лобкового та крижово-клубового зчленувань. Поведінка моделей I–II (2-й варіант) та II–III (3-й варіант) типів, за даними співвідношень показників напружень/переміщень, також демонструє достатню стабільність фіксації елементів моделі.
Висновки
1. Результати біомеханічних досліджень демонструють максимальну надійність II типу (1-й варіант) внутрішньої геміпельвектомії.
2. Виявлено відсутність залежності стабільності конструкції від довжини гвинтів.
3. Доцільність встановлення балки для об’єднання головок гвинтів піддана сумніву, що потребує додаткового дослідження.
4. Збільшення обсягу поліметилметакрилату в конструкції призводить до збільшення навантаження контралатеральної сторони моделі, де можуть виникати ділянки залишкових напружень. При цьому зростають напруження в самому поліметилметакрилаті, що в умовах неякісної фіксації гвинтів та армування під дією циклічних навантажень може призводити до його відокремлення від металу.
5. Зменшення значень напружень у моделі виникають за рахунок збільшення показників переміщень елементів моделі, які відбуваються переважно по площині лобкового та крижово-клубового зчленувань.
6. Збільшення навантаження на конструкцію у хворих із надлишковою вагою прямо пропорційно збільшує ризик виникнення нестабільності конструкції.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Зациорский В.М. Биомеханика двигательного аппарата человека / В.М. Зациорский, А.С. Аруин, В.Н. Селуянов. — М.: Физкультура и спорт, 1981. — 143 с.
2. Напружено-деформований стан проксимального відділу стегнової кістки в умовах моделювання порожнинних кісткових дефектів в різних за навантаженням зонах / В.А. Філіпенко, З.М. Мітелева, В.О. Мезенцев, О.В. Яресько // Український морфологічний альманах. — 2006. — Т. 4, № 1. — С. 104-107.
3. Напружено-деформований стан проксимального відділу стегнової кістки з наявністю порожнистого дефекту (осередок фіброзної дисплазії) в умовах остеосинтезу різними типами фіксаторів / І.А. Лазарев, Ю.М. Гук, Ю.В. Олійник, М.В. Скибан // Травма. — 2015. — Т. 16, № 3. — С. 62-70.
4. Толстопятов Б.А. Диагностика и лечение первичных опухолей костей таза: Дис… д-ра мед. наук: 14.01.07 / Толстопятов Борис Аксентиевич. — К., 1980. — 358 с.
5. Філіпенко В.А. Метода кінцевих елементів в клінічній біомеханіці та прогнозування результатів пластики кісткових порожнин за допомогою різновидів кальцій-фосфатних керамік / В.А. Філіпенко, З.М. Мітелева, З.З. Зиман // Ортопедия, травматология и протезирование. — 2006. — № 2. — С. 34-41.
6. Bickels J. Overview of pelvic resections: surgical consi-derations and classification // Musculoskeletal Cancer Surgery / Bickels J., Malawer M. — Dordrecht: Springer, 2001. — Р. 203-213.
7. Development of finite element model for customized prostheses design for patient with pelvic bone tumor / T. Iqbal, L. Shi, L. Wang et al. // Proceedings of the Institution of Mechanical Engineers. Part H. Journal of engineering in medicine. — 2017. — V. 231, № 6. — Р. 525-533.
8. Kubichek М. Stress strain analysis of Knee joint / М. Kubichek, Z. Florian // Engineering Mechanics. — 2009. — V. 5, № 16. — Р. 315-322.
9. Maganaris C.N. In vivo human tendon mechanical pro-perties / C.N. Maganaris, J.P. Paul // Journal of Physiology. — 1990. — V. 521, № 1. — Р. 307-313.
10. One-step reconstruction with a 3D-printed, biomechanically evaluated custom implant after complex pelvic tumor resection / K.C. Wong, S.M. Kumta, N.V. Geel, J. Demol // Journal Computer Aided Surgery. — 2015. — V. 20, № 1. — Р. 14-23.
11. Pelvic Resections / A. Mavrogenis, K. Soultanis, P. Patapis et al. // Orthopedics. — 2012. — V. 35. — Р. 232-243.
12. Reconstruction of thе hemipelvis after the excision of malignant tumors / A. Abudu, R.J. Grimmer, S.R. Cannon et al. // The Journal of Bone and Joint Surgery. — 1997. — V. 79. — Р. 773-779.
13. Yongwei J. Finite Element Analysis of Pelvic Reconstruction Using Fibular Transplantation Fixed with Rod-Screw System After Type I Resection / J. Yongwei // Chinese Medical Journal. — 2008. — V. 121, № 4. — Р. 321-326.

/30-1.jpg)
/30-2.jpg)
/31-1.jpg)
/31-2.jpg)
/32-1.jpg)
/33-1.jpg)
/34-2.jpg)
/33-2.jpg)
/34-1.jpg)