Резюме
У статті описано власний спосіб моделювання травматичного остеоартрозу колінного суглоба в кролів. Тваринам здійснювали доступ до суглоба, пересікали великогомілкову зв’язку, механічним шляхом проводили деструкцію центральної ділянки епіфізарної поверхні епіфіза великогомілкової кістки, судини суглобової сумки коагулювали по контуру суглоба для створення додаткової ішемізації. Гістологічні дослідження через 1,5 і 2,5 місяця після операції засвідчили дегенеративні зміни гіалінового хряща, редукцію товщини і клітинного складу хряща, інвазію кровоносних судин і формування лакун у глибоких шарах хряща. Виявлені випадки повної (тотальної) дегенерації суглобової поверхні.
В статье описан собственный способ моделирования травматического остеоартроза коленного сустава у кроликов. Животным осуществляли доступ к суставу, пересекали большеберцовую связку, механическим путем проводили деструкцию центрального участка эпифизарной поверхности эпифиза большеберцовой кости, сосуды суставной сумки коагулировали по контуру сустава для создания дополнительной ишемизации. Гистологические исследования через 1,5 и 2,5 месяца после операции показали дегенеративные изменения гиалинового хряща, редукции толщины и клеточного состава хряща, инвазию кровеносных сосудов и формирование лакун в глубоких слоях хряща. Выявлены случаи полной (тотальной) дегенерации суставной поверхности.
Our own way of modeling traumatic knee osteoarthrosis in rabbits is described in the article. The access to the animals’ joint was provided, the tibial ligament was cut, destruction of the central part of the epiphyseal surface of the tibial bone was performed mechanically, the vessels of the bursal sac were coagulated on a joint contour for additional ischemia. Histological researches 1.5 and 2.5 months after the operation showed the degenerative changes of the hyaline cartilage, reduction in cartilage thickness and cellular structure, invasion of blood vessels and lacuna formation in the deep cartilage layers. The cases of the full (total) degeneration of the joint surface were detected.
Вступ
Дослідження елементарних моделей остеоартрозу (остеоартриту) сьогодні є цікавим напрямом вивчення в науковій медичній сфері, що пояснюється значним поширенням і високою соціальною значимістю даної патології. У сучасній науковій літературі остеоартроз розглядається як гетерогенна група захворювань різної етіології з подібними біологічними, морфологічними і клінічними проявами [1–3].
Загальноприйнятою світовою практикою є моделювання остеоартрозу в лабораторних тварин із дослідженням ефективності різних методів лікування. При цьому використовують різні види лабораторних тварин. На сьогодні запропоновано три основні напрямки моделювання остеоартрозу: 1) шляхом введення в суглоб хімічних речовин (стероїдних препаратів, парорідинного струменя азоту); 2) за рахунок фізичних факторів (значного фізіологічного навантаження); 3) механічними і травматичними порушеннями, що призводять до відсутності стабільності суглоба [4].
Найчастіше моделювання остеоартриту відбувається за рахунок попадання в суглоб агентів, що суттєво шкодять його елементам. Наприклад, у роботі [5] розглянутий спосіб моделювання остеоартрозу дворазовим внутрішньосуглобовим введенням мишам 1 од. колагенази VII (із Clostridium histolyticum) з інтервалом у 2 дні. Внутрішньосуглобова ін’єкція препарату послаблює суглобові зв’язки, що викликає нестабільність суглоба. При цьому повномасштабний остеоартроз розвивається протягом 6 тижнів.
Можливим також є введення в колінний суглоб натрієвої солі монойодуксусної кислоти [6], дексаметазону [7]. Зручність даних методів моделювання остеоартрозу полягає в неінвазивності, проте основним їх недоліком є потужний системний вплив на організм, що відображається як у локальних паталогічних змінах, так і на всій обмінній системі тварин.
Достатньо відомим є спосіб моделювання остеоартриту, що полягає у введенні один раз на добу в суглоб лабораторних щурів вітаміну А (із розрахунку 13,5–13,9 мг на 1 кг маси тіла) протягом 2 діб, що порушує процеси синтезу/резорбції тканин суглоба і призводить до яскраво виражених запальних деструктивних змін у суглобі та параартикулярних тканинах [8].
Радикальним хірургічним способом моделювання остеоартрозу можна вважати метод формування експериментального артриту колінного суглоба шляхом видалення латерального виростка стегна в кроликів [9]. Більш щадним напрямком є нанесення дефектів різного ступеня тяжкості на суглобову поверхню та пошкодження зв’язкового апарату. Наприклад, широко відомим є спосіб моделювання посттравматичного артрозу тазостегнового суглоба щурів за допомогою нанесення стандартного дефекту у вигляді круглого отвору діаметром 2 мм, що проникає через суглобовий хрящ у субхондральну кістку [10]. Запальні і дегенеративно дистрофічні зміни зв’язкового апарату, як правило, викликані травмуванням у колінному суглобі. Часто перетинають передню хрестоподібну зв’язку — таку методику застосовують у собак [11], кроликів [12–14], щурів [15]. Використання даного способу спричиняє стабільні зміни в суглобному хрящі та субхондральній кістці, які будуть помітні тільки через 30–40 днів після операції. Але ці зміни також є обмеженими і тому не відображають випадки тотальної втрати суглобової поверхні. У зв’язку з цим є потреба розробки такої моделі остеоартрозу.
Мета роботи: розробити експериментальну модель остеоартрозу в кролів із подальшим дослідженням способів лікування даного захворювання.
Матеріали та методи
Дослідження проведено на кролях вагою 3–4 кг. Модель остеоартрозу полягала в механічному пошкодженні суглобової поверхні великогомілкової кістки. Для цього тварин наркотизували тіопенталом натрію в дозі 60 мг/кг (внутрішньоочеревинно). Тварин у стані наркотичного сну фіксували в положенні на спині. Ділянку шкіри навколо колінного суглоба брили та зрошували бетадином (Egis, Угорщина). Скальпелем здійснювали доступ до колінного суглоба через медіальну поверхню, пересікали великогомілкову зв’язку. Шляхом циркулярних обертів модифікованою спи-цею Ілізарова з напайкою, пошкоджуюча частина якої приводилася в рух низькообертовим приводом, наносили пошкодження в центральній ділянці суглобової поверхні. Епіфізарну поверхню стегнової кістки залишали інтактною. Суглобову сумку зашивали шовним матеріалом 3/0. По поверхні суглобової сумки здійснювали термічну коагуляцію з метою створення регіонального ішемічного пошкодження. Шкіру на рівні доступу також зашивали матеріалом 3/0 і зрошували бетадином.
Через 1,5 і 2,5 місяця після моделювання артрозу тварин виводили з експерименту шляхом швидкої декапітації. Здійснювали доступ до колінного суглоба, анатомічні утворення суглоба фіксували протягом 3 днів у 10% розчині нейтрального формаліну. Після фіксації виділяли епіфіз великогомілкової кістки. Зразки промивали і проводили декальцинацію в розчині OsteoFast 2 (BioGnostLtd., Хорватія) упродовж 4–5 тижнів (3 зміни декальцинуючого розчину). Після завершення декальцифікації проби промивали водою. Із зразків отримували кріозрізи товщиною 20–25 мкм. Зрізи забарвлювали толуїдиновим синім та за методикою Шморля. Гістологічні зрізи поміщали під покривне скельце в синтетичний бальзам.
Препарати суглобової поверхні досліджували на мікроскопі Olympus BX 51. Кількісну оцінку проводили за методикою, що описана в публікації J. Fitzgerald (2008) [16]. Методологічний підхід дозволив отримати узагальнену картину якісних та кількісних змін суглобової поверхні. Результат дослідження оцінювали в балах. У шкалу включено 5 показників: зміни клітинної морфології (0–4 бали), рівень забарвлення матриксу хряща (0–3), регулярність поверхні (0–3), товщину хряща (0–2) та інтеграцію з нативним хрящем (0–2). Максимальна кількість балів за шкалою — 14, мінімальна — 0, що відповідає повній деструкції хрящової поверхні епіфіза кістки.
Статистичну оцінку проводили за непараметричним критерієм Крускала — Уолліса. Вибірки даних аналізували з використанням програмного забезпечення OriginLab version 8.0. Результати вимірювань наведено у вигляді медіани з меншим та більшим квартилем (M [Q1–Q3]). Різницю вважали статистично вірогідною при P < 0,05.
Результати та їх обговорення
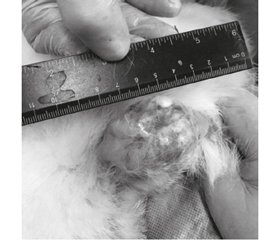
Через 1,5 і 2,5 місяця після операції було досліджено колінний суглоб тварин на макроскопічному та мікроскопічному рівнях. Колінна ділянка характеризувалася збільшенням щільності кровоносних судин, набряком суглобової сумки, наявністю рубцевих змін навколо ділянки хірургічного доступу до суглобових поверхонь. На рис. 1 показано результати макроскопії колінного суглоба. Виявлено різного рівня деструктивні зміни суглобової поверхні. Хрящова основа епіфізарної поверхні була зменшена в товщині, відмічено ділянки повної деструкції й «оголення» кістки. Латеральні ділянки епіфізарної поверхні на макроскопічному рівні залишались незміненими. Меніск між суглобовими поверхнями також візуально був не змінений, що дозволило його відділити від епіфізарної поверхні.
/72-1.jpg)
На рис. 2 показано результати гістологічного дослідження латеральної поверхні епіфіза великогомілкової кістки. Головними структурними проявами деструктивних змін були зменшення товщини хрящової поверхні, редукція клітинного складу, зміна контуру між гіаліновим хрящем і кістковою тканиною. Між термінами спостереження відмічено прогресуюче зменшення клітинного складу хряща. Лакуни ізогенних груп часто були порожніми, хоча хрящовий матрикс структурно був збереженим. Рівень профарбовування і метахромазія хрящового матриксу при забарвленні толуїдиновим синім був зменшеним, що вказує на зменшення вмісту кислим глікозамінокліканів у хондромукоїді. Поверхневий шар гіалінового хряща часто деформований, безклітинний. Відмічено локальні деформації і заглиблення в товщу шару хряща. Це є свідченням деформаційних змін латеральних поверхонь. У глибоких шарах хряща реєстрували появу лакун із кровоносними судинами. Судини з лакунами проникали в гіаліновий хрящ, змінюючи контур епіфізарної поверхні. Ці зміни було оцінено як прояв деструктивних змін й ініціації остеоартрозу.
/73-1.jpg)
У табл. 1 наведено результати кількісної оцінки структурних змін епіфіза великогомілкової кістки контралательної та іпсилатеральної кінцівки. Виявлено тенденцію прогресуючої деструкції латеральних поверхонь гіалінового хряща. Статистично значущої різниці за шкалою J. Fitzgerald (2008) між термінами 1,5 і 2,5 місяця не виявлено.
/74-1.jpg)
На основі результатів гістологічних досліджень зроблено висновок про те, що запропонована модель дозволяє відтворити остеоартроз колінного суглоба з чіткою локалізацією та обсягом ураження. Зменшення рівня профарбовування хондромукоїду є раннім проявом структурних змін хряща. Редукція хондроцитів внаслідок набряку і деструкції клітин, апоптозу хондроцитів є раннім проявом дегенеративних змін. Прогресуючі зміни характеризуються деструкцією і втратою поверхневим шарів епіфізарного хряща. Інвазія кровоносних судин у гіаліновий хрящ із супутньою дегенерацією і редукцією глибоких шарів хряща є раннім морфологічним проявом остеоартрозу. Втрата епіфізарного хряща й «оголення» кісткової тканини є остаточним (кінцевим) етапом розвитку остеоартрозу.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Список литературы
1. Felson D.T. Arthroscopy as a treatment forknee osteoarthritis // Ibid. — 2010. — V. 24, № 1. — P. 47-50.
2. Appleton C., Pitelka V., Henry J., Beier F. Global analyses of gene expression in early experimental osteoarthritis // Arth. Rheum. — 2007. — V. 56, № 6. — P. 1854-1868.
3. Van Dijk G., Veenhof C., Lankhorst G., Dekker J. Limitations in activities in patients with osteoarthritis of the hip or knee: the relationship with body functions, comorbidity and cognitive functioning // Disabil. Rehabil. — 2009. — V. 31, № 20. — P. 1685-1691.
4. Englund M. The role of biomechanics in theinitiation and progression of OA of the knee // Best Pract. Res. Clin. Rheumatol. — 2010. — V. 24, № 1. — P. 39-46.
5. Seung’Ah Y., Bo’Hyoung P., Hyung’Ju Y. et al. Calcineurin Modulates the Catabolic and Anabolic Activity of Chondrocytes and Participates in the Progression of Experimental Osteoarthritis // Arth. Rheum. — 2007. — V. 56, № 7. — P. 2299-2311.
6. Baragi V.M., Becher G., Bendele A.M. et al. A newclass of potent matrix metalloproteinase 13 inhibitors for potential treatment of osteoarthritis: Evidence of histologic and clinical efficacy without musculoskeletal toxicity in rat models // Ibid. — 2009. — V. 60, № 7. — P. 2008-2018.
7. Вишневский В.А., Малышкина С.В. Моделирование артроза путем введения дексаметазона в коленный сустав крысы // Ортоп. травмат. протезир. — 2004. — № 4. — С. 76-80.
8. Пат. 79206 Україна, МПК8 G 09 В 23/28.Спосіб моделювання остеоартрозу з синовіїтом / Коваленко В.М., Вікторов О.П., Корж М.О., Дедух Н.В., Лисенко І.В., заявник і патентовласник Інститут кардіології ім. акад. М.Д. Стражеска АМН України. — № 200510418; Заявл. 4.11.2005; Опубл. 25.05.2007; Бюл. № 7.
9. Engh G.A., Chrisman O.D. Experimentalarthritis in rabbit knees: a study of relief of pressure on one tibial plateau in immature and mature rabbits // Clin. Orthop. Relat. Res. — 1977. — V. 125. — P. 221-226.
10. 3упанец И.А., Дроговоз С.М., Бездетко Н.В., Дедух Н.В. Экспериментальное моделирование посттравматического остеоартроза тазобедренного сустава у крыс // Оценка фармакологической активности химических соединений: принципы и подходы: Тез. докл. Всесоюз. науч. конф. — М., 1989. — Ч. 2. — С. 132-133.
11. Smith G. Jr, Myers S.L., Brandt K.D. et al. Effect of intraarticular hyaluronan injection on vertical ground reaction force and progression of osteoarthritis after anterior cruciate ligament transaction // J. Rheumatol. — 2005. — V. 32, № 2. — P. 325-334.
12. Ozkan F.U., Ozkan K., Ramadan S., Guven Z. Chondroprotective effect of N-acetylglucosamine and hyaluronate in early stages ofosteoarthritis — an experimental study in rabbits // Bull. NYU Hosp. Jt. Dis. — 2009. — V. 67, № 4. — P. 352-357.
13. Batiste D.L., Kirkley A., Laverty S. et al. Exvivo characterization of articular cartilage and bone lesions in a rabbit ACL transection model of osteoarthritis using MRI and micro-CT // Osteoarth. Cartil. — 2002. — V. 10, № 2. — P. 145-155.
14. Tiraloche G., Girard C., Chouinard L. et al. Effect of oral glucosamine on cartilage degradation in a rabbit model of osteoarthritis // Arth. Rheum. — 2005. — V. 52, № 4. — P. 1118-1128.
15. Jean Y.H., Wen Z.H., Chang Y.C. et al. Intraarticular injection of the cyclooxygenase-2 inhibitor parecoxib attenuates osteoarthritis progression in anterior cruciate ligament transected knee in rats: role of excitatory amino acids // Osteoarth. Cartil. — 2007. — V. 15, № 6. — P. 638-645.
16. Fitzgerald J., Rich C., Burkhardt D., Allen J., Herzka A.S., Little C.B. Evidence for articular cartilage regeneration in MRL/MpJmice // Osteoarthritis Cartilage. — 2008 Nov. — 16(11). — Р. 1319-26.

/72-1.jpg)
/73-1.jpg)
/74-1.jpg)