Резюме
Актуальність. Паранеопластичний синдром (ПНПС) при раку легені (РЛ) характеризується ревматологічними і неврологічними періартикулярними проявами. ПНПС став актуальною проблемою сучасної онкології, але особливості його перебігу і розвиток самого пухлинного процесу залишаються вивченими недостатньо. Мета дослідження: оцінити клініко-лабораторні прояви паранеопластичного (неоплазмового) періартикулярного синдрому (ПАС) у контексті зв’язків з окремими ознаками РЛ. Матеріали та методи. ПНПС виявлений у 258 (16 %) хворих на РЛ, а ПАС — в 114 (44 %) випадках ПНПС. Ці пацієнти (83 чоловіки і 31 жінка, середній вік 59 років) становили основну групу спостережень, а інші 144 пацієнти з ПНПС увійшли до групи порівняння. Результати. Серед хворих із паранеопластичним ПАС остеоартропатію діагностовано в 24 % випадків, периферійну нейропатію — в 11 %, фіброзити і тендовагініти — в 6 %, фасціїти й ентезопатії — в 4 %, альгодистрофію — в 3 %, що порівняно з іншими обстеженими, які страждають від ПНПС, вірогідно частіше розвивається в жінок (у 1,9 раза) і локалізується в середній долі (у 3,8 раза). У цієї категорії пацієнтів частіше формується плоскоклітинний гістологічний варіант пухлини (у 1,5 раза), спостерігається проростання її в грудну стінку (у 2,1 раза), стиснення поворотного нерву (у 3,8 раза) і більша кількість груп метастазів у лімфатичних вузлах (на 1/4), але відсутнє двобічне ураження легенів, рідше відзначається крупноклітинна карцинома (у 3,2 раза), компресійний синдром (у 4 рази), проростання неоплазми в трахею (у 2,5 раза), що залежить від потужності використаної хіміотерапії, вживаних препаратів платини, алкілантів, алкалоїдів барвінку й антрациклінів. При цьому періартикулярні паранеопластичні прояви сприяють виникненню мієлодепресії, променевого фіброзу легені та езофагіту. Висновки. Формування паранеопластичного ПАС спостерігається майже у кожного другого хворого з ПНПС, обумовленим РЛ, що супроводжується особливостями перебігу пухлинного процесу, а отримані дані диктують необхідність подальших досліджень для виділення критеріїв ранньої діагностики ПАС та інформативних прогностичних чинників щодо подальшого перебігу РЛ.
Актуальность. Паранеопластический синдром (ПНПС) при раке легкого (РЛ) характеризуется ревматологическими и неврологическими периартикулярными проявлениями. ПНПС стал актуальной проблемой современной онкологии, но особенности его течения и развитие самого опухолевого процесса остаются изученными недостаточно. Цель исследования: оценить клинико-лабораторные проявления паранеопластического (неоплазменного) периартикулярного синдрома (ПАС) в контексте связей с отдельными признаками РЛ. Материалы и методы. ПНПС выявлен у 258 (16 %) больных РЛ, а ПАС — в 114 (44 %) случаях ПНПС. Эти пациенты (83 мужчины и 31 женщина, средний возраст 59 лет) составили основную группу наблюдений, а остальные 144 пациента с ПНПС вошли в группу сравнения. Результаты. Среди больных с паранеопластическим ПАС остеоартропатия диагностирована в 24 % случаев, периферическая нейропатия — в 11 %, фиброзиты и тендовагиниты — в 6 %, фасцииты и энтезопатии — в 4 %, альгодистрофия — в 3 % случаев, что в сравнении с остальными обследованными, страдающими ПНПС, достоверно чаще развивается у женщин (в 1,9 раза) и локализуется в средней доле (в 3,8 раза). Также у этой категории пациентов чаще формируется плоскоклеточный гистологический вариант опухоли (в 1,5 раза), наблюдается прорастание ее в грудную стенку (в 2,1 раза), сдавление возвратного нерва (в 3,8 раза), большое количество групп метастазов в лимфатических узлах (на 1/4), но отсутствует двустороннее поражение легких, реже отмечается крупноклеточная карцинома (в 3,2 раза), компрессионный синдром (в 4,0 раза), прорастание неоплазмы в трахею (в 2,5 раза), что зависит от мощности использованной химиотерапии, применяемых препаратов платины, алкилантов, алкалоидов барвинка и антрациклинов. При этом периартикулярные паранеопластические проявления способствуют возникновению миелодепрессии, лучевого фиброза легких и эзофагита. Выводы. Формирование паранеопластического ПАС наблюдается почти у каждого второго больного с ПНПС, обусловленным РЛ, что сопровождается особенностями течения опухолевого процесса, а полученные данные диктуют необходимость дальнейших исследований для выработки критериев ранней диагностики ПАС и информативных прогностических факторов в отношении дальнейшего течения РЛ.
Background. Paraneoplastic syndrome (PNPS) associated with lung cancer (LC) is characterized by rheumatologic and neurologic periarticular manifestations. PNPS has become an urgent problem of modern oncology, but features of its course and development of tumor process itself are underinvestigated. The purpose was to estimate clinical laboratory manifestations of paraneoplastic (neoplasmic) periarticular syndrome (PAS) within the context of correlation with some signs of LC. Materials and methods. PNPS was detected in 258 (16 %) patients with LC, and PAS — in 114 (44 %) cases of PNPS. These patients (83 men and 31 women with an ave-rage age of 59 years) made up the main study group, and the remai-ning 144 patients with PNPS were included into comparison group. Results. Among patients with paraneoplastic PAS, osteoarthropathy was diagnosed in 24 % of cases, peripheral neuropathy — in 11 %, fibrositis and tendovaginitis — in 6 %, fasciitis and enthesopathy — in 4 %, algodystrophy — in 3 %, which in comparison with the others persons with PNPS more often develops in women (by 1.9 times) and localize in the middle lobe (by 3.8 times). Also, these patients more often have squamous histological variant of tumor (by 1.5 times), its extension into chest wall (by 2.1 times), compression of recurrent nerve (by 3.8 times), a large number of groups of metastases in lymph nodes (by 1/4), but they do not have bilateral pulmonary involvement, large-cell carcinoma (by 3.2 times), compression syndrome (by 4.0 times), neoplasm extension into trachea (by 2.5 times), which depends on the power of chemotherapy, used platinum-based drugs, alkylating agents, vinca alkaloids and anthracyclines, while periarticular paraneoplastic manifestations lead to myelodepression, radiation-induced pulmonary fibrosis and esophagitis. Conclusions. Formation of paraneoplastic PAS is observed in almost every second patient with PNPS associated with LC, which is accompanied by the features of tumor process, and obtained data necessitate the further investigations to develop criteria for early diagnosis of PAS and informative prognostic factors for the further course of LC.
Введение
В структуре онкологической заболеваемости лидирующие позиции занимает рак легкого (РЛ) [3, 5, 12], от которого ежегодная смертность в некоторых регионах планеты достигает 15 % [13, 16]. В последние годы связь РЛ и болезней опорно-двигательного аппарата рассматривается с новых позиций — в контексте формирования при таком новообразовании суставных и периартикулярных признаков, включаемых в паранеопластический синдром (ПНПС) [10]. ПНПС непосредственно не связан с первичной опухолью и ее метастазами, а обусловлен сложными вторичными воспалительно-дегенеративными изменениями, зачастую протекающими в виде костно-суставных и неврологических проявлений «перекреста» (overlap) и опухолевого заболевания [8, 14]. ПНПС чаще возникает при мелкоклеточном РЛ и аденокарциноме легких, может проявляться периартикулярными мышечными симптомами [1, 9, 11].
Если артикулярные составляющие ПНПС при РЛ достаточно неплохо изучены [2, 7, 15], то периартикулярные проявления требуют дальнейшего изучения [4, 6].
Целью исследования стала оценка клинико-лабораторных признаков паранеопластического (неоплазменного) периартикулярного синдрома (ПАС) в контексте связей с отдельными факторами течения РЛ.
Материалы и методы
Среди обследованных 1669 больных РЛ были отобраны 258 (15,5 %) человек в возрасте от 24 до 79 лет (в среднем 58,60 ± 0,65 года), у которых выявлены те или иные проявления ПНПС. Из них основную группу составили 114 больных с ПАС, что имело место у 6,8 % от общего числа наблюдаемых больных РЛ и 44,2 % от числа пациентов с ПНПС (144 человека вошли в группу сравнения). Соотношение IA-ІВ, ІІА-ІІВ, ІІІА, ІІІВ и IV стадий заболевания составило 1 : 2 : 23 : 35 : 36.
Средний параметр дифференциации РЛ был равен 1,190 ± 0,038 балла, интегральной стадийности — 5,870 ± 0,032 о.е., индекса тяжести опухолевого процесса (WTI) — 2,850 ± 0,024 о.е. Его оценивали по формуле: WTI = ln(T + N2 + (ƩM)2), где ln — десятичный логарифм, Т — международный показатель характера первичной опухоли, N — международный показатель метастатического поражения региональных лимфатических узлов, ƩМ — сумма отдаленных органов и костей с метастазами.
Для диагностики РЛ, его метастазов и ПНПС применяли методы обычной рентгенографии, компьютерной, магнитно-резонансной и позитронно-эмиссионной томографии, сонографии (аппараты Multix-Compact-Siеmens, Германия; Somazom-Emotion-6-Siemens, Германия; Gygoscan-Intera-Philips, Нидерланды; RDS-Eclipse-RD-Siemens, Германия; Biograph-64-TruePoint-Siemens, Германия; Envisor-Phi–lips, Нидерланды). Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного, непараметрического корреляционного и однофакторного дисперсионного анализа ANOVA (программы Microsoft Excel и Statistica-StatSoft, США). Оценивали средние значения, их стандартные ошибки и отклонения, непараметрические коэффициенты корреляции Кендалла (τ), критерии дисперсии (D), различий Стьюдента (t) и Макнемара — Фишера (χ2), а также достоверности статистических показателей (p).
Результаты и обсуждение
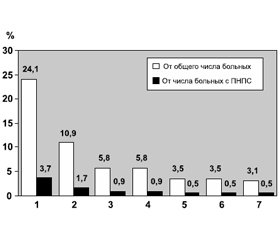
/92-1.jpg)
Как видно на рис. 1, остеоартропатия Мари — Бамбергера диагностирована у 3,7 % от общего числа больных и у 24,1 % от числа пациентов с ПНПС, периферическая нейропатия — соответственно у 1,7 и 10,9 %, фиброзиты и тендовагиниты — соответственно у 0,9 и 5,8 %, фасцииты и энтезопатии — у 0,5 и 3,5 %, альгодистрофия — у 0,5 и 3,1 %.
Если в основной группе соотношение мужчин и женщин составило 3 : 1, то в группе сравнения — 6 : 1 (χ2 = 6,29, р = 0,012). При этом средний возраст больных не различался и соответственно был равен 59,4 ± 0,9 и 58,00 ± 0,93 года. В группе с ПАС отсутствовали случаи двустороннего РЛ, тогда как среди остальных пациентов с ПНПС таковых было 5,6 % (χ2 = 6,54, р = 0,011). Необходимо отметить, что в основной группе в 3,8 раза чаще констатировали среднедолевую локализацию опухолевого процесса, которая составляла соответственно 7,9 и 2,1 % (χ2 = 4,85, р = 0,028). Обе группы больных не различались по форме РЛ (центральная и периферическая, соотношение которых составило 3 : 1). Вместе с тем в основной группе соотношение мелкоклеточного и немелкоклеточного гистологического варианта РЛ было равно 1 : 9, тогда как в группе сравнения — 1 : 4 (χ2 = 6,15, р = 0,013). Обращало на себя внимание увеличение (на 52 %) частоты плоскоклеточного РЛ в группе с ПАС (χ2 = 4,96, р = 0,026), но уменьшение в 3,2 раза количества случаев крупноклеточной карциномы (χ2 = 8,02, р = 0,005).
Основная группа отличалась большим (на 22 %) числом групп метастазов в лимфатических узлах (соответственно 1,870 ± 0,148 и 1,530 ± 0,091; t = 2,05; p = 0,042). В группе больных с ПАС (рис. 2) в 3,5 раза чаще отмечали прорастание опухоли в грудную стенку (χ2 = 5,49, р = 0,019) и в 3,8 раза чаще — сдавление неоплазмой возвратного нерва (χ2 = 4,85, р = 0,028), но в 4 раза реже диагностировали компрессионный синдром (χ2 = 5,49, р = 0,015) и в 3,5 раза — прорастание РЛ в трахею (χ2 = 3,85, р = 0,049). По результатам выполненного дисперсионного анализа на число признаков ПАС влияет наличие у больных обтурационного ателектаза (D = 4,16, p = 0,008). Необходимо отметить, что у одного больного основной группы были установлены от 1 до 4 признаков ПАС (в среднем у остальных пациентов — 1,260 ± 0,054).
На формирование ПАС оказывает воздействие мощность химиотерапии РЛ (D = 3,24, p = 0,013), но не мощность лучевой терапии. Однофакторный дисперсионный анализ продемонстрировал связь развития ПАС с использованием алкилантов (D = 5,67, p < 0,001) и алкалоидов барвинка (D = 4,17, p = 0,003), а непараметрический корреляционный анализ Кендалла показал прямую связь с примененными дозами препаратов платины (τ = +0,092, p = 0,048) и антрациклиновых антибиотиков (τ = +0,097, p = 0,045). Наличие у больных РЛ ПАС негативно влияет на развитие таких осложнений радиохимиотерапии, как лучевой фиброз легких (D = 3,81, p = 0,047), лучевой эзофагит (D = 4,26, p = 0,040) и миелодепрессия (D = 5,36, p = 0,025).
На следующем этапе нашей работы мы выделили показатели течения РЛ, которые одновременно имели достоверные дисперсионные и корреляционные связи с выраженностью отдельных проявлений ПАС. Оказалось, что остеоартропатия тесно и прямо связана с наличием экссудативного плеврита (D = 16,49, p < 0,001; τ = +0,358, p < 0,001), альгодистрофия — с количеством групп метастазов в костях (D = 6,25, p = 0,014; τ = +0,147, p = 0,021), фасцииты — с аденокарциномой (D = 7,74, p = 0,006; τ = +0,254, p < 0,001), фиброзиты — с мелкоклеточным гистологическим вариантом неоплазмы (BF = 5,98, p = 0,016; τ = +0,216, p = 0,001) и обтурационным ателектазом (D = = 13,95, p < 0,001; τ = +0,343, p < 0,001), тендовагиниты — с прорастанием опухоли в пищевод (D = 6,70, p = 0,011; τ = +0,227, p < 0,001) и числом отдаленных органов с метастазами (D = 9,10, p = 0,003; τ = +0,343, p < 0,001), энтезопатии — с IWT (D = 4,36, p = 0,039; τ = +0,235, p < 0,001), периферическая нейропатия — с плоскоклеточной карциномой (D = 14,90, p < 0,001; τ = +0,343, p < 0,001) и числом групп метастазов в лимфатических узлах (D = 4,55, p = 0,035; τ = +0,269, p < 0,001).
C учетом результатов выполненного вариационного, дисперсионного и корреляционного статистического анализа сделано заключение, имеющее практическую направленность: при наличии у больных фасциита можно думать об аденокарциноме, в случаях наличия фиброзитов — о мелкоклеточном РЛ, а при периферической нейропатии — о плоскоклеточной карциноме.
Выводы
1. ПАС наблюдается у 44 % от числа больных РЛ с ПНПС. Среди них остеоартропатия имеет место в 24 % случаев, периферическая нейропатия — в 11 %, фиброзиты и тендовагиниты — в 6 %, фасцииты и энтезопатии — в 4 %, альгодистрофия — в 3 % случаев.
2. При РЛ ПАС в сравнении с остальными обследованными, страдающими ПНПС, достоверно чаще развивается у женщин (в 1,9 раза) и локализуется в средней доле (в 3,8 раза). При этом чаще формируется плоскоклеточный гистологический вариант опухоли (в 1,5 раза), прорастание ее в грудную стенку (в 2,1 раза), сдавление возвратного нерва (в 3,8 раза) и наблюдается большое количество групп метастазов в лимфатических узлах (на 1/4).
3. Возникновение ПАС у больных РЛ зависит от мощности и характера использованной химиотерапии.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов при подготовке данной статьи.
Список литературы
1. Aggarwal R., Oddis C.V. Paraneoplastic myalgias and myositis // Rheum. Dis. Clin. North Am. — 2011. — 37 (4). — 607-21. doi: 10.1016/j.rdc.2011.09.007.
2. Cantini F., Niccoli L., Nannini C., Chindamo D., Bertoni M., Cassarà E. et al. Isolated knee monoarthritis heralding resectable non-small-cell lung cancer. A paraneoplastic syndrome not previously described // Ann. Rheum. Dis. — 2012. — 71 (12). — 1672-4.
3. Ceniceros L., Aristu J., Castanon E., Rolfo C., Legaspi J., Olar-te A. et al. Stereotactic body radiotherapy (SBRT) for the treatment of inoperable stage I non-small cell lung cancer patients // Clin. Transl. Oncol. — 2015. — 55 (8). — 213-9. doi: 10.5306/wjco.v5.i3.197.
4. Durieux V., Coureau M., Meert A.P., Berghmans T., Sculier J.P. Autoimmune paraneoplastic syndromes associated to lung cancer: A systematic review of the literature // Lung Cancer. — 2017. — 106 (4). — 102-9. doi: 10.1016/j.lungcan.2017.01.015.
5. Grаdalska-Lampart M., Karczmarek-Borowska B., Radzis-zewska A.U. Lung cancer in Podkarpackie region in the years 2002–2011 // Pneumonol. Alergol. Pol. — 2015. — 83 (2). — 109-19.
6. Hakkou J., Rostom S., Bahiri R., Hajjaj-Hassouni N. Paraneoplastic rheumatic syndromes: report of eight cases and review of literature // Rheumatol. Int. — 2012. — 32 (6). — 1485-9. doi: 10.1007/s00296-011-2252-9.
7. Han Y.M., Fang L.Z., Zhang X.H., Yuan S.H., Chen J.H., Li Y.M. Polyarthritis as a prewarning sign of occult lung cancer // Kaohsiung J. Med. Sci. — 2012. — 28 (1). — 54-6. doi: 10.1016/j.kjms.2011.06.035.
8. Hébant B., Miret N., Berthelot L., Jaafar M., Maltête D., Lefaucheur R. Generalized pruritus preceding paraneoplastic neuropathy // J. Clin. Neurosci. — 2016. — 26. — 156-7. doi: 10.1016/j.jocn.2015.09.015.
9. Lange U., Bachmann G., Müller-Ladner U. Tibial pain and unilateral knee arthritis: Precursors of paraneoplastic arthropathy // Z. Rheumatol. — 2014. — 70 (4). — 332-5. doi: 10.1007/s00393-010-0734-x.
10. Latimer K.M. Lung cancer: clinical presentation and diagnosis // F.P. Essent. — 2018. — 464 (1). — 23-6. doi: 10.1136/practneurol-001819.
11. Leandro M.J., Isenberg D.A. Rheumatic diseases and malignancy — is there an association? // Scand. J. Rheumatol. — 2010. — 39 (4). — 185-8.
12. Muzamil J., Bashir S., Guru F.R., Nabi F., Bhat G.M. Squamous cell carcinoma lung with skeletal muscle involvement: a 8-year study of a tertiary care hospital in Kashmir // Indian. J. Med. Paediatr. Oncol. — 2017. — 38 (4). — 456-60. doi: 10.4103/ijmpo.ijmpo_169_16.
13. Qu H.M., Bai Y.N., Cheng N., Dai M., Zheng T.Z., Wang D. et al. Trend Analysis of Cancer Mortality in the Jinchang Cohort, China, 2001-2010 // Biomed. Environ. Sci. — 2015. — 28 (5). — 364-9. doi: 10.3967/bes2015.050.
14. Ramírez-Bellver J.L., Macías E., Bernárdez C., López-Robles J., Vegas-Sánchez M.D., Díaz-Recuero J.L. et al. Anti-NXP2-positive paraneoplastic dermatomyositis with histopathologic changes confined to the acrosyringia // Am. J. Dermatopathol. — 2017. — 39 (1). — 3-7. doi: 10.1097/DAD.0000000000000694.
15. Sakamoto T., Ota S., Haruyama T., Ishihara M., Natsume M., Fukasawa Y. A case of paraneoplastic remitting seronegative symmetrical synovitis with pitting edema syndrome improved by chemotherapy // Case Rep. Oncol. — 2017. — 10 (3). — 1131-7. doi: 10.1159/000484977.
16. Wilkins C.M., Johnson V.L., Fargason R.E., Birur B. Psychosis as a sequelae of paraneoplastic syndrome in small-cell lung carcinoma: A psycho-neuroendocrine interface // Clin. Schizophr. Relat. Psychoses. — 2017. — 22 (11). — 153-8. doi: 10.3371/CSRP.CWVJ.111717.
/92-1.jpg) Как видно на рис. 1, остеоартропатия Мари — Бамбергера диагностирована у 3,7 % от общего числа больных и у 24,1 % от числа пациентов с ПНПС, периферическая нейропатия — соответственно у 1,7 и 10,9 %, фиброзиты и тендовагиниты — соответственно у 0,9 и 5,8 %, фасцииты и энтезопатии — у 0,5 и 3,5 %, альгодистрофия — у 0,5 и 3,1 %.
Как видно на рис. 1, остеоартропатия Мари — Бамбергера диагностирована у 3,7 % от общего числа больных и у 24,1 % от числа пациентов с ПНПС, периферическая нейропатия — соответственно у 1,7 и 10,9 %, фиброзиты и тендовагиниты — соответственно у 0,9 и 5,8 %, фасцииты и энтезопатии — у 0,5 и 3,5 %, альгодистрофия — у 0,5 и 3,1 %.