Журнал «» №6 (62), 2018
Вернуться к номеру
Нові можливості лікування легеневої артеріальної та хронічної тромбоемболічної легеневої гіпертензії в Україні
Авторы: Радченко Г.Д.
Науково-консультативний експертний центр легеневої гіпертензії, ДУ «ННЦ «Інститут кардіології імені академіка М.Д. Стражеска» НАМН України, м. Київ, Україна
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Метою даної статті був огляд даних літератури щодо ефективності та безпечності застосування бозентану в лікуванні легеневої гіпертензії. Окрім того, висвітлюються питання діагностики, класифікації та патогенезу легеневої гіпертензії. Автор дійшов висновку, що бозентан є достатньо ефективним препаратом як у монотерапії, так і в складі комбінованої терапії пацієнтів із легеневою артеріальною гіпертензією. При хронічній тромбоемболічній легеневій гіпертензії застосування бозентану є можливим, але позитивні зміни не є такими вираженими, як у пацієнтів із легеневою артеріальною гіпертензією. Розглядаються дані літератури щодо можливих побічних явищ бозентану та способів їх уникнути.
Целью данной статьи был обзор данных литературы относительно эффективности и безопасности применения бозентана в лечении легочной гипертензии. Кроме того, освещаются вопросы диагностики, классификации и патогенеза легочной гипертензии. Автор делает вывод, что бозентан является достаточно эффективным препаратом как в монотерапии, так и в составе комбинированной терапии пациентов с легочной артериальной гипертензией. При хронической тромбоэмболической легочной гипертензии применение бозентана возможно, но положительные изменения являются не такими выраженными, как у пациентов с легочной артериальной гипертензией. Рассматриваются данные литературы о возможных побочных явлениях бозентана и способах их избежать.
The aim of this paper is the review of literature data about effectiveness and safety of bosentan in the treatment of pulmonary hypertension. In addition, it considers some aspects of diagnosis, classification and pathogenesis of pulmonary hypertension. It is concluded that bosentan is effective both as monotherapy and in combination therapy of patients with pulmonary arterial hypertension. In patients with chronic thromboembolic pulmonary hypertension, it is possible to use bosentan, but positive changes are less significant than in patients with pulmonary arterial hypertension. Data about possible adverse effects of bosentan and ways to avoid them are considered.
легенева гіпертензія; специфічна терапія; блокатори рецепторів ендотеліну; бозентан
легочная гипертензия; специфическая терапия; блокаторы рецепторов эндотелина; бозентан
pulmonary hypertension; specific therapy; endothelin receptor blockers; bosentan
Вступ
Легенева гіпертензія (ЛГ) — це гемодинамічний та патофізіологічний стан, який характеризується підвищенням середнього тиску в легеневій артерії (ЛА) > 25 мм рт.ст., що оцінюється за даними катетеризації правих відділів серця [1]. Виділяють більше 50 хвороб, при яких можливим є збільшення рівня АТ у ЛА. Серед них 80 % пов’язано із захворюваннями лівих відділів серця, 10 % — із захворюваннями легень, інші — з ураженням легеневих артерій (так звана легенева артеріальна гіпертензія — ЛАГ), хронічною тромбоемболією легеневої артерії (хронічна тромбоемболічна легенева гіпертензія — ХТЕЛГ) або багатофакторним/нез’ясованим механізмом виникнення. Тобто з огляду на визначення є зрозумілим, що здебільшого ЛГ — це не хвороба, а стан. Виключення становлять лише ЛАГ та ХТЕЛГ, що відмічаються в меншій кількості випадків. Саме для цих категорій пацієнтів сучасними рекомендаціями cхвалено застосування специфічного медикаментозного лікування, адже саме для них отримано докази ефективності в клінічних дослідженнях. Всі інші категорії хворих (група 2, 3 та більшість 5–ї) потребують лікування основного захворювання, і специфічна терапія може або змінити стан хворого, або навіть погіршити, збільшивши частоту серцево–судинних ускладнень і смерті [1].
Дана стаття присвячена огляду даних щодо специфічної терапії саме пацієнтів із ЛАГ та ХТЕЛГ. Особливий наголос зроблено на блокатори рецепторів ендотеліну. Ця група препаратів лише у 2018 році вперше вийшла на український ринок, і в українських лікарів ще немає достатнього досвіду їх застосування.
Етіопатогенетична класифікація легеневої гіпертензії (ESC, 2015)
1. Легенева артеріальна гіпертензія
1.1. Ідіопатична.
1.2. Спадкова.
1.2.1. Мутація гена, що кодує рецептори морфогенетичного протеїну кісткового мозку — BMRP2.
1.2.2. Мутація гена активін–рецептороподібної кінази ALK1 та ендогліну (з уродженою геморагічною телеангіоектазією або без неї, ENG), кавеоліну–1 (CAV1), KCN.
1.2.3. Невідомої етіології.
1.3. ЛГ, асоційована з ліками або токсинами.
1.4. ЛГ, асоційована:
1.4.1. Із захворюваннями сполучної тканини.
1.4.2. ВІЛ–інфекціями.
1.4.3. Портальною гіпертензією.
1.4.4. Уродженими вадами серця.
1.4.5. Шистосомозом.
1’ Венооклюзивна хвороба легенів і/або гемангіоматоз легеневих капілярів.
1” Персистуюча ЛГ немовлят.
2. ЛГ, асоційована з ураженням лівої половини серця
2.1. Систолічна дисфункція.
2.2. Діастолічна дисфункція.
2.3. Захворювання клапанів.
2.4. Вроджена/набута обструкція притоку/відтоку та вроджена кардіоміопатія.
3. ЛГ, асоційована із захворюваннями легенів та/або гіпоксією
3.1. При хронічній обструктивній хворобі легенів.
3.2. При інтерстиціальних хворобах легенів.
3.3. При інших захворюваннях легенів зі змішаними обструктивно–рестриктивними причинами.
3.4. При порушенні дихання під час сну.
3.5. При гіповентиляційній патології альвеол.
3.6. При хронічному перебуванні на високогір’ї.
3.7. При вадах розвитку легень.
4. Хронічна посттромбоемболічна легенева гіпертензія та інші види обструкції легеневої артерії
4.1. Хронічна тромбоемболічна легенева гіпертензія.
4.2. Інші види обструкції легеневої артерії.
4.2.1. Ангіосаркома.
4.2.2. Інші внутрішньосудинні пухлини.
4.2.3. Артеріїти.
4.2.4. Вроджені стенози легеневої артерії.
4.2.5. Паразитарні захворювання (ехінококоз).
5. ЛГ із невідомими та/або багатофакторними механізмами
5.1. Гематологічні захворювання: хронічна гемолітична анемія, мієлопроліферативні захворювання, спленектомія.
5.2. Системні захворювання: саркоїдоз, гістіоцитоз Х, лімфангіолейоміоматоз.
5.3. Метаболічні порушення: хвороби накопичення глікогену, хвороба Гоше, захворювання щитоподібної залози.
5.4. Інші причини: пухлинна обструкція, фіброзуючий медіастиніт, хронічна ниркова недостатність, сегментарна ЛГ.
Визначення та патогенез легеневої артеріальної гіпертензії
ЛАГ та ХТЕЛГ діагностуються лише при катетеризації правих відділів серця. При цьому повинні реєструватися такі параметри: рівень середнього артеріального тиску (АТ) в ЛА > 25 мм рт.ст., тиск заклинювання легеневої артерії (ТЗЛА; тиск у лівому передсерді) < 15 мм рт.ст. та опір легеневих артерій > 3 WU. При цьому мають бути відсутніми ознаки захворювання легень. У разі з ХТЕЛГ мають бути ознаки наявності тромбів у легеневій артерії. Важливим є визначення всіх вказаних вище параметрів та хвилинного об’єму крові (ХОК). Так, якщо опір ЛА менше 3 WU, навіть коли середній АТ в ЛА > 25 мм рт.ст. та ТЗЛА < 15 мм рт.ст. та підвищеним є ХОК, то така ЛГ, найімовірніше, пов’язана з гемодинамічним перевантаженням (при тиреотоксикозі, за наявності артеріовенозної фістули в пацієнтів, які перебувають на гемодіалізі, при вагітності). Вона належить до групи 5 та не потребує специфічного лікування.
Епідеміологія ЛАГ описана в декількох реєстрах [1]. Найбільш низька оцінка поширеності ЛАГ та ідіопатичної ЛАГ становить 15 та 5,9 випадку на мільйон дорослого населення відповідно. Найнижча частота виникнення ЛАГ становить 2,4 випадку на 1 млн дорослого населення на рік. У Європі поширеність і частота розвитку ЛАГ знаходяться в діапазоні 15–60 осіб на 1 млн населення і 5–10 випадків на 1 млн на рік відповідно. Приблизно половина пацієнтів із ЛАГ, які внесені в реєстр, мають ідіопатичну, спадкову або індуковану ліками ЛАГ. Основною причиною розвитку асоційованої ЛАГ є захворювання сполучної тканини, найчастіше — системний склероз. Серед пацієнтів із спадковою ЛАГ найчастіше виявляють мутацію гена рецепторів BMPR II (рецептори кістково–морфогенетичного протеїну типу 2). Окрім того, описано ще близько 20 генів, які також асоціюються з ЛАГ. Останнім часом також стали виділяти в окрему підгрупу пацієнтів, які відповідають позитивно при проведенні вазореактивного тесту. Таких хворих називають responders, і вони становлять менше 10 % пацієнтів з ідіопатичною ЛАГ.
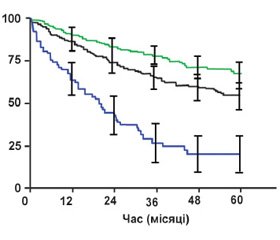
Прогноз ЛАГ та ХТЕЛГ є не дуже втішним. До ери застосування специфічної терапії середня тривалість життя пацієнтів із ЛАГ становила 3 роки. За останніми даними європейських спеціалізованих центрів, протягом 5 років виживає в середньому 75 % хворих (рис. 2). Найгірший прогноз мають пацієнти із системним склерозом. Найкращий — пацієнти з позитивним вазореактивним тестом.
До ЛАГ належать різні за етіологією стани, що мають однакові патогенетичні механізми, які призводять до ремоделювання легеневих судин (насамперед артеріол) через проліферацію та гіпертрофію гладком’язових клітин, вазоконстрикцію, дисфункцію ендотелію та утворення тромбу in situ (рис. 3). Ці зміни структури судин асоціюються із зменшенням активності простациклінсинтетази, що призводить до зменшення кількості дуже важливого вазодилататора — простацикліну, збільшенням активності та кількості рецепторів ендотеліну–1, зменшенням продукції та збільшенням руйнування оксиду азоту (NO), що викликає зменшення внутрішньоклітинного циклічного аденозинмонофосфату (цГМФ). При хронічній тромбоемболії легеневої артерії (ХТЕЛА) мають бути наявними також тромботичні маси в системі ЛА, які проростають сполучною тканиною та є основною механічною причиною збільшення опору та АТ у ЛА. Але зменшення просвіту уражених тромбами артерій (головних гілок, сегментарних та субсегментарних) призводить до збільшення току крові в артеріях, які не були уражені, що, зі свого боку, підвищує навантаження на ендотелій мілких артерій та за певних умов запускає вищевказані патогенетичні механізми ремоделювання. У приблизно 2 % хворих після перенесеної гострої ТЕЛА може виникати ХТЕЛГ. Основним методом лікування ХТЕЛА є хірургічний (тромбенд–артеріоектомія або балонна ангіопластика). У разі резидуальної (яка залишається після операції) ЛГ або при значній початковій мікроангіопатії (опір легеневих судин більше 15 WU) може застосовуватися специфічна терапія, що впливає на патологічні ланки ремоделювання легеневих судин. Вважається, що пацієнти, які позитивно відповіли на вазореактивний тест при тривалому спостереженні, мають лише гіпертрофію гладком’язових клітин та вазоконстрикцію без плексиморфного ушкодження. Саме тому в них ефективними є антагоністи кальцію.
Специфічна терапія ЛАГ
Як вказувалося вище, виділяють три основні патогенетичні шляхи ремоделювання легеневих судин. На сьогодні сучасна терапія ЛГ здатна впливати на ці три механізми (рис. 3). Окрім того, до специфічної терапії відносять антагоністи кальцію. Ці препарати з’явилися найпершими. На сьогодні доведено, що ця група препаратів ефективна лише у хворих на ЛАГ, що позитивно відповіли на вазореактивний тест. У цих пацієнтів трохи інший механізм ЛАГ — вазоконстрикція та гіпертрофія гладком’язових клітин без проліферації та плексиморфного ураження. Тому антагоністи кальцію є саме такими, що впливають на ці механізми та значно покращують клінічний стан та прогноз пацієнтів. У всіх інших хворих із ЛАГ застосування антагоністів кальцію є марним, а іноді шкідливим (наприклад, при зниженому ХОК).
Група простаноїдів (препарати — епопростенол, тепростеніл, ілопрост) є потужними вазодилататорами. Але діють ці препарати дуже короткий час, адже в організмі людини існують механізми, які протидіють простациклінам та інактивують їх. Тому препарати даної групи мають застосовуватися або постійно (в/в інфузія епопростенолу, п/ш постійне введення тепростенілу за допомогою помп), або дуже часто (кожні 2 години вдихання ілопросту), що є незручним для пацієнта. Як правило, вони використовуються в пацієнтів ІІІ–ІV функціонального класу або за відсутності ефекту від використання комбінації інших груп препаратів. Відміна цієї групи препаратів може супроводжуватися погіршенням стану пацієнтів, що обумовлює необхідність їх прийому пожиттєво або до проведення трансплантації легень. Деякою мірою недоліки застосування простагландинів усуває застосування нового препарату силексипаг, що є агоністом рецепторів І2. Він застосовується per os два рази на добу в максимально толерантній дозі. Проте силексипаг не має більшу, ніж у парентеральних простаноїдів, ефективність і, як правило, застосовується як місток перед переходом на парентеральне введення або ж при побічних явищах парентеральних препаратів.
У судинах легень відмічається дуже високий рівень фосфодіестерази 5–го типу (ФДЕ–5), що стало підгрунтям до застосування блокаторів ФДЕ–5 при ЛАГ. На сьогодні існують докази ефективності силденафілу, варденафілу та тадалафілу [1]. Вони можуть застосовуватися як в монотерапії (у пацієнтів із високим функціональним класом), так і в комбінації з блокаторами ендотелінових рецепторів. Основний механізм дії — це зменшення руйнування цГМФ. У результаті відбуваються вазодилатація та антипроліферація. Окрім того, існує препарат ріоцигуат, що збільшує синтез цГМФ. Теоретично ріоцигуат має деякі переваги перед блокаторами ФДЕ–5, адже при ЛАГ із часом відбувається зменшення синтезу цГМФ, і блокаторам ФДЕ–5 немає на що діяти. Проте практично немає клінічних досліджень, які б продемонстрували переваги в ефективності ріоцигуату над блокаторами ФДЕ–5. А враховуючи високу ціну ріоцигуату, не можна сказати, що він зможе замінити блокатори ФДЕ–5, серед яких є багато генеричних (відповідно дешевших) аналогів.
Одним із найбільш важливих порушень при ЛАГ є збільшення ендотеліну–1 (рис. 4). Його висока концентрація виявляється в легеневих артеріях [2] та циркулюючій крові [3]. Це призводить до вазоконстрикції, гіпертрофії гладком’язових клітин судин, фіброзу та запалення. Концентрація ендотеліну–1 сильно корелює із тяжкістю та прогнозом ЛАГ [2–4]. Синтез ендотеліну–1 відбувається через розщеплення залишкового пептиду попередника, відомого під назвою «препроендотелін–1». Спочатку утворюється великий ендотелін–1, що складається з 38 амінокислот. Потім під впливом ендотелінконвертуючого ферменту утворюється ізоформа, яка складається з 21 амінокислоти. Ендотелін діє на рецептори двох типів — ЕТ–А та ЕТ–В. Саме через ці рецептори медіюються фізіологічні та патологічні ефекти ендотеліну–1. Рецептори ендотеліну–1 типу А в основному знаходяться в гладком’язових клітинах судин, та їх активація призводить до вазоконстрикції. Рецептори ендотеліну–1 типу В також знаходяться в гладком’язових клітинах судин, але їх активація разом із вазоконстрикцією викликає гіперплазію гладкої мускулатури [5, 6]. Окрім того, рецептори ЕТ–В є в клітинах ендотелію, де вони стимулюють вивільнення вазодилататорних та антипроліферативних субстанцій — простациклінів [7]. У фізіологічних умовах домінуючим ефектом стимуляції ЕТ–В рецепторів є вазодилататорна відповідь. Проте при патологічних станах, наприклад ЛАГ, стимуляція ЕТ–В рецепторів призводить до вазоконстрикції та судинної проліферації [8]. Обидва типи ендотелінових рецепторів є відповідальними за фіброз, вазоконстрикцію та запалення, які відбуваються під впливом ендотеліну [9, 10]. Також стимуляція обох типів рецепторів є важливою у виникненні гіпертрофії міокарда та міокардіального фіброзу [7].
Вивчення ключової ролі ендотеліну–1 у патогенезі ЛАГ не могло не привести до створення препаратів, які блокують його рецептори. До таких препаратів відносять бозентан, що з’явився першим, амбризентан, ситаксентан, маситентан. Вони відрізняються селективністю блокади рецепторів ЕТ–А та ЕТ–В (амбризентан блокує переважно рецептори типу А) та їх безпечністю. Компанія «Пфайзер» у 2010 році відкликала ситаксентан із продажу в усіх країнах світу та припинила клінічні дослідження через два випадки смерті пацієнтів із ЛАГ від гострої печінкової недостатності. На сьогодні немає доказів, що селективні блокатори ендотелінових рецепторів більш ефективні, ніж неселективні. У 2018 році в Україні з’явилося декілька аналогів бозентану, які увійшли до національної програми із забезпечення ліками пацієнтів із ЛАГ та ХТЕЛГ. Далі ми розглянемо особливості призначення, дані щодо клінічної ефективності та безпечності застосування саме бозентану.
Історія створення
В 1985 році вперше з’явилося повідомлення про коронарний вазоконстриктор, що можуть виробляти ендотеліальні клітини, а в 1988 році було відкрито ендотелін (Hickey K.A. et al. // Am. J. Physiol. — 1985. — 248. — Р. 550–556; Yanagisawa M. еt al. // Nature. — 1988. — 332. — Р. 411–415). За своєю дією ендотелін схожий на кардіотоксичний яд дуже небезпечної гадюки (Atractaspis engaddensis), яка живе в Ізраїлі. В 1994 році Мартин Клозель, яка очолювала групу фармакологів, які працювали в компанії Hoffman–La–Roche (Basel, Швейцарія), повідомила про відкриття бозентану, що становив собою непептидний антагоніст рецепторів ендотеліну типів А та В. Спочатку дослідники припускали, що вони створили новий препарат для лікування системної артеріальної гіпертензії та серцевої недостатності. Окрім того, вони позиціювали його як препарат від спазму мозкових артерій та для лікування ниркової недостатності. При серцевій недостатності препарат вивчався в дослідженні REACH–1, що було припинено достроково в 1997 році через виявлену токсичність тих доз, які застосовувалися (250 мг двічі на день). Результати цього дослідження повністю не були опубліковані. Окрім того, у дослідженні ENABLE бозентан погіршував перебіг у пацієнтів із серцевою недостатністю та призводив до збільшення затримки рідини в організмі. Дослідження при артеріальній гіпертензії також закінчилися нічим. Проте у 2001 році в США та у 2002 році у Європі бозентан був схвалений для застосування в пацієнтів із ЛАГ [11, 12]. У 2013 році продажі бозентану становили 1,3 млрд доларів США. У 2015 році патент на бозентан закінчився і з’явилися генерики. У 2017 році з’явилося повідомлення про те, що FDA ухвалило застосування нових таблеток бозентану 32 мг для пероральної суспензії в дітей віком від 3 років.
Фармакокінетика, фармакодинаміка та спосіб застосування
Бозентан становить собою речовину з невеликою молекулярною масою 551,61 г/моль, що погано розчиняється у воді [12]. Він є доступним у вигляді таблеток у дозі 62,5 та 125 мг для дорослих та у вигляді таблеток для суспензії в дозі 32 мг для дітей. Бозентан є індуктором ферментів CYP2C9 та CYP3A4, на які також впливають циклоспорин, глібенкламід, симвастатин та варфарин. Сумісне застосування цих препаратів із бозентаном призводить до зниження їх концентрації. При цьому може підвищуватися рівень трансаміназ. Комбіноване використання циклоспорину та глібенкламіду з бозентаном протипоказано. Інгібітори CYP2C9 (флюконазол, аміодарон) та CYP3A4 (кетоконазол, ітраконазол) підвищують концентрацію бозентану. При поєднанні бозентану з оральними контрацептивами знижується концентрація гормонів, через що така контрацепція стає не надійною [13].
Всі блокатори рецепторів ендотеліну призначаються per os. Бозентан вважається неселективним блокатором (ЕТА : ЕТВ 20 : 1), у той же час амбризентан — селективним (ЕТА : ЕТВ 260 : 1) [14]. Як правило, у дорослих не потрібно змінювати початкову дозу бозентану залежно від статті, віку, маси тіла або наявності м’яких порушень функції печінки [15]. Порушення функції нирок також не потребує корекції дози бозентану. Не існує значного клінічного досвіду застосування бозентану в пацієнтів на гемодіалізі. Проте з огляду на дані, що бозентан більшою мірою зв’язується з білками крові, можна припустити, що бозентан не видаляється при гемодіалізі. Біоеквівалентність бозентану становить 50 %. Прийом їжі не впливає на біоеквівалентність. Після всмоктування 98 % зв’язуєтся із альбуміном. Метаболізується бозентан у печінці за участю системи ензимів цитохрому Р450 (CYP3A4 і CYP2C9.18). В результаті утворюються три метаболіти, один з яких — Ro 48–5033 є біологічно активним і відповідає за 20 % дії бозентану. Виводиться бозентан у незмінному вигляді або у вигляді метаболітів через біліарну систему, тільки 3 % виводиться нирками. Період напіввиведення становить 5–8 годин. Через те, що бозентан працює через систему цитохрому Р450, прийому бозентану слід уникати при помірному або тяжкому ураженні печінки або при початковому рівні печінкових трансаміназ більше 3 від верхнього нормального граничного рівня.
Ендотелін є дуже сильним стимулятором клітинної проліферації, фіброзу та запалення. Блокада ендотелінових рецепторів бозентаном призводить до збільшення концентрації ендотеліну у 2–3 рази при гострому прийомі. При хронічному прийомі вплив на концентрацію ендотеліну не такий виражений. Бозентан був протестований на декількох тваринних моделях ЛАГ. При застосуванні моделей щурів із хронічною гіпоксією бозентан не тільки запобігав розвитку ЛГ, але й призводив до оберненого розвитку вже встановленої ЛГ та судинного ремоделювання. Бозентан показав, що він впливає і на судинне ремоделювання, і на гіпертрофію правого шлуночка. Бозентан інгібує пресорні ефекти ендотелінових пептидів на рецептори типу А і В, призводить до зменшення рівня артеріального тиску та периферичного системного опору в різних моделях щурів з артеріальною гіпертензією без виникнення тахіфілаксії. Порівняно із цими патологічними ситуаціями бозентан не викликає достовірного зниження артеріального тиску в нормотензивних тваринних моделях, за виключенням нормотензивних морських свинок. Зниження артеріального тиску, індуковане бозентаном, як правило, не асоціюється з підвищенням частоти серцевих скорочень.
Дози бозентану та режим призначення в дорослих та дітей наведені в табл. 1. Як видно з табл. 1, перші 4 тижні призначається початкова доза, що збільшується на 5–му тижні.
При сумісному застосуванні бозентану з іншими препаратами для лікування ЛГ особливу увагу потрібно приділяти комбінації з блокаторами фосфодіестерази–5. Лікування бозентаном 62,5 мг два рази на добу асоціювалося із збільшенням кліренсу силденафілу у два рази. Збільшення дози бозентану до 125 мг два рази на добу призводить до подальшого збільшення кліренсу силденафілу. Це демонструє дозозалежне зниження концентрації силденафілу в плазмі аж до 55 % на фоні прийому бозентану. Для тадалафілу концентрація знижується на 41,5 %. При цьому силденафіл суттєво збільшує концентрацію бозентану в крові та частоту побічних ефектів.
Клінічна ефективність бозентану при легеневій гіпертензії
Клінічні дослідження продемонстрували ефективність бозентану (покращання якості життя, фізичного стану, функціонального класу та виживання) у пацієнтів із ЛАГ (табл. 2), що дозволило йому стати першим ухваленим та зареєстрованим FDA блокатором ендотелінових рецепторів.
Ефективність у хворих з ідіопатичною ЛАГ. Першим було плацебо–контрольоване пілотне дослідження Channick зі співавторами, в якому 32 пацієнти з ідіопатичною або асоційованою зі склеродермією ЛАГ були рандомізовані для отримання або плацебо, або бозентану (62,5 мг два рази на день протягом 4 тижнів, а потім 125 мг два рази на день) впродовж 12 тижнів [16]. Первинною кінцевою точкою було збільшення дистанції при 6–хвилинному тесті. Вторинними кінцевими точками були зміни гемодинаміки, індексу Borg, функціонального класу, побічні явища, клінічне погіршення. У пацієнтів на бозентані дистанція збільшилась на 70 м у кінці дослідження порівняно з пацієнтами на плацебо, у яких дистанція погіршилась на 6 м. При цьому спостерігалися покращання серцевого індексу та зниження опору легеневих судин, покращання функціонального класу Всесвітньої організації охорони здоров’я (ВООЗ), індексу Borg. Тільки 3 пацієнти були виключені з дослідження, і всі вони були в групі плацебо. При продовженні лікування до 12 місяців позитивний вплив бозентану зберігався. Пізніше в дослідженні Rubin ефективність бозентану майже за тими самими параметрами була підтверджена для більшої кількості хворих із ЛАГ [17]. Окрім того, у дослідженні Galie покращувалися ехокардіографічні параметри (серцевий індекс, функція правого шлуночка, розмір правого шлуночка, розмір перикардіальної інфузії) через 16 тижнів лікування бозентаном [18]. Діастолічна функція лівого шлуночка покращилася через зменшення компресії лівого шлуночка дилатованим та гіпертрофованим правим шлуночком, венозний відтік покращився вторинно до зменшення тиску в правому передсерді. До усіх цих досліджень включалися пацієнти з функціональними класами ІІІ та ІV. Єдиним дослідженням щодо виживання було спостереження McLaughlin, в якому порівнювали виживання хворих на бозентані з історичними даними реєстру Національного інституту здоров’я (рис. 5) [19].
В цьому спостереженні брали участь тільки пацієнти ІІІ та ІV функціонального класу. Бозентан використовувався як препарат першої лінії. Після 12 та 24 місяців спостереження 85 та 70 % пацієнтів залишалися на бозентані. В інших 7 % до бозентану додавали іншу терапію. Дворічне виживання становило 89 % у тих, хто приймав бозентан, та 57 % в групі контролю. У дослідженні А. Keogh зі співавторами бозентан покращував якість життя [20]. В іншому спостереженні Sitbon ефективність бозентану порівнювали з групою внутрішньовенного введення епопростенолу. Після корекції за ступенем тяжкості не було знайдено відмінностей у дворічному виживанні між групами лікування, що є дуже важливим, адже епопростенол на той час був єдиним препаратом, який покращує виживання в пацієнтів із ЛАГ [21]. У великому багатоцентровому дослідженні вивчали виживання 103 пацієнтів III та IV функціонального класу з ідіопатичною ЛАГ на бозентані. Тривалість спостереження становила 24 ± 15 місяців. Виживання становило 92, 89 та 79 % на етапах 1, 2 та 3 роки відповідно. При цьому прогнозоване виживання, за даними реєстру, — 71, 61 та 51 % відповідно [22]. В цьому реєстрі внутрішньовенний епопростенол додавали 30 пацієнтам, вентавіс — 6 пацієнтам. Тривалість спостереження становила 12 ± 10 місяців. Причинами додавання іншої терапії були зменшення дистанції 6–хвилинного тесту або погіршення серцевого індексу.
Ефективність бозентану при інших формах ЛАГ. Відносно багато досліджень ефективності бозентану було проведено за участю пацієнтів із системними захворюваннями сполучної тканини, а особливо із системним склерозом (склеродермією). Відомо, що близько 25 % пацієнтів із лімітованою шкірною формою склеродермії мають ЛАГ [23]. Рідше вона зустрічається при вовчаку, змішаній формі системного захворювання сполучної тканини та ревматоїдному артриті. Як правило, специфічне лікування ЛАГ при системних захворюваннях не дає таких вражаючих результатів, як лікування ідіопатичної ЛАГ, що, можливо, пов’язано з декількома факторами: різним патогенезом, більш старшим віком хворих, із тим, що ЛГ виникає на тлі довготривалої хвороби. Згідно з діючими керівництвами всі пацієнти зі склеродермією мають бути скриновані на наявність ЛГ та порушення функції легень [24].
У два рандомізовані пілотні плацебо–контрольовані дослідження було включено 66 пацієнтів із ЛАГ, асоційованою із захворюваннями сполучної тканини, ІІІ та ІV функціонального класу [16, 17]. 44 пацієнти отримували бозентан, та 22 пацієнти — плацебо. Група активного лікування відрізнялася більшою тяжкістю хвороби, меншою дистанцією при 6–хвилинному тесті та більшим ОЛС. Під впливом бозентану дистанція 6–хвилинного тесту збільшилася на 22 метри, що було недостовірно порівняно з плацебо. Але час до клінічного погіршення значно і достовірно збільшився при прийомі бозентану, що може свідчити про сповільнення хвороби. У подальшому 64 пацієнти із 66 продовжили участь вже у відкритому дослідженні. 40 із цих пацієнтів залишалися на бозентані, один отримував простаноїди в комбінації з бозентаном, та 23 пацієнти припинили прийом бозентану. Середня тривалість терапії бозентаном становила 1,8 ± 0,8 року. Виживання становило 85,9 % на етапі один рік та 73,4 % — два роки серед 40 пацієнтів на бозентані. У 25 % покращився функціональний клас. В іншому спостереженні серед 45 пацієнтів на бозентані, яких спостерігали в рутинній практиці, виживання становило 81 % на етапі один рік та 71 % — два роки [25]. Подібні результати були отримані і в дослідженні Girgis зі співавторами [26]. Окрім того, бозентан ревматологи застосовують для запобігання виникненню виразок на кінцівках, що зафіксовано в інструкції до препарату.
Відомо, що ВІЛ–1 глікопротеїн 120 стимулює продукцію ендотеліну. Рівень ендотеліну значно збільшується в пацієнтів із судинними ускладненнями ВІЛ–інфекції. Вважається, що це підвищення рівня ендотеліну є однією з основних причин виникнення ЛАГ при ВІЛ–інфекції. Sitbon зі співавторами описали досвід застосування бозентану протягом 16 тижнів у 16 пацієнтів із ВІЛ–інфекцією [27]. Дистанція 6–хвилинного тесту достовірно збільшилася на 91 метр, покращилися функціональний клас та показники гемодинаміки, ехокардіографії та якість життя. При цьому жоден пацієнт не помер та не спостерігалося взаємодії бозентану з антиретровірусною терапією.
Легенева гіпертензія при вроджених вадах серця розвивається за наявності системно–легеневого шунта. При цьому може бути шунт зліва направо та зправа наліво (синдром Ейзенменгера). В першому випадку можливим є хірургічне лікування, якщо ЛСО не перевищує 4 WU/m2 [1]. При синдромі Ейзенменгера та ЛСО більше 8 WU/m2 оперативне втручання абсолютно протипоказане. Призначення вазодилатуючої терапії може призводити до зниження системного опору та теоретично до збільшення шунтування. Але дослідження N. Galie зі співавторами показало, що при синдромі Ейзенменгера 16–тижнева терапія бозентаном не погіршувала сатурацію, збільшувала дистанцію 6–хвилинного тесту на 53,1 м та зменшувала ЛСО та середній тиск у легеневій артерії [28]. В іншому дослідженні протягом 15 ± 10 місяців у 57 % пацієнтів спостерігалося достовірне покращання функціонального класу та середньої сатурації в спокої — з 81 до 84 %, але не дистанції 6–хвилинного тесту [29].
У 2013 році опубліковано дані обсерваційного спостереження за хворими із синдромами Дауна та Ейзенменгера [30]. Всі пацієнти належали до ІІІ функціонального класу та отримували бозентан. Середній вік становив 29,6 ± 11,2 року (57 % були чоловіками). Початкова доза бозентану 62,5 мг двічі на день збільшувалася до 125 мг двічі на день на 5–му тижні лікування. Через 52,2 ± 3,9 місяця спостереження дистанція 6–хвилинного тесту збільшилася з 199,6 ± 69,1 до 303,7 ± 99,9 м (Р < 0,05) та сатурація в кінці тесту підвищилася з 61,6 ± 7,6 до 74,7 ± 6,2 % (P < 0,05). За даними ехокардіографії, час пришвидшення (acceleration time) підвищився з 62,9 ± 11,6 до 83,0 ± 9,6 м/с (P = 0,0156), а співвідношення час пришвидшення/час вигнання — з 0,24 ± 0,04 до 0,30 ± 0,02 (P = 0,0156). Автори зробили висновок, що бозентан значно покращує толерантність до фізичного навантаження та сатурацію при навантаженні в дорослих хворих із синдромами Дауна та Ейзенменгера. Тобто наявність синдрому Дауна не впливає на ефективність перорального прийому бозентану.
В цьому ж, 2018, році були опубліковані дані ще одного метааналізу оцінки ефективності бозентану в пацієнтів із вродженими вадами серця [31]. Загалом проаналізовані дані 17 досліджень, 3 із них були педіатричними, до яких було залучено 456 пацієнтів із вродженими вадами серця. 91,7 % лікувалися бозентаном строком не менше ніж 6 місяців. Терапія супроводжувалася збільшенням дистанції 6–хвилинного тесту, покращанням функціонального класу ВООЗ, зменшенням індексу Borg та збільшенням сатурації в спокої. Покращувалися також гемодинамічні показники: зменшувався середній тиск у ЛА та ЛСО. Проте було недостатньо даних для оцінки впливу бозентану на частоту серйозних ускладнень.
Як вже вказувалося вище, основним методом лікування ХТЕЛГ є хірургічний, проте існує висока частка пацієнтів, яких визнають неоперабельними (через супутні стани), або ж після проведення операції ЛГ залишається через наявність дистального ураження судин. В різних дослідженнях із різним періодом спостереження (до 3 років) лікування бозентаном асоціювалося з покращанням функціонального класу ВООЗ, фізичних можливостей та кардіопульмональної гемодинаміки [31–35]. Musk зі співавторами у відкритому дослідженні виявили, що лікування бозентаном при ХТЕЛГ покращує показники гемодинаміки та функціональні можливості так само, як і в пацієнтів з ідіопатичною ЛАГ [36]. В багатоцентровому дослідженні BENEFIT, в якому порівнювали бозентан із плацебо протягом 4 місяців, терапія бозентаном знижувала ЛСО, рівень натрійуретичного пептиду та продовжувала час до погіршення стану, але не спостерігалося різниці порівняно з плацебо у величині дистанції 6–хвилинного тесту [37]. В останньому метааналізі (включено дані 10 рандомізованих досліджень та 1185 пацієнтів) було проведено порівняння ефективності та безпечності бозентану в пацієнтів із ЛАГ та ХТЕЛГ [38]. Виявлено, що в пацієнтів із ЛАГ бозентан збільшував дистанцію 6–хвилинного тесту на 35,7 м, зменшував середній тиск у ЛА на 5,7 мм рт.ст., збільшував СІ на 0,4 л/хв/м2, зменшував ЛСО на 305 дин • с/см–5, запобігав погіршенню функціонального класу порівняно з плацебо. В той же час у пацієнтів із ХТЕЛГ на бозентані спостерігалися лише збільшення СІ на 0,3 л/хв/м2 та зменшення ЛСО на 176 дин • с/см–5. В обох групах не відмічалося достовірного впливу на смертність та частоту побічних подій бозентану та плацебо, за виключенням підвищення ризику змін печінкових ферментів на фоні бозентану в обох групах хворих на ЛГ. Таким чином, бозентан виявився менш ефективним при ХТЕЛГ, ніж при ЛАГ, і наразі в інструкції до бозентану немає показань до лікування ХТЕЛГ.
Бозентан досліджували в педіатричній практиці. Описано три різні дозові режими залежно від маси тіла та використання епопростенолу [39]. Виявлено, що фармакокінетика бозентану та гемодинамічні зміни в дітей дуже схожі з такими в дорослих. Rosenzweig зі співавторами спостерігали 86 дітей з ідіопатичною або асоційованою з вродженими вадами серця або захворюваннями сполучної тканини ЛАГ [40]. Строк спостереження становив 14 місяців. У 46 % пацієнтів функціональний клас ВООЗ покращився та спостерігалося достовірне зниження середнього тиску в ЛА та ЛСО. Виживання на етапах один та два роки становило 98 та 91 % відповідно. При цьому бозентан був безпечним та добре переносився дітьми.
У 2017 році було опубліковано результати рандомізованого дослідження, в якому вивчали фармакокінетику бозентану в дітей із ЛАГ віком від 3 місяців до 12 років залежно від режиму прийому — 2 мг/кг
два рази на день та 2 мг/кг три рази на день [41]. Виявилося, що фармакокінетика не відрізнялася, а тому не має сенсу призначати препарат три рази на день. Описаний випадок успішного застосування бозентану для лікування немовля, яке народилося недоношеним із масою тіла 912 г [42]. У зв’язку з недоношеністю в дитини відмічалися ознаки гіпоплазії легень, що асоціюється з ризиком виникнення персистуючої ЛГ немовлят. Застосовували стандартну терапію (дистресову терапію, оксид азоту, силденафіл), з 23–го дня додали бозентан (початкова доза — 1 мг/кг кожні 12 годин, потім 2 мг/кг кожні 12 годин). Стан дитини значно покращився.
Безпечність та переносимість бозентану
Основними побічними ефектами бозентану є порушення функції печінки та підвищення печінкових трансаміназ. Чому вони виникають, до кінця невідомо, але вважається, що це пов’язано з втручанням бозентану в екскрецію жовчі. Частота підвищення трансаміназ, більша ніж у 3 рази від верхньої межі норми, становила 9,7 % у великому плацебо–контрольованому дослідженні (цільові дози — 125 або 250 мг два рази на добу), але при цьому на дозі 125 мг два рази на день вона становила лише 4 % [17] та 14,9 % — в більш тривалому обсерваційному спостереженні [19]. Постмаркетингові опитування з використанням інтернет–ресурсу показали, що серед 4994 пацієнтів з ідіопатичною ЛАГ, які були включені в дослідження в період із травня 2002 р. по листопад 2004 р. і приймали терапію бозентаном 35 тижнів, частота підвищення печінкових ферментів становила 8,4 % [43]. Це підвищення було оберненим після зупинки прийому бозентану. Як правило, ферменти підвищуються в перші 6 тижнів лікування, але це може відбутися на інших етапах лікування. Саме тому моніторувати функцію печінки потрібно при кожній зміні дози та щомісячно. Тактика при підвищенні трансаміназ наведена в табл. 3.
Окрім підвищення рівня трансаміназ, лікування бозентаном може асоціюватися із зниженням гемоглобіну та гематокриту до 10 %. Тому рекомендованим є контроль рівня гемоглобіну після першого місяця лікування і кожні три місяці. Причина зниження гемоглобіну до кінця не відома, але можливим поясненням цього може бути затримка рідини на більше розведення крові, що пов’язано з блокадою ЕТВ–рецепторів, які є в гломерулах нирок.
Бозентан має тератогенний ефект та протипоказаний при вагітності. Не рекомендований він також у період лактації. Іншими побічними ефектами є головний біль, почервоніння лиця та синкопальні стани, що пов’язані із системною вазодилатацією.
Не дуже багато досліджень щодо синдрому відміни. Відкрите австралійське дослідження показало, що 2 % пацієнтів померли після припинення прийому бозентану [20]. Це були пацієнти, у яких спостерігалося погіршення стану на фоні терапії. Тому наразі є невідомим, чи пов’язані смерті з більш тяжким прогресуючим перебігом самої хвороби або з відміною бозентану.
Можливості застосування бозентану в комбінованій терапії ЛАГ
Згідно з останніми рекомендаціями [1] з діагностики та лікування легеневої гіпертензії, комбінована терапія повинна застосовуватися більш широко, тому що вона дозволяє діяти на декілька шляхів (простацикліновий, ендотеліновий, через оксид азоту). Все більше накопичуються дані в клінічних дослідженнях, в яких відмічаються переваги комбінованої терапії над монотерапією. Так, у метааналізі за участю 858 пацієнтів комбінована терапія порівняно з контрольною зменшувала ризик клінічного погіршення стану на 52 %, достовірно збільшувала на 22 м дистанцію при 6–хвилинному тесті та знижувала середні показники тиску в легеневій артерії, правому передсерді та ЛСО [44]. Частота виникнення серйозних побічних явищ була однаковою в групах, та за частотою загальної смерті різниці виявлено не було, що автори пояснювали малим об’ємом статистичної вибірки.
Комбінована терапія може застосовуватися або в послідовному режимі, або одразу як стартова. При послідовному режимі спочатку призначають один препарат, а при недостатній його ефективності додають інший (табл. 4 та 5). Як правило, критеріями ефективності є досягнення І–ІІ функціонального класу, нормалізація ХОК та плазмового рівня натрій–уретичного пептиду. При цьому значно покращується прогноз. Підгрунтям для стартової комбінованої терапії є те, що пацієнти з ЛАГ мають високу смертність і немає часу проводити послідовну терапію. У дослідженні BREATHE–2 вперше порівнювали ефективність стартової комбінованої терапії «бозентан + епопростенол» із монотерапією епопростенолом [45], але суттєвої різниці між групами отримано не було. Пізніше в іншому спостереженні порівняли дані 23 пацієнтів, які раніше не лікувалися та почали отримувати комбінацію епопростенолу з бозентаном, із даними ретроспективної групи, яка отримувала епопростенол [46]. Виявилося, що в групі комбінації достовірно знижувався ЛСО, але різниці у виживанні виявлено не було. Пілотне дослідження початкової потрійної терапії в більш тяжкої категорії хворих (n = 19) продемонструвало довготривалу користь [47]. У дослідженні AMBITION комбінація амбризентану та тадалафілу порівняно з монотерапією тільки амбризентаном або тадалафілом у пацієнтів із вперше виявленою ЛАГ ІІ–ІІІ функціонального класу ВООЗ знижувала на 50 % частоту подій, покращувала толерантність до фізичного навантаження та зменшувала рівень натрійуретичного пептиду [48]. Рекомендації щодо застосування стартової та послідовної комбінованої терапії наведено в табл. 4, 5. Як видно, бозентан може широко застосовуватися в комбінованому лікуванні ЛАГ.
Особливу увагу слід звернути на комбінацію бозентану із силденафілом, адже ці препарати зручні для використання (прийом per os) та зареєстровані на відміну від інших в Україні. У дослідженні Hoeper зі співавторами описані 9 пацієнтів, у яких на фоні терапії бозентаном спостерігалося спочатку клінічне покращання, а потім зниження толерантності до фізичного навантаження [49]. Їм через 11 місяців терапії бозентаном додатково призначали силденафіл. Через три місяці лікування дистанція 6–хвилинного тесту в середньому збільшилася на 115 м, і це покращання зберігалося через 9 місяців лікування. У маленькому німецькому дослідженні, в яке було залучено різних пацієнтів із ЛАГ, в тому числі ідіопатичною та асоційованою з вродженими вадами серця, продемонстровані покращання толерантності до фізичного навантаження та зниження середнього тиску в легеневій артерії на фоні комбінації силденафілу та бозентану [50]. При цьому комбінація добре переносилася хворими, але один пацієнт помер раптово через не вказані в статті причини. Як вказувалося вище, бозентан може взаємодіяти із силденафілом — збільшується концентрація бозентану і зменшується концентрація силденафілу. У дослідженні Hoeper зі співавторами не спостерігалося збільшення частоти підвищення рівня трансаміназ на фоні комбінації силденафілу та бозентану порівняно з монотерапією бозентаном [51].
McLaughlin зі співавторами досліджували комбінацію бозентану з ілопростом (ця комбінація є можливою в Україні) в багатоцентровому рандомізованому подвійному сліпому дослідженні [52]. Включалися хворі з ЛАГ (група 1) та функціональним класом ІІІ, які приймали інгаляційно ілопрост (5 мкг) або плацебо на фоні стабільної монотерапії бозентаном протягом 12 тижнів. Комбіноване лікування супроводжувалося збільшенням дистанції при 6–хвилинному тесті на 26 м, значним покращанням функціонального класу та пролонгацією часу до погіршення стану. При цьому лікування було безпечним для пацієнтів.
Висновки
Таким чином, неселективний (подвійний) блокатор ендотелінових рецепторів бозентан є відносно безпечним та ефективним препаратом для лікування ЛАГ. Його застосування супроводжується покращанням стану пацієнтів (функціонального класу), толерантності до фізичного навантаження, якості життя та виживання. Основним побічним ефектом є підвищення рівня печінкових ферментів, який потрібно контролювати, і залежно від змін проводять корекцію прийому та дози бозентану. У зв’язку з тим, що бозентан впливає на систему цитохрому Р450, пацієнти мають перебувати в тісному контакті з лікарем та сповіщати його при ініціації прийому інших пероральних препаратів, а особливо контрацептивів та антибіотиків. Бозентан має докази ефективності при майже всіх формах ЛАГ як у монотерапії, так і в комбінації з іншими препаратами для лікування ЛАГ.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
1. Galiè N., Humbert M., Vachiery J. et al. 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension: The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS): Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT) // European Heart Journal. — 2015. — 37. — Р. 67–119. https://doi.org/10.1093/eurheartj/ehv317
2. Giaid A., Yanagisawa M., Langleben D. et al. Expression of Endothelin–1 in the lungs of patients with pulmonary hypertension // N. Engl. J. Med. — 1993. — 328. — Р. 1732–9.
3. Humbert M., Morrell N.W., Archer S.L. et al. Cellular and molecular pathobiology of pulmonary arterial hypertension // J. Am. Coll. Cardiol. — 2004. — 43. — Р. 13–24.
4. Galie N., Grigioni F., Bacchi–Rggianin K. et al. Relation of endothelin–1 to survival in patients with primary pulmonary hypertension // Eur. J. Clin. Invest. — 1996. — 26. — Р. 273.
5. Clozel M., Gray G.A., Breu V. et al. The endothelin ETB receptor mediates both vasodilation and vasoconstriction in vivo // Biochem. Biophys. Res. Commun. — 1992. — 186. — Р. 867–73.
6. Neylon C.B., Avdonin P.V., Dilley R.J. et al. Different electrical responses to vasoactive agonists in morphologically distinct smooth musclecell types // Circ. Res. — 1994. — 75. — Р. 733–41.
7. Levin E.R. Endothelins // N. Engl. J. Med. — 1995. — 333. — Р. 356–63.
8. Benigni A., Ramuzzi G. Endothelin antagonists // Lancet. — 1999. — 353. — Р. 133–8.
9. Filep J.G., Fournier A., Foldes–Filep E. Acute pro–inflammatory actions of endothelin–1 in the guinea pig lung: Involvement of ETA and ETB receptors // Br. J. Pharmacol. — 1995. — 115. — Р. 227–36.
10. Katwa L.C., Guarda E., Weber K.T. Endothelin receptors in cultured adult rat cardiac fibroblasts // Cardiovasc. Res. — 1993. — 27. — Р. 2125–9.
11. US Bosentan label" (PDF). FDA. October 2016. Retrieved 6 August 2017. For label updates see FDA index page for NDA 021290 "Tracleer (bosentan) 62.5 mg and 125 mg film–coated tablets". UK Electronic Medicines Compendium. May 2017. Retrieved: 6 August 2017.
12. Tracleer (bosentan) [product information]. http://www.rxlist.com/cgi/generic3/tracleer.htm. Accessed: June 17 2012.
13. Giersbergen V.P.L., Halabi A., Dingemanse J. Pharmacokinetic interaction between bosentan and the oral contraceptives norethisterone and ethinyl estradiol // Int. J. Clin. Pharmacol. Ther. — 2006. — 44(3). — Р. 113–118.
14. Dingemanse J., Giersbergen V.P.L. Clinical pharmacology of bosentan, a dual endothelin receptor antagonist // Clin. Pharmacokinet. — 2004. — 43(15). — Р. 1089–1115.
15. Giersbergen V.P.L., Popescu G., Bodin F., Dingemanse J. Influence of mild liver impairment on the pharmacokinetics and metabolism of bosentan, a dual endothelin receptor antagonist // J. Clin. Pharmacol. — 2003. — 43(1). — Р. 15–22.
16. Channick R.N., Simonneau G., Sitbon O. et al. Effects of the dual endothelin–receptor antagonist bosentan in patients with pulmonary hypertension: a randomised placebo–controlled study // Lancet. — 2001. — 358. — Р. 1119–23.
17. Galie N., Hinderliter A.L., Torbicki A. et al. Effects of the oral endothelin–receptor antagonist Bosentan on echocardiographic and Doppler measures in patients with pulmonary arterial hypertension // J. Am. Coll. Cardiol. — 2003. — 41. — Р. 1380–6.
18. Rubin L.J., Badesch D.B., Barst R.J. et al. Bosentan therapy for pulmonary arterial hypertension // N. Engl. J. Med. — 2002. — 346. — Р. 896–903.
19. McLaughlin V.V., Sitbon O., Badesch D.B. et al. Survival with firstline bosentan in patients with primary pulmonary hypertension // Eur. Respir. J. — 2005. — 25. — Р. 244–9.
20. Keogh A.M., McNeil K.D., Wlodarczyk J. et al. Quality of life in pulmonary arterial hypertension: improved and maintained with bosentan // J. Heart Lung. Transplantation. — 2007. — 26. — Р. 181–7.
21. Barst R.J., Rubin L.J., Long W.A. et al. A comparison of continuous intravenous epoprostenol (prostacyclin) with conventional therapy for primary pulmonary hypertension. The Primary Pulmonary Hypertension Study Group // N. Engl. J. Med. — 1996. — 334. — Р. 296–302.
22. D’Alonzo G.E., Barst R.J., Ayres S.M. et al. Survival in patients with primary pulmonary hypertension. Results from a national prospective registry // Ann. Intern. Med. — 1991. — 115. — Р. 343–9.
23. Hoeper M.M. Pulmonary hypertension in collagen vascular disease // Eur. Respir. J. — 2002. — 19. — Р. 571–6.
24. Black C. Pulmonary arterial hypertension: are we doing enough to identify systemic sclerosis patients at high risk of this rare condition? // Rheumatology (Oxford). — 2005. — 44. — Р. 141–2.
25. Williams M.H., Das C., Handler C.E. et al. Systemic sclerosis associated pulmonary hypertension: improved survival in the current era // Heart. — 2006. — 92. — Р. 926–32.
26. Girgis R.E., Mathai S.C., Krishnan J.A. et al. Long–Term outcome of Bosentan treatment in idiopathic pulmonary arterial hypertension and pulmonary arterial hypertension associated with the scleroderma spectrum of diseases // J. Heart Lung Transplantation. — 2005. — 24. — Р. 1626–31.
27. Sitbon O., Gressin V., Speich R. et al. Bosentan in pulmonary arterial hypertension associated with HIV infection // Am. J. Respir. Crit. Care Med. — 2004. — 170. — Р. 1212–17.
28. Galie N., Beghetti M., Gatzoulis M.A., et al. Bosentan therapy in patients with Eisenmenger syndrome // Circulation. — 2006. — 114. — 48–54.
29. Kotlyar E., Sy R., Keogh A.M. Bosentan for the treatment of pulmonary arterial hypertension associated with congenital cardiac disease // Cardiol. Young. — 2006. — 16. — Р. 268–74.
30. Crepazet R., Romeo C., Montanaro D., De Santis S. Long–term results of treatment with bosentan in adult Eisenmenger’s syndrome patients with Down’s syndrome related to congenital heart disease // BMC Cardiovascular Disorders. — 2013. — 13. — Р. 74.
31. Hong–Yu Kuang, Yu–Hao Wu, Qi–Jian Yi, Jie Tian, Chun Wu, We Nian Shou, Tie–Wei Lu. The efficiency of endothelin receptor antagonist bosentan for pulmonary arterial hypertension associated with congenital heart disease A systematic review and meta–analysis // Medicine. — 2018. — 97. — 10(e0075).
32. Hughes R., George P., Parameshwar J. et al. Bosentan in inoperable chronic thromboembolic pulmonary hypertension // Thorax. — 2005. — 60. — Р. 707.
33. Hughes R.J., Jais X., Bonderman D. et al. Bosentan in inoperable chronic thromboembolic pulmonary hypertension: efficacy at 1 year // Eur. Respir. J. — 2006. — 28. — Р. 138–43.
34. Hoeper M.M., Kramm T., Wilkens H. et al. Bosentan Therapy for Inoperable Chronic Thromboembolic Pulmonary Hypertension // Chest. — 2005. — 128. — Р. 2363–7.
35. Bonderman D., Nowotny R., Skoro–Sajer N. et al. Bosentan Therapy for Inoperable Chronic Thromboembolic Pulmonary Hypertension // Chest. — 2005. — 128. — Р. 2599–603.
36. Musk M., Chambers D., Lawrence S. et al. Bosentan improves WHO functional class, exercise capacity and RV size in inoperable chronic thromboembolic pulmonary hypertension (CTEPH) // J. Heart Lung Transplantation. — 2006. — 25. — Р. 77.
37. Jais X., Ghofrani A., Hoeper M.M. et al. Bosentan for inoperable chronic thromboembolic pulmonary hypertension (CTEPH): a randomized, placebo–controlled trial // Am. J. Resp. Crit. Care Med. — 2007. — 173. — A896.
38. Chen X., Zhai Z., Huang Ke, Wanmu Xie Jun, Wan Chen Wang. Bosentan therapy for pulmonary arterial hypertension and chronic thromboembolic pulmonary hypertension: A systemic review and meta‐analysis // Clinical Respiratory Journal. — 2018. https://doi.org/10.1111/crj.12774
39. Barst R.J., Ivy D., Dingemanse J. et al. Pharmacokinetics, safety, and efficacy of bosentan in pediatric patients with pulmonary arterial hypertension // Clin. Pharmacol. Ther. — 2003. — 73. — Р. 372–82.
40. Rosenzweig E.B., Ivy D.D., Wilditz A. et al. Effects of long–term bosentan in children with pulmonary arterial hypertension // J. Am. Coll. Cardiol. — 2005. — 46. — Р. 697–704.
41. Berger R., Gehin M., Beghetti M., Dunbar Ivy, Andjela Kusic–Pajic A., Peter Cornelisse P., Grill S., Bonnet D. and the FUTURE–3 investigators. A bosentan pharmacokinetic study to investigate dosing regimens in paediatric patients with pulmonary arterial hypertension: FUTURE–3 // British Journal of Clinical Pharmacology. — 2017. — 83. — Р. 1734–1744.
42. Tabar M.L., Deshpande G., Xiao J. The use of bosentan in persistent pulmonary hypertension // Journal of Paediatrics and Child Health. — 2018. — 54(Suppl. 1). — Р. 3–128.
43. Gabbay E., Fraser J., McNeil K. Review of bosentan in the management of pulmonary arterial hypertension // Vascular Health and Risk Managemen. — 2007. — 3(6). — Р. 887–890.
44. Galiè N., Palazzini M., Manes A. Pulmonary arterial hypertension: from the kingdom of the near–dead to multiple clinical trial meta–analyses // Eur. Heart J. — 2010. — 31. — Р. 2080–2086.
45. Humbert M., Barst R.J., Robbins I.M. et al. Combination of bosentan with epoprostenol in pulmonary arterial hypertension: BREATHE–2 // Eur. Respir. J. — 2004. — 24. — Р. 353–359.
46. Kemp K., Savale L., O’Callaghan D.S. et al. Usefulness of first–line combination therapy with epoprostenol and bosentan in pulmonary arterial hypertension: an observational study // J. Heart Lung Transplant. — 2012. — 31. — Р. 150–158.
47. Sitbon O., Jaïs X., Savale L. et al. Upfront triple combination therapy in pulmonary arterial hypertension: a pilot study // Eur. Respir. J. — 2014. — 43. — Р. 1691–1697.
48. Galiè N., Barbera J.A., Frost A. et al. Initial Use of Ambrisentan plus Tadalafil in Pulmonary Arterial Hypertension // New Engl. J. Med. — 2015. — 379. — Р. 834–844.
49. Hoeper M.M., Faulenbach C., Golpon H. et al. Combination therapy with bosentan and sildenafil in idiopathic pulmonary arterial hypertension // Eur. Respir. J. — 2004. — 24. — Р. 1007–10.
50. Lunze K., Gilbert N., Mebus S. et al. First experience with an oral combination therapy using bosentan and sildenafil for pulmonary arterial hypertension // Eur. J. Clin. Invest. — 2006. — 36. — 3. — Р. 32–8.
51. Hoeper M.M., Kiely D.G., Carlsen J. et al. Safety profile of pulmonary arterial hypertension patients treated with bosentan and sildenafil: results from the European surveillance program // Am. J. Resp. Crit. Care Med. — 2005. — 169. — Р. 135.
52. McLaughlin V.V., Oudiz R.J., Frost A. et al. Randomized study of adding inhaled iloprost to existing bosentan in pulmonary arterial hypertension // Am. J. Respir. Crit. Care Med. — 2006. — 174. — Р. 1257–63.

/51-1.jpg)
/51-2.jpg)
/51-3.jpg)
/53-1.jpg)
/53-2.jpg)
/52-1.jpg)
/56-1.jpg)
/56-2.jpg)
/57-1.jpg)