Журнал «» №6 (62), 2018
Вернуться к номеру
Старіння судин та старіння мозку: вплив серцево-судинної терапії на ризик деменції (лекція)
Авторы: Сіренко Ю.М.
ДУ «ННЦ «Інститут кардіології ім. М.Д. Стражеска НАМН України», м. Київ, Україна
Рубрики: Кардиология
Разделы: Медицинские форумы
Версия для печати
Матеріали Міжнародного симпозіуму, організованого ГО «Всеукраїнська антигіпертензивна асоціація» та Міжнародним товариством здоров’я та старіння судин «Оцінка функції та структури артерій — клінічні аспекти» (м. Одеса, 30–31 травня — 1 червня 2018 року)
Вступ. Визначення понять
Деменція — медична, соціальна проблема, до якої прикута увага численних дослідників, та, незважаючи на певний прогрес у нашому розумінні механізмів виникнення і розвитку, до сьогодні залишається більшою мірою без адекватної відповіді у вигляді ефективних засобів запобігання та лікування. За визначенням, деменція (від лат. dementia — безумство) — синдром стійкого порушення когнітивних функцій у результаті органічного ураження мозку.
Деменція виникає в результаті ураження головного мозку різними захворюваннями і являє собою загальний стан, особливо в найстаріших вікових групах. Діагностика базується на виявленні розладів пам’яті, порушень в інших когнітивних галузях, порушень абстрактного мислення, втраті критики, прогресуючому характері захворювання з розвитком значних порушень функціонального статусу пацієнта. Деменція пов’язана із значною захворюваністю та смертністю, а також значними суспільними витратами на догляд і лікування таких пацієнтів. Деменція є результатом сукупного тягаря декількох патологій мозку, включаючи судинні захворювання. Основні етіологічні причини деменції наведені на рис. 1 у вигляді так званої «парасольки» — термін, що використовується в спеціальній літературі для описання груп захворювань, які є причиною порушення когнітивних функцій.
Дегенеративний тип (хвороба Альцгеймера) і судинна патологія мають взаємодоповнюючі та синергетичні зв’язки для розвитку і прогресування когнітивних розладів. Популяційні нейропатологічні дослідження показують, що мозок осіб похилого віку, які мають деменцію або її не мають, часто містить зміни, притаманні як судинним (підкоркові пошкодження білої речовини, інфаркти, мікрогеморагії), так і нейродегенеративним захворюванням (амілоїдні бляшки, нейрофібрилярні сплетіння, тільця Леві та ін.), і що наявність обох видів патології впливає на ступінь вираженості деменції [46]. У той же час у літературі наведено достатньо доказів, що наявність протягом життя серцево–судинних захворювань тісно пов’язана з розвитком деменції з часом. Протягом останніх років з’явилися нові дані щодо зв’язку серцево–судинних факторів ризику з ризиком виникнення слабоумства. Але ключовим у цьому процесі залишається питання, чи може лікування/профілактика серцево–судинних захворювань чи факторів серцево–судинного ризику знизити ризик розвитку та прогресування деменції?
У спільному документі (твердженні — statement) Американської асоціації серця і Американської асоціації інсульту 2011 року наведено такі діагностичні критерії для визначення когнітивних порушень судинного походження: одночасно наявні розлади когнітивної функції і візуалізовані ознаки серцево–судинних захворювань [10]. Визначають декілька варіантів захворювання: варіант А — існує чіткий зв’язок у часі між судинною подією (наприклад, клінічними проявами інсульту) та початком когнітивного дефіциту або варіант Б — існує чіткий зв’язок тяжкості і шаблону когнітивних розладів та наявності дифузної, субкортикальної серцево–судинної патології (наприклад, церебральної автосомно–домінантної артеріопатії з підкірковими інфарктами та лейкоенцефалопатією, синдрому CADASIL — Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy). У випадках, коли немає історії поступово прогресуючого когнітивного дефіциту до або після інсульту, то це свідчить про наявність нейродегенеративного розладу несудинного походження [10, 27].
Вплив атеросклерозу та артеріальної гіпертензії на розвиток деменції
Цілком зрозуміло, що атеросклероз мозкових судин може викликати когнітивні порушення і деменцію через хронічну гіперперфузію певних ділянок мозку внаслідок оклюзійного або критичного стенотичного ураження магістральних артерій. При атеросклеротичному ураженні аорти, сонних артерій та їх гілок не слід виключати процеси артеріальної (мікро–)емболії, що так само порушує або погіршує уже знижений мозковий кровотік. Не менш важливими елементами ураження мозку є локальна активація оксидативного стресу та порушення авторегуляції мозкового кровотоку й нормального стану гематоенцефалічного бар’єра.
У фінському дослідженні CAIDE (Finnish study Cardiovascular Risk Factors Aging and Dementia — Серцево–судинні фактори ризику старіння і деменції) підвищений вміст загального холестерину в сироватці в осіб середнього віку достовірно асоціювався з когнітивними порушеннями через 21 рік спостереження [48]. При цьому ця асоціація була ослаблена після врахування впливу терапії статинами. В іншому дослідженні цієї групи, що базувалося на ретроспективному аналізі медичної документації, також було показано зв’язок високого рівня холестерину в середньому віці із збільшеним ризиком розвитку судинної деменції протягом 30–річного періоду [49]. Дані щодо зв’язку вмісту холестерину в когортах пацієнтів більш старшого віку мають менш однозначний характер: у деяких було показано, що більш високий рівень холестерину асоціювався з більш низьким ризиком [28], в інших — із підвищеним ризиком судинної деменції [42].
Таким чином, раннє виявлення (у більш молодому віці) атеросклеротичного або артеріосклеротичного процесів може забезпечити більш раннє ефективне запобігання ураженню мозку з віком.
Підвищений артеріальний тиск (АТ) — відомий причинний фактор ризику інсульту, також був визначений як потенційний фактор ризику судинної деменції. Проте дослідження показали суперечливі результати щодо взаємозв’язку між рівнем АТ і судинною деменцією. Попередні аналізи когорт здорових осіб та пацієнтів із попереднім діагнозом ТІА або інсульту показали позитивний зв’язок між підвищеним рівнем АТ у середньому віці (40–50 років) і майбутнім розвитком деменції, включаючи судинну деменцію [17, 32]. У той же час були наведені дані, що низький рівень АТ у похилому віці може бути пов’язаний із збільшеним ризиком деменції [41].
Найбільше у світі дослідження щодо впливу АГ на ризик розвитку деменції, яке розставило крапки над «і» в цьому питанні, було проведено у Великій Британії: на етапі первинної медичної допомоги в когорті 4,28 мільйона осіб без значимих судинних захворювань та слабоумства було оцінено зв’язок підвищення АТ із ризиком та часом розвитку судинної деменції [7]. За середній строк спостереження протягом 7 років після виключення перших чотирьох років спостереження виникло 11 114 первинних презентацій судинної деменції. Асоціація між рівнем офісного систолічного артеріального тиску (САТ) та ризиком судинної деменції знижувалася із віком (співвідношення ризиків на кожне підвищення на 20 мм рт.ст. становило 1,62, 95% ДІ 1,13–2,35 — для 30–50 років, 1,26, 1,18–1,35 — для 51–70 років, 0,97, 0,92–1,03 — для 71–90 років, р–тренд = 0,006). Дані наведені на рис. 3. Рівень САТ залишався прогностичним маркером для розвитку судинної деменції навіть після урахування його ефекту на ризик розвитку інсульту та ТІА. Незважаючи на те, що сила цих асоціацій знижувалася із збільшенням віку, ці результати дозволяють припустити, що індивідуальні або популяційні методи зниження АТ, навіть у кінці життя, можуть додатково знизити частоту судинної деменції.
Жорсткість артерій та деменція
Одним із можливих механізмів розвитку і прогресування ураження мозку при АГ і атеросклерозі є збільшення жорсткості магістральних судин і додаткове підвищення (ампліфікація) тиску в аорті. Артеріальна жорсткість є одним із ранніх показників змін структури та функції судинної стінки та може бути оцінена за допомогою різних показників, таких як швидкість пульсової хвилі (ШПХ), каротидно–гомілковий судинний індекс, кісточково–плечовий індекс, величина пульсового АТ (ПТ), індекс аугментації (ІА), потікзалежна дилатація, товщина комплексу інтима–медіа сонної артерії (ТІМ) та іншими. Підвищена жорсткість магістральних артерій вважається незалежним предиктором серцево–судинних і цереброваскулярних захворювань [19].
В деяких дослідженнях показано, що істотне збільшення жорсткості артерій, яке виникає в середині життя, пов’язане з виникненням серйозних серцево–судинних і цереброваскулярних подій, а також із зниженням когнітивних функцій. Причинний зв’язок між жорсткістю артеріального дерева та когнітивними розладами ще не чітко встановлений, однак багато досліджень показують зв’язок між більш високими рівнями жорсткості аорти та більш низькими показниками когнітивних тестів [19]. Механізми впливу точно не встановлені, однак підвищену жорсткість артерій пов’язують із мікросудинними змінами, збільшенням опору в системі мікроциркуляції, збільшенням лейкоареозу, а також з атрофією медіальної скроневої частки мозку. Ці пошкодження сприяють розвитку деменції (включаючи хворобу Альцгеймера) і підтверджують важливість раннього виявлення і корекції підвищеної жорсткості артерій [14].
Вважають, що більша артеріальна жорсткість може викликати більшу амплітуду пульсації, яка може пошкодити мікроциркуляцію. Відомо, що мікроциркуляція мозку є вразливою до пульсового удару внаслідок особливостей опору до високого та низького викиду [20]. Пошкодження малих артерій мозку розглядають як основну причину судинних когнітивних порушень, і вона є найбільш поширеною щодо розвитку васкулярної деменції [2, 51]. Також цей процес може реалізовуватися і через механізми, подібні до нейродегенерації, яка є наслідком мікроемболії [55]. Таким чином, патогенез когнітивних порушень при збільшеній жорсткості артерій може бути пов’язаний із пошкодженням малих артерій мозку, викликаним ендотеліальною дисфункцією й аномаліями мозкового кровотоку [3]. Нещодавно показано, що підвищена жорсткість артерій була пов’язана з ураженням малих артерій мозку та відкладанням фібрилярного b–амілоїду в мозку [13]. У метааналізі, що складався з 15 перехресних когортних і 4 тривалих досліджень, висока ШПХ була пов’язана з розвитком когнітивних порушень, проте автори підкреслили, що сила такої асоціації була відносно слабкою [55]. Деякі дослідники підкреслюють, що існують певні расові, національні, вікові та статеві відмінності в оцінці такого зв’язку.
На сьогодні тільки в кількох великих дослідженнях було відстежено проспективний зв’язок між жорсткістю аорти і ризиком розвитку деменції. В Роттердамському дослідженні жорсткість аорти не була пов’язана з деменцією, помірне порушення когнітивних функцій за критеріями Петерсена не було оцінено. Автори виявили лише достовірний зв’язок між жорсткістю аорти і біднішою виконавчою функцією [38]. В іншому дослідженні при аналізі даних спостереження нащадків фремінгемської когорти було продемонстровано зв’язок між жорсткістю аорти і розвитком клінічних ознак помірного порушення когнітивних функцій (відношення ризиків 1,40; 95% ДІ 1,13–1,73), тобто когнітивними порушеннями, які виходять за межі того, що зазвичай очікується для віку й освіти, за відсутності клінічної деменції. Відношення ризиків для деменції через усі причини становило 1,45 (95% ДІ 1,13–1,87), а для хвороби Альцгеймера — 1,41 (95% ДІ 1,06–1,87) [34]. На думку авторів, жорсткість аорти є незалежним предиктором розвитку помірних когнітивних порушень, а можливість її модифікації залишає простір для потенційного дослідження можливостей терапії. Довготривале Балтиморське дослідження (Baltimore Longitudinal Study of Aging) також виявило вікові взаємодії в асоціаціях як ШПХ, так і плечового тиску з більш низьким рівнем когнітивних функцій працездатності [59]. Така сукупність даних свідчить про те, що несприятлива центральна гемодинаміка є початком шкідливого шляху, що призводить до судинного ушкодження мозку і, можливо, сприяє зниженню когнітивних функцій.
Більшість експертів погоджуються з тим, що необхідні додаткові дослідження в цьому напрямку із відповідним дизайном для більш точного визначення ролі жорсткості артерій у виникненні когнітивних порушень та деменції. Таким чином, докази з епідеміологічних досліджень та біологічна правдоподібність вимагають прийняття стратегій, спрямованих на сприяння рутинному вимірюванню показників ШПХ та когнітивних функцій у кожного пацієнта певного віку, особливо в тих, хто має вищий серцево–судинний ризик [19].
За даними літератури відомо, що поява ознак ураження сонних артерій внаслідок атеросклерозу (бляшки) або гіпертензії й атеросклерозу (збільшення товщини комплексу інтима–медіа сонних артерій) навіть у безсимптомних пацієнтів асоціюється з майбутнім ураженням мозку: інсультом, деменцією та кардіальною смертю. Взаємозв’язок між ТІМ сонних артерій і когнітивною функцією було проаналізовано в декількох перехресних [30, 31] та тривалих дослідженнях [15, 47]. Початково дослідження були неоднорідними відносно досліджуваної популяції, визначення каротидного IMT, і нейропсихологічний тест прийнятий для оцінки пізнання. Незважаючи на цю неоднорідність, спостерігався достовірний обернений взаємозв’язок між ТІМ сонних артерій і когнітивною функцією у всіх дослідженнях. Точніше, чим товщі були стінки артерії, тим нижча когнітивна функція. Достовірність цих зв’язків залишалася після стандартизації за віком й освітою. Цілком ймовірно, що загальні серцево–судинні фактори ризику можуть впливати на збільшення ТІМ сонних артерій і розвиток судинної деменції незалежним чином, але наслідки ураження судин можуть також безпосередньо впливати на розвиток порушень когнітивної функції або їх прогресування.
Інсульт і деменція
У серії досліджень, проведених у загальній популяції, було показано, що пацієнти з анамнезом інсульту в чотири–шість разів частіше мали деменцію, ніж особи без інсульту [24]. Поширеність деменції протягом 3 місяців після інсульту становила від 6 до 32 %, і цей показник був вищим у пацієнтів із повторним інсультом. Існують дані, які показують, що частка пацієнтів, у яких виникли когнітивні порушення протягом більш короткого терміну після інсульту (до 3 місяців), може бути навіть вищою: від 25 до 70 % [6, 27, 39]. У деяких пацієнтів, які перенесли інсульт, цереброваскулярна подія могла посилити вже існуючі когнітивні порушення або деменцію, які розвинулися раніше, в тому числі внаслідок нейродегенеративних процесів [18, 35]. Фактори ризику деменції, пов’язані з розвитком постінсультних когнітивних розладів, включають вік, освітній рівень, когнітивний статус до інсульту, темпоролобальну атрофію, ураження білої речовини, серцеву патологію, а також наявність кількох судинних факторів ризику [18]. Незважаючи на те, що в деяких пацієнтів когнітивна функція може поліпшитись, однак постінсультні когнітивні порушення прогресують до клінічно вираженої деменції з частотою 8 % на рік [11, 43].
За даними популяційних досліджень, до 20 % серед осіб старше 65 років (і 30–50 % пацієнтів із судинними факторами ризику, депресією або деменцією) мають ознаки щонайменше одного німого інфаркту мозку, і поширеність виявлення таких уражень зростає із віком [4, 22, 57]. Порівняно з особами без таких уражень у хворих із «німими» інфарктами та нормальними когнітивними функціями на початку протягом найближчих кількох років спостерігаються підвищений ризик розвитку інсульту та подвійний ризик розвитку деменції (у тому числі хвороби Альцгеймера) [4, 5, 23, 58r].
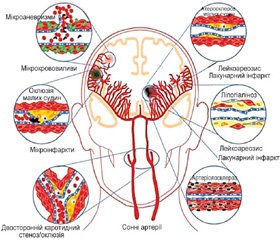
Крім інфаркту мозку, спектр цереброваскулярних захворювань включає інші типи ураження мозку, які можна виявити при неврологічному дослідженні або візуалізації (ураження білої речовини, мікрокрововиливи), і які також мають як наслідок порушення когнітивних функцій. Так, у Роттердамському дослідженні при спостереженні 1077 хворих з ураженням білої речовини та без деменції на початку дослідження протягом 5,5 року деменція виникла в 45 із них (4,1 %). При цьому більша вираженість ураження білої речовини перивентрикулярно збільшувала ризик розвитку деменції, тоді як при субкортикальному ураженні ризик деменції був менш вираженим. Відношення ризиків щодо розвитку деменції для перивентрикулярної локалізації ураження білої речовини в середньому становило 1,67 (ДІ 1,25–2,24) [40]. Дані наведені на рис. 4. В іншому масштабному дослідженні (Cardiovascular Health Study) також було показано, що пацієнти з більш вираженим ураженням білої речовини мали вдвічі більший ризик розвитку деменції в майбутньому [16].
У тому ж Роттердамському дослідженні 3257 пацієнтів з ознаками мікрокрововиливів (середній вік — 59,6 року) пройшли когнітивне тестування на початку дослідження та в кінці спостереження. Наявність понад 4 мікрокрововиливів була пов’язана із зниженням когнітивних функцій. Мікрокрововиливи в лобарному відділі (з мозочком або без нього) були пов’язані зі зниженням виконавчих функцій
(P = 0,003), функції обробки інформації (р < 0,001) та функції пам’яті (р = 0,03), тоді як мікрокрововиливи в інших ділянках головного мозку були пов’язані зі зниженням функції обробки інформації та швидкості моторики (P = 0,007). За в середньому 4,8 року спостереження в 72 хворих виникла деменція, у тому числі в 53 — деменція типу Альцгеймера. Наявність мікрокрововиливів була пов’язана з підвищеним ризиком розвитку деменції після стандартизації за віком, статтю і рівнем освіти (відношення ризиків — 2,02; 95% ДІ 1,25–3,24), у тому числі деменції типу Альцгеймера (відношення ризику — 2,10; 95% ДІ 1,21–3,64) [1].
Таким чином, пацієнтів із когнітивними порушеннями і клінічними або рентгенологічними ознаками цереброваскулярної патології слід проаналізувати, а також коригувати в них усі можливі фактори серцево–судинного ризику, особливо АГ. Хоча ці заходи можуть бути більш корисними для запобігання, а не для поліпшення перебігу деменції, існує сильне обґрунтування для агресивних заходів із вторинної профілактики інсульту в цих пацієнтів [27]. Повторний інсульт пов’язаний із більшим ризиком когнітивних порушень, а післяінсультна деменція — з більш високою смертністю.
Загальні принципи запобігання деменції
Безумовно, головною стратегією запобігання судинної деменції є профілактика нових інсультів. Це включає призначення антитромбоцитарних препаратів і боротьбу з основними факторами серцево–судинного ризику. Медикаментозне лікування переважно використовується для запобігання подальшому погіршенню судинної деменції шляхом лікування основних захворювань, таких як АГ, дисліпідемія та цукровий діабет. У літературі нещодавно з’явилися дані щодо можливого уповільнення прогресування судинної деменції під впливом аспірину [50].
В літературі є певні докази того, що середземноморська дієта може зменшити ризик когнітивних порушень: більш висока прихильність до такої дієти була пов’язана з тенденцією до зниження ризику розвитку помірних когнітивних розладів (на 17 %) і зі зниженим ризиком перетворення помірних когнітивних розладів у хворобу Альцгеймера (на 48 %) [45]. Слід підкреслити, що, незважаючи на ключову роль досліджень впливу дієти при серцево–судинних захворюваннях, визначення впливу дієти у формуванні порушень когнітивної функції наприкінці життя є набагато складнішим, і для більш точної оцінки такого впливу необхідно проведення більш детальних досліджень, особливо в осіб молодого віку.
У декількох дослідженнях встановлено, що підтримання високої фізичної активності зменшує прогресування когнітивних порушень та ризик розвитку деменції [21, 56]. У найбільш масштабному з них, 44–річному шведському дослідженні, у жінок виявили, що високий рівень фізичної активності в середньому віці був пов’язаний зі зниженням ризику розвитку деменції в подальшому житті: жінки з високим рівнем фітнесу в середньому віці мали на 88 % менший ризик розвитку деменції порівняно з жінками, у яких рівень фізичної активності був помірним. Крім того, розвиток деменції в жінки з високим ступенем фізичної підготовленості спостерігався в середньому на 11 років пізніше, ніж у жінок контрольної групи [12].
В твердженні AHA/ASA наведено оцінку поточної доказової бази щодо лікування судинних когнітивних порушень і деменції [10]. Ці дані наведені в табл. 1.
Ефективність терапії статинами була доведена відносно як первинної, так і вторинної профілактики інсульту. Дані відносно ефективності терапії статинами щодо запобігання розвитку та прогресування деменції менш однозначні. В невеликих та експериментальних дослідженнях було показано позитивний вплив статинів на розвиток деменції, тоді як у рандомізованих дослідженнях їх ефект не доведено. Так, у проспективному дослідженні PROSPER (Prospective Study of Pravastatin in the Elderly at Risk — Проспективне дослідження правастатину в осіб похилого віку з ризиком) після 4 років лікування не було виявлено різниці в когнітивних функціях, що оцінювали за шкалою MMSE, між пацієнтами, які приймали правастатин або плацебо [52]. В іншому дослідженні — LEADe (Lipitor’s Effect in Alzheimer’s Dementia — Ефекти ліпітору при деменції Альцгеймера), що включало 640 рандомізованих пацієнтів із легкою стадією хвороби Альцгеймера, інтенсивне зниження ліпідів шляхом додавання аторвастатину (80 мг) до донепезилу, не покращувало когнітивну функцію протягом періоду спостереження 72 тижні [8].
Таким чином, основними стратегіями, що можуть забезпечити запобігання та лікування хвороби, є зменшення жорсткості судин, середземноморська дієта, збільшення фізичної активності та підтримка певного рівня тренованості, зниження впливу артеріосклерозу й атеросклеротичних уражень в осіб похилого віку. Альтернативною гіпотезою є те, що деменція в осіб похилого віку — це невиліковне когнітивне старіння, або що збільшення амілоїду та тау і нейродегенерації в осіб похилого віку не є наслідком судинних захворювань.
Антигіпертензивна терапія та запобігання деменції
З урахуванням того факту, що розвиток певної частини випадків деменції можна віднести до впливу факторів ризику, які потенційно можливо модифікувати, а також значної поширеності АГ у загальній популяції, простоту і доступність методу вимірювання АТ і відносно недороге лікування гіпертензії, виглядає привабливою можливість використання антигіпертензивної терапії для запобігання розвитку деменції.
Зрозуміло, що основним ефектом антигіпертензивної терапії щодо запобігання деменції є її вплив на ризик розвитку інсульту та ТІА. Однак ідея запобігання деменції завдяки ефективному контролю АТ поза межами розвитку інсульту також не втратила своєї актуальності. Найбільш серйозний доказ цього було отримано в дослідженні Syst–Eur на початку 2000–х років: зниження ризику деменції в групі активного лікування нітрендипіном порівняно з плацебо становило 55 % [9]. Дані наведені на рис. 5.
У подальшому в інших дослідженнях до останнього часу не вдавалося повторити результати дослідження Syst–Eur. У двох метааналізах подальших досліджень, опублікованих у 2008 [37] та 2009 рр. [26], було оцінено профілактичний ефект зниження АТ на ризик розвитку деменції: відношення ризику становило 0,87 (95% довірчий інтервал 0,76–1,00) та співвідношення шансів — 0,89 (95% ДІ 0,74–1,07). Результати цих попередніх метааналізів дещо обмежили сферу застосування антигіпертензивної терапії хворими без анамнезу цереброваскулярних захворювань.
За даними останнього оприлюдненого метааналізу наявних досліджень впливу антигіпертензивної терапії на ризик розвитку деменції, ефект лікування також загалом був нейтральним [54]. Загалом із 29 029 хворих, включених в аналіз, у групі втручання у 1041 (3,6 %) діагностований розвиток нових випадків деменції й у 1090 з 28 653 (3,8 %) у контрольній групі (співвідношення ризику 0,93 (95% ДІ 0,84–1,02; I2 = 16 %). Дані наведені на рис. 6. Захворюваність на деменцію становила від 1,6 випадку/1000 осіб на рік у двох дослідженнях у відносно молодих хворих, в тому числі з діабетом, і 36,4 випадку/1000 осіб на рік у дослідженнях у пацієнтів старше 80 років. Виключення результатів дослідження Syst–Eur, які йдуть усупереч основному висновку даного метааналізу, призводило до збільшення величини співвідношення ризику до 0,96 (95% ДІ 0,88–1,04; I2 = 0 %). У 3 із проаналізованих досліджень реєстрували підтип деменції [9, 29, 36]. Зниження АТ у групі втручання недостовірно зменшувало кількість випадків хвороби Альцгеймера (коефіцієнт ризику 0,80; 95% ДІ 0,53–1,20; I2 = 71 %) або випадків судинної деменції (співвідношення ризику 0,83; 95% ДІ 0,57–1,21; I2 = 0 %).
Принциповим заключенням даного метааналізу також стала відсутність потенційно шкідливого впливу зниження АТ у хворих старшого віку або з меншим початковим рівнем САТ на розвиток когнітивних порушень та деменції.
Автори метааналізу вважають, що дані негативні висновки пояснюються тим фактом, що середній вік учасників досліджень становив 64–84 роки, тоді як найбільш сильний зв’язок між високим АТ та ризиком деменції в обсерваційних дослідженнях в основному був показаний у хворих на АГ середнього віку (35–64 роки) [33]. Однозначно, що складно продемонструвати вплив зниження АТ у середньому віці щодо запобігання розвитку деменції пізніше в житті через дуже тривалий час відставання між ризиком й ефектом лікування. Автори вважають за доцільне проведення рандомізованих клінічних досліджень з оцінки впливу антигіпертензивної терапії в середньому віці, які б включали продовжене спостереження з фокусом на розвиток деменції як кінцевої точки. Оскільки АГ є одним із багатьох факторів ризику розвитку деменції з усіх причин, a виявлено досить помірний потенційний ефект лікування, то важливо було б оцінити вплив корекції декількох факторів ризику на запобігання ризику розвитку та прогресування деменції [33].
Порівняно короткий період спостереження в більшості досліджень є іншим потенційним поясненням відсутності явного протекторного ефекту антигіпертензивної терапії. Можна стверджувати, що тривалість такого періоду менше п’яти років занадто коротка, щоб оцінити ефект зниження АТ на ризик розвитку деменції, через те, що це втручання направлено на відносно повільний патогенетичний механізм, який включає атеросклероз, цереброваскулярні ураження і, нарешті, деменцію. На думку авторів аналізу, ці причини обмежу–
ють здатність виявити ефект антигіпертензивної терапії на зменшення ризику деменції в довгостроковій перспективі [55]. Нарешті, відсутність протекторного впливу антигіпертензивної терапії на розвиток нових випадків деменції може бути частково пояснена конкуруючим ризиком розвитку смерті. Позитивний вплив на смертність у групі хворих, яким призначалася антигіпертензивна терапія, призвів до порушення балансу: збільшилося число пацієнтів, які вижили і все ще перебували під загрозою розвитку деменції, а також потенційно збільшився вік у цій групі, тоді як вік є найбільший важливим фактором ризику розвитку деменції.
Незважаючи на достатньо песимістичні висновки метааналізів, результати нещодавно оприлюднених досліджень додали доказів щодо того, що агресивне зниження САТ до 120 мм рт.ст. може достовірно зменшувати ризик помірних когнітивних порушень. Першим став аналіз дослідження SPRINT, у піддослідженні якого аналізували пацієнтів, рандомізованих до групи стандартної терапії, із цільовим рівнем САТ менше 140 мм рт.ст., або групи інтенсивної терапії з цільовим рівнем САТ менше 120 мм рт.ст. — SPRINT MIND (Memory and Cognition IN Decreased Hypertension) [61]. Дані включали аналіз 9361 хворого на АГ похилого віку з підвищеним серцево–судинним ризиком, але без діабету, деменції й інсульту. Було виявлено достовірно нижчу частоту (на 19 %) розвитку нових випадків помірних когнітивних порушень (p = 0,01) у групі інтенсивного лікування артеріального тиску. Також у групі інтенсивного лікування спостерігалося достовірно нижче (на 15 %) виникнення комбінованої точки — помірних когнітивних порушень разом із ймовірною деменцією, обумовленою усіма причинами, порівняно зі стандартним лікуванням (p = 0,02). В той же час була лише тенденція до зниження тільки деменції (HR = 0,83, p = 0,10). Дослідники підкреслили, що не було виявлено ніяких доказів того, що інтенсивний контроль АТ шкодить мозку. Як зазначалося, попередні дослідження показували когнітивні переваги контролю АТ, але це перше рандомізоване контрольоване дослідження в історії, яке показало, що можливо зменшити появу м’яких когнітивних порушень при зниженні АТ.
У рамках іншого дослідження був проведений метааналіз даних окремих пацієнтів із 6 довгострокових когортних досліджень: The Age, Gene/Environment Susceptibility–Reykjavik Study; Atherosclerosis Risk in Communities Study; Framingham Heart Study; Honolulu–Asia Aging Study; Rotterdam Study; and 3–C study [37]. Вони оцінили асоціації різних класів препаратів, що знижують АТ, із розвитком деменції і хвороби Альцгеймера в 31 090 учасників віком старше 55 років, які проживали в спільноті, на початку не мали деменції та мали дані про рівень АТ на початку дослідження та приймали препарати, що знижують АТ. Строк спостереження становив 22 роки. Аналіз було проведено для усіх 5 класів антигіпертензивних засобів. Аналіз пропорційного ризику за Коксом був скоректований за наявністю факторів ризику. Крім того, аналіз включав оцінку у хворих із початково підвищеним (САТ ≥ 140 або ДАТ ≥ 90 мм рт.ст.) або нормальним рівнем АТ незалежно від застосування лікарських засобів, а також статусу носія APOE ԑ4 (ген, що асоціюють із розвитком пізнього типу хвороби Альцгеймера).
Протягом періоду спостереження в 3728 учасників дослідження розвинулася деменція та в 1741 виникла хвороба Альцгеймера. У хворих із початково високим рівнем АТ та тих, хто приймав будь–який антигіпертензивний препарат, незалежно від класу лікарських засобів ризик розвитку деменції з усіх причин був достовірно меншим (коефіцієнт ризику 0,88, 95% довірчий інтервал 0,79–0,98) порівняно з тими, хто не отримував антигіпертензивні засоби. Це стосувалося і хвороби Альцгеймера (КР 0,85; ДІ 0,74–0,99). Частота розвитку деменції також була нижчою серед носіїв APOE ԑ4
(КР 0,77; ДІ 0,64–0,93). Не спостерігалося жодних достовірних асоціацій серед неносіїв APOE ԑ4 або в учасників із нормальним початковим рівнем АТ. Автори підкреслили, що результати аналізу надають докази, що підтверджують ефективність зниження АТ як такого, але немає доказів щодо вибору певних антигіпертензивних класів для запобігання когнітивним розладам. Результати цього метааналізу доповнили наведені вище дані, отримані в дослідженні SPRINT MIND, а також вперше показали, що антигіпертензивна терапія загалом зменшує ризик не тільки деменції, а й хвороби Альцгеймера [37].
Лікування деменції
У реальній практиці в пацієнтів із діагнозом судинної деменції аспірин призначається дуже широко — в одному з досліджень, проведеному у Великій Британії, близько 80 % пацієнтів із когнітивними порушеннями (а також із серцево–судинними факторами ризику) призначали аспірин. Однак чимало питань залишається без відповіді: чи є переконливі докази того, що аспірин має сприятливий вплив у пацієнтів із судинною деменцією? Чи впливає аспірин на функцію пізнання або поліпшує прогноз? Крім того, чи перевищує ризик церебральної або шлункової кровотечі будь–яку користь? Дані Кокранівського аналізу показали, що немає доказів того, що аспірин ефективний у лікуванні пацієнтів із діагнозом судинної деменції. Необхідні подальші дослідження для оцінки впливу аспірину на когнітивну функцію і на інші параметри, такі як поведінка та якість життя. В даний час немає жодних доказів, що стосуються інших запитань про використання аспірину для лікування деменції [60].
Дослідження специфічної фармакотерапії, спрямованої на лікування судинної деменції, показали послідовне помірне покращання когнітивних функцій при лікуванні донепезилом, галантаміном і мемантином. В той же час функціональні і загальні результати лікування були менш узгодженими: достовірні докази були отримані лише у 2 великих дослідженнях із донепезилом. У дослідженнях галантаміну менше зниження когнітивних, функціональних і глобальних результатів було показано в основному за рахунок включення хворих зі змішаною хворобою — судинною деменцією і хворобою Альцгеймера. В згаданому твердженні Американської асоціації серця та Американської асоціації інсульту сказано, що на сьогодні доказова база значно обмежена і потребує більше результатів клінічних досліджень, в тому числі з оцінкою фармакоекономічного ефекту такого лікування [10].
Оприлюднений нещодавно метааналіз 76 рандомізованих клінічних досліджень показав, що комбінована терапія інгібіторами ацетилхолінестерази та мемантином не виявила додаткових переваг порівняно з монотерапією. Показано, що монотерапія з інгібіторами ацетилхолінестерази сприяла більшому покращанню когнітивних функцій та щоденних дій, ніж комбінована терапія в пацієнтів із легким та середнім рівнем тяжкості хвороби Альцгеймера [53].
Рекомендації Американської асоціації серця та Американської асоціації інсульту щодо специфічного лікування судинної деменції включають таке:
1. Донепезил може бути корисним для покращання когнітивних функцій у пацієнтів із судинною деменцією (клас IIa, рівень доказів A).
2. Призначення галантаміну може бути корисним для пацієнтів із змішаною хворобою — судинною деменцією і хворобою Альцгеймера (клас IIa, рівень доказів A).
3. Переваги ривастигміну та мемантину при судинній деменції недостатньо встановлені (клас IIb, рівень доказів A) [10].
Популяційні тенденції щодо деменції
Оцінка досягнень сучасної медицини в боротьбі з деменцією була проведена у двох великих епідеміологічних дослідженнях по різні сторони Атлантики. За даними Фремінгемського дослідження, частота деменції в популяції протягом останніх 40 років зменшилася на 44 % [44]. Отримані результати подані на рис. 7. База даних включала спостереження за 5205 пацієнтами з 1975 року. Поширеність деменції порівнювали в чотирьох різних інтервалах часу. Хоча автори зазначають, що остаточна причина такого результату ще не з’ясована, але основним рушійним механізмом, безумовно, є зниження ризику цереброваскулярних захворювань.
Подібні дані було отримано і британськими дослідниками. Одночасне порівняння частоти спостереження деменції в трьох різних регіонах Англії показало, що протягом 20 років спостерігалося достовірне зниження частоти деменції загалом на 20 % в популяції старше 65 років у всіх вікових категоріях та незалежно від статі [25]. Дані наведені на рис. 8. Автори відмітили, що зниження ризику розвитку деменції спостерігалося за рахунок осіб, народжених більш пізніше, ніж на початку XX століття. Вони також пов’язують такий результат із впливом медицини на серцево–судинні фактори ризику деменції.
Таким чином, результати останніх досліджень довели, що в країнах із високим рівнем доходу поширеність деменції та тяжкої форми когнітивної діяльності достовірно зменшується. Виявлений масштаб зменшення є суттєвим та відповідає значному зменшенню факторів ризику в країнах із високим рівнем доходу, які були покращені внаслідок соціальних змін в останні десятиліття, таких як вдосконалення освіти та впровадження ефективних стратегій профілактики та лікування. Незважаючи на те, що багато факторів (наприклад, цукровий діабет 2–го типу, старіння населення, виживання після інсульту й інших судинних інцидентів), що накопичуються в сучасному суспільстві, можуть призвести до збільшення поширеності деменції в певних вікових групах, останнім десятиліттям спостерігається переважання впливу факторів, що можуть зменшити поширеність деменції та когнітивних розладів, — покращання профілактики серцево–судинних захворювань, більш тривалий активний спосіб життя та більш високий рівень освіти. Профілактичні втручання можуть мати скромний вплив на індивідуальному рівні, але призводять до значного зменшення ризику розвиту деменції на популяційному рівні. Заходи включають зміни способу життя, контроль за факторами ризику судин, лікування супутніх серцево–судинних захворювань і застосування усіх доведених стратегій профілактики інсульту.
На закінчення хотілося б підкреслити, що судинні когнітивні порушення посідають провідне місце у формуванні деменції і включають будь–які порушення, пов’язані із судинною патологією або викликані нею насамперед внаслідок старіння судин. Важливість цього положення полягає в тому, що судинний компонент є фактором, що піддається лікуванню, і, таким чином, його наслідкам можна запобігти. У нас є достатньо засобів для лікування судинних факторів ризику, і ми маємо право очікувати того, що це не тільки може зменшити ймовірність розвитку інсульту та судинних когнітивних порушень, але, можливо, відкладе або уповільнить розвиток хвороби Альцгеймера.
Конфлікт інтересів. Автор заявляє про відсутність конфлікту інтересів при підготовці даної статті.
1. Akoudad S., Wolters F.J., Viswanathan A. et al. Association of Cerebral Microbleeds With Cognitive Decline and Dementia // JAMA Neurol. — 2016. — 73(8). — Р. 934–943.
2. Benjamin P., Lawrence A.J., Lambert C. et al. Strategic lacunes and their relationship to cognitive impairment in cerebral small vessel disease // Neuroimage Clin. — 2014. — 4. — Р. 828–837.
3. Choi S.Y., Park H.E., Seo H., Kim M., Cho S.H., Oh B.H. Arterial stiffness using cardioankle vascular index reflects cerebral small vessel disease in healthy young and middle aged subjects // J. Atheroscler. Thromb. — 2013. — 20(2). — Р. 178–185.
4. Das R.R., Seshadri S., Beiser A.S. et al. Prevalence and correlates of silent cerebral infarcts in the Framingham ofspring study // Stroke. — 2008. — 39. — Р. 2929–35.
5. Debette S., Beiser A., DeCarli C. et al. Association of MRI markers of vascular brain injury with incident stroke, mild cognitive impairment, dementia, and mortality: the Framingham Offspring Study // Stroke. — 2010. — 41. — Р. 600–6.
6. Desmond D.W., Moroney J.T., Paik M.C. et al. Frequency and clinical determinants of dementia after ischemic stroke // Neurology. — 2000. — 54. — Р. 1124–31.
7. Emdin C.A., Rothwell P.M., Salimi–Khorshidi G. et al. Blood pressure and risk of vascular dementia: evidence from 4.3 million adults and a cohort study of TIA and stroke // Stroke. — 2016. — 47. —Р. 1429–1435.
8. Feldman H.H., Doody R.S., Kivipelto M. et al. LEADe Investigators. Randomized controlled trial of atorvastatin in mild to moderate Alzheimer disease: LEADe // Neurology. — 2010. — 74. — Р. 956–964.
9. Forette F., Seux M–L., Staessen E.A. et al. The prevention of dementia with antihypertensive treatment. New evidence from Syst–Eur Study // Arch. Intern. Med. — 2002. — 152. — Р. 2046–2052.
10. Gorelick P.B., Scuteri A., Black S.E. et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the American Heart Association/American Stroke Association // Stroke. — 2011. — 42. — Р. 2672–2713.
11. Gottesman R.F., Hillis A.E. Predictors and assessment of cognitive dysfunction resulting from ischaemic stroke // Lancet Neurol. — 2010. — 9. — Р. 895–905.
12. Hörder H., Johansson L., Guo X., Grimby G., Kern S., Östling S. et al. Midlife cardiovascular fitness and dementia: A 44–year longitudinal population study in women // Neurology. — 2018. — 10. — 90(15). — Р. 1298–1305.
13. Hughes T.M., Wagenknecht L.E., Craft S. et al. Arterial stiffness and dementia pathology // Neurology. — 2018. — 90(14). — Р. 1248–1256.
14. Joly L. Arterial stiffness and cognitive function. Geriatr // Psychol. Neuropsychiatr. Vieil. — 2017. — 1. — 15(1). — Р. 83–88.
15. Komulainen P., Kivipelto M., Lakka T.A., Hassinen M., Helkala E.L., Patja K., Nissinen A., Rauramaa R. Carotid intima–media thickness and cognitive function in elderly women: a population–based study // Neuroepidemiology. — 2007. — 28. — Р. 207–213.
16. Kuller L.H., Lopez O.L., Newman A. et al. Risk factors for dementia in the cardiovascular Health Cognition Study // Neuroepidemiology. — 2003. — 22. — Р. 13–22.
17. Launer L.J., Ross G.W., Petrovitch H., Masaki K., Foley D., White L.R., Havlik R.J. Midlife blood pressure and dementia: the Honolulu–Asia aging study // Neurobiol Aging. — 2000. — 21. — Р. 49–55.
18. Leys D., Henon H., Mackowiak–Cordoliani M.A., Pasquier F. Poststroke dementia // Lancet Neurol. — 2005. — 4. — Р. 752–759.
19. Li X., Lyu P., Re Y., An J., Dong Y. Arterial stiffness and cognitive impairment // Journal of the Neurological Sciences. — 2017. — 380. — Р. 1–10.
20. Lim S.L., Gao Q., Nyunt M.S. et al. Vascular health indices and cognitive domain function: Singapore longitudinal ageing studies // J. Alzheimers Dis. — 2016. — 50. — 1. — Р. 27–40.
21. Liu–Ambrose T., Best J.R., Davis J.C., Eng J.J., Lee P.E., Jacova C., Boyd L.A., Brasher P.M., Munkacsy M., Cheung W., Hsiung G.R. Aerobic exercise and vascular cognitive impairment: A randomized controlled trial // Neurology. — 2016. — 87(20). — Р. 2082–2090.
22. Longstreth W.T. Jr, Dulberg C., Manolio T.A. et al. Incidence, manifestations, and predictors of brain infarcts defined by serial cranial magnetic resonance imaging in the elderly: the Cardiovascular Health Study // Stroke. — 2002. — 33. — Р. 2376–82.
23. Longstreth W.T. Jr, Arnold A.M., Beauchamp N.J. Jr et al. Incidence, manifestations, and predictors of worsening white matter on serial cranial magnetic resonance imaging in the elderly: the Cardiovascular Health Study // Stroke. — 2005. — 36. — Р. 56–61.
24. Manly J.J., Bell–McGinty S., Tang M.X. et al. Implementing diagnostic criteria and estimating frequency of mild cognitive impairment in an urban community // Arch. Neurol. — 2005. — 62. — Р. 1739–46.
25. Matthews F.E., Arthur A., Barnes L.E. et al. on behalf of the Medical Research Council Cognitive Function and Ageing Collaboration. A two–decade comparison of prevalence of dementia in individuals aged 65 years and older from three geographical areas of England: results of the Cognitive Function and Ageing Study I and II // Lancet. — 2013. — 382. — Р. 1405–1412.
26. McGuinness B., Todd S., Passmore P., Bullock R. Blood pressure lowering in patients without prior cerebrovascular disease for prevention of cognitive impairment and dementia // Cochrane Database Syst. Rev. — 2009. — 4. — CD004034.
27. Merino J.G., Hachinski V. What is vascular cognitive impairment? // The Behavioral and Cognitive Neurology of Stroke / ed. Olivier Godefroy. — Cambridge University Press, 2013. — P. 1–8.
28. Mielke M.M., Zandi P.P., Sjogren M. et al. High total cholesterol levels in late life associated with a reduced risk of dementia // Neurology. — 2005. — 64. — Р. 1689–1695.
29. Moll van Charante E.P., Richard E., Eurelings L.S., van Dalen J.W., Ligthart S.A., van Bussel E.F. et al. Effectiveness of a 6–year multidomain vascular care intervention to prevent dementia (preDIVA): a cluster–randomised controlled trial // Lancet. — 2016. — 388. — Р. 797–805.
30. Morović S., Jurasić M.J., Martinić Popović I., Serić V., Lisak M., Demarin V. Vascular characteristics of patients with dementia // J. Neurol. Sci. — 2009. — 283. — Р. 41–43.
31. Muller M., Grobbee D.E., Aleman A., Bots M., van der Schouw Y.T. Cardiovascular disease and cognitive performance in middle–aged and elderly men // Atherosclerosis. — 2007. — 190. — Р. 143–149.
32. Ninomiya T., Ohara T., Hirakawa Y., Yoshida D., Doi Y., Hata J., Kanba S., Iwaki T., Kiyohara Y. Midlife and late–life blood pressure and dementia in Japanese elderly: the Hisayama study // Hypertension. — 2011. — 58. — Р. 22–28.
33. Norton S., Matthews F.E., Barnes D.E., Yaffe K., Brayne C. Potential for primary prevention of Alzheimer’s disease: an analysis of population based data // Lancet Neurol. — 2014. — 13. — Р. 788–794.
34. Pase M.P., Beiser A., Himali J.J. et al. Aortic Stiffness and the Risk of Incident Mild Cognitive Impairment and Dementia // Stroke. — 2016. — 47(9). — Р. 2256–2261.
35. Pendlebury S.T., Rothwell P.M. Prevalence, incidence, and factors associated with pre–stroke and post–stroke dementia: a systematic review and meta–analysis // Lancet Neurol. — 2009. — 8. — Р. 1006–18.
36. Peters R., Beckett N., Forette F., Tuomilehto J., Clarke R., Ritchie C. et al. Incident dementia and blood pressure lowering in the Hypertension in the Very Elderly Trial cognitive function assessment (HYVET–COG): a double–blind, placebo controlled trial // Lancet Neurol. — 2008. — 7. — Р. 683–689.
37. Peters R. Investigation of Antihypertensive Class Effects on Dementia and Cognitive Decline: A Collaborative Meta–Analysis of Participant Data. Alzheimer’s Association International Conference (AAIC) 2018. — Abstract 25142. — Presented July 24, 2018.
38. Poels M.M.F., Van Oijen M., Mattace–Raso F.U.S., Hofman A., Koudstaal P.J., Witteman J.C.M. et al. Arterial stiffness, cognitive decline, and risk of dementia: The Rotterdam study // Stroke. — 2007. — 38. — Р. 888–892.
39. Pohjasvaara T., Erkinjuntti T., Vataja R., Kaste M. Dementia three months after stroke. Baseline frequency and effect of different definitions of dementia in the Helsinki Stroke Aging Me–mory Study (SAM) cohort // Stroke. — 1997. — 28. — Р. 785–92.
40. Prins N., von Dijk M.J., der Hejer T. et al. Cerebral white matter leisure and the risk of dementia // Arch. Neurol. — 2004. — 61. — Р. 1531–1534.
41. Qiu C., Winblad B., Fratiglioni L. The age–dependent relation of blood pressure to cognitive function and dementia // Lancet Neurol. — 2005. — 4. — Р. 487–499.
42. Reitz C., Tang M.X., Luchsinger J., Mayeux R. Relation of plasma lipids to Alzheimer disease and vascular dementia // Arch. Neurol. — 2004. — 61. — Р. 705–714.
43. Sachdev P.S., Chen X., Brodaty H. et al. The determinants and longitudinal course of post–stroke mild cognitive impairment // J. Int. Neuropsychol. Soc. — 2009. — 15. — Р. 915–23.
44. Satizabal C.L., Beiser A.S., Chouraki V. et al. Incidence of Dementia over Three Decades. in the Framingham Heart Study // N. Engl. J. Med. — 2016. — 374. — Р. 523–532.
45. Scarmeas N., Stern Y., Mayeux R., Manly J.J., Schupf N., Luchsinger J.A. Mediterranean diet and mild cognitive impairment // Arch. Neurol. — 2009. — 66. — Р. 216–225.
46. Schneider J.A., Arvanitakis Z., Bang W., Bennett D.A. Mixed brain pathologies account for most dementia cases in community–dwelling older persons // Neurology. — 2007. — 69. — Р. 2197–204.
47. Silvestrini M., Gobbi B., Pasqualetti P., Bartolini M., Baruffaldi R., Lanciotti C., Cerqua R., Altamura C., Provinciali L., Vernieri F. Carotid atherosclerosis and cognitive decline in patients with Alzheimer’s disease // Neurobiol. Aging. — 2009. — 30. — Р. 1177–1183.
48. Solomon A., Kanstareholt I., Ngandu T. et al. Serum total cholesterol, statins and cognition in non–demented elderly // Neurobiol. Aging. — 2009. — 30. — Р. 1006–1009.
49. Solomon A., Kivipelto M., Wolozin B., Zhou J., Whitmer R.A. Midlife serum cholesterol and increased risk of Alzhei–mer’s and vascular dementia three decades later // Dement. Geriatr. Cogn. Disord. — 2009. — 28. — Р. 75–80.
50. Sujyoti C., Malabendu J., Kalipada P. Aspirin induces Lysosomal biogenesis and attenuates Amyloid plaque pathology in a mouse model of Alzheimer's disease via PPARα // Journal of Neuroscience. — 2018. — 0054–18. DOI: 10.1523/JNEUROSCI.0054–18.2018.
51. Teodorczuk A., Firbank M.J., Pantoni L. et al. Relationship between baseline whitematter changes and development of late–life depressive symptoms: 3–year results from the LADIS study // Psychol. Med. — 2010. — 40(4). — Р. 603–610.
52. Trompet S., van Vliet P., de Craen A.J. et al. Pravastatin and cognitive function in the elderly: results of the PROSPER study // J. Neurol. — 2010. — 257. — Р. 85–90.
53. Tsoi K. et al. Combination Therapy Showed No Additional Benefit over Monotherapy for Alzheimer’s Disease: A Network Meta–Analysis of 76 Randomized Controlled Trials. Alzheimer’s Association International Conference (AAIC) 2018. — Abstracts 20352, presented July 25, 2018.
54. van Middelaar T., van Vught L.A., van Gool W.A. et al. Blood pressure–lowering interventions to prevent dementia: a systematic review and meta–analysis // J. Hypertens. — 2018. — 36. — Р. 1780–1787.
55. van Sloten T.T., Protogerou A.D., Henry R.M., Schram M.T., Launer L.J., Stehouwer C.D. Association between arterial stiffness, cerebral small vessel disease and cognitive impairment: a systematic review and meta–analysis // Neurosci., Biobehav. Rev. — 2015. — 53. — Р. 121–130.
56. Verdelho A., Madureira S., Ferro J.M. et al. LADIS Study. Physical activity prevents progression for cognitive impairment and vascular dementia: results from the LADIS (Leukoaraiosis and Disability) study // Stroke. — 2012. — 43(12). — Р. 3331–3335.
57. Vermeer S.E., Prins N.D., den Heijer T. et al. Silent brain infarcts and the risk of dementia and cognitive decline // N. Engl. J. Med. — 2003. — 348. — Р. 1215–22.
58. Vermeer S.E., Longstreth W.T. Jr, Koudstaal P.J. Silent brain infarcts: a systematic review // Lancet Neurol. — 2007. — 6. — Р. 611–19.
59. Waldstein S.R., Rice S.C., Thayer J.F., Najjar S.S., Scuteri A., Zonderman A.B. Pulse pressure and pulse wave velocity are related to cognitive decline in the Baltimore Longitudinal Study of Aging // Hypertension. — 2008. — 51. — Р. 99–104.
60. Williams P.S., Rands G., Orrel M., Spector A. Aspirin for vascular dementia // Cochrane Database Syst. Rev. — 2000. — CD001296.
61. Williamson J. and the SPRINT Research Group. A Randomized Trial of Intensive Versus Standard Systolic Blood Pressure Control and the Risk of Mild Cognitive Impairment and Dementia: Results from SPRINT MIND. Alzheimer’s Association International Conference (AAIC) 2018. Abstracts 27525 and 27526, presented July 25, 2018.

/77-1.jpg)
/82-1.jpg)
/78-1.jpg)