Журнал «Здоровье ребенка» Том 13, №8, 2018
Вернуться к номеру
Коррекция метаболических нарушений при вторичном ацетонемическом синдроме в условиях острой респираторной вирусной инфекции у детей
Авторы: Стоева Т.В.(1), Титкова Е.В.(1), Сытник В.В.(1), Карташова В.А.(1, 2), Синенко В.В.(1), Радюк Л.П.(3)
(1) — Одесский национальный медицинский университет, г. Одесса, Украина
(2) — КУ «Городской специализированный дом ребенка № 1», г. Одесса, Украина
(3) — Городская детская больница им. академика Б.Я. Резника, г. Одесса, Украина
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
Ацетонемічний синдром (АС) — одне з найбільш частих метаболічних порушень у дітей. Незважаючи на велику кількість робіт, присвячених патогенезу гіперкетонемії, остаточно не з’ясована роль процесів клітинного енергетичного обміну в розвитку даного стану. Вивчення енергетичного балансу метаболізму дозволяє виявити важливі патогенетичні ланки, прогностичні критерії виникнення і перебігу АС, а також визначити підходи до його корекції. Проведено порівняльне контрольоване дослідження серед 64 дітей із вторинним АС на тлі запальних захворювань респіраторного тракту, в структурі яких визначалися: гострий ринофарингіт, гострий простий бронхіт, гострий стенозуючий ларинготрахеїт, позалікарняна пневмонія, гострий трахеїт, гострий обструктивний бронхіт. У ході роботи визначені значущі предиктори виникнення АС. Доведено статистично вірогідний зв’язок між рівнем ацетонурії і тяжкістю стану пацієнта. З метою корекції АС застосовували комплексний збалансований препарат Іоніка у 36 дітей основної групи. Застосування глюкозовмісного препарату Іоніка дозволило поліпшити показники активності ферментів енергообміну (СДГ, ЛДГ, ГФДГ, ГДГ), скоротити тривалість проявів АС в основній групі, знизити необхідність в інфузійній терапії.
Ацетонемический синдром (АС) — одно из самых частых метаболических нарушений у детей. Несмотря на большое количество работ, посвященных патогенезу гиперкетонемии, окончательно не выяснена роль процессов клеточного энергетического обмена в развитии данного состояния. Изучение энергетического баланса метаболизма позволяет выявить важные патогенетические звенья, прогностические критерии возникновения и течения АС, а также определить подходы к его коррекции. Проведено сравнительное контролируемое исследование среди 64 детей с вторичным АС на фоне воспалительных заболеваний респираторного тракта, в структуре которых определялись: острый ринофарингит, острый простой бронхит, острый стенозирующий ларинготрахеит, внебольничная пневмония, острый трахеит, острый обструктивный бронхит. В ходе работы определены значимые предикторы возникновения АС. Доказана статистически достоверная связь между уровнем ацетонурии и тяжестью состояния пациента. С целью коррекции АС применяли комплексный сбалансированный препарат Ионика у 36 детей основной группы. Применение глюкозосодержащего препарата Ионика позволило улучшить показатели активности ферментов энергообмена (СДГ, ЛДГ, ГФДГ, ГДГ), сократить длительность проявлений АС в основной группе, снизить необходимость в инфузионной терапии.
Acetonemic syndrome (AS) is one of the most frequent metabolic disorders in children. Despite the large number of works on the pathogenesis of hyperketonemia, the role of the processes of cellular energy metabolism in the development of this condition has not been finally clarified. The study of the metabolism energy balance makes it possible to identify important pathogenetic links, prognostic criteria for the occurrence and course of AS, and also to determine approaches to its correction. A comparative controlled study was conducted among 64 children with secondary AS on the background of inflammatory diseases of the respiratory tract: acute rhinopharyngitis, acute simple bronchitis, acute laryngotracheitis, community-acquired pneumonia, acute tracheitis, acute obstructive bronchitis. The work identified significant predictors for the occurrence of the AS. Statistically significant relationship was revealed between the level of acetonuria and the severity of the patient’s condition. In order to correct the AS, the combination balanced preparation Ionica was used in 36 children of the main group. The use of the glucose-containing drug Ionica allowed improving the activity of energy metabolism enzymes (succinate dehydrogenase, lactate dehydrogenase, glycerophosphate dehydrogenase, glutamate dehydrogenase), reduce the duration of AS manifestations in the main group, as well as the need for infusion therapy.
ацетонемічний синдром; діти; енергодефіцит; метаболічна корекція
ацетонемический синдром; дети; энергодефицит; метаболическая коррекция
acetonemic syndrome; children; energy shortage; metabolic correction
Введение
Ацетонемический синдром (АС) — одно из самых частых нарушений обмена веществ и кислотно-основного баланса у детей. Явления кетонемии и ацетонурии проявляются в клинической картине разных заболеваний. Недостаточная выявляемость вторичного АС, широкий спектр заболеваний, при которых он может встречаться, невыясненная частота возникновения на фоне гипертермии, различные виды интоксикаций являются до конца не решенными вопросами. Несмотря на то что в основе АС лежит снижение активности ферментов печени, низкая ацетилирующая способность ацетил-КоА, дефицит щавелевой кислоты, нарушение пуринового, жирового и углеводного обмена, окончательно не выяснена роль процессов клеточного энергетического обмена в его развитии.
Образование энергии в организме обеспечивается тремя механизмами: гликолизом, бета-окислением жирных кислот, трансаминированием аминокислот. Основным субстратом для производства энергии является глюкоза. В то же время энергодефицитные состояния требуют включения альтернативных механизмов получения энергии: при углеводном дефиците энергия синтезируется в результате расщепления жирных кислот и образования кетоновых тел из ацетил-КоА, главным образом в митохондриальной матрице клеток. При этом использование кетоновых тел в качестве топлива замедляет метаболизм глюкозы, снижает эффективность энергообразования. Метаболическое влияние кетоза имеет не только патологический, но и физиологические эффекты (табл. 1).
Однако высокая интенсивность кетогенеза в условиях функциональной незрелости метаболических механизмов может осложнять течение различных патологических процессов и усугублять явления интоксикации вследствие невозможности использования ацетона в качестве субстрата энергии организмом из-за высокой волатильности и невозможности обратной трансформации в ацетил-КоА. Поэтому его избыток выводится с мочой и выдыхаемым воздухом, вызывая характерный «фруктовый» запах.
Снижение синтеза АТФ в условиях дефицита глюкозы и гиперкетонемии отрицательным образом сказывается на функционировании всех систем организма. А присоединение дыхательной гипоксии при респираторной патологии еще больше снижает эффективность энергообмена.
Сегодня состоянию энергозависимых механизмов защитных реакций организма отводится важная роль в формировании иммунологической резистентности [1], что указывает на необходимость их исследования у детей с повышенной частотой инфекционных заболеваний. Показано, что клинически значимыми признаками энергодефицита являются не только различные варианты нарушения психического или физического развития, признаки дисплазии соединительной ткани (ДСТ) (гипермобильность суставов, деформации позвоночника, плоскостопие, венозная сеть на коже, слабость мышц живота, склонность к образованию гематом, астеническое телосложение и др.), но и частые рекуррентные респираторные заболевания.
Полное понимание данных механизмов требует детального рассмотрения функций иммунокомпетентных клеток. В ряде современных исследований отмечены две ключевые роли макрофагов: 1) быстрое реагирование на инфекции и травмы — провоспалительный фенотип, 2) участие в восстановлении поврежденных в результате иммунного ответа тканей — противовоспалительный фенотип. Механизмы подобных изменений окончательно не выяснены, однако существует предположение о возможности изменения функций митохондрий, в частности влияния на производство активных форм кислорода (АФК) в метаболическом пути [2]. Макрофаги в состоянии покоя используют эффективную форму окислительного метаболизма — электронную транспортную цепь (ЭТЦ) для получения АТФ [3]. Столкновение макрофагов с инфекционным агентом увеличивает их потребность в глюкозе для пролиферации, перехода в провоспалительный фенотип, выработки медиаторов воспаления. При этом провоспалительные макрофаги более гликолитичны, производят больше АФК и накапливают сукцинат в большей степени, чем макрофаги в состоянии покоя. В дендритных клетках (DCs) переход на гликолиз и подавление окислительного фосфорилирования поддерживает синтез жирных кислот, необходимый для производства и секреции ключевых белков, активации DC [4] и предотвращения апоптоза в условиях пониженного уровня продукции АТФ [5]. Таким образом, усиленное продуцирование сукцината является критическим регулятором провоспалительного ответа. При этом недостаточность ферментных митохондриальных систем может препятствовать смене фенотипа макрофагов, а следовательно, влиять на общую резистентность к инфекциям.
Универсальным индикатором состояния организма на цитохимическом уровне является ферментный статус лимфоцитов, изучение которого, особенно сукцинатдегидрогеназы (СДГ) и альфа-глицерофосфатдегидрогеназы (a-ГФДГ), позволяет косвенно оценить резервные возможности, поскольку они характеризуют энергетический потенциал клетки, а их активность предопределяет функцию клеточного звена иммунной защиты, являясь подобием «энзиматического зеркала» метаболических сдвигов [6].
Многонаправленность патогенетических сдвигов в условиях энергодефицита, кетоацидоза, интоксикации, гипоксии требует направленной коррекции. Говоря о терапевтических возможностях при кетонемических состояниях, следует упомянуть о доказанной эффективности широкого спектра препаратов (табл. 2).
Следует отметить, что, несмотря на широкий спектр представленных в последнее время работ, ведущим направлением остается регидратационная терапия, а эффективность ее применения во многом зависит от состава используемых растворов.
Цель исследования: повышение эффективности терапии и профилактики АС у детей на фоне острых респираторных вирусных инфекций (ОРВИ) с помощью регидратации и метаболической коррекции энергетических процессов.
Материалы и методы
Проведено сравнительное контролируемое исследование в параллельных группах, отобранных методом стратифицированной рандомизации по нозоформам. В исследовании приняли участие 64 ребенка со вторичным АС на фоне воспалительных заболеваний респираторного тракта, находившиеся на лечении в педиатрическом и пульмонологическом отделениях ОДГБ им Б.Я. Резника. Всем детям был проведен стандартный комплекс клинико-лабораторного обследования. Критериями включения в исследование были: ОРВИ, подтвержденный вторичный АС, информированное согласие официальных представителей ребенка. Критериями исключения из исследования были: первичный АС, АС эндокринного, центрального происхождения, синдром циклической рвоты (СЦР), острая хирургическая патология, гиперчувствительность к компонентам препарата, отсутствие информированного согласия официальных представителей ребенка. Все пациенты были разделены на 2 группы. 36 детей основной группы в составе комплексной терапии получали препарат Ионика. В контрольную группу вошли 28 детей. Для оценки энергетического состояния организма определяли активность митохондриальных ферментов (СДГ, ГФДГ, ЛДГ, ГДГ) в лимфоцитах периферической крови. Статистический анализ полученных данных осуществлялся с использованием пакетов программ Statistica 7.0 и Microsoft Excel 2016 с интеграцией AtteStat 13.1, интернет-калькулятора SISA (Simple Interactive Statistical Analysis). Для оценки значимости симптомов и лабораторных показателей у детей разных групп наблюдения был использован метод «Feature Selection and Variable Filtering» модуля интеллектуального анализа данных (Data mining). В качестве оценочного коэффициента дихотомических признаков использовался c2 с коэффициентом значимости Р.
Результаты и обсуждение
Средний возраст обследованных детей с АС на фоне ОРВИ составил 6,038 ± 3,640 года; мальчиков было 34 (53,12 %; 95% ДИ 0,3474–0,7091), девочек — 30 (46,88 %; 95% ДИ 0,2909–0,6526). Воспалительные заболевания респираторного тракта были представлены следующими нозологиями: ОРВИ, острый ринофарингит — 53,125 % (95% ДИ 0,3645–0,6913), ОРВИ, острый простой бронхит — 21,875 % (95% ДИ 0,1073–0,3904), острый стенозирующий ларинготрахеит — 12,5 % (95% ДИ 0,0436–0,2868), внебольничная пневмония — 9,375 % (95% ДИ 0,0246–0,2500), ОРВИ, острый трахеит — 6,25 % (95% ДИ 0,0072–0,2116), ОРВИ, острый обструктивный бронхит — 6,25 % (95% ДИ 0,0072–0,2116).
У всех детей в клинике основного заболевания присутствовали катаральные симптомы. Гипертермический синдром проявлялся фебрильной температурой. Среднее значение температуры тела составило 38,800 ± 0,774 °С. Симптомы дегидратации выявлялись у 44 детей (68,75 %; 95% ДИ 0,5132–0,8216): сухость слизистых оболочек — у 44 (68,75 %), жажда — у 40 (62,5 %), незначительное снижение тургора мягких тканей — у 12 (18,75 %). У 40 (62,5 %) пациентов наблюдалось более 1, у 10 (15,62 %) — более 2 симптомов дегидратации.
Анализируя сроки возникновения АС, установили, что у большинства детей (90,63 %; 95% ДИ 0,7500–0,9754) вторичный АС развивался позже 2-го дня основного заболевания. Клинически АС проявлялся слабостью (90,625 %; 95% ДИ 0,7500–0,9754), вялостью (87,5 %; 95% ДИ 0,7132–0,9564), отказом от еды (59,375 %; 95% ДИ 0,4223–0,7451), тошнотой (59,375 %; 95% ДИ 0,4223–0,7451), запахом ацетона в выдыхаемом воздухе (56,25 %; 95% ДИ 0,3931–0,7185), рвотой (28,125 %; 95% ДИ 0,1540–0,4554).
В результате проведенного интеллектуального анализа данных было выяснено, что наиболее значимыми клиническими признаками вторичного АС на фоне ОРВИ у детей являются (в порядке убывания): запах ацетона в выдыхаемом воздухе (c2 = 18,9721612, р = 0,26876599), лихорадка (c2 = 12,0107177, р = 0,0000744517839), рвота (c2 = 11,4425864, р = 0,0220154098), тяжесть общего состояния (c2 = 9,70757835, р = 0,00779877059), тошнота (c2 = 6,85266618, р = 0,0325059187), отказ от еды, питья (c2 = 4,55655905, р = 0,102460336), слабость (c2 = 1,4882405, р = 0,475152132) (рис. 1).
Биохимическое исследование крови выявило средний уровень глюкозы крови 4,0400 ± 0,6154 ммоль/л (95% ДИ 3,8250–4,2687). У всех пациентов на момент поступления определялась ацетонурия различной степени выраженности (100 %; 95% ДИ 0,9070–1,0000): «2+» — 31,25 % (95% ДИ 0,1784–0,4868), «3+» — 40,625 % (95% ДИ 0,2549–0,5777), «4+» — 28,125 % (95% ДИ 0,1540–0,4554).
Детально были проанализированы предикторы ацетонурии. Так, наиболее значимыми предикторами положительного теста на ацетонурию являлись: запах ацетона в выдыхаемом воздухе (c2 = 28,9169063, р = 0,00000802379787), тяжесть общего состояния (c2 = 11,9972325, р = 0,0016259619), рвота (c2 = 7,0815032, р = 0,00313077252), отказ от еды (c2 = 2,90225597, р = 0,0987949356), лихорадка (c2 = 1,51084991, р = 0,211046624), жажда (c2 = 1,23856359, р = 0,27458643), слабость (c2 = 0,485491071, р = 0,491309775), снижение тургора (c2 = 0,215707965, р = 0,645682945), признаки ДСТ (c2 = 0,215707965, р = 0,645682945), частые ОРЗ (c2 = 0,0224820144, р = 0,881815464) (рис. 2).
При поступлении в стационар у 37,5 % (95% ДИ 0,2288–0,5480) пациентов наблюдалось тяжелое состояние, у 62,5 % (95% ДИ 0,4520–0,7712) — состояние средней тяжести. В основной группе тяжелое состояние у пациентов наблюдалось в 44,44 % (95% ДИ 0,2454–0,6630) случаев, в контрольной группе — у 28,57 % (95% ДИ 0,1134–0,5503) детей.
Исследование корреляционной связи между уровнем ацетонурии и тяжестью состояния пациентов выявило между ними статистически значимую прямую заметную связь (r = 0,531, p = 0,001811) по шкале Чеддока. При этом относительный риск (RR) тяжелого состояния при высокой ацетонурии составил 5 (95% ДИ 0,744–33,624) (рис. 3).
Клинико-анамнестические признаки энергодефицитного состояния были выявлены у 20 пациентов (31,25 %, 95% ДИ 19,89–42,61). Чаще встречались: мышечная слабость — у 21,88 % (95% ДИ 0,1073–0,3904) детей, головная боль — у 15,63 % (95% ДИ 0,0639–0,3223), заболевания бронхолегочной системы в периоде новорожденности — у 6,25 % (95% ДИ 0,0852–0,3568) пациентов, частые ОРЗ в анамнезе — у 31,25 % (95% ДИ 0,1784–0,4868) детей, симптомы ДСТ (гипермобильность суставов, деформации позвоночника, плоскостопие, венозная сеть на коже, слабость мышц живота, склонность к образованию гематом, астеническое телосложение) — у 18,75 % (95% ДИ 0,0852–0,3568) детей. В группе пациентов с энергодефицитом 18,75 % (95% ДИ 0,0852–0,3568) детей были рождены в результате вспомогательных репродуктивных технологий (ВРТ). Характерно, что у 70 % (95% ДИ 0,3923–0,8967) пациентов наблюдалось сочетание 3 и более признаков энергодефицита.
Клинические проявления энергетической дисфункции были подтверждены результатами цитохимического анализа (рис. 4), свидетельствовавшими о равномерном снижении активности митохондриальных ферментов: СДГ — на 31,25 % , ГФДГ — на 41,53 %, ЛДГ — на 40,42 %, ГДГ — на 42,94 % по сравнению с нормативными показателями.
После проведения метаболической коррекции с применением препарата Ионика показатели митохондриальных ферментов соответствовали возрастным нормативным значениям (рис. 5).
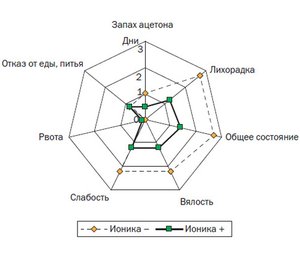
Важно отметить, что применение препарата Ионика позволило не только корригировать энергетические процессы, но и снизить длительность АС: средняя продолжительность симптомов у детей в основной группе составила 1,55 ± 1,03 суток, а в контрольной группе — 2,71 ± 0,95 суток (рис. 6). В основной группе наблюдалось быстрое купирование таких симптомов, как рвота, запах ацетона в выдыхаемом воздухе, отказ от еды и питья в первые сутки (0,420 ± 0,091 суток); исчезновение вялости, слабости, снижение гипертермии, улучшение общего состояния наступало уже на 2-е сутки после назначения комплексной терапии (1,290 ± 0,005 суток).
В основной группе продолжительность симптомов АС была значительно меньшей, чем в контрольной группе (ОШ — 20,429, 95% ДИ 2,166–192,645). Использование препарата Ионика в комплексной терапии позволило снизить потребность в инфузионной терапии у пациентов основной группы (ОШ — 2,6, 95% ДИ 0,598–11,31). Среднее количество дней госпитализации для основной группы составило 7,22 ± 2,06 дня, для контрольной — 6,57 ± 1,90 дня.
Таким образом, в настоящее время изучение АС требует детального рассмотрения его патогенетических механизмов с разных точек зрения и выбора подходов к их коррекции, включая регидратацию, энтеросорбцию, седацию. Учитывая особую роль дефицита глюкозы в патогенезе развития АС, особенно при оказании помощи на ранней амбулаторно-поликлинической стадии, кроме проведения регидратационных и дезинтоксикационных мероприятий, патогенетически обосновано применение глюкозосодержащих препаратов. Препарат Ионика производства «ФДС Лтд» для «Евро Лайфкер Лтд» (Индия/Великобритания) с новой низкоосмолярной формулой (до 245 мОсм/л) с низкой концентрацией хлорида натрия (до 75 ммоль/л) и глюкозы (до 75 ммоль/л) полностью соответствует всем требованиям ВОЗ к оральным регидратационным смесям. Следует отдельно отметить отсутствие побочных, токсических и аллергических реакций при применении Ионики у всех пациентов. Приверженность к терапии данным препаратом повышается благодаря хорошей переносимости, высоким органолептическим свойствам и удобной форме выпуска. Все вышеперечисленное позволяет рекомендовать данное средство оральной регидратации для широкого использования в схемах лечения ацетонемического синдрома на фоне ОРВИ.
Выводы
1. Вторичный АС у детей сопровождает течение воспалительных заболеваний верхних и нижних дыхательных путей, в структуре которых отмечаются: ОРВИ, острый ринофарингит — 53,125 % (95% ДИ 0,3645–0,6913), ОРВИ, острый простой бронхит — 21,875 % (95% ДИ 0,1073–0,3904), острый стенозирующий ларинготрахеит — 12,5 % (95% ДИ 0,0436–0,2868), внебольничная пневмония — 9,375 % (95% ДИ 0,0246–0,2500), ОРВИ, острый трахеит — 6,25 % (95% ДИ 0,0072–0,2116), ОРВИ, острый обструктивный бронхит — 6,25 % (95% ДИ 0,0072–0,2116). Наиболее значимыми предикторами возникновения вторичного АС оказались запах ацетона в выдыхаемом воздухе, тяжесть общего состояния, рвота, отказ от еды, лихорадка, жажда, слабость, снижение тургора, признаки ДСТ, частые ОРЗ. Уровень ацетонурии определяет тяжесть общего состояния пациента (RR — 5,000 (95% ДИ 0,744–33,624)).
2. Развитие вторичного АС на фоне ОРВИ ассоциируется с клинико-анамнестическими признаками энергодефицита и сопровождается снижением активности ключевых митохондриальных ферментов (СДГ — на 31,25 %, ГФДГ — на 41,53 %, ЛДГ — на 40,42 %, ГДГ — на 42,94 %).
3. Применение препарата Ионика позволяет улучшить показатели энергообмена, что сопровождается существенным улучшением клинических показателей, сокращением длительности проявлений АС в основной группе (ОШ — 20,429, 95% ДИ 2,166–192,645)), снижением необходимости в инфузионной терапии (ОШ — 2,600, 95% ДИ 0,598–11,310).
Конфликт интересов. Не заявлен.
1. Виноградова Т.В. и др. Влияние биоэнергетических нарушений на функцию иммунокомпетентных клеток при различных заболеваниях в детском возрасте // Российский вестник перинатологии и педиатрии. — 2012. — Т. 57, № 4–2.
2. O’Neill L.A.J., Pearce E.J. Immunometabolism governs dendritic cell and macrophage function // Journal of Experimental Medicine. — 2016. — Т. 213, № 1. — С. 15-23.
3. Tannahill G.M. et al. Succinate is an inflammatory signal that induces IL-1b through HIF-1a // Nature. — 2013. — Т. 496, № 7444. — С. 238.
4. Everts B. et al. TLR-driven early glycolytic reprogramming via the kinases TBK1-IKKɛ supports the anabolic demands of dendritic cell activation // Nature immunology. — 2014. — Т. 15, № 4. — С. 323.
5. Everts B. et al. Commitment to glycolysis sustains survival of nitric oxide-producing inflammatory dendritic cells // Blood. — 2012. — blood-2012-03-419747.
6. Ильенко Т.Л. Клинико-диагностическое и прогностическое значение метаболических и микроциркуляторных нарушений у детей с ацетонемической рвотой: дис… канд. мед. наук: специальность 14.01.08 «педиатрия» / Т.Л. Ильенко. — Астрахань, 2011. — С. 64-69.

/49-1.jpg)
/50-1.jpg)
/52-1.jpg)
/52-2.jpg)
/53-1.jpg)